22-23 июня в Москве состоялся «Нейрофорум-2023» – важнейшее научно-образовательное мероприятие России, которое уже третий год объединяет ведущих экспертов для обсуждения новейших данных передовых научных исследований в области неврологии и нейронаук, нейровизуализации, кардионеврологии, нейроинфекций и нейрореаниматологии. Организатором «Нейрофорума» выступило ведущее научно-исследовательское и лечебное учреждение в области нейронаук ФГБНУ «Научный центр неврологии». Участники мероприятия обсудили вопросы, актуальные для врачей смежных направлений. Проблеме диагностики и терапии болезни Альцгеймера и болезни Паркинсона, одних из наиболее социально значимых нейропсихиатрических патологий, был посвящен симпозиум «Старение мозга и нейродегенерация: возможности терапии».
Симпозиум открыла Наталия Васильевна Пономарева, д.м.н., руководитель лаборатории возрастной физиологии и нейрокибернетики Института мозга ФГБНУ «Научный центр неврологии». В своем докладе эксперт остановилась на генетических механизмах нейропластичности при старении мозга и нейродегенерации. Про возможности ранней диагностики и терапии болезни Альцгеймера в своем выступлении рассказала Юлия Александровна Шпилюкова, к.м.н., научный сотрудник ФГБНУ «Научный центр неврологии».
Завершил симпозиум доклад Сергея Николаевича Иллариошкина, д.м.н., профессора, академика РАН, заместителя директора по научной работе ФГБНУ «Научный центр неврологии», директора Института мозга ФГБНУ «Научный центр неврологии», президента общества по изучении Болезни Паркинсона, «Нейродегенеративная основа немоторных проявлений болезни Паркинсона».
Клеточные и молекулярные механизмы нейропластичности
Нейропластичность – важнейшее свойство мозга, которое лежит в основе процессов памяти и обучения. Оно заключается в возможности нейрональных структур изменяться с образованием новых синаптических связей и даже нейрогенеза в ответ на внешние воздействия или после повреждения в течение всей жизни. Выделяют структурную и функциональную нейропластичность. Как следует из названия, первая связана с изменением структурных свойств мозга, в то время как в основе функциональной нейропластичности лежит реорганизация функциональных сетей, в частности, переход функций от поврежденных к неповрежденным областям. На молекулярном уровне в основе нейропластичности лежит повышение активности сигнальных путей, транскрипции генов и синтеза белков в ответ на длительную и интенсивную активацию нейрональных структур. На клеточном уровне происходит индукция нейрогенеза (пролиферация, дифференциация, миграция и созревание нейронов), миелинизации, дендритогенеза с изменением морфологии шипиков, активация процессов аутофагии с последующей деградацией неиспользуемых клеточных элементов или патологич��ских субстратов. Наконец, на уровне синапса происходит долговременная потенциация и депрессия, а также изменение транскрипции белков и структуры синаптических контактов. Сегодня нейропластичность активно изучается как на макро-, так и на микроуровне. В первом случае широкое применения нашли электрофизиологические методы, такие как ЭЭГ и МЭГ (спонтанная или вызванная активность), и функциональные методы, например, фМРТ и анализ функциональной коннективности сетей мозга в покое и при нагрузке. На микроуровне с использованием животных моделей выявляются клеточные маркеры нейропластичности, а также описываются процессы долговременной потенциации и депрессии.
Важно отметить, что при БА нейропластические процессы частично сохранены. При дисфункции левого гиппокампа, его функцию на себя может взять гиппокамп контралатерального полушария. При этом, важно помнить, что структурная МРТ в данном случае не будет являться специфическим биомаркером БА. Признаки атрофии гиппокампа также могут обнаруживаться при склерозе гиппокампа, болезни с аргирофильными зернами (таупатия), болезни диффузных телец Леви, а также LATE (limbic predominant age-related TDP-43 encephalopathy).
Нейропластичность и возраст-зависимые заболевания
Наиболее распространенным возраст-зависимыми нейродегенеративными заболеваниями являются болезнь Альцгеймера, болезнь Паркинсона (БП) и болезнь Гентингтона. Все они связаны с изменением пластичности в определенных нейронных сетях.
Болезнь Альцгеймера (БА) – это нейродегенеративное заболевание, для которого характерны нарушения памяти и специфичный патоморфологический процесс, включающий формирование сенильных бляшек и нейрофибриллярных клубков. Согласно современным критериям, клинический фенотип БА включает не только амнестический симптом, логопенический вариант первичной прогрессирующей афазии и заднюю корковую атрофию, но и более редкие фенотипы, включая поведенческий/дизрегуляторный синдром, схожий с проявлениями лобно-височной деменции, кортикобазальный синдром, а также аграмматический и семантический варианты первичной прогрессирующей афазии, также часто являющиеся проявлениями лобно-височной дегенерации.
Наталия Васильевна Пономарева подчеркнула, что на нейрофизиологическом уровне БА в большей степени затрагивает сеть пассивного режима работы мозга (default mode network), ассоциированную с процессами памяти. Причиной таких изменений может являться бета-амилоид. Он нарушает долговременную потенциацию и вызывает появление эпилептиформной активности в мозге. Накопление бета-амилоида увеличивает проницаемость мембраны нейронов для ионов кальция и запускает свободнорадикальные процессы. Это, в конечном итоге, приводит к гибели нейронов. Для БП более характерны нарушения в субкортикальной сети, а при болезни Гентингтона страдает сенсомоторная сеть и стриатальные образования.
Поскольку на нейрональном уровне нейродегенеративные заболевания сопровождаются формированием аберрантных белков (бета-амилоида и гиперфосфорилированного тау-протеина при БА, альфа-синуклеина при БП и гентингтина при болезни Гентингтона) современные критерии диагностики БА наряду с полиморфизмом клинических проявлений заболевания учитывают исследования биомаркеров. Однако во многих странах оценка биомаркеров не является частью рутинной практики. Как отметила Юлия Александровна Шпилюкова, при наличии редких фенотипов БА исследования биомаркеров имеют особенно высокую ценность – для подтверждения наличия альцгеймеровской патологии необходимо изменение уровней как бета-амилоида, так и тау-белка (при этом, диагноз будет считаться вероятностным). Повышение уровня тау-белка, даже при наличии типичных фенотипов БА, позволяет поставить только вероятностный диагноз.
Генетические факторы развития болезни Альцгеймера
Способность мозга к нейропластичности снижается с возрастом. Во многом это обусловлено генетическими факторами. Ключевыми «игроками» являются гены синаптической пластичности (гены CREB, NMDA рецептора, ADORA2D), гены нейротрофических факторов (BDNF, NGF) и гены факторов воспаления и окислительного стресса, включая интерлейкины и цитокины. В частности, при интенсивной активации синаптического контакта активация кальциевых каналов, повышение концентрации цАМФ и увеличение активности протеинкиназ приводят к фосфорилированию транскрипционного фактора CREB1 (chr2q33.3-q34; cAMP response element-binding protein), который играет важную роль в регуляции процессов, лежащих в основе обучения и памяти: контроле экспрессии, обеспечении пластических изменений синаптических контактов, нейрогенезе и выживании клеток. Другие факторы, влияющие на нарушение синаптической пластичности при старении, включают ADORA2A (chr22q11.23) и APOE (chr19q13), а также ассоциированные изменения чувствительности и количества кальциевых каналов и аденозиновых А2-рецепторов. В частности, при повышении концентрации кальция в нейронах нарушаются процессы долговременной потенциации, которые также чувствительны к уровню нейротрофического фактора BDNF. Последний, помимо этого, влияет на процессы пролиферации и выживаемости нейронов. Полиморфизм гена BDNF Val66/Met rs6265 (chr11p13) ассоциирован с различиями в секреции белка BDNF, объемом кратковременной памяти, объемом гиппокампа и дорсолатеральной префронтальной коры. Содержание BDNF в клетке повышается на фоне терапии ингибиторами ацетилхолиновых (иАХЭ) рецепторов центрального действия, такими как донепезил (Алзепил). Донепезил также оказывает влияние на бета-секретазу, тем самым регулируя продукцию бета-амилоида. Применение препарата приводит к усилению коннективности в ряде структур мозга, в частности, префронтальной коры, спустя 12 недель терапии.
Одним из ключевых факторов, связанных с генетической предрасположенностью к БА, является аполипопротеин АроЕ Е4. У носителей двух гомозиготных аллелей АроЕ Е4 риск развития заболевания повышается в 10 раз. Этот белок влияет на накопление в мозге бета-амилоида, участвует в транспорте холестерина и фосфолипидов и в репаративных процессах, влияет на синаптическую передачу, миелинизацию нервных волокон и кровоснабжение ЦНС. Снижая фосфорилирование CREB (в т.ч. через изменение активности NMDA-рецепторов), АРОЕ Е4 нарушает синаптическую пластичность в гиппокампе и приводит к снижению продукции миелина олигодендроглиоцитами. У клинически здоровых носителей генотипа АpoЕ4+ при гипервентиляции на ЭЭГ с большей частотой выявляются эпилептиформная или пароксизмальная высокоамплитудная тета-активность, локализованная в передней поясной извилине, которая в больше степени поражается при БА. В молодом возрасте у молодых носителей АpoЕ4+ по данным фМРТ наблюдается гиперконнективность, которая снижается в процессе старения. Вместе с этим уменьшение количества синаптических контактов сопровождается изменениями индивидуальной частоты пика альфа-ритма, что на поведенческом уровне проявляется снижением вербальной беглости.
Генотип белка кластерина CLU rs11136000 (chr8) – еще один фактор риска БА. Кластерин – уникальный внутри- и внеклеточный шаперон. Он ингибирует вызванную стрессом агрегацию других белков, включая бета-амилоид, модулирует организацию нейронных сетей, защищает от протеотоксичности посредством стимуляци аутофагии, участвует в транспорте холестерина и фосфолипидов, модулирует иммунный ответ через NK-kB и пути комплемента. При наличии «аллели риска» кластерина у людей в процессе старения наблюдается повышенная активация мозга при нагрузке, в частности, изменение десинхронизации альфа-активности при выполнении теста вербальной беглости. Наконец, PICALM, ген фосфатидилинозитол-связывающего белка сборки клатрина (хромосома 11q14), который участвует в клатрин-опосредованном эндоцитозе, также играет важную роль в патогенезе БА, в частности, процессинге АРР, клиренсе и накоплении бета-амилоида и тау, аутофагии и нейротрансмиссии. Было показано, что наличие аллели риска PICALM сопровождается снижением коннективности, а на поведенческом уровне – нарушениями памяти.
К людям с абсолютным риском относят носителей мутаций в генах АРР, PSEN1, PSEN2, и также трисомии по 21 паре хромосом. Люди с высоким риском имеют позитивные маркеры тау и бета-амилоида по данным анализа цереброспинальной жидкости/ПЭТ, распределение тау-патологии за пределы лимбической коры по данным ПЭТ (стадия Braak 5 или выше), а также гомозиготность аллеля Е4 гена АРОЕ. Неопределенный риск устанавливается при наличии позитивного маркера бета-амилоида при отрицательном или неизвестном уровне тау, либо при позитивном маркере тау и негативном бета-амилоиде.
Гентингтин – мультифункциональный белок, который в норме участвует в регуляции транскрипции, аутофагии и везикулярном транспорте – является фактором риска развития болезни Гентингтона. Мутантный гентингтин, содержащий полиглутаминовые повторы (тринуклеотидные повторы в гене белка), влияет на процессы транскрипции и гомеостаз белков, приводит к изменениям синаптической пластичности, нарушениям гомеостаза кальция и нейротрансмиттеров, и, в конечном счете, нейродегенерации. На доклиническом этапе у носителей мутации в белке наблюдаются изменения коннективности по данным фМРТ (в большинстве случаев, снижение). На данных ЭЭГ обнаруживается снижение спектральной мощности на границе тета- и альфа-диапазонов, которое коррелирует с тяжестью симптомов. Нормализация ЭЭГ наблюдается у пациентов, получающих лечение томинерсеном, антисмысловым нуклеотидом, уменьшающим продукцию гентингтина.
Роль оценки биомаркеров в диагностике болезни Альцгеймера
«Золотым стандартом» оценки биомаркеров БА является анализ цереброспинальной жидкости, полученной посредством люмбальной пункции. Он позволяет выявить наличие бета-амилоида 1-41, общего и фосфорилированного тау. Несмотря на высокую доступность этот метод является инвазивным. В качестве альтернативы все более широкое применение в мире находит метод ПЭТ, который, однако, гораздо дороже стандартного анализа цереброспинальной жидкости и на данный момент недоступен в России. ПЭТ-ФДГ может быть полезна в дифференциальной диагностике деменций в целом, а ПЭТ с лигандами к бета-амилоиду – в подтверждении диагноза БА.
По данным анализа биомаркеров у 71 пациента (36-81 год, средний возраст 64±9 лет) с когнитивными нарушениями, длительностью заболевания 3.5±2.4 лет и тяжестью симптомов по шкале CDR 0.5 (n=34) и 1 (n=30) балл, проведенного в ФГБНУ НЦН в 2019-2022 гг., было показано, что для участников с типичными фенотипами БА было более характерно снижение уровня бета-амилоида (80% vs 27%). Позитивный маркер фосфорилированного тау выявлялся приблизительно у трети больных в обеих группах. Изменение обеих маркеров было обнаружено у трети больных с типичным фенотипом и только у 12% пациентов с редким фенотипом БА. Таким образом, пациенты с типичным фенотипом заболевания чаще имеют патологию альцгеймеровского типа.
Биомаркеры также могут использоваться для досимптомной диагностики БА. Однако как показывают результаты исследований, их изменение не всегда предшествует когнитивным нарушениям. Это значит, что биомаркеры не могут использоваться вне контекста клинических проявлений заболевания.
Таким образом, оценка биомаркеров с целью подтверждения диагноза БА будет необходимым требованием в случае появления болезнь-модифицирующей терапии в клинической практике. В настоящее время оценка биомаркеров БА может быть полезной с клинической точки зрения при наличии неамнестического фенотипа. Оценка биомаркеров также рекомендована в случае наличия амнестического фенотипа и раннего дебюта заболевания (≤65 лет). Подтверждение диагноза позволяет остановить бесконечные поиски диагноза, а также более грамотно спланировать стратегии медикаментозной и немедикаментозной поддержки уже на ранних стадиях заболевания.
Немоторные проявления болезни Паркинсона
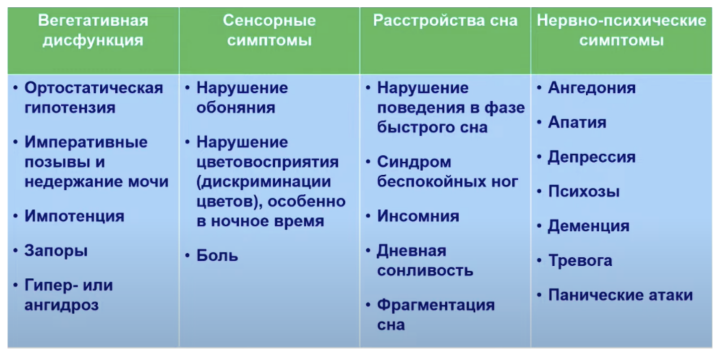
БП обусловлена накоплением патологических агрегатов белка альфа-синуклеина в цитоплазме дегенерирующих нейронов, в том числе в нейронах черной субстанции, голубого пятна и вегетативных нейронах слюнной железы, где они формируют морфологические маркеры БП – нейриты и тельца Леви. Немоторные проявления БП включают вегетативную дисфункцию, сенсорные симптомы, расстройства сна и нервно-психические симптомы (Рис. 1). Наиболее значимыми среди них, как отметил
Немоторные подтипы БП включают:
- подтип с когнитивными нарушениями;
- подтип с апатией;
- подтип с депрессией и тревогой;
- подтип с нарушениями сна;
- подтип с болевым синдромом;
- подтип с вегетативными нарушениями.
Нарушения поведения в фазу быстрого сна – наиболее ранний немоторный симптом БП. Еще одно немоторное проявление заболевания, сиалорея (рис. 2), может приводить к развитию периорального дерматита и нарушению гигиены полости рта, увеличению оральной бактериальной микрофлоры, затруднениям с речью, приемом пищи, а также повышенной частоте респираторных инфекций вследствие незаметных эпизодов аспирации слюны.
| |
| Рисунок 2. Множественность нейродегенеративных механизмов в реализации немоторных проявлений болезни Паркинсона на примере сиалореи |
Аффективные нарушения при болезни Паркинсона
Типичным немоторным симптомом БП являются аффективные нарушения, в частности, депрессия, которая встречается у трети пациентов в начальной стадии заболевания. При этом, депрессия и тревога могут манифестировать за много лет (до 20) до дебюта БП, но их частота особенно повышается за 3-6 лет до постановки клинического диагноза. Частота депрессии также повышена и у родственников пациентов с БП. Верно и обратное: лица с депрессией имеют в 2-3 раза более высокий риск развития заболевания по сравнению с людьми без аффективных расстройств.
В основе патогенеза аффективных нарушений лежат повреждение голубого пятна, повышение уровня норадреналина в цереброспинальной жидкости и крови, увеличение содержания кортикотропин-рилизинг гормона в крови, а также поражение серотонинергических структур. Последнее обуславливает эффективность СИОЗС/СИОЗСН в терапии депрессии у пациентов с БП. Специфический пространственный паттерн дезинтеграции locus ceruleus определяет характер ряда норадренергических немоторных проявлений БП.
В частности, снижение сигнала от голубого пятна в режиме нейромеланина имеет характерный рострокаудальный и дорсовентральный градиент и коррелирует с норадренергическими и немоторными проявлениями.
В 2021 году на Дельфийском консенсусе экспертов в области психиатрии, неврологии и гериатрии был достигнут консенсус по 81.6% из 49 вопросов, касающихся этиопатологических механизмов, клинических особенностей, диагностики и лечения депрессии при БП.
- Депрессивные симптомы могу считаться факторами риска развития БП, но не клиническими индикаторами прогрессирования заболевания.
- Пациентов с БП следует систематических обследовать на депрессию, дифференцируя при этом депрессивные проявления от ангедонии и апатии, поскольку последние не обязательно связаны с депрессией и могут носить самостоятельный характер.
- Клинические шкалы (гериатрическая шкала GDS-15) могут помочь в установлении диагноза депрессии, которая потребует лечения независимо от степени тяжести симптомов.
- Эффективными и хорошо переносимыми препаратами являются СИОЗСН (венлафаксин, десвенлафаксин и дулоксетин), а также СИОЗС (сертралин), мультимодальные препараты (вортиоксетин, бупропион, миртазапин, тианептин) и агонисты дофаминовых рецепторов (ропинирол, прамипексол, ротиготин). СИОЗСН (венлафаксин) и СИОЗС в равной степени безопасны с точки зрения их влияния на двигательную сферу.
- ТЦА и комбинация иМАО-В с серотонинергическими препаратами не рекомендованы.
- Электросудорожная терапия показана в тяжелых и лекарственно-резистентных случаях, тогда как когнитивно-поведенческая терапия – пациентам с легкой выраженностью симптомов.
Венлафаксин (Велаксин) селективно ингибирует обратный захват серотонина, норадреналина и дофамина (в очень высоких дозах) из синаптической щели в нейрон, потенцируя передачу нервного импульса между нейронами. Благодаря дозозависимому действию на три основных типа нейромедиаторов препарат устраняет симптомы депрессии любой степени тяжести. При легкой и умеренной депрессии, сопровождающейся гипотимией и тревогой, обсессиями и компульсиями венлафаксин назначается в дозировке 75-125 мг; при умеренной меланхоличной депрессии с психомоторной заторможенностью и рассеянностью рекомендуемая дозировка составляет 125-225 мг; при тяжелой психотической депрессии дозировка может подниматься до 375 мг – это позволяет воздействовать на три медиаторные системы. Венлафаксин включен в Федеральные клинические рекомендации по лечению БП, вторичного паркинсонизма и заболеваний, сопровождающихся синдромом паркинсонизма. Эффективность препарата сопоставима с ТЦА, при этом переносимость сопоставимо с плацебо.
По данным клинических исследований, антидепрессивное действие венлафаксина у пациентов с тяжелой депрессией регистрировалось уже на 4 день лечения при быстрой эскалации дозы (≥200 мг/сут), а в первые 4 недели терапии применение препарата в адекватных дозах в 2.5 раза снижало выраженность депрессии. Важно отметить, что Велаксин также проявляет выраженный противотревожный эффект, особенной в начале терапии депрессии.
Встречаемость тревоги при БП составляет 40-50%, тогда как в обычной популяции – 10-29%. При этом, она характеризуется высокой коморбидностью с депрессией – до 76%. У 12-20% пациентов с БП отмечается сочетание нескольких форм тревожного расстройства (генерализованное тревожное расстройство (ГТР), панические атаки, фобии).
Выявленное в нейровизуализационных исследованиях снижение функции 5-НТ1А-рецепторов и сниженное связывания серотонина в коре и лимбической системе делает обоснованным использование некоторых СИОЗС (нежелательно назначение флуоксетина – возможно усиление тревоги), однако предпочтение стоит отдавать мультитаргетным препаратам, обеспечивающим оптимальный баланс модуляции серотонинергической и дофаминергической систем. Одним из таких средств, доступных сегодня на российском рынке, является буспирон (Спитомин), полный агонист пресинаптических 5-НТ1А-ауторецепторов в ядрах шва и частичный агонист постсинаптических 5-НТ1А-рецепторов в гиппокампе и коре, а также антагонист пресинаптических D2-дофаминовых рецепторов. Препарат проявляет анксиолитический и антидепрессивный эффекты, включая коррекцию сопутствующих нарушений сна, апатии и вегетативной дисфункции. Действие на дофаминергические рецепторы обуславливает когнитивный эффект и уменьшение экстрапирамидных симптомов. Спитомин показал эффективность в лечении состояний, сопровождающихся тревогой, в т.ч. ГТР, а также в качестве дополнительной терапии депрессивных расстройств: добавление буспирона к СИОЗС вдвое снижало симптомы депрессии и помогало достичь полной/частичной ремиссии у 6 из 10 пациентов, принимавших ранее СИОЗС без эффекта. По данным сравнительных исследований, снижение тревоги буспироном к 4-й неделе терапии соответствовало выраженности противотревожного эффекта диазепама, при этом сонливость развивалась в 2.5 раза реже.
Недавние исследования также продемонстрировали способность буспирона предотвращать нейродегенерацию в модели ротенон-индуцированной дегенерации. Препарат ослаблял индукцию экспрессии интерлейкина-1-бета и интерлейкина-6 ротеноном, активировал BDNF, улучшал функцию митохондрий и антиоксидантную активность. Эти данные указывают на нейропротекторную активность буспирона, что предполагает его потенциальное использование при нейродегенеративных и нейровоспалительных заболеваниях.
Использование ТЦА и бензодиазепинов для лечения тревоги при БП ограничено у пожилых лиц в связи с множественными побочными эффектами в первом случае и усугублением когнитивных нарушений и падений – во втором.
Таким образом, многообразие «мишеней» нейродегенеративного процесса при БП, определяющих (помимо двигательной системы) развитие большого числа немоторных проявлений, диктуют необходимость использования препаратов с комбинированным действием. Это повышает безопасность проводимой терапии и позволяет избежать полипрагмазии, что особенно важно у пожилых, коморбидных пациентов.