Острые респираторные вирусные инфекции (ОРВИ) — это обширная группа заболеваний, характеризующихся сходной клинической картиной. После перенесенных ОРВИ развивается типоспецифический и непродолжительный иммунитет, что обусловливает повторные случаи заболеваний, вызванных даже принадлежащими к той же таксономической группе вирусами [1]. Несмотря на многочисленные исследования, посвященные проблемам гриппа и ОРВИ, профилактика и лечение этих заболеваний остаются крайне сложной задачей и в настоящее время. Среди основных причин следует отметить этиологическую гетерогенность ОРВИ, высокую контагиозность возбудителей, а также изменчивость антигенных свойств вирусов (особенно гриппа), что делает создание средств профилактики и специфического лечения крайне затруднительным [2].
Особенно серьезной проблемой являются острые респираторные инфекции у детей первого года жизни в связи с высоким уровнем заболеваемости, повышенным риском развития осложнений, а также значительным удельным весом этих инфекций в структуре летальных исходов у детей раннего возраста [3, 4].
Основными факторами, которые определяют тяжесть течения ОРВИ, являются индивидуальные и возрастные особенности детского организма, фоновые состояния (недоношенность, морфофункциональная незрелость, иммунодефицитные состояния, искусственное вскармливание и пр.), а также тип возбудителя. У детей первых лет жизни чаще, чем в других возрастных группах, отмечаются случаи более тяжелого течения респираторных инфекций, а также неблагоприятные исходы заболевания [5]. Стоит отметить, что максимальный показатель смертности от гриппа (35%) отмечается именно среди детей в возрасте до 2 лет [6]. Поэтому обсуждение вопросов рациональной терапии ОРВИ у детей раннего возраста представляется крайне актуальным.
Организм новорожденного ребенка наиболее подвержен действию различных инфекционных агентов в силу ряда факторов, среди которых превалирующее значение имеет физиологическая незрелость иммунной системы [4]. Первая неделя жизни ребенка представляет собой период радикальной функциональной, а в ряде случаев и анатомической перестройки всех органов и систем [7]. Результатом происходящих изменений является адаптация организма новорожденного ребенка к внеутробной жизни. Роль иммунной системы в ранней постнатальной адаптации чрезвычайно важна. Моментальный переход от условий внутриутробного развития в условия крайне высокой антигенной нагрузки модифицирует все структуры иммунной системы. В результате одновременно происходят разнонаправленные процессы: становление адекватного иммунного ответа, формирование иммунологической памяти и поддержание иммунологической толерантности, сдерживание возможного развития гиперергических реакций и воспаления [8]. Особенности иммунитета в неонатальном периоде предохраняют ребенка от избыточных реакций в ответ на контакт с микроорганизмами окружающего мира, но одновременно делают его уязвимым в отношении срыва защитных реакций и развития инфекционных заболеваний.
Иммунная система новорожденных находится в состоянии физиологической депрессии и характеризуется незавершенным характером фагоцитоза, низким числом Пейеровых бляшек, сниженным процессом распознавания антигенов клетками главного комплекса гистосовместимости НLА 1-го типа, сниженным количеством СD8- и СD4+ лимфоцитов, отсутствием клеток памяти, преобладанием супрессорных реакций, преимущественным образованием Тh2-клеток, недостаточностью реакции пути активации системы комплемента, недостаточным синтезом иммуноглобулинов, а также сниженной продукцией интерферона (ИФН) [9].
Слизистые респираторного тракта детей первых месяцев жизни практически лишены локальной защиты, так как секреторный иммуноглобулин А (sIgА) к моменту рождения не вырабатывается. Становление продукции sIgА у доношенных детей происходит лишь к 3-му месяцу жизни, однако она остается недостаточной вплоть до школьного возраста. Бактерицидная функция sIgА реализуется в присутствии лактоферрина, который оказывает бактериостатическое действие на многие инфекционные патогены. Слизистые оболочки кишечника детей раннего возраста способны вырабатывать лактоферрин лишь в очень низкой концентрации [10]. Активный гуморальный фактор защиты лизоцим, способный лизировать 75% видов микробов, в секретах новорожденного отсутствует, появляясь в незначительных количествах лишь к 2–3-недельному возрасту [9]. Для детей 3–6 месяцев жизни характерна утрата полученных от матери антител на фоне низкой продукции иммуноглобулинов M, А и отсутствия синтеза иммуноглобулинов G [11].
В период новорожденности (0–28 дней) в сыворотке крови циркулирует значительное количество «раннего» ИФН. «Ранние» ИФН отличаются по физико-химическим и, что особенно важно, биологическим свойствам от ИФН, синтезируемых клетками взрослого организма: они более гидрофобны, имеют сниженные противовирусные, антипролиферативные и иммуномодулирующие свойства. У новорожденных детей в становлении противоинфекционной защиты организма принимает участие только гамма-звено интерфероновой защиты, активность которой в ряде случаев значительно снижена, особенно у недоношенных детей. Уменьшение способности новорожденных к синтезу ИФН гамма обусловливает изменение показателей иммунорегуляторного индекса в сторону преобладания супрессорной активности Т-лимфоцитов и снижения киллерной активности клеток [4].
В связи с высокой восприимчивостью к инфекционным заболеваниям, несостоятельностью иммунной системы и относительно малым выбором лекарственных средств, терапия у новорожденных и детей грудного возраста должна проводиться с высокой степенью осторожности, а используемые препараты должны обладать доказанной эффективностью и благоприятным профилем безопасности [4, 12, 13].
Решить проблему эффективного и безопасного лечения гриппа и ОРВИ у детей в периоде новорожденности и первых месяцев жизни возможно, используя препараты рекомбинантного ИФН альфа. ИФН альфа способен оказывать прямой противовирусный эффект, не обладающий специфичностью, то есть данный цитокин эффективен против респираторных вирусов любой этиологии [3, 14, 15]. Дополнительным терапевтическим действием ИФН альфа при различных инфекциях является его иммуномодулирующая активность, поскольку ИФН выступает в роли регуляторного цитокина и кооперирует работу иммунокомпетентных клеток. Оптимальной лекарственной формой для применения ИФН у детей являются суппозитории. Такая лекарственная форма обеспечивает возможность использования относительно низких доз ИФН и благодаря постепенному попаданию в системный кровоток не оказывает типичных для инъекционно вводимых препаратов ИФН нежелательных лекарственных реакций [14, 16]. Учитывая указанные ранее особенности функционирования иммунной системы детского организма в первые месяцы жизни, применение экзогенного ИФН альфа играет значимую роль в лечении инфекционных заболеваний у новорожденных и грудных детей [5, 15, 17].
ИФН альфа в лекарственной форме суппозиториев положительно зарекомендовал себя при лечении вирусных и бактериальных инфекций у новорожденных: ОРВИ, сепсиса, пневмонии, специфических внутриутробных инфекций. Результаты проведенных клинических исследований и ретроспективный анализ клинического опыта применения показали взаимосвязь между факторами специфической, неспецифической и антиоксидантной защиты организма, корригируемой препаратами ИФН альфа [4].
Наиболее современным препаратом рекомбинантного человеческого интерферона α-2b (рчИФН-α-2b) является Генферон® лайт, который производится российской биотехнологической компанией «Биокад» (номер регистрационного удостоверения ЛСР-005614/09, дата регистрации — 13.07.2009). В состав препарата входит также аминокислота таурин, оказывающая положительное воздействие при воспалительных процессах. Таурин широко применяется при целом ряде заболеваний в виде офтальмологических капель, входит в состав растворов для парентерального питания у новорожденных детей. Таурин обладает антиоксидантным действием, непосредственно взаимодействуя с активными формами кислорода, избыточное накопление которых способствует развитию патологических процессов (воспаление, интоксикация и т. д.) [18]. В НИИ гриппа Минздрава РФ (г. Санкт-Петербург) было проведено сравнительное исследование влияния ИФН в сочетании с различными антиоксидантами на течение острой экспериментальной инфекции, вызванной вирусом гриппа,
Терапия животных интерфероном в комбинации с таурином снижала показатели смертности на 43–46%. Использование токоферола в комбинации с аскорбиновой кислотой хотя и умеренно снижало смертность животных (на 14–23% в зависимости от дозы вируса), но не повышало эффективности интерферона при совместном применении. При использовании сочетания ИФН и аскорбиновой кислоты при введении мышам инфицирующей дозы вируса, равной 10 LD50, продемонстрирован индекс защиты 23,1%, в то время как комбинация ИФН с таурином обусловливала 46,2%-ный индекс защиты. Также проводилось исследование противовирусной активности ИФН в комбинации с антиоксидантами in vitro. Кроме противовирусной активности ИФН в сочетании с антиоксидантами, в исследовании изучалась собственная противовирусная активность антиоксидантов и их дозозависимая цитотоксичность. К сравнению были представлены комбинации ИФН альфа в дозе 10000 МЕ с токоферолом, аскорбиновой кислотой, таурином и унитолом. В результате исследования было установлено, что наибольшей противовирусной активностью обладала комбинация ИФН и таурина. Важным наблюдением стало то, что таурин проявлял собственную противовирусную активность и, в отличие от других антиоксидантов, даже в максимальных исследованных дозах (5000 мкг/мл) не оказывал цитотоксического действия на клеточную культуру [20].
На основании этих данных можно сделать вывод, что сочетание ИФН с таурином в одной лекарственной форме позволяет обеспечить более широкий спектр действия препарата и оказывать выраженное терапевтическое действие даже при более низких дозах ИФН.
Полученные данные представляются особенно актуальными, так как при выборе терапии у детей первого года жизни важно избегать полипрагмазии и учитывать степень лекарственной нагрузки.
С целью доказательства того, что комбинация таурина и ИФН позволяет снизить дозу последнего и добиться как минимум эквивалентной эффективности в терапии ОРВИ у новорожденных и детей первых месяцев жизни по сравнению с более высокой дозой препарата ИФН (150000 МЕ), в котором антиоксиданты представлены в качестве вспомогательных компонентов (аскорбиновая кислота и токоферол), проведено настоящее клиническое исследование. Исследование проводилось на основании разрешения Министерства здравоохранения № 137 от 13 июня 2012 г.
Материалы и методы исследования
Согласно протоколу клинического исследования, для достижения поставленной цели необходимый размер выборки составил 102 человека. В исследование включались дети в возрасте от 0 до 6 месяцев включительно с клинический установленным диагнозом ОРВИ, установленным на основании клинических данных, продолжительность катаральных явлений у которых на момент включения не превышала 48 часов.
До включения в исследование врач проводил подробную беседу с родителями (или с законными представителями ребенка) с детальным объяснением процедур исследования, его целей и задач, а также потенциальных рисков, после чего в случае принятия положительного решения родители подписывали информированное согласие.
В результате проведения рандомизации пациенты были разделены на две группы. Пациенты основной группы получали препарат Генферон® лайт в дозе 125 000 МЕ + 5 мг ректально 2 раза в сутки в течение 5 дней параллельно симптоматической терапии. Симптоматическая терапия включала обильное теплое питье, аскорбиновую кислоту в возрастной дозировке, деконгестанты, жаропонижающие препараты (по показаниям). Допускалась антибактериальная терапия при наличии симптомов смешанной бактериально-вирусной инфекции. У пациентов группы сравнения применялись суппозитории, содержащие 150 000 МЕ рчИФН α-2b, ректально 2 раза в сутки в течение 5 дней (также в сочетании с симптоматическим лечением и антибактериальной терапией при наличии соответствующих показаний).
До начала лечения и на 6–7 день у всех больных определялось наличие респираторных вирусов в мазке с носоглотки с помощью метода полимеразной цепной реакции (ПЦР) (определялись антигены/генетический материал вируса гриппа А, вируса гриппа В, аденовирусов, респираторно-синцитиального вируса, вирусов парагриппа 1-го, 2-го и 3-го типов, риновируса, метапневмовируса). Также проводился клинический анализ крови, тщательный общий осмотр, оценка состояния верхних дыхательных путей, регистрировались случаи развития осложнений и нежелательных явлений.
На протяжении всего периода лечения (5 дней) проводилось заполнение мультипараметрической таблицы, которая отражала выраженность основных симптомов ОРВИ (лихорадка, интоксикация, катаральные изменения со стороны респираторного тракта). На 30-й день врач устанавливал телефонный контакт с родителями ребенка с целью выявления повторных эпизодов ОРВИ, случаев возникновения иных заболеваний и нежелательных явлений.
Обязательному анализу подлежали все случаи нежелательных явлений, наблюдаемые у больных, вне зависимости от наличия/отсутствия связи с исследуемой терапией. Тщательная оценка безопасности осуществлялась у всех пациентов, получивших хотя бы одно введение исследуемого препарата или препарата сравнения.
Статистическая обработка данных производилась с помощью программного обеспечения Statistica 10.0.
Величины показателей представлены в виде среднего значения и стандартного отклонения или медианы и интерквартильного размаха в зависимости от типа распределения данных. Сравнение двух групп по количественному признаку в случае нормального распределения признака осуществлялось с помощью t-критерия Стьюдента. В случае распределения признака, отличающегося от нормального, сравнение в группах осуществлялось с использованием критерия Манна–Уитни. Сравнение групп по качественному бинарному признаку (анализ частот) проводилось с помощью точного критерия Фишера. При интерпретации результатов использовались стандартные методы сравнительного анализа и описательной статистики. Статистически значимыми считались различия при р < 0,05.
Результаты
В общей сложности в исследование было включено 103 пациента в возрасте от 0 до 6 месяцев включительно. В основную группу включены 52 пациента (31 мальчик, 21 девочка), в группу сравнения 51 пациент (26 мальчиков, 25 девочек). 1 пациент основной группы был исключен из анализа эффективности в связи с нарушением комплаентности. Таким образом, в анализ безопасности вошло 103 пациента, в анализ эффективности 102 пациента.
Медианы возраста больных основной группы составили 4,14 [2,10–6,10] месяца, группы сравнения — 4,15 [2,24–5,21] месяца (р > 0,05). По данным акушерско-гинекологического анамнеза матерей пациентов из группы препарата Генферон® лайт медиана возраста матери на момент родов составила 28 [24,00–33,00] лет, в группе препарата сравнения — 28,00 [24,00–31,00] лет (р > 0,05).
У пациентов из основной группы состояние при рождении определялось как удовлетворительное в 47 (92,16%) случаях, средней тяжести в 3 (5,88%) случаях, тяжелое у одного (1,96%) пациента. У пациентов из группы сравнения состояние при рождении определялось как удовлетворительное в 46 (90,20%) случаях, средней тяжести в 4 (7,84%) случаях, тяжелое состояние при рождении зарегистрировано у одного (1,96%) пациента (р > 0,05).
В группе препарата Генферон® лайт было 3 (5,88%) пациента, которые родились раньше положенного срока, в группе сравнения было 2 (3,92%) недоношенных ребенка (р > 0,05).
Сопутствующая патология
К наиболее распространенным (выявлены более чем у 4 человек) сопутствующим заболеваниями относились синдром мышечной дистонии, синдром нервно-рефлекторной возбудимости, перинатальное поражение ЦНС. Частота встречаемости отдельных сопутствующих заболеваний в обеих группах была сопоставимой (р > 0,05). Аллергии на лекарственные средства не отмечалось в анамнезе ни у одного пациента из двух групп исследуемых препаратов. У 4 (7,84%) детей из группы Генферон® лайт и у 4 (7,84%) пациентов из группы препарата сравнения имелась пищевая аллергия в анамнезе (р > 0,05).
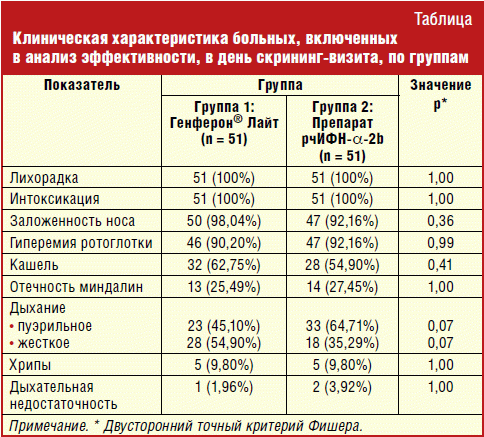
Клиническая характеристика больных при включении в исследование
Длительность симптомов ОРВИ у всех пациентов на момент включения не превышала 48 часов. Клиническая картина ОРВИ была представлена классическими симптомами: интоксикацией (вялость, снижение аппетита, сонливость), лихорадкой, катаральными изменениями со стороны носо- и ротоглотки (ринит, фарингит и т. п.).
Сравнительная оценка клинических признаков ОРВИ не выявила достоверных различий по частоте встречаемости тех или иных симптомов исследования на момент включения у пациентов основной группы и группы сравнения (табл.).
Сроки купирования отдельных симптомов ОРВИ в группах
Лихорадка
На момент включения пациентов в исследование лихорадочный синдром наблюдался в 100% случаев как в основной группе, так и в группе сравнения.
Длительность лихорадочного синдрома в основной группе составила, в среднем, 2,88 ± 0,73 дня (медиана 3,00 [2,00–3,00]). У пациентов, получавших рекомбинантный ИФН в дозе 150 000 МЕ — 3,17 ± 0,88 дня (медиана 3,00 [3,00–4,00]) (р > 0,05).
На 2-й день исследования лихорадка сохранялась у 33 (64,70%) детей из группы препарата Генферон® лайт и у 40 (78,0%) детей из группы сравнения (р > 0,05). К 4-му дню исследования лихорадки не было ни у одного ребенка из группы препарата Генферон® лайт, а в группе сравнения лихорадка наблюдалась у 3 (5,88%) детей (р > 0,05). На 5-й лихорадка наблюдалась только в группе сравнения у 1 (1,96%) ребенка (р > 0,05). На 6–7 день исследования, по окончании приема исследуемых препаратов, лихорадка отсутствовала у всех пациентов из обеих групп (р > 0,05) (рис. 1).
На фоне приема исследуемых препаратов ни у одного ребенка не зарегистрировано случаев развития типичных для инъекционно вводимого ИФН нежелательных лекарственных реакций: утяжеления лихорадки или эпизодов резкого подъема температуры тела, связанных с проводимой терапией (так называемого гриппоподобного синдрома).
Сроки купирования симптомов интоксикации
На момент включения пациентов в исследование симптомы интоксикации наблюдались в 100% случаев в двух группах. На 6–7 день исследования, по окончании приема исследуемых препаратов, симптомы интоксикации отсутствовали у пациентов из основной группы, в группе сравнения указанные симптомы наблюдались у 1 (1,96%) ребенка (р > 0,05) (рис. 2).
Среднее время до купирования симптомов интоксикации в основной группе составило, в среднем, 3,23 ± 0,92 дня (медиана 3,00 дня [3,00; 4,00]). У пациентов, получавших рекомбинантный ИФН в дозе 150 000 МЕ — 3,19 ± 0,80 дня (медиана 3,00 дня [3,00; 4,00]) (р > 0,05). Как показали результаты статистического анализа, частота и сроки купирования интоксикации в исследуемых группах не имели достоверных отличий, характеризовались одновекторной направленностью и одинаковой динамикой.
Сроки купирования основных симптомов гриппа и других ОРВИ
Для анализа были взяты следующие симптомы воспалительных изменений верхних дыхательных путей, которые отражают течение гриппа и ОРВИ: затруднение носового дыхания, гиперемия слизистой ротоглотки, кашель.
В целом показатель среднего времени до клинического улучшения, заключавшегося в купировании основных симптомов гриппа и ОРВИ, в группе препарата Генферон® лайт составил 3,67 ± 1,14 дня, медиана 4,00 дня [3,00; 5,00], в группе сравнения в дозе 150 000 МЕ 3,71 ± 1,09 дня, медиана 4,00 дня [3,00; 4,00] (р > 0,05).
Достижение критериев реконвалесценции к 6–7 дню исследования
Пациент считался реконвалесцентом при наличии всех перечисленных критериев: отсутствие лихорадки (температура тела, измеренная в подмышечной впадине, не превышает 37,2 °С) и признаков интоксикации; полное отсутствие катаральных явлений или остаточные проявления гриппа или другой ОРВИ, выраженность которых согласно итоговому баллу не превышает 2; отсутствие осложнений гриппа или другой ОРВИ.
К 6–7 дню исследования количество детей, достигших реконвалесценции, в основной группе (препарат Генферон® лайт) составило 46 (90,20%), в группе сравнения (препарат рчИФН-α-2b) 47 (92,16%). Представленные результаты не имели статистически значимых различий (р > 0,05).
Элиминация возбудителя
В качестве дополнительного критерия были оценены результаты ПЦР-диагностики для выявления элиминационной активности препаратов.
По данным проведенного на скрининге ПЦР-исследования на возбудителей ОРВИ (гриппа А, В, парагриппа, аденовируса, риновируса, респираторно-синцитиального вируса, метапневмовируса) в группе препарата Генферон® лайт вирус гриппа А определялся у 3 (5,8%) пациентов, респираторно-синцитиальный вирус определялся у 5 (9,8%) пациентов, вирус парагриппа — у 5 (9,8%) пациентов, риновирус — у 6 (11,76%) пациентов, метапневмовирус — у 1 (1,96%) пациента. В группе препарата рчИФН-α-2b вирус гриппа А определялся у 2 (3,92%) пациентов, респираторно-синцитиальный вирус — у 6 (11,76%) пациентов, вирус парагриппа — у 3 (5,8%) пациентов, риновирус — у 8 (15,69%) пациентов, метапневмовирус — у 1 (1,96%) ребенка (р > 0,05).
Доля пациентов, у которых на 6–7 день от начала терапии зарегистрирована элиминация возбудителя по данным ПЦР-диагностики, в группе препарата Генферон® лайт составила 60% (12 случаев элиминации после лечения из 20 случаев, выявленных ПЦР-диагностикой на скрининге). В группе препарата сравнения — 30% (8 случаев элиминации после лечения из 20 случаев, выявленных ПЦР-диагностикой на скрининге) (р > 0,05) (рис. 3). В группе Генферон® лайт отмечалась тенденция к более высокой элиминационной активности.
Среднее значение баллов согласно мультипараметрической таблице
Анализ данных мультипараметрической таблицы, в которую ежедневно вносились данные с целью оценки регресса клинических проявлений ОРВИ, показал, что уже к 4 дню в обеих группах наблюдалась достоверная положительная динамика выраженности симптомов.
Среднее ежедневное значение температуры тела в течение 5 дней применения исследуемого препарата не имело статистически значимых различий между двумя группам. На момент включения медианы температуры тела пациентов, составляли в основной группе 37,5 [37,40; 38,00] °C, в группе сравнения 37,50 [37,40; 38,00] °C.
На 2-е сутки температура тела в группе препарата Генферон® лайт имела медианы 37,30 [39,90; 37,40] °C, в группе препарата Виферон® 37,30 [37,20; 37,50] °C. С 3-х суток и до окончания применения исследуемой терапии, медианы температуры тела в группах имели нормальное значение. На 6–7-е сутки медианы температуры тела в группе препарата Генферон® лайт, как и в группе препарата Виферон® составили 36,60 [36,50; 36,60] °C.
Медианы баллов выраженности симптома интоксикации на протяжении исследования в группах не имели различий и составили 1,00 балла [0,00; 1,00] в основной группе (препарат Генферон® лайт) и 1,00 балла [0,00; 1,00] в группе сравнения (препарат Виферон®).
Среднее значение баллов, отражающих выраженность катаральных симптомов гриппа или другой ОРВИ, оцениваемых ежедневно в течение 5 дней применения исследуемой терапии, также не показало статистически достоверных различий между группами (р > 0,05).
Анализ изменений гемограммы
Анализ крови выполнялся всем включенным в исследование больным. В течение периода мониторинга клинического анализа крови не было выявлено достоверной отрицательной динамики по всем исследованным параметрам (гемоглобин, эритроциты, лейкоциты, нейтрофилы, лимфоциты, тромбоциты и скорости оседания эритроцитов), за исключением увеличения процентного соотношения лимфоцитов, не выходящего по значению медиан за пределы нормы. От скрининга к визиту 2 (6–7 день исследования) прослеживалась тенденция к увеличению числа пациентов с нормализацией показателей клинического анализа крови. Различий между группой препарата Генферон® лайт и группой препарата сравнения на протяжении исследования не было (р > 0,05).
Безопасность исследуемой терапии
В ходе исследования установлено, что ректальное введение суппозиториев не вызывает местных и общих патологических реакций. Зарегистрированные нежелательные лекарственные реакции в основном представляли собой незначительные отклонения от возрастной нормы показателей гемограммы, которые, по мнению исследователей, отражали закономерные гематологические изменения при имеющейся вирусной инфекции и не были связаны с применением исследуемой терапии.
Заключение
Терапия острых инфекционных заболеваний у новорожденных и детей раннего возраста является актуальной проблемой, используемые в данной возрастной группе лекарственные средства должны обладать клинически установленной эффективностью и не оказывать негативного влияния на организм ребенка. Также крайне важно избегать полипрагмазии и учитывать степень лекарственной нагрузки при лечении детей первого года жизни.
В приведенном исследовании производилась сравнительная оценка препарата в лекарственной форме суппозиториев, содержащих комбинацию ИФН a-2b в дозе 125 000 МЕ и таурина, и препарата ИФН a-2b в дозе 150 000 МЕ в суппозиториях.
По результатам исследования установлено, что использование комбинации низкой дозы ИФН с таурином позволяет достигать как минимум не меньшей эффективности в купировании основных признаков ОРВИ по сравнению с препаратом, содержащим ИФН в большей дозе, но без высокоактивного антиоксиданта таурина.
После лечения в основной группе наблюдалась тенденция к более высокой элиминационной активности — элиминация достигнута у 60% больных, по сравнению с группой сравнения (30%).
Данные проведенного клинического исследования показали, что Генферон® лайт характеризуется хорошей переносимостью и безопасностью при применении у детей в возрасте 0–6 месяцев, страдающих ОРВИ, что обеспечивает возможность применения данного препарата в педиатрической практике у новорожденных и детей грудного возраста.
Таким образом, полученные данные позволяют заключить, что использование меньшей дозировки интерферона альфа в препарате Генферон® лайт в дозе 125 000 МЕ в комбинации с антиоксидантом таурином по сравнению с препаратом рекомбинантного интерферона в дозе 150 000 МЕ позволяет достичь одинакового терапевтического действия, что уменьшает лекарственную нагрузку на организм ребенка.
Литература
- Тимченко В. Н. Инфекционные болезни у детей: учеб. для пед. фак. мед. вузов. 3-е изд., испр. и доп. СПб: СпецЛит, 2008. 144 с.
- Ерофеева М. К., Позднякова М. Г., Максакова В. Л. Применение новых препаратов для профилактики гриппа и других ОРВИ // Русский медицинский журнал. 2011. № 8. С. 508–512.
- Горелов А. В., Феклисова Л. В., Грачева Н. М., Каннер Е. В., Погорелова О. О., Целипанова и др. Иммунотропная терапия острых респираторных вирусных инфекций в педиатрической практике — опыт клинического применения препаратов интерферона альфа // Consilium Medicum. Педиатрия. 2010. № 1.
- Колобухина Л. В. Современные возможности лечения и профилактики гриппа // РМЖ. 2005, т. 4, с. 203–205.
- Red Book: 2000. Report of the Committee on Infection Diseases. 25 rd: American Academy of Pediatrics, 2000, 855 p.
- Маркова Т. П. Профилактика и лечение респираторных инфекций // РМЖ. 2010, т. 18, № 2, с. 77.
- Володин Н. Н., Дегтярева М. В., Дегтярев Д. Н., Асмолова Г. А., Бахтикян К. К. и др. Особенности иммунологической адаптации у новорожденных детей в норме, при респираторном дистресс-синдроме и при пневмонии бактериальной этиологии // Int. J. on Immunorehabilitation. 1999, 11: 82–91.
- Seghaye M.-C., Heyl W., Grabitz R. G., Schumacher K., von Bernuth G., Rath W., Duchateau J. The Production of Pro- and Anti-Inflammatory Cytokines in Neonates Assessed by Stimulated Whole Cord Blood Culture and by Plasma Levels at Birth // Biology of the Neonate. 1998. 73 (4): 220–227.
- Велътищев Ю. Э., Длин В. В. Развитие иммунной системы у детей. М., 2005. 78 с.
- Руш К., Петере У. Кишечник — центр управления иммунной системой // Биологическая медицина. 2003, № 3, с. 4–9.
- Щеплягина Л. А., Круглова И. В. Возрастные особенности иммунитета у детей // РМЖ. 2009; 17 (23): 1564–1569.
- Зайцев А. А., Клочков О. И., Горелов А. В. Острые респираторные вирусные инфекции: перспективы противовирусной терапии // Вестник семейной медицины. 2009. № 5.
- Смирнов В. С. Современные средства профилактики и лечения гриппа и ОРВИ. СПб: ФАРМиндекс, 2008. 48 с.
- Горелов А. В., Грачева Н. М., Феклисова Л. В., Погорелова О. О. Результаты сравнительного исследования эффективности и безопасности препаратов интерферона альфа в суппозиториях у детей, больных острыми респираторными вирусными инфекциями // Инфекционные болезни. 2009. № 3.
- Горелов А. В. и др. Новые возможности в терапии острых кишечных инфекций у детей // Инфекционные болезни. 2012. Т. 10. № 1. С. 42–49.
- Коколина В. Ф. и соавт. Использование препарата Генферон лайт в лечении урогенитальных инфекций у подростков // Эфф. фармакотер. в акушерстве и гинекологии. 2009. № 2.
- Ершов Ф. И., Романцов М. Г. Лекарственные средства, применяемые при вирусных заболеваниях. М.: ГЭОТАР-Медиа, 2007. 368 с.
- Абрамченко В. В. Антиоксиданты и гипоксанты в акушерстве. СПб, 2001.
- Зарубаев В. В. и др. Протективная активность интерферона в комбинации с различными антиоксидантами в отношении экспериментальной летальной гриппозной инфекции // Русский медицинский журнал. 2012. Т. 20. № 28. С. 1416–1420.
- Штро А. А. и др. Активность интерферона в комбинации с антиоксидантами против ДНК-и РНК-содержащих вирусов человека // Лечащий врач. 2012. №. 10. С. 22–26.
И. Л. Алимова**, доктор медицинских наук, профессор
Л. В. Феклисова***, доктор медицинских наук, профессор
Е. Е. Целипанова***, кандидат медицинских наук
Е. В. Михайлова#, доктор медицинских наук, профессор
Н. М. Шведова#, кандидат медицинских наук
А. В. Романовская#, кандидат медицинских наук
Т. И. Антонова##, кандидат медицинских наук
* ФБУН ЦНИИЭ Роспотребнадзора, Москва
** ГБОУ ВПО СГМА МЗ РФ, Смоленск
*** ГУЗ ДГКБ Св. Владимира, Москва
# ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
## ГУЗ «Детская городская поликлиника № 35», Санкт-Петербург
Контактная информация: evm808@mail.ru
Купить номер с этой статьей в pdf