Ожирение является одной из наиболее актуальных медицинских и социальных проблем современного здравоохранения. Практически повсеместно количество детей с избыточным весом растет и удваивается каждые три десятилетия [3].
Известно, что с увеличением массы тела связано повышение обменно-воспалительных заболеваний билиарного тракта, заболеваемости ишемической болезнью сердца (ИБС), гипертонической болезнью (ГБ), сахарным диабетом (СД) 2-го типа, злокачественными новообразованиями. Больные ожирением III–IV степени живут в среднем на 15 лет меньше [4, 8].
В последние годы все чаще врачам различных специальностей приходится сталкиваться с таким симптомокомплексом, как метаболический синдром (МС). На сегодняшний день в МС включены следующие компоненты: инсулинорезистентность (ИР) с компенсаторной гиперинсулинемией, СД и другие нарушения толерантности к глюкозе, абдоминальное ожирение, артериальная гипертензия (АГ), атерогенная дислипидемия, неалкогольная жировая болезнь печени (НАЖБП), нарушения фибринолитической активности крови, гиперандрогения, гиперурикемия, микроальбуминурия.
В связи с тем, что клиническая манифестация этих состояний имеет место уже в детском возрасте, МС начинает признаваться как актуальная педиатрическая проблема.
Многочисленными исследованиями установлено, что ожирение сопровождается вторичным поражением печени по типу НАЖБП, включенной в критерии МС. Известно, что если средняя распространенность НАЖБП составляет 23% и колеблется в интервале 3–58%, то среди людей с избыточной массой тела она достигает 74–100%, при этом у 20–47% из них диагностируется неалкогольный стеатогепатит (НАСГ). Отмечается высокий процент патологии билиарного тракта (от 41,9% до 62,4%) у больных с ожирением. Так, частота желчнокаменной болезни (ЖКБ) у взрослых с избыточной массой тела составляет 64,7%, а при выраженном ожирении — до 100% случаев [1, 4–6].
Омоложение ЖКБ, как и ожирения, обусловлено совокупностью целого ряда факторов, таких как несбалансированное питание, стрессовые нагрузки, гиподинамия, ухудшение экологической обстановки. Как и у взрослых, у детей немаловажную роль играет наследственная предрасположенность. Другими факторами, способствующими формированию ЖКБ в детском возрасте, являются психосоматические, дисгормональные и рефлекторные дисфункции билиарного тракта, приводящие к нарушению желчеоттока.
Все больше данных свидетельствуют о том, что уровень инсулина натощак, который может быть маркером ИР, является фактором риска ЖКБ.
Как уже упоминалось выше, холестериновые камни формируются при участии нескольких патогенетических факторов, включая перенасыщенность печеночной желчи холестерином и нарушение моторики желчного пузыря (ЖП) [2]. Гиперинсулинемия и ИР могут воздействовать на каждый из этих факторов. Так, гиперинсулинемия напрямую влияет на метаболизм липидов в печени, увеличивает синтез холестерина, влияя на активность гидроксилметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктазы), повышает захват печенью липопротеинов низкой плотности (ЛПНП). Кроме того, инсулин подавляет базальную и стимулированную холецистокинином моторику ЖП. В экспериментах на мышах установлено, что у животных с нормальной массой и СД была снижена сократимость ЖП и в его полости быстро образовывались кристаллы холестерина, причем сократительная способность ЖП у животных с ожирением ослабевала по мере повышения уровня глюкозы и инсулина в крови.
Цель исследования. Изучить особенности клинического течения ЖКБ у детей с ожирением и метаболическим синдромом.
Материалы и методы. Обследован 51 ребенок с ЖКБ. В процессе исследования выделено две группы: I группа — 25 детей с ЖКБ и ожирением (SDS по ИМТ (индексу массы тела) более 1,99, средний возраст 12,06 ± 0,37 года, мальчиков — 9, девочек –16), II группа — 26 детей с ЖКБ, имеющих нормальную массу тела (SDS по ИМТ ± 0,99, средний возраст 9,68 ± 0,52 года, мальчиков — 11, девочек — 15).
Всем детям проводился комплекс лабораторно-инструментальных методов обследования, включающих ультразвуковое исследование (УЗИ) органов гепатобилиарной системы и поджелудочной железы, эндоскопическое исследование верхнего отдела ЖКТ, биохимическое исследование сыворотки крови с определением уровня печеночных ферментов, показателей углеводного и липидного обмена (глюкозы, инсулина, С-пептида, холестерина и его фракций). Диагностика МС основывалась на классификации Международной диабетической федерации (International Diabetes Federation, IDF) (2007), согласно которой о наличии МС у подростков 10–16 лет свидетельствует наличие абдоминального ожирения (окружность талии более 90 перцентили) в сочетании с не менее двумя из следующих признаков:
- уровень триглицеридов > 1,7 ммоль/л;
- уровень липопротеидов высокой плотности < 1,03 ммоль/л;
- повышение артериального давления > 130/85 мм рт. ст.;
- повышение уровня глюкозы венозной плазмы натощак > 5,6 ммоль/л или выявленный СД 2-го типа и/или другие нарушения углеводного обмена [9].
Статистическая обработка результатов проведена с использованием статистического пакета Statistika 5.5. Различия среднеарифметических величин считали достоверными при р < 0,05.
Результаты и их обсуждение. В результате проведенного обследования установлено, что признаки экзогенно-конституционального ожирения имели 15 (60,0%) детей I группы, гипоталамического ожирения — 9 (36,0%), причем у 5 (55,6%) из них гипоталамический синдром развился на фоне первичного ожирения. Еще у 1 ребенка (4,0%) диагностировано нейроэндокринное ожирение (микроаденома гипофиза). У 16 (64,0%) больных определялась I–II степень ожирения, у 11 (44,0%) — III–IV степень ожирения. В 2/3 случаев (17–68%) жировая клетчатка распределялась по абдоминальному и смешанному типу, реже — по гиноидному. Признаки МС выявлены у 16 (64,0%) детей I группы. Все дети с МС были подросткового возраста, причем половина из них (13–52,0%) — старше 12 лет.
Выявлены характерные межгрупповые возрастные различия (табл. 1).
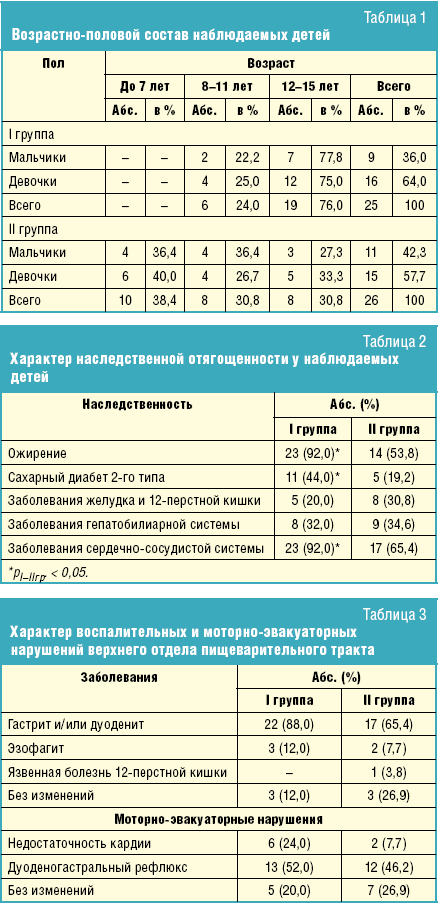
В обеих группах преобладали дети пубертатного возраста, при этом подростки 12 лет и старше в I группе встречались значительно чаще, чем во II группе, — соответственно 76,0% и 30,8% (р < 0,05). Дети младшего возраста (до 7 лет) встречались исключительно во II группе (38,4%). Полученные данные свидетельствуют о высокой частоте диагностики МС и ЖКБ у детей старшего школьного возраста, что может свидетельствовать о единых механизмах их патогенеза.
Как в I группе, так и во II группе преобладали девочки (16–64% и 15–57,7% соответственно). Преобладание лиц женского пола характерно как для ожирения, так и для ЖКБ, причем как в детском возрасте, так и у взрослых, что согласуется с данными литературы. Высокая частота заболеваемости ЖКБ среди мальчиков II группы младшего школьного возраста свидетельствует об особенностях камнеобразования и, в частности, о высокой частоте пигментного литиаза в этом возрастном периоде.
Абсолютное большинство обследованных детей имели наследственную отягощенность по различным заболеваниям обменного характера и болезням органов пищеварения (табл. 2).
Ожирение, СД 2-го типа, а также болезни сердца и сосудов (ГБ, ИБС) значительно чаще выявлялись у родственников детей I группы (р < 0,05). Заболевания органов пищеварения регистрировались чаще во II группе, значимых различий при этом не выявлено.
В обеих группах отмечены общие закономерности. Так, среди родственников, страдающих заболеваниями гепатобилиарной системы и болезнями обменного генеза, преобладали лица женского пола, тогда как заболевания ЖКТ чаще выявлялись у мужчин. Несколько чаще наследственная отягощенность прослеживалась по линии матери (11–44,0% и 12–46,2% детей I и II группы соответственно), реже — по линии обоих родителей (соответственно 6–24,0% и 6–23,1% детей).
Основными клиническими проявлениями ЖКБ у большинства детей обеих групп были болевой и диспепсический синдромы. Боли в животе в анамнезе отмечались у 19 (76,0%) детей I группы и 23 (88,5%) детей II группы. Каждый третий ребенок в обеих группах предъявлял жалобы на нарушения дефекации: неустойчивый характер стула отмечался у 8 (32,0%) детей I группы и 7 (26,9%) детей II группы, запоры — у 4 (16,0%) и 10 (38,5%) детей соответственно.
Из сопутствующей патологии со стороны органов пищеварения наиболее часто диагностировались воспалительные изменения верхнего отдела пищеварительного тракта (гастриты и/или дуодениты) и моторно-эвакуаторные нарушения (дуоденогастральный рефлюкс, недостаточность кардии) (табл. 3).
В результате проведенного эндоскопического обследования установлено, что морфофункциональные изменения слизистой пищевода на фоне нарушения деятельности верхнего кардиального сфинктера значительно чаще регистрировались у детей I группы.
Диффузные изменения поджелудочной железы в виде повышения эхогенности паренхимы, неоднородности структуры и увеличения размеров органа или его отдельных частей регистрировались у 23 (92,0%) детей I группы и 19 (73,1%) детей II группы. Увеличение поперечного размера печени при УЗИ достоверно чаще отмечалось у детей I группы, изменения паренхимы печени в виде повышения эхогенности, а также диффузной неоднородности, нечеткости сосудистого рисунка и затухания ультразвукового луча, являющиеся УЗ-признаками НАЖБП, определялись исключительно у детей I группы (табл. 4).
Различные аномалии развития ЖП регистрировались одинаково часто как у детей I, так и II группы (48,0% и 46,2% соответственно). Изменения стенки ЖП, характерные для развития холестероза, диагностировались значительно чаще у детей I группы (р < 0,05). У 2/3 детей I группы обнаруживались желчные конкременты в полости пузыря, а у 1/3 — билиарный сладж, тогда как во II группе предкаменная стадия ЖКБ определялась значительно реже — билиарный сладж в этой группе выявлялся у 11,5% больных (р < 0,05), что может свидетельствовать об отличных механизмах патогенеза камнеобразования у детей с нарушениями липидного и углеводного обмена.
Установлены характерные различия ряда показателей сыворотки крови у наблюдаемых детей (табл. 5).
У каждого четвертого ребенка I группы (7–28,0%) выявлено повышение показателя АЛТ, причем у половины из них — в 1,5 и более раз, что может свидетельствовать о течении ЖКБ на фоне формирования воспалительного процесса в печени в виде НАСГ.
У больных I группы отмечалось повышение уровня общего холестерина и триглицеридов, причем средние значения этих показателей были выше долженствующих норм для данного возраста. Значения глюкозы сыворотки крови натощак, инсулина, С-пептида и индекса ИР (НОМА-IR) были также выше у детей I группы (р < 0,05), что свидетельствует о выраженных нарушениях липидного и углеводного обмена у детей с ЖКБ, протекающей на фоне ожирения.
Таким образом, полученные данные свидетельствуют о тесной этиопатогенетической взаимосвязи холелитиаза с нарушениями углеводного и липидного обмена в детском возрасте, что требует включения в комплексную терапию детей с ожирением и тесно ассоциированным с ним МС препаратов, улучшающих морфофункциональное состояние печени и желчевыводящих путей.
Одним из препаратов выбора в лечении этой категории больных может являться препараты урсодезоксихолевой кислоты (УДХК), которая обладает доказанным спектром положительных эффектов. За счет стабилизации физико-химических свойств желчи, предотвращения осаждения кристаллов в ЖП, компенсации потерь желчных кислот и слабого холекинетического эффекта препарат способствует восстановлению моторной функции желчевыводящих путей и снижает риск образования билиарного сладжа и конкрементов в ЖП. Кроме того, он существенно уменьшает холестаз, обладает гепатопротективным, умеренным иммуномодулирующим действием, блокирует пролиферативную фазу фиброгенеза, обладает антиоксидантными свойствами.
Оптимальным и наиболее изученным лекарственным препаратом УДХК является Урсофальк, который производится в Германии с 1979 г. и применяется в большинстве стран Евросоюза в трех лекарственных формах — капсулы, таблетки и суспензия. Другие лекарственные средства, содержащие УДХК, могут иметь различия как по эффективности действия, так и по побочным реакциям. Урсофальк является референтным (эталонным) препаратом УДХК в Евросоюзе, т. е. все другие препараты УДХК для регистрации должны предоставить данные о полной фармакологической и клинической эквивалентности именно Урсофальку.
Целесообразно и патогенетически обосновано включение в комплексную терапию МС препаратов на основе пищевых волокон. К ним относится Мукофальк (псиллиум), содержащий в своем составе пищевые волокна семян подорожника овального (Plantago ovata). При приеме Мукофалька образующаяся в тонкой кишке гельформирующая фракция связывает желчные кислоты (ЖК), снижая их реабсорбцию в терминальном отделе подвздошной кишки и увеличивая их экскрецию с калом. Потеря ЖК активизирует внутриклеточную 7-альфа-гидроксилазу холестерина, что приводит к повышенному образованию ЖК из холестерина и уменьшению его запасов внутри клеток. Как следствие повышается активность рецепторов ЛПНП на поверхности клеток и увеличивается экстракция холестерина ЛПНП из крови, что приводит к снижению уровня холестерина в плазме крови. В связи с тем, что сорбируются желчные кислоты неодинаково (свободные ЖК связываются больше, чем конъюгаты), снижается индекс литогенности желчи. Растворимые объем-формирующие вещества расщепляются кишечной микрофлорой на короткоцепочечные жирные кислоты, ингибирующие ГМГ-КоА-редуктазу, что снижает новый синтез холестерина. Псиллиум способствует снижению уровня глюкозы крови, замедляя всасывание сахара в тонкой кишке. Уменьшается и всасывание холестерина из кишечника.
Выводы
- ЖКБ у детей, страдающих ожирением, с высокой частотой сочетается с МС (64%) и абдоминальным характером распределения жировой ткани (68%).
- Среди детей с ЖКБ, протекающей на фоне ожирения, значительно чаще выявляются подростки 12 лет и старше (44%, р < 0,05).
- Установлена высокая частота наследственной отягощенности по заболеваниям сердечно-сосудистой системы, болезням обменного характера у детей с ЖКБ, протекающей на фоне ожирения, что оказывает определенное влияние на формирование и течение заболевания у данной категории больных.
- Высокая частота диагностики у детей с ожирением предкаменной стадии ЖКБ может свидетельствовать об особенностях формирования желчных конкрементов у этой категории больных.
- У детей с ожирением и МС с высокой частотой ЖКБ сочетается с диффузными изменениями печени и поджелудочной железы, характерными для развития стеатоза, воспалительными и моторными нарушениями верхнего отдела ЖКТ.
- Патогенетически обосновано включение в комплексную терапию детей с ЖКБ, протекающей на фоне ожирения и МС, препаратов УДХК (Урсофальк) и псиллиума (Мукофальк), оказывающих спектр положительных эффектов на липидный и углеводный обмен, улучшающих морфофункциональное состояние гепатобилиарной системы, снижающих литогенность желчи.
- Бокова Т. А., Урсова Н. И. Патология гепатобилиарной системы у детей и подростков с ожирением и метаболическим синдромом // Врач. 2011, № 1, с. 56–58;
- Герок В. Заболевания печени и желчевыделительной системы. М.: МЕДпресс-информ, 2009. 199 с.
- Дедов И. И., Мельниченко Г. А. Ожирение в подростковом возрасте. Результаты российского эпидемиологического исследования // Терапевт. архив. 2007. № 10, с. 28–32.
- Лазебник Л. Б., Звенигородская Л. А. Метаболический синдром и органы пищеварения. М., 2009. 177 с.
- Маев И. В., Дичева Д. Т. Патогенетические механизмы формирования патологии гепатобилиарной системы у больных с метаболическим синдромом и пути их коррекции // Consilium medicum. Гастроэнтерология. 2008, № 2, с. 33–36.
- Успенский Ю. П., Балукова Е. В. Метаболический синдром и неалкогольный стеатогепатит: причинно-следственный континуум // Consilium medicum. Гастроэнтерология. 2009, № 1, с. 41–45.
- Харитонова Л. А., Запруднов А. М. Обменно-воспалительные заболевания билиарного тракта у детей (алгоритмы диагностики и лечения). М., 2010, 36 с.
- Чазова И. Е., Мычка В. Б. Профилактика, диагностика и лечение метаболического синдрома. М., 2005. 48 с.
- Zimmet P., Alberti G. The metabolic syndrome in children and adolescents // Lancet. 2007. 369: 2059–2961.
Т. А. Бокова, кандидат медицинских наук, доцент
ГБУЗ МОНИКИ им. М. Ф. Владимирского, Москва
Контактная информация об авторе для переписки: bta2304@mail.ru
Купить номер с этой статьей в pdf