Резюме. При критических состояниях одним из самых частых нарушений кислотно-основного состояния является метаболический ацидоз. При этом незаслуженно забытым параметром при диагностике метаболического ацидоза является анионный пробел плазмы. Целью исследования было определить возможности использования анионного пробела плазмы для дифференциальной диагностики метаболического ацидоза у новорожденных с неонатальным сепсисом. Для реализации поставленной цели проведено обследование пациентов отделения реанимации и интенсивной терапии для новорожденных. Критериями включения в исследование были период новорожденности, наличие неонатального сепсиса, лабораторные признаки метаболического ацидоза. Всего под наблюдением находились 17 новорожденных детей с неонатальным сепсисом. Диагноз неонатального сепсиса устанавливался на основании подозреваемой или документированной инфекции в сочетании с остро возникшей органной дисфункцией, о развитии которой судили по индексу шкалы pSOFA на 2 балла и более от базового значения. Метаболический ацидоз был выявлен у 5 пациентов. У новорожденных с неонатальным сепсисом чаще регистрировался метаболический ацидоз с ростом анионного пробела плазмы, что обусловлено лактатным ацидозом в результате накопления молочной кислоты как маркера тканевой гипоксии. Уменьшение анионного пробела плазмы выявлялось реже и могло свидетельствовать о потерях бикарбонатного аниона через желудочно-кишечный тракт или в результате гипоальбуминемии. Показано, что анионный пробел плазмы может служить дополнительным информационным критерием для характеристики метаболического ацидоза. Расчет анионного пробела плазмы является недорогим и эффективным инструментом, способным помочь провести дифференциальный диагноз метаболического ацидоза у новорожденных с неонатальным сепсисом для назначения адекватной интенсивной терапии.
При критических состояниях одним из самых частых нарушений кислотно-основного состояния (КОС) является метаболический ацидоз (МА). МА возникает при самых различных заболеваниях и может привести к летальному исходу [1, 2]. Частота возникновения тяжелого МА у пациентов отделений реанимации и интенсивной терапии (ОРИТ) может составлять 6% и коррелировать с высоким уровнем смертности – до 57% [3].
Клинические симптомы МА неспецифичны, но при этом накопление водородных ионов ([Н+]) в организме приводит к нарушению органных функций в виде легочной гипертензии, ишемии почек, угнетения сократительной способности миокарда, расстройств мозгового кровообращения [4], нарушений жизнедеятельности клеток вплоть до их гибели [5]. Поэтому от раннего распознавания и лечения основной причины МА зависит выживаемость пациентов. Основные причины МА сводятся к задержке в организме сильно диссоциирующих кислот и/или потере бикарбонатного аниона (HCO3-) [6-8].
При лабораторной диагностике МА применяются современные автоматические газовые анализаторы крови с возможностью измерения нескольких десятков расчетных параметров. Практически каждый из этих параметров является инструментом для получения информации о нарушении гомеостаза в целом и МА [9]. Примером такого параметра может служить анионный пробел плазмы (АПП). Мы согласны с мнением, что этот показатель является незаслуженно забытым при экспресс-диагностике МА [10]. При МА может встречаться как увеличенный, так и уменьшенный АПП, но наибольшее значение представляет увеличенный АПП. В англоязычной медицинской литературе этот параметр обозначен единым термином «anion gap» (или аббревиатурой AG) [11].
Следует сказать, что плазма крови представляет собой водный раствор, который содержит вещества, имеющие как положительный (катионы), так и отрицательный (анионы) заряд, в совокупности называемые ионами [5]. На основании закона электрохимической нейтральности сумма катио-нов всегда равна сумме анионов. Этот закон представлен на рисунке, где графически отображена концентрация основных ионов в сыворотке крови [12].
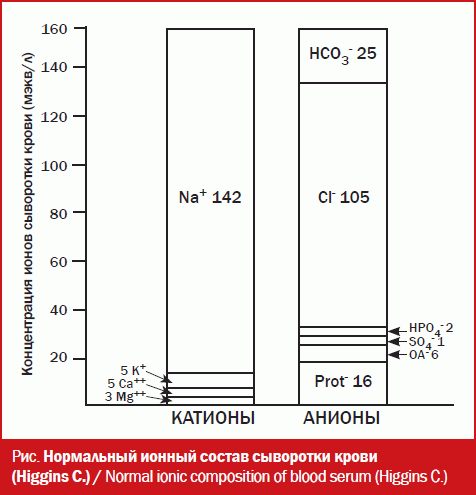
Как видно из рисунка, количественно наиболее значимым катионом в сыворотке крови является натрий (Na+), а наиболее значимыми анионами являются хлоридный (Cl-) и бикарбонатный (HCO3-).
В клинической лабораторной практике обычно измеряется содержание именно этих ионов. При этом концентрация основного катиона натрия (142 ммоль/л) превышает суммарную концентрацию двух основных анионов – хлорида и бикарбоната (130 ммоль/л) на 12 ммоль/л. АПП определяется как разница между концентрацией натрия в плазме и суммой концентраций хлорида и бикарбоната. АПП (ммоль/л) = [Na
Рассчитанный АПП отражает тот факт, что концентрация обычно измеряемых катионов превышает концентрацию обычно измеряемых анионов, а закон электрохимической нейтральности требует, чтобы общий АПП после учета суммарной концентрации всех неизмеренных катионов [UC] и всех неизмеренных анионов [UA] был равен нулю: АПП = ([Na+] + [UC]) – ([Cl-] + [HCO3-] + [UA]) = 0. Таким образом, «рассчитанный» АПП отражает неравенство между объединенной концентрацией неизмеренных анионов [UA] и объединенной концентрацией неизмеренных катионов [UC]. Одновременно АПП является такой же функцией концентрации неизмеренных ионов, как концентрации измеренных ионов (Na+, Cl-, HCO3-), что и используется для расчета. Из приведенного выше уравнения можно считать: [Na+] + [UC] = [Cl-] + [HCO3-] + [UA] или [Na+] – ([Cl-] + [HCO3-]) = [UA] – [UC] и поскольку АПП = [Na+] – ([Cl-] + [HCO3-]), то АПП = [UA] – [UC]. Поэтому АПП также можно определить как разницу между неизмеренными катионами и неизмеренными анионами [15, 16].
Аномальный АПП является довольно распространенным явлением среди пациентов ОРИТ. В клинической практике при МА чаще встречается увеличенный АПП [17]. Теоретически, увеличенный АПП может быть результатом либо уменьшения неизмеренных катионов, либо увеличения неизмеренных анионов. На практике это почти исключительно результат увеличения неизмеренных анионов, полученных из метаболических кислот. Таким образом, МА является наиболее распространенной причиной увеличения АПП. При МА происходит высвобождение во внутреннюю среду организма огромного количества [Н+]. В ответ на образование большого количества кислот включается в процесс главный буфер внеклеточной жидкости HCO3- и происходит снижение его уровня в плазме крови. Возможны и прямые потери HCO3- или неадекватный синтез HCO3- почками. Электронейтральность плазмы при снижении HCO3- поддерживается за счет роста Cl- с развитием гиперхлоремического МА, но с нормальным АПП. Однако чаще электронейтральность плазмы поддерживается неизмеряемыми патологическими анионами, в этом случае Cl- заменяется другими анионами с развитием гипо-хлоремического МА с увеличенным АПП [12]. Таким образом, патологическое накопление любой кислоты, не содержащей хлорида, может вызвать возникновение МА с ростом АПП. В связи с тем что HCO3- расходуется на инактивацию [Н+] кислоты, анион кислоты накапливается, тем самым сохраняя электрохимический нейтралитет. Поскольку накапливающийся анион «не измерен», АПП увеличивается.
В связи с вышеизложенным, для дифференциальной диагностики МА в клинической практике можно использовать АПП. МА подразделяют на ацидоз с ростом АПП и без роста АПП [18]. Наиболее часто встречающиеся причины МА в зависимости от АПП представлены в табл. 1.
Обращает на себя внимание работа J. Kraut, N. Madias, в которой авторы предполагают, что полезность АПП не так очевидна, как считалось ранее. Однако при этом исследователи подчеркивают, что для диагностики сложных расстройств КОС необходимо использовать АПП не изолированно, а в сочетании с другими константами [19]. Поэтому рассчитанный АПП должен интерпретироваться в каждом конкретном случае индивидуально [20]. Резюмируя вышеизложенное, можно предположить, что при МА происходит одновременное увеличение содержания лактата и АПП. Эта корреляция, возможно, позволит использовать АПП в качестве теста для определения роста уровня молочной кислоты у пациентов в критическом состоянии.
Следует отметить, что МА чаще встречается у детей периода новорожденности. У этих пациентов более интенсивные обменные процессы, которые требуют поддержания постоянной температуры с большим потреблением энергии и образованием нелетучих кислых метаболитов – 2-3 ммоль/кг вместо 1 ммоль/кг у взрослых. Синтез белка происходит в 20 раз интенсивнее, чем у старших детей. В сутки у новорожденных образуется 330 ммоль/кг углекислоты вместо 280 ммоль/кг у взрослых. Образование HCO
Целью данного исследования было определить возможности использования АПП для дифференциальной диагностики МА у новорожденных с неонатальным сепсисом.
Материалы и методы исследования
Для реализации поставленной цели проведено обследование пациентов в ОРИТ для новорожденных (Областная детская клиническая больница им. Н. Н. Силищевой). Критерии включения пациентов в исследование: период новорожденности, наличие неонатального сепсиса, лабораторные признаки МА. Диагноз неонатального сепсиса устанавливался на основании заподозренной или документированной инфекции в сочетании с остро возникшей органной дисфункцией [22-24], о развитии которой судили по отклонению индекса шкалы pSOFA на 2 балла и более от базового значения [25, 26]. У всех пациентов в момент манифестации клинической симптоматики неонатального сепсиса проведено исследование показателей газов крови, КОС, содержания ионов и АПП. Определение КОС и газов проводилось в капиллярной крови с помощью аппарата «EASY BLOOD GAS» (Medica Corp., США). Уровень основных ионов определялся в сыворотке крови с помощью аппарата «EASYLYTE Na/K» (Medica Corp., США). Содержание хлорида в сыворотке крови определялось аппаратом «MINDRAY BS 120» (Mindray, США). При статистической обработке материала проводилось определение среднего арифметического и среднеквадратичного отклонения (M ± m) некоторых показателей.
Результаты и их обсуждение
Всего под наблюдением находилось 17 новорожденных детей с неонатальным сепсисом. МА был выявлен у 5 пациентов. Из них было 2 доношенных и 3 недоношенных ребенка. Гестационный возраст пациентов – 32 ± 4,9 недели, масса тела при рождении – 1504 ± 844 г.
У 5 пациентов с неонатальным сепсисом был зарегистрирован декомпенсированный МА, который проявлялся сниженными значениями pH и HCO3-. При этом у новорожденных доминировала клиническая симптоматика неонатального сепсиса.
Основные показатели КОС и рассчитанный АПП (ммоль/л) по формуле [Na+] – ([Cl-] + [HCO3-]) представлены в табл. 2.
У 4 пациентов определялся МА с ростом АПП более 15 ммоль/л (табл. 2). На основании полученных данных был проведен дифференциальный диагноз МА. Как известно, одной из причин МА с ростом АПП (табл. 1) может быть метаболический кетоацидоз. Этот вариант ацидоза может возникать при сохраненной способности δ-клеток поджелудочной железы синтезировать инсулин. К такому кетоацидозу приводит гипогликемия как причина угнетения синтеза инсулина. В этих случаях концентрация HCO3- обычно не падает ниже 18 ммоль/л, а АПП не увеличивается более 19 ммоль/л [18]. Поэтому введение глюкозы пациентам прек-ращает кетогенез, и метаболический кетоацидоз купируется.
Всем пациентам с неонатальным сепсисом проводилось внут-ривенное введение глюкозы. Уровень глюкозы крови у новорожденных был 5,26 ± 3 ммоль/л. Гипогликемия (2,2 ммоль/л) отмечалась у одного пациента и была кратковременной. Второй вариант метаболического кетоацидоза может возникать вследствие патологических изменений δ-клеток поджелудочной железы (диабетический кетоацидоз), который купируется введением инсулина [27]. У 2 пациентов в момент обследования отмечалась кратковременная гипергликемия (глюкоза крови была соответственно 7,5 и 10,2 ммоль/л). Однако эта клиническая ситуация не расценивалась как вариант диабетического кетоацидоза, пациенты не получали инсулин. Кратковременная гипергликемия у пациентов трактовалась как стрессовая реакция на сепсис. На основании этих данных можно считать, что этиопатогенетическая причина МА с ростом АПП в результате метаболического кетоацидоза была исключена.
Еще одним вариантом МА с ростом АПП у пациентов может быть острое почечное повреждение (ОПП, табл. 1). По некоторым данным при сепсисе у детей в 21% случаев может возникать ОПП, которое, как правило, сопровождается МА и в дальнейшем становится самостоятельным фактором риска летального исхода [28]. У всех обследованных новорожденных в момент определения КОС и основных ионов в сыворотке крови клинико-лабораторные признаки ОПП отсутствовали.
У взрослых пациентов причиной МА с ростом АПП может быть интоксикация различными ядами (табл. 1). В клинической практике чаще всего встречается интоксикация этиленгликолем и метанолом, в результате которой происходит метаболизм этих соединений в гликолевую и муравьиную кислоты [29]. У обследованных нами пациентов эта причина МА с ростом АПП, естественно, была исключена.
Следует отметить, что существуют и другие причины, которые могут привести к небольшому увеличению АПП. В частности, повышенный уровень сывороточного альбумина (гипер-альбуминемия) может увеличить АПП по тому же механизму, по которому снижение сывороточного альбумина (гипоальбуминемия) уменьшает АПП [30]. У 2 пациентов отмечался нормальный уровень сывороточного альбумина (32 и 36 г/л). В 3 случаях была выявлена гипоальбуминемия (24, 16 и 22 г/л), которая довольно часто возникает при неонатальном сепсисе.
Только в одном случае (табл. 2) при неонатальном сепсисе был зафиксирован МА без роста АПП (6 ммоль/л). Этот пациент был с основным диагнозом «ранний неонатальный сепсис, некротизирующий энтероколит, перитонит, операция – дренирование брюшной полости». В данном клиническом случае можно предположить, что МА без роста АПП мог быть обусловлен потерями HCO3- из желудочно-кишечного тракта. Одновременно с этим из предшествующего обсуждения значения АПП было очевидно, что уменьшение его теоретически произойдет, если будет иметь место увеличение неизмеренных катионов или уменьшение неизмеренных анионов [12]. Поскольку альбумин является наиболее распространенным из преимущественно анионных белков в сыворотке и его снижение уменьшает АПП, поэтому другой возможной причиной МА без роста АПП у этого пациента могла быть гипоальбуминемия (22 г/л). Таким образом, на основании проведенного дифференциального диагноза получено, что МА с ростом АПП у новорожденных с неонатальным сепсисом чаще всего обусловлен лактатным ацидозом.
Выводы
- АПП является дополнительным информационным критерием для характеристики МА, который можно легко подсчитать на основании биохимического профиля ионов и без значительных экономических затрат.
- У новорожденных с неонатальным сепсисом чаще регистрировался МА с ростом АПП, что обусловлено лактатным ацидозом в результате накопления молочной кислоты как маркера тканевой гипоксии. Это объясняется повреждением собственных тканей и органов при сепсисе с расстройствами клеточного метаболизма и развитием целлюлярной дисфункции.
- Уменьшение анионного пробела плазмы выявлялось реже и могло свидетельствовать о потерях бикарбонатного аниона через желудочно-кишечный тракт или в результате гипоальбуминемии.
- Расчет АПП является недорогим и эффективным инструментом, который может помочь провести дифференциальный диагноз МА у новорожденных с неонатальным сепсисом для проведения адекватной интенсивной терапии.
КОНФЛИКТ ИНТЕРЕСОВ. Автор статьи подтвердил отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- Kraut J. A., Madias N. E. Metabolic acidosis: pathophysiology, diagnosis and management // Nat. Rev. Nephrol. 2010. Vol. 6, № 5, p. 274-285.
- Тепаев Р. Ф., Ластовка В. А., Пыталь А. В., Савлук Ю. В. Метаболический ацидоз: диагностика и лечение // Педиатрическая фармакология. 2016. Т. 13, № 4, с. 384-389. [Tepaev R. F., Lastovka V. A., Pytal' A. V., Savluk Yu. V. Metabolic acidosis: diagnosis and treatment // Pediatricheskaya farmakologiya. 2016, T. 13, № 4, pp. 384-389.]
- Jung B., Rimmele T., Le Goff C. et al. Severe metabolic or mixed acidemia on intensive care unit admission: incidence, prognosis and administration of buffer therapy. A prospective, multiple-center study // Crit. Care. 2011. Vol. 15, № 5, R238.
- Кирилочев О. К. Шкале Апгар 60 лет // Российский вестник перинатологии и педиатрии. 2012. № 2, с. 9-11. [Kirilochev O. K. Apgar scale 60 years // Rossijskij vestnik perinatologii i pediatrii. 2012. № 2, pp. 9-11.]
- Литвицкий П. Ф. Нарушения кислотно-основного состояния // Вопросы современной педиатрии. 2011. T. 10, № 1, с. 83-92. [Litvickij P. F. Acid-base disorders // Voprosy sovremennoj pediatrii. 2011. T. 10, № 1, pp. 83-92.]
- Халиуллина С. В., Анохин В. А., Хаертынов Х. С., Назарова О. А. Метаболические нарушения при острых инфекционных диареях у детей // Российский вестник перинатологии и педиатрии. 2017. T. 62, № 5, с. 161-166. [Haliullina S. V., Anohin V. A., Haertynov H. S., Nazarova O. A. Metabolic disorders in acute infectious diarrhea in children // Rossijskij vestnik perinatologii i pediatrii. 2017. T. 62, № 5, pp. 161-166.]
- Andrade O. V., Ihara F. O., Troster E. J. Metabolic acidosis in childhood: why, when and how to treat // J. Pediatr. (Rio. J. ). 2007. Vol. 83, № 2, p. 11-21.
- Скворцов В. В., Скворцова Е. М., Бангаров Р. Ю. Лактатацидоз в практике врача — анестезиолога-реаниматолога // Вестник анестезиологии и реаниматологии. 2020. T. 17, № 3, с. 95-100. [Skvorcov V. V., Skvorcova E. M., Bangarov R. YU. Laktat-acidoz v praktike vracha? anesteziologa-reanimatologa // Vestnik anesteziologii i reanimatologii. 2020. T. 17, № 3, pp. 95-100.]
- Kraut J. A., Madias N. E. Lactic Acidosis // N. Engl. J. Med. 2014. Vol. 371, № 24, p. 2309-2319.
- Торшин В. А. Измеряемые и расчетные параметры анализа газов крови у больных в критическом состоянии. Клиническая значимость анионного промежутка // Российский вестник детской хирургии, анестезиологии и реаниматологии. 2014. T. 14, № 4, с. 109-112. [Torshin V. A. Measured and calculated parameters of blood gas analysis in critically ill patients. Clinical significance of the anion gap // Rossijskij vestnik detskoj hirurgii, anesteziologii i reanimatologii. 2014; T. 14, № 4, pp. 109-112.]
- Berkman M., Ufberg J., Nathanson L. A., Shapiro N. I. Anion gap as a screening tool for elevated lactate in patients with increased risk of developing sepsis in the emergency department // J. Emerg. Med. 2009. Vol. 36, № 4, p. 391-394.
- Higgins C. Clinical aspects of the anion gap. 2009. www.acutecaretesting.org.
- Emmett M., Nairns R. Clinical use of the anion gap // Medicine. 1977. Vol. 56, № 1, p. 38-54.
- Roberts W. L., Johnson R. D. The serum anion gap. Has the reference interval really fallen? // Arch. Pathol. Lab. Med. 1997. Vol. 121, № 6, p. 568-572.
- Bartlett D. Understanding the anion and osmolal gaps. Laboratory values: What they are and how to use them // J. Emerg. Nursing. 2005. Vol. 31, № 1, p. 109-111.
- Lolekha P., Vanavanan S., Lolekha S. Update on value of the anion gap in clinical diagnosis and laboratory evaluation // Clin. Chim. Acta. 2001. Vol. 307 (1-2), p. 33-36.
- Lolekha P., Lolekha S. Value of the anion gap in clinical diagnosis and laboratory evaluation // Clin. Chem. 1983. Vol. 29, № 2, p. 279-283.
- Шанин В. Ю. Клиническая патофизиология. СПб: Элбис-СПб, 2003. С. 436. [Shanin V. Yu. Clinical pathophysiology. SPb: Elbis-SPb, 2003. P. 436.]
- Kraut J., Madias N. Serum anion gap: its uses and limitations in clinical medicine // Clin. J. Am. Soc. Nephrol. 2007. Vol. 2, № 1, p. 162-174.
- Hughes D., Doery J. C., Choy K. W., Flatman R. Calculated Chemistry Parameters – do they need to be harmonised? // Clin. Biochem. Rev. 2016. Vol. 37, № 3, p. 131-134.
- Шабалов Н. П. Неонатология: в 2 т. Т. 1: учеб. пособие. 6-е изд., испр, и доп. М.: ГЕОТАР-Медиа, 2016. С. 704. [Shabalov N. P. Neonatology: in 2 volumes. Vol. 1: textbook. allowance. 6th ed., Revised, and additional. GEOTAR-Media, 2016. P. 704.]
- Seymour C. W., Liu V. X., Iwashyna T. J. et al. Assessment of clinical criteria for sepsis: for the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3) // JAMA. 2016. Vol. 315, № 8, p. 762–774.
- Shankar-Hari M., Phillips G., Levy M. et al. Developing a new definition and assessing new clinical criteria for septic shock for the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3) // JAMA. 2016. Vol. 315, № 8, p. 775-787.
- Кирилочев О. К., Жидовинов А. А., Дорфман И. П. и др. Клинические варианты поражения гепатобилиарной системы у новорождённых при внутриутробных инфекциях и сепсисе // Астраханский медицинский журнал. 2019. № 1, с. 85-92. [Kirilochev O. K., ZHidovinov A. A., Dorfman I. P. i dr. Clinical variants of lesions of the hepatobiliary system in newborns with intrauterine infections and sepsis // Astrahanskij medicinskij zhurnal. 2019. № 1, pp. 85-92.]
- Matics T. J., Sanchez-Pinto L. N. Adaptation and validation of a pediatric sequential organ failure assessment score and evaluation of the Sepsis-3 definitions in critically ill children // JAMA Pediatr. 2017. Vol. 171: e 172352.
- Schlapbach L. J., Straney L., Bellomo R. et. al. Prognostic accuracy of age-adapted SOFA, SIRS, PELOD-2, and qSOFA for in-hospital mortality among children with suspected infection admitted to the intensive care unit // Intensive Care. Med. 2018. Vol. 44, № 2, p. 179-188.
- Kim S. Y. Endocrine and metabolic emergencies in children: hypocalcemia, hypoglycemia, adrenal insufficiency, and metabolic acidosis including diabetic ketoacidosis // Ann. Pediatr. Endocrinol. Metab. 2015. Vol. 20, p. 179–186.
- Fitzgerald J. C., Basu R. K., Akcan-Arikan A. et al. Acute Kidney Injury in Pediatric Severe Sepsis: An Independent Risk Factor for Death and New Disability // Crit. Care. Med. 2016. Vol. 44, № 12, p. 2241-2250.
- Mycyk M., Aks S. A. Visual schematic for clarifying the temporal relationship between the anion and osmol gaps in toxic alcohol poisoning // Am. J. Emerg. Med. 2003. Vol. 21, № 4, p. 333-335.
- Feldman M., Soni N., Dickson B. Influence of hypoalbuminemia or hyperalbuminemia on the serum anion gap // J. Clin. Lab. Med. 2005. Vol. 146, № 6, p. 317-320.
ФГБОУ ВО Астраханский ГМУ Минздрава России, Астрахань, Россия
Контактная информация: kirilochevoleg@gmail.com
Клиническое значение расчета анионного пробела плазмы при метаболическом ацидозе у новорожденных с неонатальным сепсисом/ О. К. Кирилочев
Для цитирования: Кирилочев О. К. Клиническое значение расчета анионного пробела плазмы при метаболическом ацидозе у новорожденных с неонатальным сепсисом // Лечащий Врач. 2021; 9 (24): 44-47. DOI: 10.51793/OS.2021.24.9.008
Теги: период новорожденности, неонатальный сепсис, диагностика
Купить номер с этой статьей в pdf