Хандаева Патимат Магомедовна, к.м.н., врач-эндокринолог
Матюшкина Анна Сергеевна, врач-эндокринолог
Белопахов Дмитрий Сергеевич, старший научный советник проекта PMI science
Резюме. С каждым годом увеличивается число больных с сахарным диабетом (СД). По последним данным ВОЗ и Международной федерации диабета (IDF) число больных СД в возрасте от 20 до 79 лет на 2019 год составляло примерно 463 млн человек. СД является ключевой причиной 1.5 млн смертей и косвенно способствует дополнительным 17.5 млн смертей ежегодно. Сахарный диабет 2 типа (СД2) составляет 90-95% случаев диабета и выражается нарушением углеводного обмена, вызванным преимущественно инсулинорезистентностью и прогрессирующей потерей функции и массы β-клеток, что приводит к нарушению секреции инсулина и относительной инсулиновой недостаточности. Поскольку риск СД2 тесно связан с окружающей средой, питанием и образом жизни человека, выявление известных факторов риска путем ранней модификации образа жизни остается наиболее эффективной стратегией снижения распространенности заболеваний и смертности. По различным литературным данным курение увеличивает риск СД2 на 30-40% у активных курильщиков по сравнению с некурящим населением, а значит отказ от курения следует рассматривать как важнейшую стратегию общественного здравоохранения для борьбы с глобальной эпидемией диабета. Целью настоящей работы было освещение патогенетических механизмов курения и его влияния на риски и течение СД.
Введение
С каждым годом увеличивается число больных с сахарным диабетом (СД). По последним данным ВОЗ и Международной федерации диабета (IDF) число больных СД в возрасте от 20 до 79 лет на 2019 год составляло примерно 463 млн человек. СД является ключевой причиной 1.5 млн смертей и косвенно способствует дополнительным 17.5 млн смертей ежегодно [1].
Сахарный диабет 2 типа (СД2) составляет 90-95% случаев диабета и выражается нарушением углеводного обмена, вызванным преимущественно инсулинорезистентностью и прогрессирующей потерей функции и массы β-клеток, что приводит к нарушению секреции инсулина и относительной инсулиновой недостаточности [2]. Поскольку риск СД2 тесно связан с окружающей средой, питанием и образом жизни человека, выявление известных факторов риска путем ранней модификации образа жизни остается наиболее эффективной стратегией снижения распространенности заболеваний и смертности [3].
По различным литературным данным курение увеличивает риск СД2 на 30-40% у активных курильщиков по сравнению с некурящим населением, а значит отказ от курения следует рассматривать как важнейшую стратегию общественного здравоохранения для борьбы с глобальной эпидемией диабета [4].
Целью настоящей работы было освещение патогенетических механизмов курения и его влияния на риски и течение СД.
Статистика курения и сахарного диабета
Резкое увеличение распространенности СД представляет собой серьезную проблему для общественного здравоохранения. СД характеризуется хронической гипергликемией, которая вызывает необратимое повреждение кровеносных сосудов и, следовательно, приводит к макрососудистым (ишемическая болезнь сердца, цереброваскулярные заболевания, заболевания артерий нижних конечностей), микрососудистым (диабетическая ретинопатия и нефропатия) осложнениям и неврологическим нарушениям (диабетическая нейропатия) [2, 5].
Курение является одним из наиболее важных модифицируемых факторов риска развития СД [6]. Воздействие сигаретного дыма связано с повреждением сосудов, эндотелиальной дисфункцией и активацией каскада свертывания крови [7]. Хроническая гипергликемия в комбинации с токсическим действием сигарет ускоряет повреждение сосудов у курящих людей с диабетом. Общепризнано, что курение сигарет существенно увеличивает риск микро- и макрососудистых осложнений у пациентов с СД 2 типа [8,9], в то время как отказ от курения существенно снижает этот риск [10].
По ВОЗ данным 2018 года, распространенность курения среди людей старше 15 лет составила 28.3 % (40.9 % среди мужчин, 15.7 % среди женщин). В 2019 году Росстат провел выборочную оценку поведенческих факторов населения: почти четверть россиян в возрасте старше 15 лет постоянно потребляли табак (24.2 %).
У американских женщин в постменопаузе, выкуривающих в среднем 16.2 сигареты в день, риск развития СД был в 1.28 раза выше, чем у женщин, которые бросили курить. Стоит отметить, что после 10 лет отказа от курения риск развития диабета становился эквивалентен прежде не курящим людям [11]. В проспективном исследовании корейской когорты из 1 236 443 мужчин и женщин в возрасте 30-95 было показано, что курение связано с повышенным риском резистентности к лечению диабета, госпитализации и смертности как среди мужчин, так и среди женщин, причем риск увеличивался пропорционально количеству выкуриваемых в день сигарет.
В исследованиях также изучалась связь между курением и гликемией. В крупном перекрестном исследовании с участием 2 704 мужчин и 3 385 женщин, проведенном в рамках Европейского исследования рака (EPIC-Norfolk), курение сигарет было независимо связано с более высокими концентрациями гликированного гемоглобина (HbA1c), который отражает среднию гликемию в течение 3 месяцев и является одним из наиболее чувствительных показателей течения СД. Так, в исследовании было показано, что за 20 лет курения уровень HbA1 повышался на 0.12% [12]. Аналогично, как показывают данные Национального исследования здоровья и питания с участием 17 287 взрослых без диабета, у курильщиков уровень HbA1c увеличивался на 7% по сравнению с теми, кто никогда не курил [13].
Взаимосвязь между кумулятивным воздействием курения и развитием преддиабета была продемонстрирована в исследовании с участием 2 142 здоровых европейцев (от 25 до 41 года), в котором был выявлен повышенный риск преддиабета у курильщиков по сравнению с некурящими [14]. Эти данные указывают на то, что курение, вероятно, ускоряет развитие нарушения толерантности к глюкозе, способствуя развитию резистентности к инсулину [15].
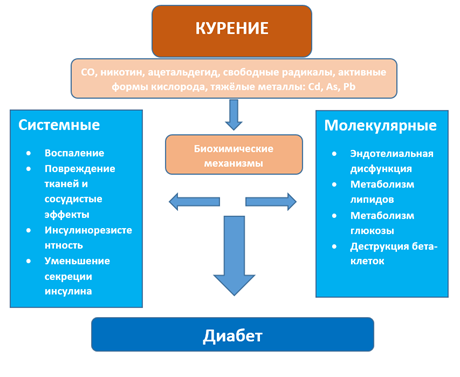
Рисунок 1. Патогенетические механизмы влияния курения и на СД [15].
Как известно, избыточная масса тела, ожирение и нарушения в балансе подкожного и висцерального жира играют одну из ключевых ролей в развитии инсулинорезистетности и нарушения толерантности к глюкозе – механизмов, лежащих в основе развития и прогрессирования СД.
Соотношение талии и бедер используется в практике врачей как показатель состояния здоровья человека и индикатор наличия абдоминального ожирения. По данным ВОЗ абдоминальное ожирение соответствует соотношению талии и бедер >0.90 для мужчин и >0.85 для женщин [17].
Анализ данных 21 828 мужчин и женщин в возрасте от 45 до 79 лет в Великобритании показал, что у курильщиков соотношение талии и бедер было выше по сравнению с некурящими, причем показатель достоверно коррелировал с количеством выкуриваемых сигарет в день [18]. Кроме того, в исследовании 513 японских мужчин увеличение продолжительности курения в течение жизни служило предиктором повышения соотношения талии и бедра и отношения висцеральной жировой ткани и подкожной жировой ткани по данным компьютерной томографии (КТ) [19]. Эти результаты подтверждают общее представление о том, что курение оказывает значимое влияние на изменение распределения подкожно-жировой клетчатки.
В соответствии с этими изменениями курение способствует снижению чувствительности периферических тканей к инсулину и ухудшению толерантности к глюкозе у 20 курильщиков, которым был выполнен клэмп-тест [20]. Изменения функции β-клеток поджелудочной железы в исследовании было связано с открытием дополнительных нейрональных никотиновых ацетилхолиновых рецепторов (ННАР) на поверхности β-клеток. Примечательно, что значимое снижение секреции инсулина β-клетками наблюдалось как в случае кратковременного (60 минут), так и длительного (48 ч) воздействия никотина. Полученные данные свидетельствуют о том, что ННАР играют важную роль в контроле секреции инсулина β-клетками, а стимуляция данных рецепторов во время курения объясняет механизм токсического воздействия никотина на клетки, секретирующие инсулин [21].
Рисунок 2. Взаимосвязь между курением, хроническим панкреатитом и диабетом.
Иммуногистохимическая локализация инсулина в поджелудочной железе. (а) Нормальная поджелудочная железа. Островок состоял преимущественно из хорошо гранулированных β-клеток, содержащих инсулин. (б) Курящий пациент без диабета, страдающий хроническим панкреатитом: умеренная, диффузная экспрессия гормона в клетках, расположенных в поврежденном островке; множество фиброзов внутри островка. (c) Курящий пациент с сахарным диабетом и хроническим панкреатитом: слабая иммуногистохимическая реакция на инсулин в β-клетках поврежденного островка. Вокруг островка присутствуют очаги воспалительной инфильтрации и признаки фиброза поджелудочной железы (стрелки: красный: островки поджелудочной железы; черный: фиброзные поражения в подслое) [15].
Курение и диабетическая ангиопатия
У пациентов с СД курение способствует повышению риска развития сердечно-сосудистых событий и смерти. Метаанализ проспективных исследований по диабету показал, что курение увеличивает риск смерти на 48%, ИБС на 54%, инсульта на 44% и инфаркта миокарда – на 52%, а риск ИБС, инсульта и протеинурии был напрямую связан с количеством выкуриваемых сигарет в день [22].
В когортном исследовании, проведенном на большой популяции из Шведского национального регистра диабета, курение было одним из пяти наиболее сильных предикторов смерти и острого инфаркта миокарда среди пациентов с СД2; другими предикторами являлись уровень гликированного гемоглобина, систолическое артериальное давление, уровень липопротеинов низкой плотности и физическая активность [23].
Курение также связано с преждевременным развитием микрососудистых осложнений: диабетической нефропатии и ретинопатии, а также полинейропатии. Диабетическая нефропатия проявляется постепенным увеличением экскреции альбумина с мочой, снижением скорости клубочковой фильтрации (СКФ) и повышением артериального давления, и приводит к развитию терминальной стадии почечной недостаточности [24].
У курильщиков с СД чаще развивается микро- или макроальбуминурия и прогрессирующее снижение СКФ по сравнению с некурящими пациентами. Так, по сравнению с некурящими пациентами, у тех, кто курил 15-30 или более 30 лет, вероятность развития протеинурии была, соответственно, в 2.78 (95% ДИ 1.34-5.76) и 3.20 (95% ДИ 1.74-5.86) раза выше [16].
Компоненты табачного дыма оказывают негативное влияние на структуру и функцию почечного клубочка. Тяжелые металлы, входящие в состав дыма, вызывают утолщение базальной мембраны нефрона [25], а прогрессирующие снижении функции почек у курильщиков часто приводит к развитию терминальной почечной недостаточности.
Повреждение органов у пациентов с диабетом связано с перекисным окислением липидов клеточных структур на фоне повышенного образования свободных радикалов. Показано, что уровни малонового диальдегида (продукта перекисного окисления липидов) в плазме крови было выше у курящих пациентов с СД1 по сравнению с некурящими [26]. В другом исследовании было обнаружено, что в крови курильщиков также достоверно повышается уровень F2-изопростанов и простагалндинов, вызывающих окислительное повреждение почек [27].
Общее пагубное воздействие курения на стенку сосудов в значительной степени обусловлено прогрессированием эндотелиальной дисфункции [28]. Вещества, присутствующие в табачном дыме, стимулируют высвобождение свободных радикалов, способствуя развитию эндотелиальной дисфункции, характеризующейся снижением выработки или доступности оксида азота в результате гиперпродукции эндотелина-1 [15]. Дисбаланс между оксидом азота и эндотелином, вызванный компонентами сигаретного дыма, увеличивает сосудистое воспаление, которое, в свою очередь, способствует развитию атеросклероза.
Рисунок 3. Краткая схема механизмов влияния никотина и компонентов табачного дыма (смол) на патогенез СД [35, 36].
Необходимо отметить, что исследования, уточняющие роль никотина в процессах индукции эндотелиальной дисфункции, идут уже давно. Например, в монументальной работе Benowitz et al. [37] было показано, что никотин играет прямую роль в процессах эндотелиальной дисфункции наряду с другими компонентами табачного дыма, роль которых не вызывает сомнений. Однако, в этой же работе отмечено, что «Никотин можно безопасно использовать, чтобы помочь курильщикам бросить курить, и, вероятно, он будет достаточно безопасен для длительного поддержания никотиновой зависимости вместо курения сигарет для тех, кто не может избавиться от зависимости» [37]. Рекомендации Европейского общества кардиологов 2021 подтверждают этот тезис, сообщая, что «Никотин-заместительная терапия не оказывает неблагоприятного воздействия на пациентов с атеросклеротическими ССЗ» [31], то есть клиническая значимость никотина в процессах эндотелиальной дисфункции остаётся невыясненной.
Таким образом, индукция эндотелиальной дисфункции [38] и свободнорадикальные процессы в большей степени индуцируются продуктами горения табака и компонентами табачного дыма, который содержит более 4000 различных веществ, но не самим никотином [35].
В последние годы активно обсуждается влияние альтернативных источников никотина, не предполагающих горение табака: электронных сигарет и электронных систем нагревания табака. Учитывая, что пациент с аэрозолем этих устройств получает никотин, их нельзя считать безвредными. В тоже время, принимая во внимание, что многие патогенетические мехаизмы влияния курения связаны не с собственно никотином, а с продуктами горения табака и компонентами табачного дыма, можно предположить снижение вредного воздействия по сравнению с курением обычных сигарет за счет отсутствия горения. Данный тезис подтверждается последними клиническими рекомендациями Европейского общества кардиологов 2021 [31] и рядом независимых исследований [29, 32–34].
Так, исследование Римского Университета продемонстрировало, что средние значения 8-изопростагландина (биомаркер клинического риска оксидативного стресса) у пациентов, перешедших на системы нагревания табака, снижались на 16.3%. Другие показатели оксидативного стресса и хронического системного воспаления в группе пациентов, перешедших на системы нагревания табака, также заметно снижалась, что может обуславливать снижение риска развития эндотелиальной дисфункции и, как следствие, осложнений сахарного диабета. Необходимо подчеркнуть, что подобные электронные устройства не могут быть альтернативой отказу от курения, а лишь являются вынужденной мерой при невозможности полного отказа от никотина.
Выводы
Клинические и экспериментальные исследования описывают тесную взаимосвязь между активным курением и патогенезом диабета, а также развитием микро- и макрососудистых осложнений. Курение приводит к изменениям секреции инсулина β-клетками поджелудочной железы, а также может опосредовать развитие резистентности к инсулину, способствуя нарушению метаболизма глюкозы и развитию СД. Эндотелиальная дисфункция, вызванная курением, играет ключевую роль в развитии сосудистых осложнений при этом заболевании.
Резюмируя обзор литературных данных, можно заключить, что курение должно быть переведено в категорию признанного и поддающегося изменению фактора риска развития диабета
Отказ от курения постепенно снижает риск развития диабета или сосудистых осложнений у людей с установленным заболеванием. Поэтому следует уделять больше внимания отказу от курения в группе высокого риска пациентов с диабетом.
Курение – это не просто вредная привычка, а заболевание, требующее лечения. Там, где успех не был достигнут с помощью специализированных программ по отказу от курения, клиницисты должны рассмотреть альтернативные стратегии, в том числе основанные на снижении риска за счет использования новых появляющихся технологических устройств без сжигания [29].
Учитывая, что многие пациенты с диабетом продолжают курить, несмотря на хорошо известные риски для здоровья, новые технологии доставки никотина могут стать жизнеспособной и гораздо менее вредной альтернативой. Крупный интернет-опрос 574 постоянных пользователей электронных сигарет с диабетом [30] показал, что 41.9% респондентов сообщили об улучшении самочувствия после полного перехода от обычных сигарет к электронным сигаретам, в то время как об ухудшении сообщили только 0.6% [2]. Для подтверждения этих первоначальных результатов потребуются дополнительные исследования у курильщиков с диабетом.
Таким образом, курение оказывает значительное влияние на риски возникновения сахарного диабета, более тяжелого гликемического контроля и развития осложнений данного заболевания, способствующие повышению риска инвалидизации и смерти.
Список литературы:
1. https://diabetesatlas.org
2. Сахарный диабет. 2021;24(S1). DOI: 10.14341/DM12802
3. World Health Organization. [Accessed February 2017]; http://www.who.int/topics/diabetes_mellitus
4. The Health Consequences of Smoking-50 Years of Progress: A Report of the Surgeon General. Atlanta (GA): 2014
5. Fowler MJ. Microvascular and macrovascular complications of diabetes. Clin Diabetes. 2011;29:116–22
6. Pan A, Wang Y, Talaei M, Hu FB, Wu T. Relation of active, passive, and quitting smoking with incident type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2015;3:958–67.
7. Cacciola RR, Guarino F, Polosa R. Relevance of endothelial-hemostatic dysfunction in cigarette smoking. Curr Med Chem. 2007;14:1887–92.
8. Chuahirun T, Simoni J, Hudson C, Seipel T, Khanna A, Harrist RB, Wesson DE. Cigarette smoking exacerbates and its cessation ameliorates renal injury in type 2 diabetes. Am J Med Sci. 2004;327:57–67
9. McEwen LN, Kim C, Karter AJ, Haan MN, Ghosh D, Lantz PM, Mangione CM, Thompson TJ, Herman WH. Risk factors for mortality among patients with diabetes: the Translating Research Into Action for Diabetes (TRIAD) Study. Diabetes Care. 2007;30:1736–41.
10. Pan A, Wang Y, Talaei M, Hu FB. Relation of smoking with total mortality and cardiovascular events among patients with diabetes mellitus: a meta-analysis and systematic review. Circulation. 2015;10:1795–804
11. Luo J, Rossouw J, Tong E, Giovino GA, Lee CC, Chen C, et al. Smoking and diabetes: does the increased risk ever go away? American journal of epidemiology. 2013;178:937–45.
12. Sargeant LA, Khaw KT, Bingham S, Day NE, Luben RN, Oakes S, et al. Cigarette smoking and glycaemia: the EPIC-Norfolk Study. European Prospective Investigation into Cancer. International journal of epidemiology. 2001;30:547–54.
13. Clair C, Bitton A, Meigs JB, Rigotti NA. Relationships of cotinine and self-reported cigarette smoking with hemoglobin A1c in the U.S.: results from the National Health and Nutrition Examination Survey, 1999–2008. Diabetes Care. 2011;34:2250–5
14. Aeschbacher S, Schoen T, Clair C, Schillinger P, Schönenberger S, Risch M, Risch L, Conen D. Association of smoking and nicotine dependence with pre-diabetes in young and healthy adults. Swiss Med Wkly. 2014;144:w14019
15. Sliwinska-Mosson M, Milnerowicz H. The impact of smoking on the development of diabetes and its complications. Diabetes Vasc Dis Res. 2017;14:265–76
16. Ikeda, Y, Suehiro, T, Takamatsu, K. Effect of smoking on the prevalence of albuminuria in Japanese men with non-insulin-dependent diabetes mellitus. Diabetes Res Clin Pract 1997; 36: 57–61
17. Waist Circumference and Waist–Hip Ratio: Report of a WHO Expert Consultation Geneva, 8–11 December 2008
18. Canoy D, Wareham N, Luben R, Welch A, Bingham S, Day N, et al. Cigarette smoking and fat distribution in 21,828 British men and women: a population-based study. Obes Res. 2005;13:1466–75.
19. Fujiyoshi A, Miura K, Kadowaki S, Azuma K, Tanaka S, Hisamatsu T, et al. Lifetime cigarette smoking is associated with abdominal obesity in a community-based sample of Japanese men: The Shiga Epidemiological Study of Subclinical Atherosclerosis (SESSA) Prev Med Rep. 2016;4:225–32
20. Frati AC, Iniestra F, Ariza CR. Acute effect of cigarette smoking on glucose tolerance and other cardiovascular risk factors. Diabetes Care. 1996;19:112–8.]
21. Yoshikawa, H, Hellström-Lindahl, E, Grill, V. Evidence for functional nicotinic receptors on pancreatic β cells. Metabolism 2005; 54: 247–254.
22. Martín-Timón, I, Sevillano-Collantes, C, Segura-Galindo, A. Type 2 diabetes and cardiovascular disease: have all risk factors the same strength? World J Diabetes 2014; 15: 444–470
23. Rawshani A. Risk factors, mortality, and cardiovascular outcomes in patients with type 2 diabetes. NEJM. 2018. https://doi.org/10.1056/NEJMoa1800256.
24. Saran R, Robinson B, Abbott KC, Agodoa LY, Ayanian J, BraggGresham J, et al. US renal data system 2016 annual data report epidemiology of kidney disease in the United States. Am J Kidney Dis. 2017;69(1 Suppl):S1–S688. The most comprehensive and updated report on the epidemiology of kidney disease in the United States, as well as its risk factors and consequences
25. Ritz, E, Benck, U, Orth, SR. Acute effects of cigarette smoking on renal hemodynamics. Contrib Nephrol 2000; 130: 31–38.
26. Zoppini, G, Targher, G, Monauni, T. Increase in circulating products of lipid peroxidation in smokers with IDDM. Diabetes Care 1996; 19: 1233–1236
27. Morrow, JD, Frei, B, Longmire, AW. Increase in circulating products of lipid peroxidation (F 2-isoprostanes) in smokers – smoking as a cause of oxidative damage. N Engl J Med 1995; 332: 1198–1203
28. Foy, CG, Bell, RA, Farmer, DF. Smoking and incidence of diabetes among U.S. adults: findings from the Insulin Resistance Atherosclerosis Study. Diabetes Care 2005; 28: 2501–2507
29. Polosa R, Rodu B, Caponnetto P, Maglia M, Raciti C. A fresh look at tobacco harm reduction: the case for the electronic cigarette. Harm Reduct J. 2013;10:19.] [Farsalinos KE, Polosa R. Safety evaluation and risk assessment of electronic cigarettes as tobacco cigarette substitutes: a systematic review. Ther Adv Drug Saf. 2014;5:67–86.
30. Farsalinos KE, Romagna G, Tsiapras D, Kyrzopoulos S, Voudris V. Characteristics, perceived side effects and benefits of electronic cigarette use: a worldwide survey of more than 19,000 consumers. Int J Environ Res Public Health. 2014;11(4):4356–73. https://doi.org/10.3390/ijerph110404356.
31. Vissere F.L.J. и соавт. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. European Heart Journal (2021) 42, 32273337. doi:10.1093/eurheartj/ehab484
32. Giuseppe Biondi-Zoccai, Sebastiano Sciarretta, Christopher Bullen, Cristina Nocella, Francesco Violi, Lorenzo Loffredo, Pasquale Pignatelli, Ludovica Perri, Mariangela Peruzzi, Antonino G.M. Marullo, Elena De Falco, Isotta Chimenti, Vittoria Cammisotto, Valentina Valenti, Flaminia Coluzzi, Elena Cavarretta, Albino Carrizzo, Francesco Prati, Roberto Carnevale, and Giacomo Frati, Acute Effects of Heat-Not-Burn, Electronic Vaping, and Traditional Tobacco Combustion Cigarettes: The Sapienza University of Rome-Vascular Assessment of Proatherosclerotic Effects of Smoking (SUR-VAPES) 2 Randomized Trial, Journal of the American Heart Association. Vol.8 №6, 2019
33. Choi S, Lee K, Park SM. Combined Associations of Changes in Noncombustible Nicotine or Tobacco Product and Combustible Cigarette Use Habits With Subsequent Short-Term Cardiovascular Disease Risk Among South Korean Men: A Nationwide Cohort Study. Circulation. 2021 Nov 9;144(19):1528-1538. doi: 10.1161/CIRCULATIONAHA.121.054967. Epub 2021 Oct 4. Erratum in: Circulation. 2021 Nov 9;144(19):e306. PMID: 34601948.
34. Berlowitz JB, Xie W, Harlow AF, Hamburg NM, Blaha MJ, Bhatnagar A, Benjamin EJ, Stokes AC. E-Cigarette Use and Risk of Cardiovascular Disease: A Longitudinal Analysis of the PATH Study (2013-2019). Circulation. 2022 May 17;145(20):1557-1559. doi: 10.1161/CIRCULATIONAHA.121.057369. Epub 2022 May 6. PMID: 35514292.
35. Caliri AW, Tommasi S, Besaratinia A. Relationships among smoking, oxidative stress, inflammation, macromolecular damage, and cancer. Mutat Res Rev Mutat Res. 2021 Jan-Jun;787:108365. doi: 10.1016/j.mrrev.2021.108365. Epub 2021 Jan 11. PMID: 34083039; PMCID: PMC8287787.
36. Barua RS, Ambrose JA. Mechanisms of coronary thrombosis in cigarette smoke exposure. Arterioscler Thromb Vasc Biol. 2013 Jul;33(7)
37. Benowitz NL. Cigarette smoking and cardiovascular disease: pathophysiology and implications for treatment. Prog Cardiovasc Dis. 2003 Jul-Aug;46(1):91-111. doi: 10.1016/s0033-0620(03)00087-2. PMID: 12920702.
38. George J, Hussain M, Vadiveloo T, Ireland S, Hopkinson P, Struthers AD, Donnan PT, Khan F, Lang CC. Cardiovascular Effects of Switching From Tobacco Cigarettes to Electronic Cigarettes. J Am Coll Cardiol. 2019 Dec 24;74(25):3112-3120.