Резюме. В статье особое внимание уделено негативной роли гиперальдостеронизма при сердечно-сосудистых заболеваниях и возможности его контроля при применении селективного антагониста минералкортикоидных рецепторов – эплеренона. На основании многочисленных многоцентровых клинических исследований показано преимущество применения эплеренона в комплексной терапии сердечно-сосудистых заболеваний. Эплеренон является селективным блокатором минералкортикоидных рецепторов с минимальной активностью в отношении андрогенных и прогестероновых рецепторов. С современных позиций эплеренон рассматривается как антифибротический препарат с двойным механизмом действия: блокирует К
В 1954 г. был открыт гормон коры надпочечников альдостерон, имеющий стероидную структуру и являющийся ключевым гормоном ренин-ангиотензин-альдостероновой системы (РААС), обладающий минералкортикоидной активностью, образование и выделение которого регулируется в основном ангиотензином II (АТII). Вначале альдостерон ассоциировался с развитием синдрома Дж. Кона (первичный альдостеронизм), автономной опухолью коры надпочечников, вызывающей артериальную гипертензию (АГ) и гипокалиемию. В 1959 г. J. Cella и C. Kagawa синтезировали первый конкурентный антагонист альдостерона – спиронолактон, сходный с прогестероном, эффекты которого реализовывались через открытые в 1960 г. минералокортикоидные рецепторы (МКР): их блокада приводит к росту сывороточного калия, потере натрия, усилению диуреза и снижению артериального давления (АД). В дальнейшем в результате многочисленных исследований были получены данные о том, что гиперальдостеронизм при хронической сердечной недостаточности (ХСН) связан не только с задержкой жидкости и электролитными нарушениями. Было установлено, что альдостерон образуется локально и опосредует свое влияние на сердечно-сосудистую систему через открытые в 1990-е гг. полиорганные мембранные рецепторы, которые, кроме эпителия почечных канальцев, найдены в гладкомышечных клетках сосудистой стенки, сердце, легких, кишечнике, скелетной мускулатуре, нервной системе. В эндотелиальных и гладкомышечных клетках сосудов и сердца происходит локальный синтез альдостерона, оказывающий прямое действие на сосудистую стенку и кардиомиоцит, индуцирующий фиброзирование и гипертрофию тканей, вызывающий дисфункцию эндотелия, вазоконстрикцию, которые являются предикторами сердечно-сосудистых осложнений (ССО) [1-3 ].
Благодаря фундаментальным исследованиям были открыты эпителиальные (почечные) и внеэпителиальные МКР, чувствительные к альдостерону. Через эпителиальные (геномные) рецепторы осуществляется действие альдостерона на ионный транспорт Na+/K+ и взаимодействие с РААС. При взаимодействии с внутриклеточными МКР и транслокации в ядро альдостерон может регулировать транскрипцию для синтеза белков. Через внеэпителиальные (негеномные) рецепторы проявляются быстрые (мембранные) эффекты альдостерона, приводящие к нарушению тонуса сосудистой стенки, повышению АД, поражению органов-мишеней (сердце, сосуды, почки), что вызывает системную и коронарную вазоконстрикцию, стимуляцию симпатоадреналовой системы. Негативные механизмы альдостерона стимулируют синтез коллагена I и III типов, пролиферацию фибробластов, нарастание свободнорадикального окисления, что способствует воспалительным реакциям, апоптозу, вплоть до развития фиброза и процессов ремоделирования [4-6]. Патогенетические механизмы, вызванные альдостероном, представлены на рис. 1.
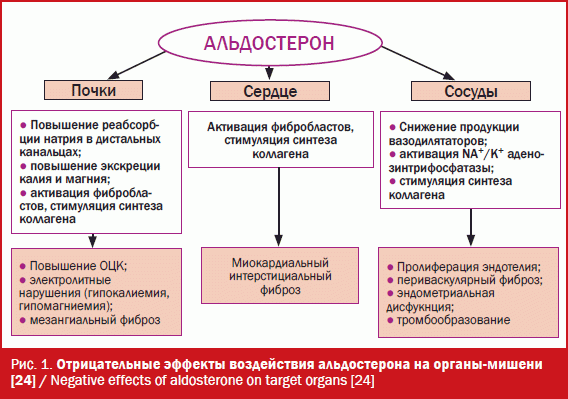
На протяжении полувека антагонист МКР (АМКР) спиронолактон применялся в терапии тяжелой ХСН как калийсберегающий диуретик в дозах 100-300 мг в сутки. Установленный феномен «ускользания» блокады синтеза альдостерона на фоне длительного приема ингибиторов ангиотензинпревращающего фермента (иАПФ) и полученные результаты исследования RALES стали основанием для включения АМКР в основную группу препаратов для лечения больных тяжелой ХСН с функцией выброса левого желудочка (ФВ ЛЖ) менее 40%. Блокада МКР приводит к уменьшению гипергидратации, гипокалиемии, повышению уровня проколлагена III типа, развитию реактивного интерстициального фиброза миокарда, вариабельности ритма сердца, увеличению захвата норадреналина миокардом и барорефлекторной чувствительности. Это, в свою очередь, способствует сокращению массы миокарда, объемов ЛВ после перенесенного инфаркта миокарда; улучшению систолической и диастолической функции ЛВ, снижению риска развития аритмий, показателей общей смертности, частоты госпитализаций, риска внезапной сердечной смерти у постинфарктных больных с ХСН. Добавление спиронолактона в дозе 12,5-50 мг в сутки к комплексной терапии больных ХСН III-IV функционального класса (ФК) достоверно снижало общую смертность на 30% (р < 0,001) в исследовании RALES [7]. В группе спиронолактона было отмечено выраженное улучшение клинического состояния больных и снижение числа госпитализаций из-за прогрессирования ХСН. Однако даже прием минимальных доз препарата приводил к развитию гинекомастии у 10% пациентов, что явилось причиной исключения больных из исследования [7]. Спиронолактон является неселективным препаратом, блокирует не только МКР, но и выступает в качестве антагониста андрогеновых и кортикостероидных и агониста прогестероновых рецепторов. Поэтому препарат вызывает ряд отрицательных эффектов: гинекомастию, импотенцию, снижение либидо, нарушение менструального цикла, маточные кровотечения, гирсутизм, гипонатриемию. Это связано со способностью спиронолактона воздействовать не только на МКР, расположенные в эпителии почечных канальцев, эпителии и гладкомышечных клетках сосудов, а также на сердце, но и на андрогенные, кортикостероидные и прогестероновые рецепторы. Решение данной проблемы реализовалось при появлении на фармацевтическом рынке селективного АМКР эплеренона.
Фармакология и фармакокинетика эплеренона
По химической структуре препарат представляет собой 9,11-эпокси-17-гидрокси-3-оксо-, γ-лактоно-метиловый эфир (7α, 11α, 17α)-прегн-4-эне-7, 21-дикарбоксиловой кислоты. Формула эплеренона представлена на рис. 2.
Эплеренон является селективным блокатором МКР с минимальной активностью в отношении андрогенных и прогестероновых рецепторов (аффинность к ним стократно меньше, чем у спиронолактона). Препарат хорошо абсорбируется после приема внутрь. При этом прием пищи не оказывает влияния на абсорбцию препарата. Биодоступность составляет 69%. Связывается с белками на 50%. Период полувыведения составляет 4-6 часов. Максимальная концентрация препарата в плазме выявляется через 1,5-2 часа после приема пероральной формы.
Метаболизм эплеренона осуществляется с помощью цитохрома Р450 (CYP3A4) с трансформацией до неактивных метаболитов. Выведение препарата в большей степени происходит с мочой – 67% и около 32% – с калом [9, 10]. В неизмененном виде элиминируется менее 5% дозы препарата. У пациентов пожилого возраста коррекции стартовой дозы не требуется, однако рекомендуется тщательный контроль уровня калия. Тяжелые нарушения функции почек и печени являются противопоказанием к назначению эплеренона. С современных позиций эплеренон рассматривается в первую очередь как антифибротический препарат с двойным механизмом действия: 1) блокирует К+-каналы регуляторных Т-лимфоцитов, уменьшает выработку ростовых клеток и способствует снижению пролиферации фибробластов сердца; 2) блокада МКР альдостероном приводит к снижению активации фибробластов (рис. 3). Антифибротический эффект способствует сохранению сократительной способности и электрической стабильности миокарда, замедляет развитие и прогрессирование ХСН [11, 12].
Еще одним важным преимуществом эплеренона перед спиронолактоном является его нейтральность по отношению к уровню гликированного гемоглобина и кортизола [13]. С практической точки зрения это делает эплеренон препаратом первого выбора у пациентов с ХСН в сочетании с сахарным диабетом (СД) 2 типа, ожирением и метаболическим синдромом
Эффективность эплеренона при АГ
Более 30 лет АМКР применяют при лечении эссенциальной АГ. Однако в клинических исследованиях уделялось внимание антигипертензивным эффектам и не учитывались неблагоприятные клинические моменты. С появлением во врачебной практике селективного эплеренона, который был разрешен вначале для применения больным с АГ, в ряде проведенных исследований была подтверждена эффективность эплеренона по снижению АД в значимой популяции больных с эссенциальной АГ. Результаты этих исследований широко представлены в периодической печати. В 2014 г. F. Pelliccia и соавт. провели систематизацию метаанализа 11 РКИ с участием 3566 пациентов. Согласно проведенному метаанализу в 5 РКИ эплеренон сравнивали с плацебо. В группе больных с эплереноном (в дозах 25-400 мг) достоверно снижались систолическое и диастолическое АД (САД и ДАД) на 8,07 мм рт. ст. и на 4,08 мм рт. ст. соответственно (р < 0,00001). Отмечался дозозависимый эффект. В 6 РКИ эплеренон показал преимущества в снижении САД и ДАД в среднем на 1,5 мм рт. ст. и 0,54 мм рт. ст. (р < 0,0001). По результатам этих исследований был сделан вывод о сопоставимости антигипертензивного действия эплеренона с другими препаратами (эналаприл, лозартан, амлодипин и др.) и усилении эффекта в сочетании с эплереноном [14]. Кроме того, E. Burgess и соавт. (2003 г.) изучали долгосрочную терапию 586 больных с АГ по переносимости 50-200 мг/сут эплеренона. Продолжительность наблюдения составила 14 мес. Частота нежелательных явлений со стороны половой сферы была редкой и составила всего 3%. Завершили исследование 66% больных, у 17% не было получено антигипертензивного эффекта. В исследовании также подтверждалась хорошая переносимость препарата [15].
Кардио- и нефропротективные эффекты эплеренона при АГ
Известно, что гиперактивация РААС способствует гипертрофии ЛЖ (ГЛЖ) и риску развития ССО, которые можно уменьшить при применении эплеренона. Тому есть доказательства. В специально спланированном рандомизированном двойном слепом клиническом исследовании 4Е-LVH Study c участием 202 больных с АГ и ГЛЖ сравнивали лечение эналаприлом (40 мг/cут) с эплереноном (200 мг/cут) и их сочетанием. При необходимости к терапии АГ добавляли гидрохлортиазид или амлодипин. Исследовалась динамика показателей ГЛЖ с помощью магниторезонансной томографии (МРТ) [16]. В результате проведенного исследования получены сопоставимые положительные эффекты на снижение АД и регресс ГЛЖ в монотерапии, а совместное применение указанных препаратов привело к более выраженному регрессу ГЛЖ и снижению экскреции альбумина с мочой.
Как уже было отмечено, не только АГ, но и гиперальдостеронемия вносит значимый вклад в развитие поражений органов-мишеней через внеэпителиальные МКР сердца, сосудов, почек. Нефропротективные свойства эплеренона были получены в другом исследовании с участием 268 больных с АГ и диабетической нефропатией. Исследование продолжалось 12 мес. Больных разделили на 3 группы: участники первой принимали эналаприл (20 мг/сут), второй – эплеренон (50 мг) + эналаприл (20 мг) и третьей – эплеренон (100 мг) + эналаприл (20 мг). Исследовалась динамика индекса альбумин/креатинин: наибольшее снижение этого показателя (на 41,0-48,4% для доз 50-100 мг) отмечено в группах больных, принимавших эплеренон в составе терапии (2-я и 3-я группы). В 1-й группе, получавшей монотерапию эналаприлом, снижение индекса альбумин/креатинин составило всего лишь 7,4% [17].
Можно предположить, что эплеренон, обладая антиальдостероновыми свойствами (антифибротическими, антиоксидантными, противовоспалительными и др.), способствует органопротективному воздействию на эндотелий ренальных сосудов и приводит к значимому снижению протеинурии независимо от уровня АД [18]. Следует отметить, что, несмотря на положительные моменты, связанные с уменьшением альбумин-урии, нет четких доказательств того, что АМКР можно назначать при АГ с хронической болезнью почек (ХБП) (из-за опасности гиперкалиемии). Чтобы разрешить эту проблему, необходимы крупномасштабные исследования для уточнения клинических исходов и безопасной тактики лечения.
Согласно инструкции по медицинскому применению оригинального эплеренона, препарат противопоказан только при тяжелой почечной недостаточности и может применяться при ХСН в сочетании с ХБП при скорости клубочковой фильтрации (СКФ) > 30 мл/мин. Важно, что у разных дженерических препаратов есть различия в инструкции и не все они могут применяться при умеренной почечной недостаточности. Официальные инструкции с последними изменениями можно скачать на сайте https://grls.pharm-portal.ru/. Например, пациентам с ХСН в сочетании с умеренной почечной недостаточностью (СКФ в диапазоне от 30 до 60 мл/мин) можно применять дженерический препарат Иплерон так же, как и оригинальный эплеренон, при этом лечение будет в разы доступнее. Применение эплеренона должно сопровождаться титрацией дозы под контролем креатинина и калия в плазме крови.
Резистентная АГ и роль АМКР
Согласно национальным клиническим рекомендациям РКО (2020 г.) резистентная АГ (РАГ) устанавливается на основании следующих критериев:
1) соблюдение здорового образа жизни и лечение тремя и более лекарственными средствами иАПФ, блокаторами рецепторов ангиотензина-1 (БРА), антагонистами кальция, включая диуретик) не приводит к снижению АД < 140/90 мм рт. ст.;
2) неадекватность контроля АД подтверждена с помощью суточного и/или домашнего мониторинга АД;
3) подтверждена приверженность больного к лечению;
4) исключены причины псевдорезистентности и причины вторичной АГ.
Истинная РАГ встречается не более чем в 10% случаев среди популяции больных АГ, при ХБП ее распространенность составляет около 30%. РАГ часто наблюдается у больных с ожирением, метаболическим синдромом, СД, множественным поражением органов-мишеней, синдромом обструктивного апноэ сна, при вторичных формах АГ. Тяжелое поражение органов-мишеней (выраженная ГЛЖ, особенно ХБП, жесткость и атеросклеротическое поражение крупных артерий) способствует развитию резистентности к лечению АГ [19]. Важную роль при РАГ играет клиническая инертность, включающая такие понятия, как «отсутствие интенсификации лечения больных, терапия которых не дала успехов в лечении, основанном на доказательствах». Наиболее частой причиной клинической инертности является врачебный фактор, составляющий 50%. Доля со стороны больного составляет 30%, социального фактора – 20%. Врачам необходимо всегда учитывать встречаемость сопутствующих заболеваний, которые утяжеляют прогноз [20].
Тактика ведения РАГ согласно рекомендациям РКО (2020) заключается в добавлении спиронолактона к проводимой терапии в дозе 25-50 мг для достижения целевых значений АД, или эплеренона – в дозе 25-50 мг, или других диуретиков, или бисопролола, или доксазозина [19]. Учитывая недавние результаты метаанализа 15 исследований (3 РКИ, 11 обсервационных и одного сравнительного исследования) при участии 1204 больных с РАГ, который показал эффективность снижения АД и безопасность применения АМКР, включая эплеренон, прием препарата по 50-100 мг в сутки 52 больными РАГ достоверно снизил АД в среднем на 17,6/7,9 мм рт. ст. (р < 0,0001), достигались целевые значения. На фоне применения эплеренона в сочетании с иАПФ или БРА было отмечено повышение уровня калия на 0,3 ± 0,45 мэкв/л (р < 0,001), только у двух пациентов отмечено развитие умеренной гиперкалиемии [21, 22]. Однако с учетом того, что спиронолактон применялся в течение короткого периода, следует в качестве длительной терапии все же отдавать предпочтение эплеренону (Иплерон и другие).
ХСН и острый инфаркт миокарда. Роль эплеренона
Одной из основных причин развития ХСН по-прежнему остается острый инфаркт миокарда (ОИМ) и постинфарктный кардиосклероз. Доля таких больных составляет 15,3% несмотря на усовершенствование методов лечения острого коронарного синдрома (ОКС) со своевременной реваскуляризацией [23]. В литературе подробно освещены процессы адаптации и дез-адаптации ремоделирования сердца у больных с ОИМ и успешной реперфузией или без нее [1, 3, 6, 23]. С современных позиций развитие фиброза рассматривается как главный маркер ХСН и важный показатель миокардиальной гетерогенности, приводящей к диастолической дисфункции, жесткости миокарда и аритмиям. В настоящее время не вызывает сомнения, что альдостерон является ведущим участником развития фиброза и электрического ремоделирования сердца у больных ХСН ишемического генеза. Именно альдостерон приводит к потере калия и магния, удлиняет QT-интервал, что может приводить к фатальным аритмиям сердца.
В связи с этими знаниями о роли гиперальдостеронемии в патогенезе ремоделирования сердца после ОИМ отводится значимая роль блокаде РААС на разных звеньях ее развития. Ранее считалось, что назначения иАПФ или сартанов достаточно для подавления активности альдостерона. Однако при длительном применении иАПФ стали отмечать эффект ускользания альдостерона независимо от дозы препарата и снижение эффективности самих иАПФ. Имеются данные о локальном синтезе альдостерона в эндотелии, гладкомышечных клетках сосудов и кардиомиоцитах, а блокаторы РААС влияют в основном на его надпочечниковый синтез. Предполагается, что только местно сердечный синтез альдостерона приводит в основном к постинфарктному ремоделированию [6, 10, 19, 23, 24]. Таким образом, ситуация «что бы вы ни дали больному с ХСН, а уровень альдостерона растет» диктует необходимость назначения АМКР, в частности, селективного эплеренона.
Главной доказательной базой эффективности применения эплеренона после ОИМ является следующее РКИ – двойное слепое плацебо-контролируемое исследование EPHESUS (Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study), опуб-ликованное в 2003 г. [25]. Основная гипотеза данного РКИ заключалась в оценке способности эплеренона пред-отвращать дезадаптационное ремоделирование и фиброзирование сердца при ОИМ.
В исследовании приняли участие 6632 больных ОИМ, разделенных на две группы, сроком от 3 до 14 суток (в среднем – 7,3 суток) с ФВ ЛЖ ≤ 40% (средняя ФВ ЛЖ составила 33%) и клиническими проявлениями ХСН I-IV ФК по NYHA в течение 3-14 дней после развития клинических проявлений ИМ. Эплеренон применялся по 25-50 мг, средняя доза составила 42,6 мг/cут. Большинству участников назначали оптимальную медикаментозную терапию ИМ и ХСН, включающую иАПФ или БРА (86%), бета-адреноблокаторы (75%), диуретики (60%), ацетилсалициловую кислоту (Аспирин) (88%), статины (47%). Реперфузионная терапия или реваскуляризация проводились 45% пациентов. Прогноз улучшался уже на фоне месячного приема препарата: смертность в группе эплеренона была ниже на 31% (р = 0,004).
К завершению наблюдения через 16 мес в группе эплеренона достоверно снизились:
- сердечно-сосудистая смертность на 17% (р = 0,005);
- комбинированный показатель смертности от сердечно-сосудистого заболевания (ССЗ) и частоты первой госпитализации по поводу ССЗ – на 13%, (р = 0,002);
- общая смертность и частота любой госпитализации – на 8% (р = 0,02);
- частота первой госпитализации по поводу ХСН – на 15% (р = 0,03). Наибольший эффект терапии отмечался у больных с низкой ФВЛЖ (< 30%) и клиническими проявлениями сердечной недостаточности. Эффект терапии не зависел от вмешательств на коронарных сосудах и типов ОИМ. В исследовании отмечена хорошая переносимость и безопасность проводимой терапии. У 1,6% больных отмечена гиперкалиемия (> 6 ммоль/л). Применение эплеренона привело к уменьшению частоты гипокалиемии на 4,7% [25].
Установлено, что быстрые эффекты альдостерона играют очень важную роль для постинфарктного ремоделирования сердца. Предполагают потенциальные механизмы, поясняющие эффективность снижения уровня внезапной сердечной смерти при применении эплеренона на фоне снижения желудочковых аритмий вследствие:
- предотвращения гипокалиемии;
- уменьшения симпатической активации (АМКР улучшают вариабельность сердечного ритма, дисперсию QT-интервала, функцию барорецепторов);
- блокируется активация Ca2+/кальмодулинзависимой протеинкиназы II (СаМ-киназы II) [3, 9, 24].
Таким образом, эплеренон способен устранять электрическую нестабильность, что особенно важно при острой стадии развития ИМ. Весьма важным является раннее (до 7 дней) назначение эплеренона, так как риск смерти от всех причин в этом случае снижается на максимальный 31%, риск смерти от ССЗ и госпитализации по поводу ССЗ – на 24%, от внезапной сердечной смерти – на 34%. Были получены достоверные различия в пользу ранней инициации терапией эплереноном по сравнению с поздним назначением после 7 дней от начала ОИМ [25].
Более позднее исследование REMINDER в 2014 г. подтвердило эффективность и безопасность эплеренона у 1012 больных с ОИМ с подъемом сегмента ST, без проявлений ХСН в анамнезе или текущей СН. Назначение эплеренона в дозе 25-50 мг в сутки приводило к снижению концентрации натрийуретических пептидов (BNP и N-терминального фрагмента BNP), обладающих высокой отрицательной прогностической ценностью в диагностике ХСН. Через 1 месяц наблюдения натрийуретические пептиды были повышены у достоверно меньшего количества больных в группе эплеренона (16%) по сравнению с группой контроля (25,9%) (р < 0,0002) [26]. На основании проведенных крупных исследований и полученных доказательств место эплеренона при ведении больных ОИМ с ХСН и без нее является лидирующим и жизнесохраняющим.
Так, Приказом МЗ РФ № 158 от 2 марта 2021 г. спиронолактон исключен из стандартов оказания медицинской помощи взрослому населению при ОКС без подъема сегмента ST электрокардиограммы (ЭКГ) и в группе антагонистов альдостерона оставлен только эплеренон. В двух последних клинических рекомендациях, одобренных Минздравом в 2021 г., для снижения риска смерти и прогрессирования СН у пациентов, перенесших ИМ с подъемом или без подъема ST, рекомендуется отдавать предпочтение антагонисту альдостерона эплеренону в дополнение к иАПФ и бета-блокаторам.
Место эплеренона в диуретической терапии ХСН после ОИМ представлено в табл. 1. Следующее исследование решило важный вопрос о целесообразности применения эплеренона у больных с умеренно выраженной ХСН. Речь идет об EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure), которое прекратило дискуссии по данному вопросу и расширило применение препарата.
В 2011 г. были опубликованы результаты плацебо-контролируемого исследования EMPHASIS-HF, в котором приняли участие 2737 пациентов с ХСН II ФК и систолической дисфункцией ЛЖ (ФВ ЛЖ < 5%, в среднем – 26,1%) с предшествующей госпитализацией в течение ближайших 6 месяцев по какой-либо сердечно-сосудистой причине или с повышенным уровнем одного из натрийуретических пептидов: BNP ≥ 250 пг/мл или N-терминального фрагмента pro-BNP ≥ 500 пг/мл у мужчин и ≥ 750 пг/мл у женщин. Эплеренон назначался исходно в дозе 25 мг один раз в день с последующим увеличением через 4 недели до 50 мг один раз в день под контролем уровня калия. Средняя доза эплеренона составила 39,1 ± 3,8 мг в сутки. Включение эплеренона в состав стандартной терапии ХСН способствовало достоверному снижению риска смерти по сердечно-сосудистой причине и/или госпитализации по поводу ХСН на 37% (p < 0,001). По отдельным составляющим комбинированной конечной точки получена сопоставимая положительная динамика: эплеренон уменьшил риск смерти по сердечно-сосудистой причине на 24% (p = 0,01), а число госпитализаций из-за прогрессирования ХСН – на 42% (p < 0,001) [27]. Основные результаты исследования представлены в табл. 2.
Эффект эплеренона не зависел от возраста больных, гендерных различий, уровня АД и частоты сердечных сокращений (ЧСС), наличия АГ, СД, фибрилляции предсердий, почечной дисфункции, причины развития ХСН. Эплеренон в исследовании показал высокий профиль безопасности. Достоверно более частое развитие гиперкалиемии (уровень калия > 5,5 ммоль/л) в группе эплеренона у 158 (11,8%) пациентов по сравнению с плацебо у 96 больных (7,2%) (p < 0,001) требовало коррекции дозы препарата, но не явилось причиной прекращения лечения с его помощью. Частота развития таких побочных эффектов, как гинекомастия и ухудшение функции почек, была такой же, как в группе плацебо, а эпизоды гипокалиемии (уровень калия < 3,5 ммоль/л) достоверно чаще развивались в контрольной группе (11% против 7,5%, р = 0,002). В исследовании отмечена отличная переносимость эплеренона с незначительной частотой развития осложнений, не отличавшихся в группе плацебо. Основные данные по исследованию представлены в табл. 1.
Проведенные исследования доказали не только положительное влияние эплеренона на прогноз у больных с АГ, ОИМ, ХСН, но и способность препарата снижать риск развития и прогрессирования ХСН [25-27].
На основании результатов РКИ созданы клинические рекомендации, согласно которым АМКР должны применяться у всех пациентов с симптомами ХСН II-IV ФК и ФВ ЛЖ < 40% для улучшения прогноза, клинического состояния и уменьшения повторных госпитализаций вместе с иАПФ или БРА, β-адреноблокаторами, иНГЛТ-2 (ингибиторами натрий-глюкозного ко-транспортера 2-го типа); класс рекомендаций I, уровень доказательности А. Возможность назначения препаратов из этой группы следует рассмотреть у пациентов с сохраненной и умеренно сниженной систолической функцией ЛЖ для снижения количества госпитализаций по поводу ХСН (класс рекомендаций IIа, уровень доказательности B) [1].
Таким образом, патогенетические механизмы эплеренона при ХСН заключаются в блокаде МКР, которая приводит:
- к уменьшению гипергидратации, гипокалиемии, уровня проколлагена III типа, реактивному интерстициальному фиброзу миокарда, вариабельности сердечного ритма;
- увеличению захвата норадреналина миокардом и барорефлекторной чувствительности;
- улучшению систолической и диастолической функций ЛЖ, препятствию процессам ремоделирования сердца и сосудов, органопротективному эффекту;
- снижению риска аритмий, в т. ч. мерцательной, показателей общей смертности и частоты госпитализаций, риска внезапной сердечно-сосудистой смертности у постинфарктных больных [24, 28].
Кроме того, известно, что риск ССО резко повышается на каждой стадии ХБП и задолго до развития терминальной стадии [29]. Установлено, что при снижении СКФ ≤ 60 мл/мин/1,73 м2 у больных ХСН увеличивается риск смерти в 2 раза, при снижении ФВ ЛЖ ≤ 40% и почечной недостаточности риск смерти увеличивается в 3,8 раза [1, 6]. В кардиовазопротекции важнейшей стратегией также является терапия, направленная и на торможение прогрессирования нефропатии и предупреждение развития крайне тяжелой стадии ХБП [29].
Согласно национальным рекомендациям по СН (2021) и рекомендациям по ХБП (2020) во время применения АМКР при ХСН рекомендуется строгий мониторинг биохимических показателей и электролитного баланса, особенно при сочетании с ХБП и СД 2 типа. Для оптимизации лечения и улучшения прогноза таких больных рекомендуется определение креатинина в крови, рСКФ (СКD-EPI), натрийуретического пептида и уровня К
Контроль К+ при назначении эплеренона (25 мг) при ХСН необходимо проводить в течение 1 года через 1, 4, 8, 12 недель; 6, 9, 12 мес; далее – каждые 6 мес. Терапия в любое время может осложниться гиперкалиемией по разным причинам. Если через месяц симптомы ХСН сохраняются, то дозу эплеренона увеличивают до 50 мг. При повышении К ≥ 6 ммоль/л или снижения СКФ < 30 мл/мин необходимо прекратить лечение и обратиться к кардиологу и нефрологу. При снижении калия ниже 5 ммоль/л лечение возобновляют интермиттирующим курсом в дозе 25 мг через день, под контролем уровня калия.
В настоящее время проводятся исследования с новым нестероидным АМКР – финереноном, однако этот препарат не зарегистрирован в России и не может быть рекомендован в отечественной клинической практике. Перспективным направлением в терапии ХСН с ХБП и СД 2 типа для снижения риска прогрессирования почечной патологии и кардиоваскулярных событий считается добавление к терапии ингибитора натрий-глюкозного котранспортера 2 (НГЛТ-2 дапаглифлазина) или аналога глюкагоноподобного пептида-1.
Таким образом, необходимы крупномасштабные РКИ, чтобы разрешить важные для клинической практики вопросы терапии больных с ХСН с коморбидными заболеваниями.
Заключение
Применение АМКР эплеренона в комплексной терапии больных с постинфарктным кардиосклерозом и клиническими признаками ХСН II-IV ФК, с ФВЛЖ ≤ 40% является патогенетически оправданным, клинически эффективным и безопасным.
После перенесенного ИМ особенно важно сохранить сердце жизнеспособным, поэтому антифибротические эффекты эплеренона весьма актуальны и приводят к снижению риска развития и прогрессирования ХСН.
В связи с выраженными органопротективными свойствами необходимо учитывать необходимость длительного, порой пожизненного приема эплеренона в составе комплексной терапии при ведении больных ХСН с целью улучшения прогноза и качества жизни.
Оптимизация лечения ССЗ – трудная и не до конца решенная задача. Реализация возможностей антифибротической терапии с помощью селективной блокады эффектов альдостерона является перспективным направлением в реальной клинической практике. Врачам ежедневно приходится сталкиваться с проблемой выбора оптимального лекарственного средства. В этом случае целесообразно отдавать предпочтение препаратам с доказанной клинической эффективностью, положительным влиянием на прогноз, предсказуемым действием, хорошей переносимостью и экономически более доступным для больного. В нашей стране доступный эплеренон – селективный АМКР с доказанной биоэквивалентностью оригинальному препарату – зарегистрирован под торговым названием Иплерон с дозировками 25 мг и 50 мг. Приемлемая цена и европейское качество производства повышают приверженность пациента к лечению и помогают расширить его применение в реальной клинической практике. Важным является также идентичность показаний и противопоказаний Иплерона оригиналу.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- Клинические рекомендации. Российское кардиологическое общество при участии Национального общества по изучению Сердечной недостаточности и заболеваний миокарда, Общества специалистов по сердечной недостаточности. Хроническая сердечная недостаточность. 2020. Доступ: http://cr.rosminzdrav.ru/schema/156_1. [Clinical guidelines.Chronic heart failure. Association of Cardiovascular Surgeons Russian Society of Cardiology in collaboration with the National Society for the Study of Heart Failure and Myocardial Diseases, the Society of heart Failure Specialists. 2020. Available at: http://cr.rosminzdrav.ru/schema/156_1 (in Russian)].
- Williams G. H. Cardiovascular benefits of aldosterone receptor antagonists: what about potassium? // Hypertension. 2005; 46: 265-266.
- Кириченко А. А. Кардиопротективные эффекты эплеренона // Consilium Medicum. 2018; 20 (1): 15-20. [Kirichenko A. A. Kardioprotektivnye ehffekty ehplerenona // Consilium Medicum. 2018; 20 (1): 15-20. (In Russ.)]
- Chrissobolis S. Vascular Conseguences of Aldosterone Exess and Mineralcorticoid Receptor Antagonism // Curr Hypertens Rev. 2017; 13 (1): 46-56. DOI: 10.2114/1573402113666170228151402.
- Bauersachs J., Lother A. Mineralcorticoid Receptor activation and antagonism in cardiovascular disease: cellular and molecular mechanisms // Kindey Int Suppl. 2022; 12 (1): 19-26. DOI: 10.1016/j.kisu.2021.11.001.
- Мареев В. Ю., Фомин И. В., Агеев Ф. Т. и др. Национальные рекомендации ОССН, РКО и РНМОТ. Сердечная недостаточность: хроническая и острая декомпенсированная. Диагностика, профилактика и лечение (5-й пересмотр) // Кардиология. 2018; 58 (S6). DOI: 10.18087/cardio/2475. [Mareev V. Yu., Fomin I. V., Ageev F. T. i dr. Natsional'nye rekomendatsii OSSN, RKO i RNMOT po diagnostike, profilactike i lecheniiu ostroj i khronicheskoi serdechnoi nedostatochnosti (5-peresmotr) // Kardiologija. 2018; 58 (S6). (In Russ.)]
- Pitt B., Zannand F., Remme W., et al. The effect of spirоnоlactone on morbidity and mortality in patients with severe heart failure // N Engl J Med. 1999; 341: 709-717.
- De Gasparo V., Joss U., Ramjoue H. P., et al. Threenew epoxy-spirolactone derivatives: characterization in vivo and in vitro // Jpharmacol Exp Ther 1987; 240: 650-656.
- Леонова М. В., Алимова Э. Э., Еремина Ю. Н. Эволюция антагонистов минералкортикоидных рецепторов: эплеренон и спиронолактон // Consilium Medicum. 2017; 19 (10): 60-65. DOI: 10.26442/2075-1753_19.10.60-65. [Leonova M. V., Alimova E. E., Eremina Yu. N. The evolution of mineralocorticoid receptor antagonists: eplerenone and spironolactone // Consilium Medicum. 2017; 19 (10): 60-65. (In Russ.)]
- Гиляревский С. Р., Голшмид М. В., Кузьмина И. М. Блокада минералкортикоидных рецепторов при лечении больных с сердечно-сосудистыми заболеваниями: клинические и фармакологические аспекты применения эплеренона // Сердце: журнал для практикующих врачей. 2016; 15 (3): 143-150. [Gilarevskij S. R., Golschmid M. B., Kuzmina I. M. Ingibition of mineralcorticoid receptors in treatment of cardiovascular diseases: clinical and pharmacological aspects of the eplerenone therapy // Russian Heart Jornal. 2016; 15 (3): 143-150. (In Russ.)] DOI: 10.18087/rhj.2016.3.2198.
- Евдокимова А. Г., Евдокимов В. В., Шуйская О. А. и др. Возможности применения диуретической терапии в клинике внутренних болезней // Терапия. 2017; 2: 84-94. [Evdokimova A. G., Evdokimov V. V., Shujskaja O. A., et al. Vozmognosti primenenija diureticheskoy terapii v klinike vnutrennich bolezney // Terapija. 2017; 2: 84-94. (In Russ.)]
- Azibani F., BenartL., Schlossarek S., et al. Aldosterone inhibits antifibrotic factors in mouse hypertensive heart. 212; 59 (6): 1179-1187. DOI: 10.1161/ HYPERTENSIONAHA.111.190512.
- Yamagi M., Tsutamoto T., Kawahara C., et al. Effect of Eplerenone versus spironolactone on cortisol and hemoglobin A1(c) levels in patients with chronic heart failurae // Am H J. 2010; 160: 915-921.
- Pelliccia F., Patti G., Rosano, et al. Efficacy andsafety of eplerenon in the management of mil to moderate arterial hypertension: systematic reviem and meta-analysis // Int J Cardiol. 2014; 177 (1): 219-228.
- Burgess E., Lacourciere Y., Ruilope L. M., et al. Assessment of the long-term safety and efficacy of the selective aldosterone blocker eplerenone in patients with essential hypertension // Clin Ther. 2003; 25: 2388-2404.
- Pitt B., Reichek N., Wilenbrock R., et al.effects of eplerenone, enalapril, andeplerenone/enalapril in patients with essential hypertension and left ventricular hypertrophy: the 4E-left ventricular hypertrofhy study // Circulation. 2003; 108 (15): 1831-1838.
- Epstein M., Williams G. H., Weinberger M., et al. Selective Aldosterone Blockade with Eplerenone Reduces Albuminuria in Patients with Type 2 Diabetes // Clin J Am Soc Nephrol. 2006; 1: 940-951.
- Deinum J., Riksen N. P., Lenders J. W. Pharmacological treatment of aldosterone excess // Pharmacol Ther. 2015; 154: 120-123. DOI: 10.1016/j.pharmathera. 2015.07.006.
- Клинические рекомендации. Артериальная гипертония у взрослых. 2020 // Росс. кардиологический журнал. 2020; 25 (3): 3786. [Clinical guidelines. Arterialnaya gipertensiya u vsroslich. 2020 // Ross. Kardiolog. Jornal. 2020; 25 (3): 3786. (In Russ.)] DOI: 10/15829/1560-4071-20-20-3-3786.
- Гиляревский С. Р. Влияние базовой терапии на частоту повторных госпитализаций по поводу декомпенсации сердечной недостаточности: возможности и ограничения в современной клинической практике // Российский кардиологический журнал. 2021; 26 (10): 4699. [Gilyarevsky S. R. Influence of standard heart failure therapy on readmission rate:opportunities and limitations in modern clinical practice // Russian Jornal of Cardiology. 2021; 26 (10): 4699.] DOI:10.15829/1560-4071-2021-4699.
- Dahal K., Kunwar S., Rijal J., et al. The effects of aldosterone antagonists in patients with resistant hypertension: a meta-analysis of randomized and nonrandomiezed studies // Am. J Hypertens. 2015; 28 (11): 1376-1385.
- Calhoun D. A., White W. B. Effectiveness of the selective aldosterone blocker, eplerenone, in patients with resistant hypertension // J Am Soc Hypertens. 2008; 2 (6): 1376-1385.
- Смирнова М. Д., Агеев Ф. Т. Хроническая сердечная недостаточность как осложнение инфаркта миокарда: особенности терапии // РМЖ. Медицинское обозрение. 2019; 10 (1): 40-44. [Smirnova M. D., Ageev F. T. Chronic heartfailure as a myocardialinfartion complication: therapy features // RMJ. Medical Review. 2019; 10 (1): 40-44. (In Russ.)]
- Евдокимова А. Г., Коваленко Е. В., Евдокимов В. В. и др. Антагонисты минералкортикоидных рецепторов: преимущества применения эплеренона (Иплерон) у больных хронической сердечной недостаточностью // Поликлиника. 2019; 6: 33-38. [Evdokimova A. G., Kovalenco E. V., Evdokimov V. V., et al. Antagonisti mineralcorticoidnich receptorov: preimuschestva primeneniaj eplerenona (Ipleron) in patientes of chronic heart failure // Poliklinika. 2019; 6: 33-38 (In Russ.)]
- Pitt B., Remme W., Zannad F., et al. Eplerenone, a Selective Aldosterone Blocker, in Patients with Left Ventricular Dysfunction after Myocardial Infarction // N Engl J Med. 2003; 348: 1309-1321.
- Montalescot G., Pitt B., Lopez de Sa E., et al. Early eplerenone treatment in patients with acute ST-elevation myocardial infarction without heart failure: The Randomized Double-Blind Reminder Study // European Heart Journal. 2014; 35 (34): 2295-2302.
- Zannad F., McMurray J. J. V., Drexler H., et al. Rationale and design of the Eplerenone in Mild Patients Hospitalization And Survival Study in Heart Failure (EMPHASIS-HF) // Eur J Heart Fail. 2011; 12 (6): 617-622.
- Верткин А. Л., Абдуллаева А. У., Кноринг Г. Д. Терапия хронической сердечной недостаточности: возможности эплеренона // Consilium Medicum. 2017; 19 (1): 73-80. [Vertkin A. V., Abdullaeva A. U., Knoring G. D. Terapy of chronic heart failure: the possibilities of eplerenone // Cons. Med. 2017; 19 (1): 73-78. (In Russ.)]
- Клинические рекомендации. Хроническая болезнь почек. 2021. 236 с. Ассоциация нефрологов РФ. Cr.minzdrav.gov.ru/schema/469_2. [Clinical guidelines. Hronicheskaya bolezn' pochek. 2021. 236 s. (In Russ.)]
- Shao P.-P., Liu C.-J., Xu Q., Zhang B., Li S.-H., Wu Y., Sun Z. and Cheng L.-F. (2018) Eplerenone Reverses Сardiac Fibrosis via the Suppression of Tregs by Inhibition of Kv1.3 Channel. Front. Physiol. 9:899. DOI: 10.3389/fphys.2018.00899
- Инструкция по медицинскому применению Иплерона. [Instructions for the medical use of Ipleron.]
Р. И. Стрюк, ORCID: 0000-0002-2848-046X, rstryuk@list.ru
В. В. Евдокимов, ORCID: 0000-0001-9281-579Х, vvevdokimov@rambler.ru
А. К. Каптаева, ORCID: 0000-0002-7657-6415, an_kk@list.ru
Федеральное государственное бюджетное образовательное учреждение высшего образования Московский государственный медико-стоматологический университет имени А. И. Евдокимова Министерства здравоохранения Российской Федерации; 127473, Россия, Москва, ул. Делегатская, 20/1
Сведения об авторах:
Евдокимова Анна Григорьевна, заслуженный врач РФ, д.м.н, профессор кафедры внутренних болезней Федерального государственного бюджетного образовательного учреждения высшего образования Московский государственый медико-стоматологический университет имени А. И. Евдокимова Министерства здравоохранения Российской Федерации; 127473, Россия, Москва, ул. Делегатская, 20/1; Aevdokimova@rambler.ru
Стрюк Раиса Ивановна, заслуженный врач РФ, д.м.н, профессор, заведующая кафедрой внутренних болезней Федерального государственного бюджетного образовательного учреждения высшего образования Московский государственый медико-стоматологический университет имени А. И. Евдокимова Министерства здравоохранения Российской Федерации; 127473, Россия, Москва, ул. Делегатская, 20/1; rstryuk@list.ru
Евдокимов Владимир Вячеславович, д.м.н., профессор кафедры клинической функциональной диагностики Федерального государственного бюджетного образовательного учреждения высшего образования Московский государственый медико-стоматологический университет имени А. И. Евдокимова Министерства здравоохранения Российской Федерации; 127473, Россия, Москва, ул. Делегатская, 20/1;
Каптаева Анар Каратаевна, к.м.н., доцент кафедры внутренних болезней Федерального государственного бюджетного образовательного учреждения высшего образования Московский государственый медико-стоматологический университет имени А. И. Евдокимова Министерства здравоохранения Российской Федерации; 127473, Россия, Москва, ул. Делегатская, 20/1; an_kk@list.ru
Information about the authors:
Anna G. Evdokimova, Honored Doctor of the Russian Federation, Dr. of Sci. (Med.), Professor of the Department of Internal Medicine at the Federal State Budgetary Educational Institution of Higher Education A. I. Evdokimov Moscow State University of Medicine and Dentistry of the Ministry of Health of the Russian Federation; 20/1 Delegatskaya str., Moscow, 127473, Russia; Aevdokimova@rambler.ru
Raisa I. Stryuk, Honored Doctor of the Russian Federation, Dr. of Sci. (Med.), Professor, Head of the Department of Internal Medicine at the Federal State Budgetary Educational Institution of Higher Education A. I. Evdokimov Moscow State University of Medicine and Dentistry of the Ministry of Health of the Russian Federation; 20/1 Delegatskaya str., Moscow, 127473, Russia; rstryuk@list.ru
Vladimir V. Evdokimov, Dr. of Sci. (Med.), Professor of the Department of Clinical Functional Diagnostics at the Federal State Budgetary Educational Institution of Higher Education A. I. Evdokimov Moscow State University of Medicine and Dentistry of the Ministry of Health of the Russian Federation; 20/1 Delegatskaya str., Moscow, 127473, Russia;
Anar K. Kaptaeva, MD, Associate Professor of the Department of Internal Medicine at the Federal State Budgetary Educational Institution of Higher Education A. I. Evdokimov Moscow State University of Medicine and Dentistry of the Ministry of Health of the Russian Federation; 20/1 Delegatskaya str., Moscow, 127473, Russia; an_kk@list.ru
Эффективность применения эплеренона в клинической практике с позиций доказательной медицины (двадцать лет на страже жизни) А. Г. Евдокимова, Р. И. Стрюк, В. В. Евдокимов, А. К. Каптаева
Для цитирования: Евдокимова А. Г., Стрюк Р. И., Евдокимов В. В., Каптаева А. К. Эффективность применения эплеренона в клинической практике с позиций доказательной медицины (двадцать лет на страже жизни) // Лечащий Врач. 2022; 12 (25): 16-24. DOI: 10.51793/OS.2022.25.12.003
Теги: миокард, сердечно-сосудистые заболевания, коморбидность, хроническая болезнь почек
Купить номер с этой статьей в pdf