Резюме. Пандемия коронавирусной инфекции COVID-19 по-прежнему остается значимой для современной медицинской науки и практики. В условиях пандемии COVID-19 пациенты с сопутствующей патологией, в частности артериальной гипертензией, требуют особого внимания, так как являются одними из самых уязвимых групп при этой инфекции. Это также диктует необходимость соблюдения оптимизации диагностических и клинических подходов к оказанию помощи пациентам с этой патологией. В этой связи научный и практический интерес представляет изучение течения инфекционного процесса COVID-19 у больных артериальной гипертензией. На базе Государственного бюджетного учреждения здравоохранения Городская клиническая больница имени С. П. Боткина Департамента здравоохранения города Москвы находились под наблюдением 145 пациентов, перенесших COVID-19, у 91 из которых коронавирусная инфекция сочеталась с артериальной гипертензией, у 54 больных ее не было. Всем пациентам проводилось комплексное клинико-лабораторное обследование и осуществлялось клиническое наблюдение в динамике. Течение коронавирусной инфекции COVID-19 у пациентов с артериальной гипертензией характеризуется развитием более тяжелых пневмоний (у 5,5% пациентов с артериальной гипертензией при компьютерной томографии диагностируются поражения легких более III степени) и более выраженной дыхательной недостаточности у большего числа пациентов (у 8,8% больных с артериальной гипертензией инфекция сопровождалась развитием дыхательной недостаточности II и более степени). У пациентов с артериальной гипертензией отмечались более высокие показатели С-реактивного белка, ферритина и глюкозы, при этом изменения в лейкоцитарной формуле были сопоставимы между группами. Динамика уровня постинфекционных антител класса IgG характеризовалась постепенным снижением их уровня в течение года, при этом у больных, у которых COVID-19 протекал на фоне артериальной гипертензии, отмечались в среднем более высокие показатели постинфекционных антител класса IgG в первые месяцы после перенесенной инфекции. Развитие новой коронавирусной инфекции у пациентов с сопутствующей патологией, в частности артериальной гипертонией, требует от врача особого внимания ввиду риска развития тяжелой формы COVID-19.
Глобальной проблемой мирового здравоохранения является артериальная гипертония (АГ). В общей популяции взрослого населения распространенность АГ составляет 30-45%. В российской популяции среди мужчин в возрасте 25-65 лет распространенность АГ достигает 47%, среди женщин – 40%. Присоединение инфекционной патологии может влиять на течение АГ, а у больных с данной сопутствующей патологией клиническая картина инфекции может характеризоваться определенными особенностями, что наглядно показала пандемия новой коронавирусной инфекции (НКИ) COVID-19.
Вирус SARS-CoV-2, как и другие коронавирусы, пользуется типичными рецепторными механизмами для инвазии в клетку [1]. Связывание вируса с рецептором ангиотензин-превращающего фермента 2 (АПФ2) с участием сериновой протеазы – корецептора TMPRSS2, также предпочитаемой вирусами гриппа, обусловливает расположенный на поверхности вирусной частицы спайк-белок. Используя этот механизм, вирус успешно проникает в клетку-мишень [2, 3]. Ключевым моментом эффективного заражения и последующего распространения вируса является связывание спайкового энзима с АПФ2-рецептором. Есть мнение, что их высокой аффинностью друг к другу также объясняется исключительная вирулентность SARS-CoV-2 [4-6]. В свою очередь рецептор АПФ2 является одним из важнейших составляющих ренин-ангиотензин-альдостероновой системы (РААС). Эта система играет ключевую роль в регуляции уровня артериального давления (АД) и водно-электролитного баланса [7, 8].
В научной литературе большое внимание уделяется изучению сопутствующих заболеваний у больных НКИ как дополнительных факторов риска тяжелого течения болезни и развития ее осложнений. Так, имеются данные о том, что при наличии бронхолегочных заболеваний повышается вероятность неблагоприятного течения COVID-19 [9, 10].
Предполагается, что большая концентрация рецепторов АПФ2 в сосудистой стенке, перицитах и миокарде и дисфункция РААС/АПФ2 под воздействием вируса SARS-CoV-2 имеют важное патогенетическое значение в развитии патологии сердечно-сосудистой системы при COVID-19 [11-13]. О высокой частоте повреждения миокарда у пациентов с тяжелой формой COVID-19 говорят результаты одного из ретроспективных исследований [14].
Описан клинический случай кардиомиопатии такоцубо в остром периоде COVID-19 c типичной электро- и эхокардиографической картиной (ЭКГ и ЭхоКГ), с отсутствием поражения коронарных артерий по данным коронарографии. Случай имел признаки миокардита, подтвержденные по результатам эндомиокардиальной биопсии [15]. Также имеются случаи развития инфаркта миокарда с подъемом сегмента ST в результате однососудистого и многососудистого тромбоза коронарных артерий у больных COVID-19 [16]. При коронарографии выявлены тромботические массы, окклюзирующие и неокклюзирующие просвет различных коронарных артерий (передней нисходящей артерии и правой коронарной) [17]. Также описан случай многососудистой спонтанной диссекции коронарных артерий у больного на 18-е сутки от начала заболевания COVID-19. Диагностирована диссекция 2А типа нескольких ветвей передней нисходящей артерии и правой коронарной артерии, что явилось причиной развития неатеросклеротического инфаркта миокарда нижнебоковой и верхушечной стенки левого желудочка [18].
Имеющиеся на настоящий момент данные о течении НКИ у больных с АГ противоречивы. Так, анализ публикаций показывает, что ряд авторов считает, что распространенность тяжелых форм COVID-19 с развитием острого респираторного дистресс-синдрома и летальность у пациентов с АГ выше, чем у пациентов без нее. На основании этих данных предлагается рассматривать АГ как независимый фактор риска степени тяжести течения COVID-19 [18-23]. В то же время результаты одного из проведенных французских исследований показали, что наличие АГ не оказывает влияния на тяжесть течения COVID-19 и, следовательно, не требует более частого применения искусственной вентиляции легких во время стационарного лечения такой категории пациентов [24].
Последующие результаты множественного анализа показывают, что возраст ≥ 50 лет, наличие АГ и мужской пол выступают как независимые факторы риска негативного течения и необходимости госпитализации при COVID-19 [25]. Необходимо учитывать, что пациенты с более тяжелыми формами COVID-19 и АГ могут быть более уязвимыми к повреждающему действию SARS-CoV-2 в силу возрастных особенностей иммунной системы [26]. Следует отметить, что у страдающих АГ часто имеется большее количество сопутствующих заболеваний, также способных влиять на течение инфекционного процесса [27].
Центр по контролю и профилактике заболеваний не включил АГ в список факторов риска, способных повлиять на степень тяжести COVID-19 [28]. Это связано с тем, что в настоящее время нет четких доказательств, подтверждающих роль АГ как независимого фактора риска развития тяжелого течения или смерти от инфекции COVID-19 [29].
В условиях пандемии COVID-19 пациенты с сопутствующей патологией, в частности АГ, требуют особого внимания со стороны врача, так как относятся к одной из самых уязвимых групп, что определяет научный и практический интерес к изучению течения инфекционного процесса COVID-19 у больных с АГ.
В связи с этим целью настоящего наблюдения было установление особенностей клинических и лабораторных проявлений коронавирусной инфекции COVID-19 у больных с АГ.
Пациенты и методы исследования
На базе ГБУЗ ГКБ им. С. П. Боткина находились под наблюдением 152 пациента, перенесших COVID-19, у 98 из которых НКИ сочеталась с АГ (1-я группа), а у 54 больных АГ не было (2-я группа).
Критерии включения пациентов в 1-ю группу – установленный диагноз коронавирусной инфекции COVID-19; наличие АГ I-II стадии (степень 1-3); возможное наличие сопутствующих заболеваний (нарушение толерантности к углеводам, сахарный диабет 2 типа, метаболический синдром, ожирение не более II степени, а также иные заболевания, не способные изменить течение АГ); подписанное добровольное информированное согласие. Для пациентов 2-й группы критерии включения были те же, за исключением наличия установленного диагноза АГ.
Критерии невключения пациента в наблюдение: наличие факторов, способных изменить течение АГ, в том числе вторичная АГ, бронхообструктивный синдром, ожирение III степени; тиреотоксикоз; клинически выраженная ишемическая болезнь сердца; участие пациента в клинических исследованиях лекарственных препаратов в течение последних 6 месяцев.
Группы были сопоставимы по полу и возрасту.
Всем пациентам проводилось общепринятое клиническое и лабораторное обследование (клинический и биохимический анализы крови, включая показатели глюкозы и гликозилированного гемоглобина, ферритин, общий и С-реактивный белок (СРБ), исследование гормонов щитовидной железы (ТТГ) и коагулограммы, включая D-димер). Оценку динамики постинфекционного иммунитета проводили в течение 12 месяцев после COVID-19 методом иммуноферментного анализа с определением титра JgG к SARS-CoV-2 в ед/мл с использованием иммунохемилюминесцентного анализатора Mindray (производство – Китай) и инструментальных методов обследования (ЭКГ, суточный мониторинг АД) с оценкой клинической картины COVID-19 и течения АГ в остром периоде заболевания и в периоде реконвалесценции НКИ.
Статистическую обработку полученных данных проводили на основании ГОСТ Р 50779.21-96 с использованием лицензионных программ средств Microsoft Excel. Статистический анализ включал оценку количественных и порядковых данных с расчетом значений среднего арифметического (M), стандартного отклонения (SD), ошибки среднего (m), медианы (Ме), 95% доверительного интервала (ДИ). Оценка качественных переменных проводилась путем расчета значений выборочной доли (W), ее стандартной ошибки (SE). Сравнение достоверности различий количественных и порядковых переменных между группами проводили после проверки допущений для применения параметрического многофакторного одномерного дисперсионного анализа с последующим расчетом достигнутых уровней значимости по t-критериям для связанных и несвязанных выборок или по непараметрическим критериям. Различия считались достоверными при р < 0,05 [30].
Результаты собственных исследований
Тяжелая форма коронавирусной инфекции COVID-19 достоверно чаще наблюдалась у пациентов с отягощенным АГ преморбидным фоном (32 человека – 32,7%) по сравнению с группой пациентов, у которых АГ не было (10 человек – 18,5%) (р < 0,05).
Вирус SARS-CoV-2 преимущественно распространяется аэрогенно, поэтому дыхательные пути (области носа, носоглотки или ротоглотки) являются входными воротами инфекции, поражение данных органов отмечается в дебюте инфекции [31]. Сравнительный анализ клинических симптомов, характерных для интоксикационного синдрома, в том числе лихорадочной реакции, а также поражения верхних дыхательных путей и органов желудочно-кишечного тракта, в группах сравнения показал отсутствие значимой разницы (рис. 1, 2).
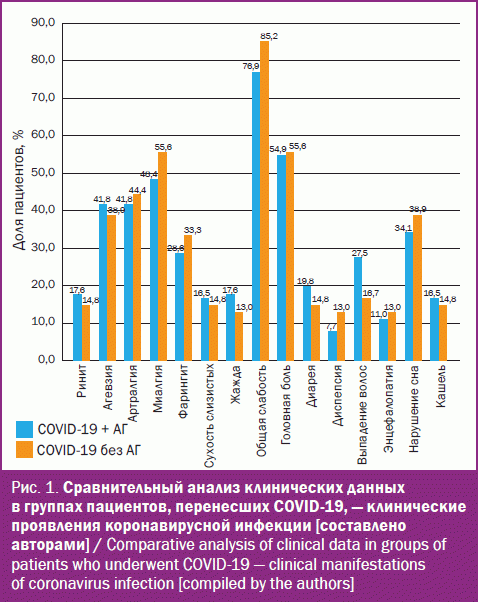
Частота развития такой клинической формы коронавирусной инфекции COVID-19, как пневмония, в группах сравнения достоверно не различалась: у пациентов с АГ она составила 44,9% (44 человека), без АГ – 35,2% (19 человек) (р > 0,05). Однако в ходе проведенного наблюдения обнаружилось, что у пациентов с АГ достоверно чаще развиваются более тяжелые формы пневмонии по данным компьютерной томографии (КТ). Также в этой группе пациентов достоверно чаще развивалась более высокая степень дыхательной недостаточности (рис. 3).
Одной из отличительных особенностей коронавирусной инфекции COVID-19 является развитие аносмии, клинические проявления которой принципиально отличаются от наблюдаемых симптомов снижения обонятельной функции при других острых респираторных инфекциях. В настоящем наблюдении такой симптом, как аносмия, достоверно чаще встречался в группе пациентов, у которых преморбидный фон не был отягощен АГ (рис. 4).
Проведенный анализ данных лабораторного обследования показал, что показатели гемограммы в группах достоверно не отличались. В то же время показатели уровня СРБ, ферритина и глюкозы были выше в группе пациентов с АГ и отличались достоверно (рис. 5).
Динамика изменения уровня постинфекционного иммуноглобулина G к SARS-CoV-2, проводившаяся методом иммуноферментного анализа, характеризовалась постепенным снижением их уровня в течение года, при этом у больных, у которых COVID-19 протекал на фоне АГ, отмечались в среднем более высокие показатели постинфекционных антител класса IgG в первые месяцы после перенесенной инфекции (рис. 6).
При динамическом наблюдении пациентов в период реконвалесценции НКИ было установлено, что в 54,1% случаев (53 человека) течение АГ после перенесенной инфекции не менялось, у 14,3% пациентов (14 человек) отмечалось снижение АД, у 4 больных этой группы даже стало возможным снижение доз антигипертензивных препаратов. У 31,6% пациентов (31 человек) течение АГ приобрело прогрессирующий характер, что потребовало коррекции терапии АГ.
Таким образом, проведенное исследование показало, что НКИ у пациентов с эссенциальной артериальной гипертензией не сопровождается повышенным риском развития поражения нижних дыхательных путей, однако в случае развития пневмонии она характеризуется развитием более тяжелых форм по степени поражения легочной ткани и более выраженной дыхательной недостаточностью. В периоде реконвалесценции COVID-19 пациенты с АГ требуют динамического наблюдения, так как у трети больных отмечается прогрессирование данного заболевания.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- Li W., Moore M., Vasilieva N., et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus // Nature. 2003; 426: 450-454. DOI: https://doi.org/10.1038/nature02145.
- Lan J., Ge J., Yu J., et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor // Nature. 2020; 581: 215-220. DOI: https://doi.org/10.1038/s41586-020-2180-5.
- Walls A. C., et al. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein // Cell. 2020; 181: 281-292. DOI: https://doi.org/10.1016/j.cell.2020.02.058.
- Li F., Li W., Farzan M., Harrison S. C. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor // Science. 2005; 309: 1864-1868. DOI: https://doi.org/10.1126/science.1116480.
- Wang Q., Zhang Y., Wu L., Niu S., et al. Structural and functional basis of SARS-CoV-2 entry by using human ACE2 // Cell. 2020; 181 (4): 894-904. DOI: https://doi.org/10.1016/j.cell.2020.03.045.
- Lei C., Qian K., Li T., Zhang S., et al. Neutralization of SARS-CoV-2 spike pseudotyped virus by recombinant ACE2-Ig // Nat Commun. 2020; 11 (1): 2070. DOI: https://doi.org/10.1038/s41467-020-16048-4.
- Donoghue M., Hsieh F., Baronas E., et al. A novel angiotensin-converting enzyme-relatedcarboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9 // Circ Res. 2000; 87: E1-9. DOI: 10.1161/01.res.87.5.e1.
- Santos R. A. S., Sampaio W. O., Alzamora A. C., Motta-Santos D., Alenina N., Bader M., et al. The ACE2/Angiotensin-(1-7)/MAS Axis of the Renin-Angiotensin System: Focus on Angiotensin-(1-7) // Physiological Reviews. 2018; 98 (1): 505-553. DOI: 10.1152/physrev.00023.2016.
- Голухова Е. З., Сливнева И. В., Рыбка М. М., Мамалыга М. Л., Алехин М. Н., Ключников И. В. и др. Легочная гипертензия как фактор оценки риска неблагоприятного исхода у пациентов с COVID-19 // Российский кардиологический журнал. 2020; 12 (25): 121-133. [Golukhova Ye. Z., Slivneva I. V., Rybka M. M., Mamalyga M. L., Alekhin M. N., Klyuchnikov I. V. i dr. Pulmonary hypertension as a risk factor for adverse outcomes in patients with COVID -19 // Rossiyskiy kardiologicheskiy zhurnal. 2020. T. 25, № 12. P. 121-133.]
- Самсонова М. В., Михалева Л. М., Зайратьянц О. В., Варясин В. В., Быканова А. В., Мишнев О. Д. и др. Патология легких при COVID-19 в Москве // Архив патологии. 2020; 4 (82): 32-40. DOI: https://doi.org/10.17116/patol20208204132. [Samsonova M. V., Mikhaleva L. M., Zayrat'yants O. V., Varyasin V. V., Bykanova A. V., Mishnev O. D. i dr. Pulmonary pathology in COVID-19 in Moscow // Arkhiv patologii. 2020. T. 82, № 4. P. 32-40.] DOI: https://doi.org/10.17116/patol20208204132]
- Wu Y. Compensation of ACE2 Function for Possible Clinical Management of 2019-nCoV-Induced Acute Lung Injury // Virologica Sinica. 2020; 35 (3): 256-258. DOI: 10.1007/s12250-020-00205-6.
- Hamming I., Timens W., Bulthuis M., Lely A., Navis G., van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis // The Journal of Pathology. 2004; 203 (2): 631-637. DOI: 10.1002/path.1570.
- Alcocer-Díaz-Barreiro L., Cossio-Aranda J., Verdejo-Paris J., Odinde-Los-Ríos M., Galván-Oseguera H., Álvarez-López H. et al. COVID-19 and the renin, angiotensin, aldosterone system. A complex relationship // Arch. Cardiol. Mex. 2020. Vol. 90, suppl. P. 19-25. DOI: https://doi. org/10.24875/ACM.M20000063.
- Shi S., Qin M., Cai Y., Liu T., Shen B., Yang F. et al. Characteristics and clinical significance of myocardial injury in patients with severe coronavirus disease 2019 // European Heart Journal. 2020; 41 (22): 2070-2079. DOI: 10.1093/eurheartj/ehaa408.
- Sala S., Peretto G., Gramegna M., Palmisano A., Villatore A., Vignale D. et al. Acute myocarditis presenting as a reverse Tako-Tsubo syndrome in a patient with SARS-CoV-2 respiratory infection // European Heart Journal. 2020; 41 (19): 1861-1862. DOI: 10.1093/eurheartj/ehaa286.
- Ueki Y., Otsuka T., Windecker S., Räber L. ST-elevation myocardial infarction and pulmonary embolism in a patient with COVID-19 acute respiratory distress syndrome // European Heart Journal. 2020; 41 (22): 2134. DOI: 10.1093/eurheartj/ehaa399.
- Dominguez-Erquicia P., Dobarro D., Raposeiras-Roubín S., Bastos Fernandez G., Iñiguez-Romo A. Multivessel coronary thrombosis in a patient with COVID-19 pneumonia // European Heart Journal. 2020; 41 (22): 2132. DOI: 10.1093/eurheartj/ehaa393.
- Fernandez Gasso L., Maneiro Melon N. M., Sarnago Cebada F., Solis J., Garcia Tejada J. Multivessel spontaneous coronary artery dissection presenting in a patient with severe acute SARS-CoV-2 respiratory infection // European Heart Journal. 2020; 41 (32): 3100-3101. DOI: 10.1093/eurheartj/ehaa400.
- Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study // The Lancet. 2020; 395 (10229): 1054-1062. DOI: 10.1016/S0140-6736(20)30566-3.
- Dong E., Du H., Gardner L. An interactive web-based dashboard to track COVID-19 in real time // The Lancet Infectious Diseases. 2020; 20 (5): 533-534. DOI: 10.1016/S1473-3099(20)30120-1.
- Clerkin K. J., Fried J. A., Raikhelkar J., Sayer G., Griffin J. M., Masoumi A. et al. COVID-19 and Cardiovascular Disease // Circulation. 2020; 141 (20): 1648-1655. DOI: 10.1161/CIRCULATIONAHA.120.04694.
- Li X., Xu S., Yu M., Wang K., Tao Y., Zhou Y. et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan // Journal of Allergy and Clinical Immunology. 2020; 146 (1): 110-118. DOI: 10.1016/j.jaci.2020.04.006.
- Cai Q., Chen F., Wang T., Luo F., Liu X., Wu Q. et al. Obesity and CO-VID-19 Severity in a Designated Hospital in Shenzhen, China // Diabetes Care. 2020; 43 (7): 1392-1398. DOI: 10.2337/dc20-0576.
- Simonnet A., Chetboun M., Poissy J., Raverdy V., Noulette J., Duhamel A. et al. High Prevalence of Obesity in Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2) Requiring Invasive Mechanical Ventilation // Obesity. 2020; 28 (7): 1195-1199. DOI: 10.1002/oby.22831.
- Shi Y., Yu X., Zhao H., Wang H., Zhao R., Sheng J. Host susceptibility to severe COVID-19 and establishment of a host risk score: findings of 487 cases outside Wuhan // Critical Care. 2020; 24 (1): 108. DOI: 10.1186/s13054-020-2833-7.
- Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S. et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China // JAMA Internal Medicine. 2020; 180 (7): 934-43. DOI: 10.1001/jamainternmed.2020.0994.
- European Society of Cardiology. ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic. Last updated on 10 June 2020. URL: https://www.escardio.org/Education/ COVID-19-and-Cardiology/ESC-COVID-19-Guidance (дата обращения: 18.02.2022).
- Centers for Disease Control and Prevention. People at Increased Risk for Severe Illness. 2020. URL: https://www.cdc.gov/coronavirus/2019-ncov/need-extra-precautions/index.html (дата обращения: 18.02.2022).
- Shibata S., Arima H., Asayama K., Hoshide S., Ichihara A., Ishimitsu T. et al. Hypertension and related diseases in the era of COVID-19: are port from the Japanese Society of Hypertension Task Force on COVID-19 // Hypertension Research. 2020; 43 (10): 1028-1046. DOI: 10.1038/s41440-020-0515-0.
- Петри А., Сэбин К. Наглядная медицинская статистика. М.: ГЭОТАР-МЕД, 2010. 169 с. [A. Petri, K. Sebin. Visual medical statistics. M.: GEOTAR-MED, 2010. P. 16.]
- Al-Swiahb J. N., Motiwala M. A. Upper respiratory tract and otolaryngological manifestations of coronavirus disease 2019 (COVID-19): A systemic review // SAGE Open Med. 2021 May 20; 9: 20503121211016965. DOI: 10.1177/20503121211016965. PMID: 34094558; PMCID: PMC8141987.
А. Г. Комарова1, zambotk@botkinmoscow.ru
М. В. Ильина1, maria467i@yandex.ru
А. А. Плоскирева2, 3, Scopus: 56848285800, ORCID: 0000-0002-3612-1889, antonina@ploskireva.com
1 Государственное бюджетное учреждение здравоохранения Городская клиническая больница имени С. П. Боткина Департамента здравоохранения города Москвы; 125284, Россия, Москва, 2-й Боткинский пр-д, 5
2 Федеральное государственное автономное образовательное учреждение высшего образования Российский национальный исследовательский медицинский университет имени Н. И. Пирогова Министерства здравоохранения Российской Федерации; 117997, Россия, Москва, ул. Островитянова, 1
3 Федеральное бюджетное учреждение науки Центральный научно-иследовательский институт эпидемиологии Роспотребнадзора, 111123, Россия, Москва, ул. Новогиреевская, 3а
Сведения об авторах:
Демина Ирина Алексеевна, врач Государственного бюджетного учреждения здравоохранения Городская клиническая больница имени С. П. Боткина Департамента здравоохранения города Москвы; 125284, Россия, Москва, 2-й Боткинский пр-д, 5; doctor.demira@gmail.com
Комарова Анна Григорьевна, заместитель главного врача по медицинской части (по Региональному сосудистому центру) Государственного бюджетного учреждения здравоохранения Городская клиническая больница имени С. П. Боткина Департамента здравоохранения города Москвы; 125284, Россия, Москва, 2-й Боткинский пр-д, 5;
Ильина Мария Валерьевна, врач функциональной диагностики Государственного бюджетного учреждения здравоохранения Городская клиническая больница имени С. П. Боткина Департамента здравоохранения города Москвы; 125284, Россия, Москва, 2-й Боткинский пр-д, 5; maria467i@yandex.ru
Плоскирева Антонина Александровна, д.м.н., профессор кафедры педиатрии с инфекционными болезнями у детей факультета дополнительного профессионального образования Федерального государственного автономного образовательного учреждения высшего образования Российский национальный исследовательский медицинский университет имени Н. И. Пирогова Министерства здравоохранения Российской Федерации; 117997, Россия, Москва, ул. Островитянова, 1; заместитель директора по клинической работе Федерального бюджетного учреждения науки Центральный научно-иследовательский институт эпидемиологии Роспотребнадзора, 111123, Россия, Москва, ул. Новогиреевская, 3а; antonina@ploskireva.com
Information about the authors:
Irina A. Demina, Doctor of the State Budgetary Healthcare Institution S. P. Botkin City Clinical Hospital of the Moscow Department of Health; 5 2nd Botkin Ave., Moscow, 125284, Russia; doctor.demira@gmail.com
Anna G. Komarova, Deputy Chief Medical Officer (Regional Vascular Center) at the State Budgetary Healthcare Institution S. P. Botkin City Clinical Hospital of the Moscow Department of Health; 5 2nd Botkin Ave., Moscow, 125284, Russia;
Maria V. Ilina, Doctor of functional diagnostics of the State Budgetary Healthcare Institution S. P. Botkin City Clinical Hospital of the Moscow Department of Health; 5 2nd Botkin Ave., Moscow, 125284, Russia; maria467i@yandex.ru
Antonina A. Ploskireva, Dr. of Sci. (Med.), Professor of the Department of Pediatrics with infectious diseases in children of the Faculty of Additional Professional Education at the Federal State Autonomous Educational Institution of Higher Education Pirogov Russian National Research Medical University Ministry of Health of the Russian Federation; 1 Ostrovityanov str., Moscow, 117997, Russia; Deputy Director for Clinical Work of the Federal Budgetary Institution of Science Central Research Institute of Epidemiology of Rospotrebnadzor, 3a Novogireevskaya str., Moscow, 111123, Russia; antonina@ploskireva.com
Клинические особенности коронавирусной инфекции COVID-19 у пациентов с артериальной гипертензией/ И. А. Демина, А. Г. Комарова, М. В. Ильина, А. А. Плоскирева
Для цитирования: Демина И. А., Комарова А. Г., Ильина М. В., Плоскирева А. А. Клинические особенности коронавирусной инфекции COVID-19 у пациентов с артериальной гипертензией // Лечащий Врач. 2022; 4 (25): 54-59. DOI:10.51793/OS.2022.25.4.010
Теги: коронавирус, осложнения, пневмония, гипертензия
Купить номер с этой статьей в pdf