В настоящее время искусственное кровообращение (ИК) является неотъемлемой частью операций на открытом сердце, так как обеспечивает надежную и безопасную основу сердечно-легочной поддержки. Проведение ИК сопряжено с развитием таких состояний, как гемодилюция, потребление плазменных факторов, гипотермия, контакт клеток крови с синтетическими поверхностями экстракорпорального контура, не пульсирующий характер кровотока. Вышеперечисленные факторы могут приводить к развитию синдрома системного воспалительного ответа, увеличению выработки тканевого фактора и тромбина [1]. Вследствие воздействия экстракорпорального кровообращения, операционной травмы отмечается активация системы фибринолиза. Не пульсирующий характер кровотока сопровождается дисфункцией эндотелиальных клеток с высвобождением оксида азота и простациклина. С первых минут ИК отмечается снижение уровня тромбоцитов до 50% от дооперационных значений, нарушение функциональных показателей тромбоцитов, повышение уровня биохимических индикаторов активации тромбоцитов — тромбоцитарного фактора-4, ß-тромбоглобулина и тромбоксана B2 [2]. Снижение концентраций плазменных факторов V, VII, IX, X и XIII, фибриногена, протромбина, а также антитромбина, плазминогена и антиплазмина существенно повышает риск как геморрагических, так и тромботических осложнений. Особенно подвержены гемокоагуляционным нарушениям дети первого года жизни ввиду незрелости системы гемостаза, выраженной гемодилюции. Вероятность геморрагических осложнений у детей после операций в условиях экстракорпорального кровообращения достаточно высока и занимает третье место в общей структуре осложнений (8,4% от общего числа осложнений) [3]. Наиболее неблагоприятными осложнениями являются ишемические (3,9%) и геморраг��ческие поражения центральной нервной системы (5,2%) [4]. Развитие гемокоагуляционных осложнений (ГКО) приводит к увеличению затрат на лечение, снижению качества жизни, ухудшению течения заболевания, увеличению летальности.
В настоящее время не существует надежных клинико-лабораторных алгоритмов предупреждения развития ГКО, связанных с применением искусственного кровообращения, что определяет актуальность поиска в нашей работе дополнительных предикторов ГКО, особенно у детей первого года жизни.
Цель и задачи данного исследования заключались в том, чтобы определить показатели плазменного гемостаза, которые можно рассматривать в качестве предикторов тромбозов у детей первого года жизни, оперируемых по поводу врожденных пороков сердца (ВПС) с применением искусственного кровообращения.
Материалы и методы исследования
Исследование проводилось на базе отделения реанимации и интенсивной терапии ФГАУ НМИЦ ЗД МЗ РФ в период с 1 декабря 2017 г. до мая 2018 г.
В данное исследование включено 26 детей в возрасте от 2 дней жизни до 11 месяцев 29 дней (медиана возраста — 5,5 месяцев), которым были проведены операции по поводу ВПС с ИК. Среди них девочек — 7 (27%) и мальчиков — 19 (73%), соотношение девочки/мальчики 1:2,7. Краткая характеристика группы обследованных пациентов, вошедших в исследование, представлена в табл. 1.
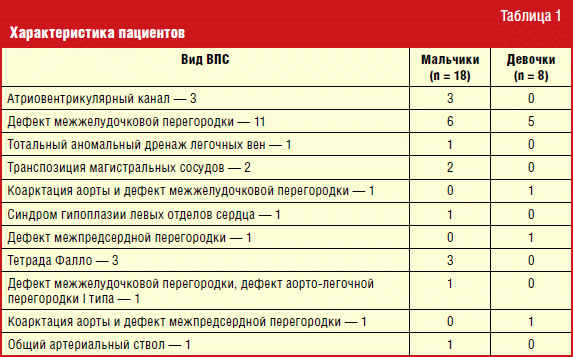
Как видно из табл. 1, большую часть пациентов составили дети с дефектом межжелудочковой перегородки — 11 пациентов (42%); атриовентрикулярным каналом — 3 пациента (11,5%); тетрадой Фалло — 3 пациента (11,5%); транспозицией магистральных сосудов — 2 пациента (7,7%) и по одному пациенту — с тотальным аномальным дренажем легочных вен; коарктацией аорты; синдромом гипоплазии левых отделов сердца; дефектом межпредсердной перегородки, сочетанным дефектом межжелудочковой перегородки и дефектом аорто-легочной перегородки I типа, коарктацией аорты и дефектом межпредсердной перегородки, общим артериальным стволом (по 3,9%).
Наряду с показателями скрининга плазменного гемостаза (концентрации фибриногена, активированным частичным тромбопластиновым временем (АЧТВ), международным нормализованным отношением (МНО), тромбиновым временем (ТВ), протромбиновым временем (ПВ) исследовали уровни фибрин-мономеров (ФМ) и концентрации фактора фон Виллебранда (фВ) на автоматическом коагулографе STACompaсt (Stago, Франция) в цитратной плазме на базе централизованной клинико-диагностической лаборатории. Обследование проводилось в трех точках — до начала операции, в первые сутки после операции и на третьи послеоперационные сутки.
Использовался аппарат искусственного кровообращения Sorin s 5 (Sorin Group Deutschland GmbH, Германия).
Для статистической обработки результатов использовали пакет программ Statistika 6.0 (StatSoftInc., Tulsa, Ok, USA). Статистический анализ различия независимых переменных, не подчиняющихся закону нормального распределения, осуществляли с использованием критерия Манна–Уитни. Различия считали статистически значимыми при p ≤ 0,05.
Результаты
Тромботические осложнения отмечались у четырех (15,4%) детей. Из них один случай закончился летально. Все пациенты были разделены на две группы: в первую группу вошли дети без тромботических осложнений (n = 22), во вторую с эпизодами тромбозов (n = 4). Среди тромбозов преобладали тромбозы сосудов головного мозга — у трех пациентов (11,5%). В одном случае наблюдался пристеночный тромбоз в верхушке левого желудочка (3,8%).
При исследовании уровня ФМ в обеих группах было установлено, что в первой группе его значения до операции находились в пределах референсного интервала. Как видно из рис. 1, медиана значений ФМ в первой точке составила 8,21 мкг/мл (референсные значения 2,46–11,96 мкг/мл), во второй точке (первые послеоперационные сутки) Ме — 13,78 мкг/мл и в третьей точке Ме — 8,72 мкг/мл. Таким образом, в первой группе имеются лишь незначительные предпосылки к тромбообразованию после операции (что вполне закономерно); уровень ФМ возвращался к дооперационному состоянию уже к третьим послеоперационным суткам. А во второй группе медианы значений ФМ составили: в первой точке — 78,33; 37,15 и 79,44 мкг/мл во второй и третьей точках соответственно. Таким образом, во второй группе пациентов уровни ФМ во всех точках значительно превышали референсные значения (в 3 и более раз). При этом значения ФМ во второй группе в третьей точке превышали значения в первой и второй точках. Однако до операции его уровень был значительно выше референсных значений и уровня ФМ во второй точке.
На рис. 2 представлена динамика показателей АЧТВ в трех точках исследования. В первой группе наблюдалась тенденция к гиперкоагуляции по сравнению со второй группой, в которой имелась тенденция к гипокоагуляции по внутреннему пути свертывания (p ≤ 0,05).
Как видно из графика на рис. 3, значения ПВ не превышали референсные значения, а во второй группе пациентов наблюдалась гипокоагуляция по внешнему пути свертывания крови.
На рис. 3 представлены данные динамики показателей ПВ в обеих группах в каждой из трех точек. В группе 2 (группа случая) отмечалось удлинение ПВ во второй и третьей точках, по сравнению с первой группой (p ≤ 0,05).
При исследовании активности фактора фВ выявлено, что его значения в группе детей с тромбозами значительно (на 22%) превышали уровень фактора фВ у детей без тромбозов. В первой группе его активность колебалась от 71% до 290% (Ме 105%), а во второй группе активность составила — Ме 128% (Min — 100, Max — 228%). Референсный интервал 50–120%. При этом наибольших значений активность фактора фВ достигла во второй точке в обеих группах. На третьи послеоперационные сутки активность фактора фВ снижалась быстрее в первой группе пациентов, а во второй группе активность оставалась на высоком уровне. Обращает на себя внимания тот факт, что во второй группе пациентов до операции активность фактора фВ значительно превышала (в 1,85 раза) таковую у пациентов первой группы и резко возрастала в первые сутки после хирургического вмешательства.
Клинический пример
Мальчик Н., 3 месяца жизни. Родился от второй беременности (первые роды — мальчик, 11 лет, здоров), протекавшей на фоне угрозы прерывания в 6–7 недель (мама получала терапию дициноном, дюфастоном). Роды на сроке 35 недель путем экстренного кесарева сечения (преждевременное излитие околоплодных вод, ягодичное предлежание). Масса при рождении 3170 г, длина 51 см, оценка по шкале Апгар 7/7 баллов.
После рождения при обследовании выявлен порок сердца: тетрада Фалло. В возрасте 3 месяцев выполнена радикальная коррекция порока с трансанулярной пластикой. Время пережатия аорты составило 73 минуты, время ИК — 125 мин.
Ребенку выполнено исследование показателей коагулограммы в трех точках: до начала операции (во время постановки центрального венозного катетера, в операционной), через сутки после операции и на третьи сутки после оперативного вмешательства.
На третьи сутки по данным нейросонографии в паренхиме головного мозга, слева в теменно-височной области с распространением назад визуализировался гиперэхогенный очаг с нечетким, неровным, «размытым» контуром, размером до 35 × 19 мм, аваскулярный по цветному допплеровскому картированию. С третьих послеоперационных суток, в связи с развитием синдрома малого сердечного выброса, пациенту проводилась экстракорпоральная мембраннач оксигенация (ЭКМО). На десятые послеоперационные сутки и после семи суток ЭКМО наступила смерть пациента.
Как видно из табл. 2, у ребенка отмечался повышенный уровень ФМ уже до операции, и этот показатель достиг максимальных значений на третьи послеоперационные сутки.
Обсуждение
Повышение уровня ФМ отмечалось во всех точках у больных с тромбозами — как до операции, так и после. Причем наиболее критичные значения наблюдались на третьи сутки после операции. Следует отметить тот факт, что у пациентов в первой группе повышения уровня ФМ не наблюдалось ни в одной точке. У детей первого года жизни, которым проводились оперативные вмешательства по поводу ВПС с использованием ИК, отмечалось динамическое повышение уровня ФМ при определении во второй и третьей точках. У детей во второй группе уровень ФМ был выше, по сравнению с детьми из первой группы (p ≤ 0,05).
При этом колебания значений данного показателя во второй группе составили Ме 78,33; 37,15 и 79,44 мкг/мл в первой, второй и третьй точках соответственно. Референсный интервал 2,46–11,96 мкг/мл. Межквартильный размах 146,24 — первая точка, 64,86 — вторая точка, 143,12 — третья точка. Значения уровня ФМ в первой группе составили 8,21; 13,18 и 8,72 мкг/мл в первой, второй и третьей точках соответственно (2; 90). Межквартильный размах 6,48 — первая точка, 19,34 — вторая точка, 6,34 — третья точка.
У пациентов второй группы уровень ФМ значительно превышал референсные значения уже до операции (на 555%, 211% и 564% в каждой из трех точек соответственно). Однако после операции показатель снизился почти в 2 раза — медиана 37,15 мкг/мл, а на третьи сутки вновь повысился, медиана 79,44 мкг/мл. Выявлена закономерность, что все случаи тромбозов регистрировались на 3–4 сутки после операций.
- В первой группе значение активности фактора фВ до операции находилось в пределах референсных значений — медиана 104% (референсные значения 50–120%); во второй точке (первые послеоперационные сутки) значение повысилось до 292%, и в третьи послеоперационные сутки значение фактора фВ снизилось до 170%.
- Во второй группе отмечается аналогичная динамика показателей активности фактора фВ, однако значения в каждой точке выше референсных и значительно выше, чем в соответствующей точке в первой группе (p ≤ 0,05). Me составили 192%, 362% и 301% в первой, второй и третьей точках соответственно.
При сравнении динамики показателей активности фактора фВ в первой и второй группе можно предположить, что эндотелиальная дисфункция более выражена у пациентов во второй группе (значения во всех трех точках значительно выше, чем у пациентов первой группы, — 192%, 362% и 301% — в первой, второй и третьей точках соответственно) (p ≤ 0,05). Высокий уровень фактора фВ можно рассматривать как маркер эндотелиальной дисфункции, и повышение этого показателя может ассоциироваться с возникновением тромбозов у детей с ВПС после операций на сердце с применением ИК [5].
По данным литературы [6], повышенный уровень ФМ ассоциируется с высоким риском сердечно-сосудистых осложнений, смертностью от сердечно-сосудистых заболеваний и повышает риск общей летальности у пациентов с фибрилляцией предсердий.
Заключение
Исходя из проведенного обследования, можно предположить, что изначально повышенный уровень ФМ и фактора фВ является одним из факторов развития тромботических осложнений у детей в возрасте до одного года, после операций на сердце с использованием ИК.
В свою очередь уровень фВ в крови является патофизиологическим маркером дисфункции эндотелия, позволяющим оценивать наличие и степень выраженности нарушения функционального состояния эндотелия при различных заболеваниях.
Учитывая, что показатели скрининга при исследовании системы гемостаза не чувствительны к активации процессов гиперкоагуляции, определение уровня ФМ и фактора фВ можно использовать как прогностические маркеры тромботических осложнений в плазме крови пациентов с ВПС, перенесших хирургическое лечение пороков сердца с использованием ИК.
Литература
- Sniecinski R. M., Wayne L. Chandler: Activation of the Hemostatic System During Cardiopulmonary Bypass // Anesth Analg. 2011; 113: 1319–1333.
- Gu Y. J., Boonstra P. W., Graaff R., Rijnsburger A. A., Mungroop H., van Oeveren W. Pressure Drop, Shear Stress, and Activation of Leukocytes During Cardiopulmonary Bypass. A Comparison Between Hollow Fiber and Flat Sheet Membrane Oxygenators // Artificial organs. 2000; 24 (1): 43–48.
- Benavidez O. J., Gauvreau K., DelNido P., Bacha E., Jenkins K. J. Complications and risk factors for mortality during congenital heart surgery admissions // Ann Thorac Surg. 2007, Jul; 84 (1): 147–155.
- Pediatric Critical Care 4th Edition: St. Louis: Elsevier; 2011.
- Shahidi M. Thrombosis and von Willebrand Factor // Adv Exp Med Biol. 2017; 906: 285–306.
- Rivera-Caravaca J. M., Roldán V., Romera M., Asunción M., Pastor E., Valdés M., Lip G. Y. H., Vicente V., Marín F. Soluble Fibrin Monomer Complex and Prediction of Cardiovascular Events in Atrial Fibrillation: The Observational Murcia Atrial Fibrillation Project // J Gen Intern Med. 2018; 33 (6): 847–854.
О. Б. Гордеева1, кандидат медицинских наук
Р. Ф. Тепаев, доктор медицинских наук, профессор
А. Р. Биджиев
ФГАУ НМИЦ ЗД Минздрава России, Москва
1 Контактная информация: obr@yandex.ru
DOI: 10.26295/OS.2019.33.40.007
Оценка динамики фибрин-мономера и фактора фон Виллебранда в послеоперационном периоде у детей с врожденными пороками сердца/ В. А. Ластовка, О. Б. Гордеева, Р. Ф. Тепаев, А. Р. Биджиев
Для цитирования: Лечащий врач № 7/2019; Номера страниц в выпуске: 36-39
Теги: сердце, операции, гемокоагуляционные осложнения
Купить номер с этой статьей в pdf