Пациентка П., 1959 г. р., в июне 2018 г. обратилась в клинику с жалобами на частые ноющие, периодически сильные, нестерпимые жгучие боли в ногах (стопы, голени, несколько больше слева) в покое; частые ощущения жжения и онемения в ногах средней интенсивности, частые ощущения покалывания, «ползания мурашек» в ногах, жжения языка, а также неустойчивость, пошатывание при ходьбе, мышечную слабость.
Из анамнеза болезни известно: 9 лет назад впервые при профилактическом обследовании был выявлен сахарный диабет (СД) 2 типа. С этого времени строго соблюдает диету с исключением легкоусвояемых углеводов, ограничением суточного потребления жира. Около 8 лет в постоянном режиме принимает метформин (в течение последних 5 лет в суточной дозе 1,5 г/сут), в течение последних 5 лет — в сочетании с Гликлазидом МВ Фармстандарт 60 мг/сут. Средний уровень глюкозы крови по дневнику самоконтроля за последние 2 недели: натощак 7,8 ммоль/л, через 2 часа после еды 10,5 ммоль/л. Кетоацидоз и тяжелые гипогликемии отрицает, легкие гипогликемии — редко (однократно в течение последних 6 месяцев) при нарушении режима питания. Около 2 лет назад выявлена непролиферативная диабетическая ретинопатия, диабетическая нефропатия (хроническая болезнь почек 2-й стадии, альбуминурия 1-й стадии), по поводу чего регулярно проходит профилактические обследования. Ощущения жжения, покалывания, онемения, ноющие боли в ногах беспокоят периодически достаточно давно (несколько лет), в связи с малой выраженностью особого внимания на эти симптомы не обращала. Около 6 месяцев назад вышеперечисленные жалобы усилились: боли в ногах стали практически постоянными, стали возникать в покое, особенно выраженные — в ночное время, стихающие при движении, массаже ног, в связи с чем нарушился ночной сон; в течение 2–3 последних месяцев появилась слабость в ногах, особенно выраженная при подъеме по лестнице, ощущения неустойчивости при ходьбе, пошатывание. В связи с указанными жалобами неоднократ��о была консультирована врачом-терапевтом, сосудистым хирургом, эндокринологом, ревматологом, по рекомендациям в соответствии с врачебными заключениями (установленные диагнозы: деформирующий остеоартроз, диабетическая дистальная полинейропатия, остеохондроз позвоночника, хроническое заболевание вен) принимала нестероидные противовоспалительные средства (местно и per os), венотонические средства (местно и
Из анамнеза жизни известно, что пациентка не курит и отрицает злоупотребление алкоголем, не отмечает воздействие профессиональных вредных факторов в течение жизни. Наследственный анамнез по неврологической и эндокринной патологии не отягощен. В 2007 г. выявлена артериальная гипертензия (артериальное давление (АД) max 160/100 мм рт. ст.), по поводу которой в постоянном режиме принимает бисопролол 2,5 мг 1 раз в день, лозартан 25 мг/сут (АД по дневнику около 110/60–70 мм рт. ст.), а также кардиомагнил 75 мг/сут. На момент обращения пациентка отрицала ранее установленные заболевания желудочно-кишечного тракта, питалась разнообразно, не принимала других лекарственных средств, кроме вышеуказанных.
Особенности клинического статуса и результатов обследования. Состояние удовлетворительное. Рост 150 см, масса тела 75 кг, индекс массы тела (ИМТ) 33,5 кг/м2. Глоссит Гюнтера–Мюллера. Кожные покровы обычной окраски, кожа голеней, тыльной поверхности стоп субатрофична, суховата, имеется умеренно выраженный подошвенный гиперкератоз. Тоны сердца ритмичные, значительно приглушены, частота сердечных сокращений 78 в минуту, акцент II тона на аорте. АД 130/80 мм рт. ст. Стопы теплые, пульсация на артериях тыла стоп снижена, на подколенных артериях сохранена. Оценка периферической чувствительности, рефлексов, силы мышц: болевая чувствительность (колесико Вартенберга) сохранена, тактильная чувствительность снижена на подошвенной поверхности стоп, температурная (тип-терм) снижена на подошвенной и тыльной поверхностях стоп, снижена вибрационная чувствительность (медицинский камертон) — 4–5 баллов. Гипотрофия мелких мышц стоп. Пошатывание в позе Ромберга. Тесты диагностики кардиальной формы диабетической автономной нейропатии (на фоне кратковременной отмены бисопролола) отрицательны: тест с глубоким дыханием — 16 уд./мин; тест в положении стоя — 1,06; проба Вальсальвы — 1,25; ортостатическая проба — 5 мм рт. ст. Оценка предъявляемых жалоб (боль, жжение, парестезии, онемение) по шкале неврологических симптомов (TSS, Total Symptoms Score) составила 9,32 балла, индекс шкалы нейропатического дисфункционального счета (NDS) составил 10 баллов, свидетельствуя об умеренно выраженной сенсомоторной нейропатии. Дуплексное сканирование сосудов нижних конечностей выявило признаки атеросклероза магистральных артерий нижних конечностей. При электронейромиографии выявлены признаки нейропатии малоберцового нерва с обеих сторон по типу миелопатии (демиелинизирующий процесс). Пациентке было проведено исследование эндотелийзависимой (ЭЗВД) и эндотелийнезависимой вазодилатации (ЭНЗВД) — пробы с нитроглицерином и сальбутамолом соответственно (фотоплетизмограф PulseTrace, MicroMedical, Англия), в ходе которого выявлена эндотелиальная дисфункция — парадоксальная реакция на сальбутамол в виде повышения индексов отражения и ригидности.
В ходе проведения дифференциальной диагностики проявлений дистальной полинейропатии (ДПН) пациентке было проведено дополнительное лабораторное обследование, в результате которого были выявлены: отсутствие отклонений в общем анализе крови, эутиреоз (ТТГ 3,4 мМЕ/мл), гипергомоцистеинемия, дефицит витамина В12, нормальное содержание фолиевой кислоты, близкий к тяжелому дефицит витамина D, умеренное повышение паратгормона (табл. 1). Учитывая выявленные изменения, пациентке было рекомендовано проведение фиброгастродуоденоскопии, выявившей атрофический гастрит (патологические изменения умеренные, H. pylory не обнаружен). Тестирование по госпитальной шкале тревоги и депрессии (HADS) не выявило отклонений от нормы (показатель шкалы тревоги — 4, шкалы депрессии — 5). Оценка качества жизни по опроснику SF-36 показала существенное снижение физического компонента здоровья (значение показателя — 20,22) и некоторое снижение психического компонента (значение показателя — 49,42).
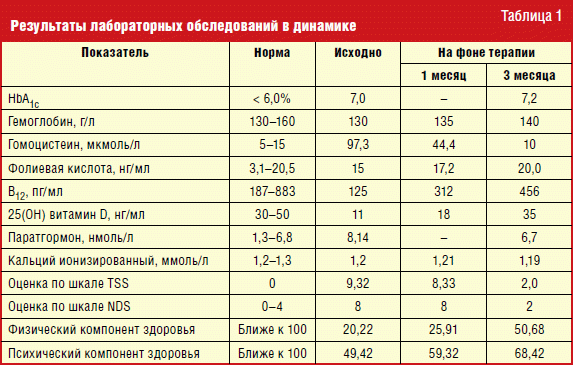
Учитывая результаты обследования, был сформулирован диагноз: «Сахарный диабет 2 типа. Диабетическая ретинопатия обоих глаз, непролиферативная. Диабетическая нефропатия. Хроническая болезнь почек С2, А1. Диабетическая дистальная сенсомоторная полинейропатия, болевая форма (синдром беспокойных ног). Целевой уровень HbA1c 7–7,5% (достигнутый 7,0). Артериальная гипертензия 3-й стадии, риск 4. Хронический атрофический, HB-негативный гастрит. Дефицит витамина В12. Дефицит витамина D. Вторичный гиперпаратиреоз».
Назначена терапия: колекальциферол 50 000 МЕ в неделю на 8 недель с последующим снижением дозы (согласно [1]); витамин В12 в/м 1 мг 3 раза в неделю в течение 2 недель, далее в/м 1 раз в неделю в течение 2 недель, далее в/м 1 раз в месяц.
При контрольном визите (через 1 месяц) отмечена незначительная субъективная положительная динамика (снижение показателя шкалы TSS, небольшой прирост физического и психического компонентов здоровья опросника SF-36) без изменения показателя шкалы NDS. Доминирующая по выраженности жалоба на интенсивные боли в ногах сохранялась, но боли возникали реже, несколько меньше была частота возникновения ощущений жжения, онемения и парестезии. По лабораторным данным была отмечена положительная, но недостаточно выраженная динамика в уровнях витамина D и гомоцистеина, значимые изменения уровня витамина В
Существенная положительная динамика была достигнута через 3 месяца терапии: боли в ногах были купированы, значительно уменьшились прочие нейропатические проявления, исчезли жалобы на пошатывание при ходьбе и неустойчивость походки, улучшилось общее самочувствие, восстановился сон, возросли показатели качества жизни. По результатам контрольного лабораторно-инструментального обследования были достигнуты целевые значения витаминов D и В12, гомоцистеина, паратгормона. При оценке функции эндотелия также отмечена некоторая положительная динамика: улучшение характеристик ЭЗВД и ЭНЗВД, уменьшение выраженности парадоксальной реакции на сальбутамол. Пациентке было предложено продолжить прием метформина, к лечению добавлен комплекс Ангиовит (цианокобаламин 6 мкг; фолиевая кислота 5 мг; гидрохлорид пиридоксина 4 мг; 1 таблетка в течение 30 дней) с последующей оценкой эффективности терапии — контрольное исследование уровня витамина В12 и решение вопроса о коррекции сахароснижающей терапии (отмена метформина) и необходимости продолжения парентерального введения цианокобаламина.
Обсуждение клинического наблюдения
Дистальная полинейропатия — одно из самых частых хронических осложнений СД и одна из основных причин заболеваемости и смертности при СД в целом и среди пациентов пожилого возраста с СД в частности [2]. Дистальная симметричная полинейропатия — это пример диффузной ПН и наиболее распространенная форма диабетической ПН, выявляемая более чем у 50% пациентов с СД в целом и в 20% случаях — на момент диагностики СД [3]. У пациентов с СД хроническая симметричная ПН является примером группы «типичных» ДНП: развивается на фоне длительной хронической гипергликемии, ассоциирована с метаболическими нарушениями (накопление конечных продуктов гликирования, окислительный стресс, липотоксичность), кардиоваскулярными факторами риска, гипергомоцистеинемией, микроангиопатиями (нефропатия, ретинопатия). В Американском эпидемиологическом исследовании распространенность ДПН в возрастной группе 60–74 года составила 32–50% для лиц с СД, 11% для лиц с нарушенной толерантностью к глюкозе и 7,2% для нормогликемических лиц [4]. Проявления ДН могут встречаться при ряде других состояний и заболеваний, в том числе наиболее распространенных среди лиц пожилого возраста (табл. 2).
Один из частных случаев развития ДПН — дефицит витамина В12. Витамин B12, также известный как кобаламин, — водорастворимый кобальтсодержащий витамин. Витамином B12 обобщенно именуется группа кобаламинов, включающая цианокобаламин, гидроксикобаламин, метилкобаламин и 5-дезоксиаденозил кобаламин. Все формы витамина В12 внутриклеточно преобразуются в биологически активные формы 5-дезоксиаденозил кобаламин и метилкобаламин [5]. Витамин В12 является кофактором трех основных реакций (конверсии метилмалоновой кислоты в сукцинил коэнзим А, конверсии гомоцистеина в метионин, конверсии 5-метилтетрагидрофолата в тетрагидрофолат), имеющих ключевое значение для функционирования нервной системы и продукции клеток крови [6]. Клинические проявления дефицита витамина В12 чрезвычайно разнообразны (табл. 3).
Дефицит витамина В12 является наиболее значимой причиной гипергомоцистеинемии (ГГЦ), в связи с чем уровень гомоцистеина рассматривается как показатель статуса витамина В12 [6]. Выявленные у пациентки П. глоссит Гюнтера–Мюллера и выраженная ГГЦ натолкнули на необходимость оценки уровня витамина В12, которая подтвердила предположение о дефиците В12. В данном наблюдении ГГЦ действительно можно расценить как ожидаемое лабораторное отклонение и «маркер» дефицита В12.
Следует отметить, что дефицит витамина В12 у пациентов с СД рассматривается рядом авторов как фактор риска развития диабетической нейропатии [7–9].
Известно, что частота дефицита В12 увеличивается с возрастом. В недавнем проспективном исследовании показано, что 15% взрослого населения старше 65 лет имеют по лабораторным данным дефицит витамина B12 [10, 11]. По данным турецкого исследования дефицит витамина В12 обнаруживается в 62,2%, 72,2% и 50% случаев в возрасте 60–74, 75–84 и > 85 лет соответственно [12]. По данным ВОЗ предполагается увеличение актуальности проблемы дефицита В12, обусловленное удвоением к 2025 г. и утроением к 2050 г. числа больных в возрастной группе 60 лет и старше. Помимо пожилого возраста, являющегося независимым фактором риска, достаточно подробно изучены и прочие причины развития дефицита В12 (табл. 4).
Классическим этиологическим фактором дефицита В12 является аутоиммунная деструкция париетальных клеток желудка, ведущая к развитию атрофического аутоиммунного гастрита со сниженной продукцией внутреннего фактора Касла, в комплексе с которым происходит усвоение 99% поступающих в желудок витамина В12 и фолиевой кислоты, в результате чего резко уменьшается всасывание витамина В12, постепенно развивается его дефицит и пернициозная анемия [5]. Однако в последние годы ведущим причинным фактором выступает нарушение высвобождения витамина В12 из связи с транспортными белками пищи вследствие патологии желудка — ахлоргидрии, атрофического гастрита, резекции желудка и, возможно, инфекции Helicobacter pylori [5]. Одной из наиболее частых значимых в контексте дефицита В12 форм поражения желудка является атрофический гастрит. В частности, частота его выявления в возрастной группе от 31 до 50 лет составляет около 30%, среди пожилых людей — около 70%. Атрофический гастрит характеризуется потерей соответствующего количества желез в слизистой оболочке желудка [14], вследствие чего и развиваются соответствующие дефицитные состояния. Выявленный у пациентки П. атрофический гастрит можно рассматривать как причину дефицита витамина В12.
Медикаментозно-ассоциированный В12-дефицит описан при длительном (более 2 лет) приеме ингибиторов протонной помпы блокаторов Н2-гистаминовых рецепторов. Показано, что риск развития В
У пациентов с СД 2 типа мальабсорбция витамина В12 была описана впервые в 1971 г. в группе больных, получавших метформин. Результаты недавно опубликованного метаанализа подтверждают, что применение метформина (являющегося на сегодняшний день препаратом первого выбора в терапии СД 2 типа) ассоциировано со снижением сывороточного уровня В12 [16]. На сегодняшний день распространенность В12-дефицита среди пациентов, получающих метформин, по разным данным варьирует от 5,8% до 52% [5]. Процент снижения уровня витамина В12 на фоне метформина колеблется от 17,8% до 26,8% в кросс-секционных исследования и от 6,3% до 18,7% в клинических исследованиях длительностью 6–16 недель. Отмечается положительная ассоциация между дозой метформина и концентрацией витамина В12 [5]. Проведенный недавно систематический обзор 6 РКИ подтвердил, что прием метформина ассоциирован со снижением уровня В12 в дозозависимой форме [17]. По некоторым данным риск В12-дефицита повышается при длительности приема метформина от 4 месяцев [6]. Наиболее обсуждаемый механизм влияния метформина заключается в предположении, что метформин выступает как антагонист катионов кальция, мешая связываться кальцийзависимому комплексу «В
Клиническое значение В12-дефицита при СД продолжает дискутироваться. Установлено, что выявляемый у части пациентов с СД 2 типа дефицит В12 может быть связан с более тяжелыми проявлениями ДН [18, 19]. Кроме того, развивающаяся ГГЦ повышает исходно высокий риск сердечно-сосудистых осложнений у больных СД 2 типа, в связи с чем, по мнению некоторых авторов, необходим скрининг дефицита витамина В12 среди больных, получающих метформин [20]. Систематический обзор и метаанализ РКИ (12 РКИ, 1311 участников, пациенты с СД 2 типа или СПКЯ, в одном РКИ — пациенты с ишемической болезнью сердца без СД), ставивший целью выявить эффект метформина в отношении гомоцистеина, показал, что в отсутствие приема витаминных добавок применение метформина действительно ассоциировано с достоверно более высоким уровнем гомоцистеина [20]. Многоцентровое рандомизированное плацебо-контролируемое исследование, проведенное в Нидерландах, в котором приняли участие 390 пациентов с СД 2 типа, продемонстрировало, что прием метформина (длительность наблюдения 4,3 года) ассоциирован не только с 19% снижением уровня В12, но и со снижением на 15% уровня фолатов и повышением гомоцистеина на 5% [21].
Учитывая клиническую симптоматику, наблюдаемую у пациентки П., нельзя не обратить внимание на выявленный дефицит витамина D. Известно, что недостаточность витамина D, определяемая уровнями 25(OH)D менее 30 нг/мл, у женщин в постменопаузе в России составляет 74–83,2% [1]. Хотя многие аспекты взаимосвязи статуса витамина D и СД, его осложнений по-прежнему оцениваются как не имеющие достаточно доказательств, некоторыми авторами дефицит витамина D у пациентов с СД рассматривается как фактор риска, демонстрирующий сильную ассоциацию с развитием ДПН [22]. Накапливаются клинические данные о распространенности среди пациентов с ДПН дефицита витамина D, указывающие на патогенетическую роль последнего и его негативное влияние на клинические проявления ДПН [23–27]. Более того, в недавнем исследовании в группах пациентов с СД 2 типа без ДПН, с СД 2 типа и ДПН и с СД 2 типа и болевой формой ДПН, после коррекции на фактор солнечного света и физическую активность, установлено, что в развитии болевой формы ДПН единственной независимой значимой переменной оказался уровень витамина D. Уровень витамина D прямо коррелировал с порогом чувствительности в холодовой пробе и субэпидермальной плотностью нервных волокон. В итоге авторы также поддержали предположение о патогенетической роли дефицита витамина D в развитии нейропатии мелких волокон при СД [28]. Таким образом, выявленный у пациентки П. дефицит витамина D можно рассматривать как дополнительный фактор усугубления симптомов ДПН, генез которой следует признать комплексным. В данной клинической ситуации для коррекции дефицита витамина D использовался водный раствор колекальциферола (витамин D3, Аквадетрим). Учитывая, что физиологическое усвоение витамина D
Таким образом, учитывая достаточно протяженное формирование клинических проявлений ДПН у пациентки с длительным анамнезом СД 2 типа, наличие классической диабетической ДПН не вызывает сомнений. Тем не менее, в данном наблюдении было выявлено присутствие патогенетически значимой патологии — дефицита витамина D и дефицита витамина В12, а также выявлены вероятные причины последнего (атрофический гастрит, длительный прием метформина). Существенная субъективная положительная динамика в проявлениях ДПН, общем самочувствии, качестве жизни была отмечена на фоне достижения целевых уровней витаминов D и В
Литература
- Пигарова Е. А., Рожинская Л. Я., Белая Ж. Е., Дзеранова Л. К. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых // Проблемы эндокринологии. 2016; 4; 60–84. DOI: 10.14341/probl201662460–84.
- Кроненберг Г. М., Мелмед Ш., Полонски К. С., Рид Л. П. Сахарный диабет и нарушения углеводного обмена / Пер. с англ. под ред. И. И. Дедова, Г. И. Мельниченко. М.: ООО «Рид Элсивер», 2010. 448 с.
- Marcus J., Lasch K., Wan Y., Yang M. et al. An Assessment of Clinically Important Differences on the Worst Pain Severity Item of the Modified Brief Pain Inventory in Patients with Diabetic Peripheral Neuropathic Pain // Pain Research and Management. 2018, Article ID2140420, 8 p. https://doi.org/10.1155/2018/2140420.
- Dyck P. J., Clark V. M. et al. Impaired Glycemia and Diabetic Polyneuropathy // Diabetes Care. 2012, Mar; 35 (3): 584–591. DOI: 10.2337/dc11–1421.
- Marwan A. A. Metformin and Vitamin B12 Deficiency: Where Do We Stand? // J Pharm Pharm Sci. 2016; 19 (3): 382–398.
- Langan R. C., Goodbred A. J. Vitamin B12 Deficiency: Recognition and Management // Am Fam Physician. 2017; V. 15; 96 (6): 384–389.
- Ben Ahmed H., Bouzid K., Hassine М. et al. Prevalence of non-conventional cardiovascular risk factors in Tunisian diabetics // Presse. Med. 2014; 43 (1), e9-e16.
- Molina М., González R., Folgado J., Real J. T. et al. Correlation between plasma concentrations of homocysteine and diabetic polyneuropathy evaluated with the Semmes-Weinstein monofilament test in patients with type 2 diabetes mellitus // Med. Clin. (Barc). 2013; 141 (9), 382–386.
- Li J., Shi M., Zhang H., Yan L. et al. Relation of homocysteine to early nephropathy in patients with Type 2 diabetes // Clin. Nephrol. 2012; 77 (4), 305–310.
- Herrmann W., Obeid R. Causes and Early Diagnosis of Vitamin B12 Deficiency // Dtsch Arztebl Int. 2008; 105 (40): 680–685. DOI: 10.3238/arztebl.2008.0680.
- Al-Ameri G. A., Alkadasi M. N., E. Ali Hassan Al-shuga, Sallam A. et al. Association of Chronic H. pylori infection with Pernicious Anemia in Ibb // The Journal of Medical Research. 2018; 4 (2): 93–97.
- Yildirim T., Yalç?n A., Atmis V. et al. Prevalence anemia, iron, vitamin B12 and deficiencies of folic acid in community housing for older people in Ankara, Turkey //Arched Gerontol Geriatr. 2015; 60: 344–348. DOI: 10.1016/j.archger.2015.01.001.
- Hunt A., Harrington D., Robinson S. Vitamin B12 deficiency // BMJ. 2014; 349: g5226.
- Correa P. Chronic gastritis: a clinico-pathological classification // Am J Gastroenterol. 1988; 83: 504–509.
- Lam J. R., Schneider J. L., Zhao W., Corley D. A. Proton pump inhibitor and histamine 2 receptor antagonist use and vitamin B12 deficiency // JAMA. 2013; 310 (22): 2435–2442.
- Niafar M., Hai F., Porhomayon J., Nader N. D. The role of metformin on vitamin B12 deficiency: a meta-analysis review // Intern Emerg Med. 2015, Feb; 10 (1): 93–102.
- Liu Q., Li S., Quan H., Li J. Vitamin B12 Status in Metformin Treated Patients: Systematic Review. // PLoS ONE. 2014; 9 (6): e100379. DOI: 10.1371/journal.pone.0100379.
- Wile D. J., Toth C. Association of metformin, elevated homocysteine, and methylmalonic acid levels and clinically worsened diabetic peripheral neuropathy // Diabetes Care. 2010. 33: 156–161.
- Ahmed M. A., Muntingh G., Rheeder P. Vitamin B12 deficiency in metformin-treated type-2 diabetes patients, prevalence and association with peripheral neuropathy // BMC. Pharmacology & Toxicology. 2016; 17: 44. DOI: 10.1186/s40360–016–0088–3.
- Zhang Q., Li S., Li L. et al. Metformin Treatment and Homocysteine: A Systematic Review and Meta-Analysis of Randomized Controlled Trials // Nutrients. 2016; 8 (12): 798. DOI: 10.3390/nu8120798.
- De Jager J., Kooy A., Lehert P. et al. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B12 deficiency: randomised placebo controlled trial // BMJ. 2010; 340: c2181.
- Papanas N., Ziegler D. Risk Factors and Comorbidities in Diabetic Neuropathy: An Update // The Review of Diabetic Studies: RDS. 2015; 12 (1–2): 48–62. DOI: 10.1900/RDS.2015.12.48.
- Lv W. S., Zhao W. J., Gong S. L., Fang D. D. et al. Serum 25-hydroxyvitamin D levels and peripheral neuropathy in patients with type 2 diabetes: a systematic review and meta-analysis // J Endocrinol Invest. 2015; 38 (5): 513–518.
- Qu G. B., Wang L. L., Tang X., Wu W., Sun Y. H. The association between vitamin D level and diabetic peripheral neuropathy in patients with type 2 diabetes mellitus: An update systematic review and meta-analysis // J Clin Transl Endocrinol. 2017; 9: 25–31. DOI: 10.1016/j.jcte.2017.04.001.
- Bilir B., Tulubas F., Bilir B. E. et al. The association of vitamin D with inflammatory cytokines in diabetic peripheral neuropathy // J Phys Ther Sci. 2016; 28 (7): 2159–2163.
- He R., Hu Y., Zeng H. et al. Vitamin D deficiency increases the risk of peripheral neuropathy in Chinese patients with type 2 diabetes // Diabetes Metab Res Rev. 2017, Feb; 33 (2). DOI: 10.1002/dmrr.2820.
- Shehab D., Al-Jarallah K., Mojiminiyi O. A., Al Mohamedy H., Abdella N. A. Does Vitamin D deficiency play a role in peripheral neuropathy in Type 2 diabetes? // Diabet Med. 2012, Jan; 29 (1): 43–49. DOI: 10.1111/j.1464–5491.2011.03510.x.
- Shillo P. et al. Reduced vitamin D levels in painful diabetic peripheral neuropathy. First published: 13 August 2018. https://doi.org/10.1111/dme.13798.
- Громова О. А., Торшин И. Ю. Витамин D — смена парадигмы. Е. И. Гусев, И. Н. Захарова, ред. М.: ТОРУС ПРЕСС, 2017: 576 с.
- Захарова И. Н., Коровина Н. А., Боровик Т. Э., Дмитриева Ю. А. Рахит и гиповитаминоз D — новый взгляд на давно существующую проблему: пособие для врачей. М., 2011: 96 с.
- Коровина Н. А., Захарова И. Н., Чебуркин А. В. Новый взгляд на витамины группы D // Русский медицинский журнал. 2000; 1: 46–51.
- Громова О. А., Торшин И. Ю., Захарова И. Н., Спиричев В. Б., Лиманова О. А., Боровик Т. Э., Яцык Г. В. О дозировании витамина D у детей и подростков // Вопросы современной педиатрии. 2015; 14 (1): 38–47.
- Новиков П. В., Кази-Ахметов Е.А., Сафронов А. В. Новая (водорастворимая) форма витамина D3 для лечения детей с витамин-D-дефицитным и наследственным витамин-D-резистентным рахитом // Российский вестник перинатологии и педиатрии. 1997; 6: 45–48.
И. В. Друк**, 1, доктор медицинских наук
Г. И. Нечаева**, доктор медицинских наук, профессор
* ФГБУЗ ЗСМЦ ФМБА РФ, Омск
** ФГБОУ ВО ОмГМУ МЗ РФ, Омск
1 Контактная информация: drukinna@yandex.ru
Клиническое наблюдение дистальной полинейропатии у пациентки с сахарным диабетом 2 типа, дефицитом витаминов D и В12/ А. С. Лялюкова, И. В. Друк, Г. И. Нечаева
Для цитирования: Лечащий врач № 3/2019; Номера страниц в выпуске: 14-19
Теги: дистальная полинейропатия, вибрационная чувствительность, витамин В12.
Купить номер с этой статьей в pdf