Способность ощущать боль в норме служит адаптации и сохранению жизни индивидуума. Каждый человек из личного опыта узнает, что такое боль. Обусловленная патологическими состояниями боль, особенно хроническая, нередко ограничивает качество жизни не только самого пациента, но и окружающих его людей. Согласно данным Европейской федерации по изучению боли (European pain federation, EFIC), хронической болью страдает 20% взрослого населения. Примечательно, что 28% из них думают, что доктор не сможет им помочь; у 19% из них нарушена бытовая, социальная и профессиональная адаптация; 16% из них периодически думают об «уходе из жизни» [1].
Несмотря на то, что современная медицина располагает значительным арсеналом лекарственных средств, способных купировать боль, выбор препарата, который обеспечит быстрое, надежное и безопасное купирование боли удобным для пациента способом, — не всегда простая задача. Известно, что даже один и тот же человек может воспринимать одно и то же болевое ощущение в разное время и в разных условиях по-разному: от ничтожного до катастрофического. Длительность, интенсивность и характер боли, реакция пациента определяются не только силой и характером повреждения, но и зависят от особенностей личности и социально-экономических условий. Толерантность к боли зависит от воспитания и этнической принадлежности. Различают три основных типа боли: ноцицептивную (в ответ на раздражение болевых рецепторов, или обусловленную воспалением), нейропатическую (при повреждении соматосенсорной нервной системы) и дисфункциональную [2–4]. Некоторые авторы выделяют воспалительную боль в самостоятельную форму. Нередко боль носит характер сочетанной.
Частой причиной обращения людей в меди��инские учреждения считают боль в спине. Острая боль в спине в течение жизни случается у 80–90% населения, примерно в 20% случаев она становится периодической, рецидивирующей или хронической. Л. Я. Лившиц и Ю. А. Лабзин показали, что пациенты с болью в спине составляют до 34% в структуре обращений по поводу боли в поликлиники г. Саратова [5]. Н. Н. Яхно и соавт. на основании проведенных в РФ исследований установили, что чаще всего пациенты жалуются на боль в нижних отделах спины (35% случаев) и в области шеи (12%) [6].
Для эффективной помощи пациенту с болью в спине, с точки зрения невролога, чрезвычайно важно определить топический диагноз и, по возможности, установить этиологию боли. Существует множество заболеваний, проявляющихся болью в спине: диффузные заболевания соединительной ткани, дегенеративно-дистрофические, деструктивные и воспалительные изменения позвоночника, болезни внутренних органов и другие. Нередко боль становится междисциплинарной проблемой и рассматривается при участии невролога, ревматолога, ортопеда-травматолога и других специалистов. Однако в подавляющем большинстве (около 85%) случаев боль в спине неспецифична и, следовательно, может и должна быть быстро и надежно купирована назначением анальгетиков и (или) нестероидных противовоспалительных препаратов (НПВП).
При острой боли, вызванной повреждением, достаточна терапия анальгетиками; при острой или подострой боли, возникшей вследствие воспаления, наиболее эффективны НПВП. Поражение соматосенсорной нервной системы, в основе которого лежат механизмы центральной и периферической сенситизации, способствует формированию хронической нейропатической боли, развитию тревоги и депрессии; в таких случаях требуется назначение антидепрессантов и (или) антиконвульсантов. Накопленная в последние годы информация свидетельствует о важной роли гендерной принадлежности, особенностей личности, социально-культурных факторов в формировании болевых ощущений, что позволило А. Б. Данилову и соавт. сформулировать биопсихосоциальную концепцию боли, согласно которой эффективность лечения пациентов определяется воздействием не только на биологические, но и на психологические и социальные механизмы формирования боли [2].
Боль в спине в основном доброкачественна. Однако примерно в 15% случаев она все же обусловлена специфическими причинами. Согласно концепции «красных флагов», к признакам серьезной специфической патологии относят: 1) возникновение боли в возрасте моложе 20 или старше 55 лет; 2) перенесенную травму позвоночника; 3) нарастающую с течением времени интенсивность боли; 4) отсутствие облегчения болевого синдрома или его усиление после пребывания в горизонтальном положении; 5) перенесенные онкологические заболевания; 6) дебют болевого синдрома в грудном отделе позвоночника; 7) длительный прием кортикостероидов; 8) внутривенное употребление наркотических препаратов; 9) иммунодефицит различного происхождения; 10) существующие на протяжении длительного периода времени недомогание и (или) лихорадку; 11) необъяснимую потерю веса; 12) аномалии развития; 13) очаговый неврологический дефицит [7, 8].
По характеру течения выделяют острую (длительностью менее 4 недель), подострую (от 4 до 12 недель) и хроническую (более 12 недель) боль; такая систематизация условна, но позволяет выбрать верный алгоритм ведения конкретного пациента. В большинстве случаев боль в спине носит острый характер, продолжается несколько (3–7) дней, хорошо купируется НПВП и миорелаксантами на этапе оказания амбулаторной медицинской помощи. Однако у 30% пациентов боль сохраняется на протяжении 6 недель. Хронизация боли обуславливает формирование у пациента «болевого поведения», изменение восприятия боли, появление страха ожидания боли, появление раздражительности, тревожных и депрессивных расстройств. Важно заметить эти «желтые флаги»: 1) отсутствие мотивации больного к активному лечению, несмотря на достаточное информирование его врачом об отсутствии опасности серьезных осложнений; 2) пассивное ожидание результатов лечения; 3) поведение, неадекватное характеру боли, избегание физической активности; 4) конфликты на работе и в семье; 5) депрессия, тревога, постстрессовые расстройства, избегание социальной активности [7, 8]. Трансформация боли в хроническую форму требует иного подхода к ведению больного и назначения антиконвульсантов и (или) антидепрессантов.
При повторном визите к врачу пациента с болью в спине необходим тщательный анализ клинической картины и анамнеза, оценка комплаентности и эффективности лечения. В случае обнаружения «красных флагов», инструментальные и лабораторные методы обследования позволяют определить этиологический диагноз и провести дифференциальную диагностику с соматическими и неврологическими заболеваниями.
В числе причин, вызывающих у докторов различных специальностей затруднения при купировании боли, — различия в этиологии и патогенезе, многообразие «масок» боли, а также наличие коморбности — ситуации, когда у одного пациента сочетаются два и более хронических заболевания, патогенетически взаимосвязанных между собой или совпадающих по времени вне зависимости от активности каждого из них [9, 10]. M. Fortin и соавт., основываясь на анализе данных семейных врачей, установили, что коморбидность значительно увеличивается с возрастом: у молодых людей (18–44 лет) она составляет 69%, а у лиц старшей возрастной группы (старше 65 лет) достигает 98%. При этом количество хронических болезней нарастает от 2,8 у молодых до 6,4 у пожилых пациентов [11].
Следует уделять особое внимание определению плана обследования и выбору тактики лечения таких пациентов, тем более что коморбидные состояния снижают приверженность пациентов к терапии. Определение верного алгоритма купирования боли является залогом успеха лечения в целом — важно не только купировать болевой синдром в кратчайший срок, но и сформировать правильный двигательный стереотип. Крайне важна профилактика рецидива боли [12].
В ряду коморбидных заболеваний центральной нервной системы особое место занимает болезнь Паркинсона (БП). Во-первых, она имеет значительную распространенность среди населения, особенно среди лиц пожилого возраста. В современном мире каждый час диагностируют новый случай БП, выявляя заболевание в основном у пожилых (БП страдает один из 50 людей старше 80 лет), но при этом ≈ 10% случаев БП приходятся на лиц в возрасте моложе 40 лет [13]. Прогнозируют, что рост продолжительности жизни во многих странах приведет к 2030 г. к удвоению числа заболевших БП [13, 14]. По данным отчетов неврологических стационаров г. Москвы, БП занимает пятое место в структуре нозологических форм [15]. Пациенты с БП составляют до 5,7% лиц, госпитализированных в клинику нервных болезней (КНБ) Саратовского ГМУ, где в структуре нозологических форм БП занимает четвертое место, уступая цереброваскулярным заболеваниям, болезням периферической нервной системы и демиелинизирующим заболеваниям. Во-вторых, БП отличает нетривиальная диагностика, нередко рассредоточенная во времени, что связано с многообразием двигательных (моторных) и так называемых немоторных симптомов и признаков. Одним из наиболее распространенных немоторных симптомов (НМС) считается боль, которая возникает у ≈ 60% пациентов с БП, что в два-три раза больше, чем среди лиц такого же возраста в общей популяции [16]. Боль может задолго предшествовать расстройству движений, но нередко неправильно трактуется или игнорируется врачами. Этот НМС может оказать значительное влияние на приверженность к лечению и качество жизни пациентов с БП, усиливая степень и скорость наступления инвалидизации.
Взаимосвязь боли и БП была замечена еще со времени первых классических описаний заболевания. Так, уже в известном «Эссе о дрожательном параличе» Джеймса Паркинсона [17] упоминается визит автора «…к женщине около сорока лет, жалующейся на выраженную боль в руках, которая распространялась от плеч к кончикам пальцев. Ее боль началась около 9 месяцев назад … и не наблюдалось эффекта от проводимой терапии. Однако через 3–4 недели боль постепенно стихла, сменившись слабостью и дрожанием в кистях и руках».
Как известно, диагноз БП определяется клинически по наличию облигатных признаков — гипокинезии, которая сочетается с тремором покоя, мышечной ригидностью и постуральными нарушениями. В последнее время к облигатным стали относить и немоторные проявления БП, которые развиваются у пациентов, как правило, за несколько лет до дебюта расстройств движений. Данный факт хорошо согласуется с теорией патогенеза БП, предложенной H. Braak [18], который полагает, что в патологический процесс первоначально вовлекаются экстранигральные структуры, в частности обонятельные луковицы и дорзальное моторное ядро блуждающего нерва, что в свою очередь клинически проявляется гипосмией и вегетативными нарушениями. В последующем процесс распространяется на нижние отделы ствола головного мозга, в результате чего появляются сенсорные и аффективные расстройства. И только после этого дегенеративные изменения возникают в черной субстанции.
В настоящее время изучен широкий спектр НМС, которые могут развиваться уже на продромальной стадии БП и далее прогрессировать на последующих стадиях двигательной фазы заболевания, вплоть до последней паллиативной стадии [19, 20]. У каждого пациента с БП наблюдается 8–12 НМС, которые включают сенсорные, вегетативные, нервно-психические расстройства, нарушение сна и бодрствования [21]. К самым распространенным среди сенсорных расстройств у пациентов с БП относят боль. По данным различных клинических исследований (КИ), она наблюдается у 40–70% больных, что значительно выше распространенности боли в общей популяции [22]. Зачастую боль является одним из первых предвестников развития болезни. Как правило, она локализована на той стороне, где в последующем будет развиваться двигательная симптоматика. Врачи могут длительное время наблюдать таких пациентов с ошибочными диагнозами: «плечелопаточный периартроз», «дорсопатия», «спондилоартроз», «остеоартроз» и другими, поскольку боль очень напоминает скелетно-мышечную [23]. В других случаях скелетно-мышечная боль действительно сочетается с БП. Например, непосредственной причиной боли в спине может служить спондилоартроз, усугубившийся вследствие нарушений осанки и двигательного стереотипа у пациента, страдающего БП.
На фоне развернутой клинической симптоматики двигательных проявлений БП боль может иметь самую различную локализацию и разнообразные механизмы возникновения.
B. Ford [24] считает, что по характеру боль при БП можно разделить на четыре группы:
- ноцицептивная (скелетно-мышечная, связанная с ригидностью, крампи, дискинезиями);
- невропатическая (корешковая/псевдокорешковая, первичная или центральная, связанная с акатизией);
- психогенная (связана с аффективными нарушениями);
- комбинированная.
Боль при БП также зависит от выраженности нейромедиаторных нарушений, в связи с чем выделяют следующие три ее типа:
- боль, обусловленная гиподофаминергическим состоянием (возникает в период «выключения» при моторных флуктуациях, на фоне отмены дофаминергических препаратов или вследствие недостаточности дозы дофаминергических препаратов);
- боль, обусловленная гипердофаминергическим состоянием (возникает при избыточной дофаминергической стимуляции);
- боль, не имеющая очевидной связи с приемом дофаминергических средств [25].
В 2006 г. во Франции было проведено первое КИ, посвященное оценке распространенности боли в спине у пациентов с БП [26]. В исследовании приняли участие 104 пациента. Распространенность боли в спине составила 59,6%. Выраженность боли при оценке по визуально-аналоговой шкале (ВАШ) составила в среднем 54 ± 23 мм.
В 2007 г. в Германии было проведено аналогичное исследование с целью оценки взаимосвязи боли в спине у пациентов с БП с клиническими симптомами заболевания [27]. Согласно результатам этого исследования, боль наблюдалась у 74% пациентов. Однако интенсивность боли в спине не зависела от продолжительности болезни, ее степени тяжести по шкале Хен и Яра, возраста пациента. Наиболее частой причиной боли в спине являлись повышение мышечного тонуса по пластическому типу и постуральные нарушения. Следует отметить, что пациенты с БП в этом исследовании не получали обезболивающие препараты, что позволило авторам сделать вывод о том, что боль в спине у пациентов с БП зачастую остается без коррекции лекарственными препаратами.
В 2016 г. в Турции проведено другое исследование по оценке распространенности боли у пациентов с БП. У 64,6% выявлена хроническая боль, причем у 16,4% она возникла до появления моторных проявлений болезни [28]. Хроническая боль у пациентов в данном исследовании коррелировала с клиническими проявлениями болезни (ригидностью и гипокинезией), а также с полом и наличием депрессии. Авторы пришли к выводу, что, помимо лечения моторных проявлений и лекарственных дискинезий, лечение сопутствующих НМС заболевания, таких как боль и депрессия, имеет большое значение для улучшения качества жизни пациентов с БП.
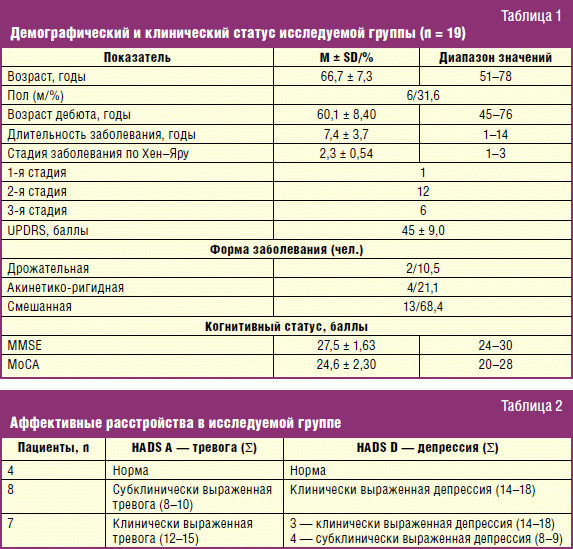
В условиях КНБ Саратовского ГМУ проведено пилотное исследование, в которое включены 19 пациентов (6 мужчин и 13 женщин), страдающих БП, предъявляющих жалобы на боль и не имеющих признаков деменции. Диагноз БП устанавливали в соответствии с общепринятыми Критериями Банка головного мозга общества болезни Паркинсона Великобритании [29, 30], стадию заболевания — по шкале Хен и Яра. Выраженность двигательных нарушений стандартизировали по шкале UPDRS [13]. Когнитивный статус определяли по Монреальской шкале оценки когнитивных функций (МоСА) и Краткой шкале оценки психического статуса (MMSE) [31]. Половозрастная и клиническая характеристика пациентов представлена в табл. 1.
Для объективизации болевого синдрома результаты врачебного осмотра формализовали расчетом индекса распространенности боли (Widespread Pain Index, WPI) и оценкой интенсивности болевого синдрома по визуально-аналоговой шкале (ВАШ). Степень выраженности тревоги и депрессии оценивали с помощью Госпитальной шкалы тревоги и депрессии (HADS). По показаниям пациентам проводилось рентгенологическое или МРТ-исследование для уточнения этиологии болевого синдрома.
Хронический болевой синдром длительностью более 3 месяцев выявлен у 15 пациентов (78,9%), из них длительностью более 1 года — у 12 (63,2%) человек. Рецидивирующий болевой синдром с ремиссиями длительностью 2–3 месяца наблюдался у четырех пациентов (21,1%). Из 15 человек с хроническим болевым синдромом у 10 (66,6%) боль появилась практически одновременно с двигательными нарушениями, у трех пациентов возникла на премоторной стадии БП — в период до 1 года до появления моторных симптомов. Два пациента отмечали развитие боли по мере прогрессирования болезни в течение двух лет. У 13 (68,4%) пациентов боль проявлялась на гомолатеральной стороне двигательных нарушений (гипокинезия, ригидность) и, как правило, локализовалась в проксимальных отделах конечностей, чаще в области плеча 10 (52,6%). Одна больная с дебютом заболевания с тремора левой руки ощущала боль на противоположной стороне (плечевой пояс справа) за 4 месяца до появления моторных проявлений. Пять пациентов (26,3%) отмечали хронический болевой синдром с двух сторон. Боль в конечностях (преимущественно болезненные дистонии) выявлена у всех шести пациентов с 3-й стадией заболевания; в нижней части спины — у 14 пациентов (73,6%) и не зависела от формы БП, степени тяжести, длительности заболевания и стороны дебюта двигательных нарушений; в области бедра — у 4 (21,0%) пациентов.
Интенсивность болевого синдрома по ВАШ достигала в среднем 58 ± 27 мм. При прогрессировании БП, на 3-й стадии с выраженным паркинсонизмом (гипокинезия и ригидность), интенсивность болевого синдрома у пациентов повышалась до 60 ± 12 мм.
Симптомы депрессии и тревоги выявлены у 15 (78,9%) больных. Результаты применения Госпитальной шкалы тревоги и депрессии представлены в табл. 2. Следует отметить, что степень выраженности депрессии и тревоги коррелировала с интенсивностью болевого синдрома по ВАШ.
Очевидно, что максимально быстрое, надежное и безопасное купирование острой боли и предотвращение ее хронизации у пациентов с БП является не только таким же приоритетным направлением, каким оно считается в отношении всех лиц, страдающих от боли, но и приобретает особо важное значение, поскольку оказывает существенное (иногда необратимое) влияние на качество жизни пациентов с БП, усиливая степень и скорость наступления инвалидизации. В силу особенностей диагностики БП и наличия коморбидной патологии выбор препарата для купирования боли нередко представляет для доктора очень сложную и весьма ответственную задачу.
Общие подходы к лечению болевых синдромов при БП включают оптимальную коррекцию противопаркинсонической терапии, коррекцию сопутствующей аффективной и скелетно-мышечной патологии, применение лечебной физкультуры, массажа, методов физиотерапии.
Критериями выбора НПВП для купирования боли являются высокая его клиническая эффективность и безопасность, последнее особенно важно при наличии коморбидной патологии. Современными принципами назначения НПВП для купирования острой ноцицептивной боли считают: 1) раннее и полное устранение боли; 2) использование минимальной эффективной дозы препарата; 3) одновременный прием не более одного НПВП; 4) оценка клинической эффективности через 7–14 дней от начала терапии; 5) отмена препарата сразу после купирования боли; 6) активное вовлечение пациента в процесс лечения и реабилитации, обучение его методам профилактики рецидива боли.
Однако выполнение некоторых из вышеуказанных правил в условиях лечения больного с коморбидной патологией может оказаться затруднительным.
Следует согласиться с авторами, полагающими, что курс лечения НПВП может быть продлен до 4–8 недель в тех случаях, когда ноцицептивная боль сохраняется дольше 14 дней [32–35]. Согласно данным F. P. Luyten и соавт., V. Strand и соавт., в таких ситуациях длительное непрерывное применение НПВП может обеспечить лучший контроль симптомов болезни, чем их использование в режиме «по требованию» [36, 37]. В других случаях (предполагаемая физическая нагрузка или необходимость длительного пребывания в неудобной позе при визите к стоматологу или в транспорте, инвазивные обследования и др.) режим «по требованию» может оказаться максимально безопасным.
Результаты КИ и практический опыт врачей свидетельствуют о том, что в адекватных дозах все НПВП практически эквивалентны по своему лечебному действию. Эффективность НПВП в целом зависит от дозы. В настоящее время выбор препарата определяется в основном путем анализа возможных побочных эффектов конкретного НПВП и наличия коморбидной патологии у конкретного пациента, а также с учетом остроты ситуации и необходимости длительного анальгетического эффекта.
Все НПВП обладают нежелательными побочными действиями, такими как: 1) диспепсия, язвы, кровотечения и перфорация желудочно-кишечного тракта (ЖКТ); 2) дестабилизация артериальной гипертонии и сердечной недостаточности, повышение риска острых кардиоваскулярных событий и связанной с ними летальности; 3) негативное влияние на функцию печени и почек; 4) повышение риска кровотечения после хирургических вмешательств и инвазивных медицинских манипуляций; 5) гематологические осложнения, аллергические реакции [38].
НПВП принято делить на несколько групп в зависимости от степени ингибирования фермента циклооксигеназы 1-го и 2-го типа (ЦОГ-1 и ЦОГ-2): преимущественно ингибирующие ЦОГ-1 (например, ацетилсалициловая кислота в небольших дозах); приблизительно одинаково ингибирующие оба типа ЦОГ (например, декскетопрофена трометамол и др.); преимущественно ингибирующие ЦОГ-2 (например, нимесулид и др.).
Значительную помощь практическим врачам при лечении боли у пациентов с коморобидной патологией представляют клинические рекомендации «Рациональное применение НПВП в клинической практике», разработанные ведущими специалистами РФ. Авторы обоснованно обращают внимание на необходимость учета особенностей назначения анальгетической терапии в нашей стране, среди которых: 1) отсутствие практики последовательного подхода к обезболивающей терапии с использованием парацетамола; 2) ограниченное применение опиоидных анальгетиков: 3) доступность НПВП в аптечной сети без рецепта; 4) значительное разнообразие НПВП; 5) обилие не всегда достоверной информации о клинических достоинствах тех или иных НПВП [38].
С целью профилактики нежелательных явлений эксперты предлагают заведомо определять риск их развития при назначении НПВП. Наиболее важными факторами риска осложнений со стороны ЖКТ являются: язвенный анамнез (наличие клинически выраженной язвы желудка и (или) двенадцатиперстной кишки, выявленной при эндоскопическом исследовании, рентгенографии или визуально в ходе операции), наличие в анамнезе ЖКТ-кровотечения и сопутствующий прием препаратов, влияющих на свертывающую систему крови.
Для оценки кардиоваскулярного риска предлагают использовать прогрессивную количественную оценку, основанную на применении таблицы SCORE (суммарный риск смерти от сердечно-сосудистых заболеваний в ближайшие 10 лет) [39, 40].
Авторы «Клинических рекомендаций…» предлагают три основных сценария применения НПВП: 1) использование любого НПВП при низкой вероятности развития осложнений — отсутствие факторов риска со стороны ЖКТ и SCORE = 0; 2) использование наиболее безопасных НПВП без дополнительной профилактики или других НПВП на фоне медикаментозной профилактики осложнений при умеренной вероятности развития осложнений — наличие «неглавных» факторов риска ЖКТ-осложнений и SCORE = 1–4; 3) применение наиболее безопасных для ЖКТ или сердечно-сосудистой системы препаратов, обязательно в сочетании с активной медикаментозной профилактикой при высокой вероятности осложнений — наличие «главных» факторов риска ЖКТ-осложнений и SCORE ≥ 5.
Методом активной профилактики осложнений со стороны верхних отделов ЖКТ является назначение ингибиторов протонной помпы (ИПП).
По мнению экспертов, очень высокий риск кардиоваскулярных осложнений (ишемическая болезнь сердца, перенесенный инфаркт миокарда или инсульт, хроническая сердечная недостаточность II ст. и более) следует рассматривать как противопоказание для использования любых НПВП. В такой ситуации с целью купирования боли рекомендуют применять комбинации парацетамола и опиоидов, локальное применение НПВП и глюкокортикостероидов.
При умеренном сочетанном риске, например, наличии диспепсии и уровне SCORE 1–4, предлагают выбирать «мягкие» неселективные НПВП [38].
Среди нежелательных эффектов, развивающихся на фоне приема НПВП, первое место занимают гастродуоденопатии, которые проявляются развитием эрозий и язв желудка и (или) двенадцатиперстной кишки, а также кровотечениями, перфорациями и нарушениями проходимости ЖКТ. Гастродуоденопатия может возникнуть у любого пациента, принимающего НПВП любой группы [41, 42].
По данным F. Bradbury, частота поражения ЖКТ на фоне приема нимесулида (8,1%; n = 3807) была заметно ниже, чем при приеме диклофенака (12,1%; n = 3553), но не отличается от таковой при использовании ибупрофена (8,6%; n = 1470) [43]. A. Conforti и соавт. провели анализ спонтанных сообщений (n = 10608) о серьезных побочных эффектах, связанных с приемом различных НПВП за период с 1988 по 2000 гг. Частота гастродуоденопатий при приеме нимесулида составила 10,4%, при использовании диклофенака — 21,2%, кетопрофена — 21,7%, пироксикама — 18,6% [44]. В результате мультицентрового исследования J. R. Laporte at al. [45] установлено, что 38% всех случаев кровотечений из верхних отделов ЖКТ у лиц старше 18 лет связаны с приемом НПВП, что составляет 152 на 1 млн населения в год. Наиболее высокий риск кровотечения отмечен при приеме кеторолака (24,7). При назначении рофекоксиба и мелоксикама он заметно выше (7,2 и 5,7 соответственно), нежели при использовании декскетопрофена (4,9), диклофенака (3,7), нимесулида (3,2), ацеклофенака (1,4) и целекоксиба (0,3).
Интересными представляются результаты исследования J. Castellsague и соавт., в котором изучен риск развития патологии ЖКТ при использовании НПВП. Относительный риск для пациентов, принимающих НПВП, составил 3,28, в частности: для рофекоксиба, целекоксиба и нимесулида — менее 2, для напроксена, ибупрофена, диклофенака, эторикоксиба и мелоксикама — не более 5, для кетопрофена, пироксикама и кеторолакcа — более 5. При этом значения коэффициента частоты развития патологии ЖКТ за период между 2001 и 2008 гг. снизились на 50% [46].
Важным вопросом безопасного применения НПВП является оценка его влияния на функцию печени. Серьезные гепатотоксические осложнения, проявляющиеся выраженным внутрипеченочным холестазом или острой печеночной недостаточностью, возникают примерно у 1 из 10 тыс. больных, регулярно принимающих НПВП [47]. Механизм повреждения гепатоцитов связан с активацией хемооксигеназы-1 и работой системы цитохрома Р450, в результате чего у пациента развивается гепатит [48]. По данным G. Traversa и соавт, частота изменения функции печени у больных, принимавших НПВП в период с 1997 по 2001 г., составила 29,8 на 100 тыс. пациенто-лет. На фоне лечения нимесулидом она достигает 35,3, при применении диклофенака — 39,2, что ниже, чем при использовании кеторолака (66,8) и ибупрофена (44,6) [49].
Среди сердечно-сосудистых осложнений при лечении НПВП наиболее актуальным (особенно для больных пожилого возраста) является повышение уровня артериального давления (АД) и снижение эффективности некоторых гипотензивных препаратов (ингибиторов АПФ и β-адреноблокаторов). Наряду с повышением АД на фоне применения НПВП могут появляться или усиливаться признаки сердечной недостаточности, что связано с задержкой жидкости, менее выраженной при использовании избирательно селективных ингибиторов ЦОГ-2 [50]. Установлено, что у пациентов с артериальной гипертонией, принимающих неселективные ингибиторы ЦОГ (диклофенак), формируются не только задержка натрия и увеличение объема внеклеточной жидкости, но и более значимая эндотелиальная дисфункция, что способствует повышению АД. В группе пациентов, принимающих нимесулид, данные о системной гемодинамике и эндотелиальной функции были сопоставимы с исходными показателями, что обосновывает возможность применения данного препарата у больных с артериальной гипертонией [51, 52]. В исследовании S. Curtis и соавт. показано, что риск кардиоваскулярных осложнений (главным образом, инфаркта миокарда) на фоне приема ингибиторов ЦОГ-2 выше по сравнению с плацебо, но сопоставим со стандартными НПВП [53]. В исследовании A. Helin-Salmivaara и соавт. выявлено, что риск развития инфаркта миокарда при использовании нимесулида составляет 1,69, что сравнимо с таковым при назначении индометацина (1,56), ибупрофена (1,41), диклофенака (1,35) и напроксена (1,19) [54]. Описания случаев снижения скорости клубочковой фильтрации и развитие тубулоинтерстициального нефрита на фоне приема НПВП нуждаются в дальнейшем изучении [55].
Одним из наиболее популярных в ряде стран Европы (Италии, России и др.) НПВП является нимесулид [41, 46]. Согласно официальной инструкции к применению нимесулида в гранулах для приготовления суспензии для приема внутрь, он главным образом ингибирует ЦОГ-2, подавляет синтез простагландинов (ПГ) в очаге воспаления. После приема внутрь нимесулид хорошо всасывается из ЖКТ. Максимальная концентрация в плазме крови после перорального приема однократной дозы нимесулида, составляющей 100 мг, достигается в среднем через 2–3 часа. Препарат выводится из организма главным образом с мочой (около 50% принятой дозы). Период полувыведения составляет 3,2–6 часов. Основными показаниями к применению этого препарата являются: острая боль (боль в спине и др.); симптоматическое лечение остеоартроза (остеоартрита) с болевым синдромом [56].
В многочисленных исследованиях показано, что нимесулид примерно в 1,3–2,5 раза обладает большей селективностью по отношению к ЦОГ-2, нежели к ЦОГ-1 [57]. В отличие от НПВП, блокирующих только ферментную активность ЦОГ, нимесулид в терапевтических дозах способен ингибировать экспрессию ЦОГ-2, что доказано в эксперименте на культуре клеток синовиальных фибробластов [58]. Нимесулид способен ингибировать синтез основных провоспалительных цитокинов (ИЛ-6, ФНО-α), активность металлопротеиназ (ММП-3 и ММП-8), ответственных, в частности, за разрушение межклеточного матрикса хрящевой ткани при остеоартрозе, оказывать антигистаминное действие, а также вызывать блокаду фермента фосфодиэстеразы IV, снижая активность макрофагов и нейтрофилов [59]. Нимесулид препятствует апоптозу хондроцитов и тем самым тормозит развитие остеоартроза [60], причем действие нимесулида на апоптоз хондроцитов является дозозависимым.
Нимесулид, как и целекоксиб, способен замедлять неоангиогенез и тормозить рост опухоли [61]. Использование нимесулида приводит также к снижению активности аттенуированной ацетилхолинэстеразы, концентрации ФНО-α, уменьшает поведенческие нарушения и расстройства памяти, спровоцированные церебральной ишемией [62]. В экспериментальных исследованиях на животных было показано, что нимесулид снижает степень нейронального повреждения (снижение объема очага поражения, выраженности неврологического дефицита) и частоту геморрагических трансформаций ишемических очагов, вызванных тромболитической реперфузией при фокальной ишемии мозга за счет угнетения экспрессии матриксных металлопротеиназ ММР-9 и ММР-2 [63].
Случаи развития гепатотоксичных осложнений при применении нимесулида редки, и их частота не превышает таковые у других НПВП [48]. Сравнительный анализ побочных реакций со стороны печени, индуцированных нимесулидом и неселективными НПВП, включающий рандомизированные и постмаркетинговые КИ, показал, что нимесулид вызывает повышение уровня печеночных ферментов не чаще, чем «традиционные» НПВП [64, 65]. При назначении нимесулида коротким курсом (не более 30 дней) повышение уровня аланин- и аспартатаминотрансферазы в 2 и более раз отмечается лишь у 0,4% больных, а при длительном многомесячном приеме не превышает 1,5% [47, 66]. Согласно данным Европейского агентства по лекарственным препаратам (European medicines agency, EMA), по состоянию на 2012 г. на 1 млн установленных суточных доз (DDD) нимесулида, принятых пациентами, приходилось 0,066 случая печеночной недостаточности [67].
Группа по изучению эффективности нимесулида (Consensus Report Group on Nimesulid) обозначила основные достоинства препарата: высокий профиль безопасности относительно осложнений со стороны ЖКТ, высокая кардиоваскулярная безопасность, выраженный противовоспалительный и анальгетический эффект [47]. Низкую частоту поражения ЖКТ на фоне лечения нимесулидом объясняют не только ЦОГ-2-селективностью препарата, но и антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [68].
Другим популярным в странах Европы НПВП является декскетопрофена трометамол. Согласно официальной инструкции к применению декскетопрофена трометамола в виде раствора для внутривенного и внутримышечного введения, механизм его действия связан с ингибированием синтеза ПГ на уровне ЦОГ-1 и ЦОГ-2. Максимальная концентрация в сыворотке после внутримышечного введения декскетопрофена трометамола достигается в среднем через 20 (10–45) минут. Главным путем его выведения является конъюгация его с глюкуроновой кислотой с последующим выделением через почки. Период полувыведения составляет около 1–2,7 часа. Основными показаниями к применению этого препарата являются: купирование болевого синдрома различного генеза (ишалгия, радикулит, невралгии, зубная боль и др.); симптоматическое лечение острых и хронических воспалительных, воспалительно-дегенеративных и метаболических заболеваний опорно-двигательного аппарата [69].
Новейший обзор ресурсов Medline, Embase и Cochrane Library показал, что декскетопрофена трометамол действительно обеспечивает быстрое и эффективное (сравнимое с опиатами) обезболивание при лечении острой боли различного происхождения (зубной боли, острых расстройств функции опорно-двигательного аппарата и др.) и хорошо переносится во время краткосрочного лечения [70, 71].
Заключение
При назначении НПВП крайне важно учитывать тип и характер боли, ее локализацию, помнить о серьезных заболеваниях, сопровождающихся болью, коморобидной патологии, а также о маскированной депрессии. Ввиду многообразия причин и «масок» боли, с одной стороны, большого числа НПВП, обладающих различным спектром безопасности и примерно одинаковой эффективностью, с другой стороны, для выбора оптимального НПВП целесообразно использовать пошаговые алгоритмы [72].
Поскольку диагностика многих хронических дегенеративных заболеваний центральной нервной системы нередко отсрочена во времени (например, при БП это обусловлено многообразием немоторных симптомов, которые предшествуют расстройству движений), с целью максимально быстрого купирования боли пациентам с коморбидной патологией показано назначение анальгетиков и (или) НПВП «по требованию» с последующим уточнением этиологии болевого синдрома. Надо иметь в виду, что при БП даже на фоне адекватного применения противопаркинсонических препаратов боль может персистировать вследствие выраженной скованности и гипокинезии, изменения позы и усугубления проявлений спондилоартрозов и спондилоартритов. Сохранение боли является основанием для продолжения приема НПВН. Следует помнить, что пациенты с БП относятся к старшей возрастной группе и у них имеется высокий риск развития осложнений со стороны как сердечно-сосудистой системы, так и желудочно-кишечного тракта, поэтому при выборе НПВП предпочтение надо отдавать наиболее безопасным препаратам.
Знания особенностей фармакодинамики и фармакокинетики НПВП позволяют рекомендовать для больных с коморбидной патологией центральной нервной системы применение препарата Дексалгин в виде раствора для внутривенного и внутримышечного введения с целью быстрого купирования острой боли «по требованию», а препарата Нимесил в гранулах для приготовления суспензии для приема внутрь — в комплексном лечении пациентов, страдающих от боли в спине.
Своевременное и эффективное купирование острой боли позволяет предотвратить ее трансформацию в хроническую и обеспечить восстановление высокого качества жизни у больных с коморбидной патологией.
Литература
- Breivik H., Collett B., Ventafridda V. et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment // Eur J Pain. 2006. Vol. 10 (4). P. 287–333.
- Данилов А., Данилов А. Управление болью. Биопсихосоциальный подход. М., 2012. 582 с.
- Classification of Chronic Pain / Merskey H., Bogduk N. (Eds.). Seattle, Wash: IASP Press, 1994. P. 209–214.
- Cruccu G., Anand P., Attal N. et al. EFNS guidelines on neuropathic pain assessment // Eur J Neurol. 2004. Vol. 11 (3). P. 153–162.
- Лабзин Ю. А. К эпидемиологии нейрогенных болевых синдромов в г. Саратове. Саратов, 1989. С. 3–9.
- Яхно Н. Н., Кукушкин М. Л., Давыдов О. С. и др. Результаты Российского эпидемиологического исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу // Боль. 2008. № 3. С. 24–32.
- ACPA resource guide to chronic pain medication & treatment [Электронный ресурс]. URL: http://www.theacpa.org/ (дата обращения: 02.11.2016).
- European guidelines for the management of acute nonspecific low back pain in primary care // Eur Spine J. 2006. Vol. 15. P. 169–191.
- Белялов Ф. И. Двенадцать тезисов коморбидности // Клиническая медицина. 2009. № 12. С. 69–71.
- Верткин А. Л., Скотников А. С. Коморбидность // Лечащий Врач. 2013. № 6. С. 66–68.
- Fortin M., Lapointe L., Hudon C. et al. Multimorbidity and quality of life in primary care: a systematic review // Health Qual Life Outcomes. 2004. Vol. 20 (2). P. 51.
- Van Tulder M., Becker A., Bekkering T. et al. European guidelines for the management of acute nonspecific low back pain in primary care // Eur Spine J. 2006. Vol. 15 (Suppl. 2). P. 169–191.
- Руководство по диагностике и лечению болезни Паркинсона / Под ред. С. Н. Иллариошкина, О. С. Левина. М., 2017. 336 с.
- Bach J. P., Ziegler U., Deuschl G., Dodel R., Doblhammer-Reiter G. Projected numbers of people with movement disorders in the years 2030 and 2050 // Mov. Disord. 2011. V. 26. № 12. P. 2286–2290.
- Мильчакова А. Е., Попов Г. Р., Быков А. В., Гехт А. Б. Клинико-фармакоэкономический анализ применения препарата пирибедил (Проноран) в лечении болезни Паркинсона // Журн. неврол. и психиатрии им. С. С. Корсакова. 2008. Т. 108. № 4. С. 49–55.
- Young Blood M. R., Ferro M. M., Munhoz R. P., Teive H. A., Camargo C. H. Classification and Characteristics of Pain Associated with Parkinson’s Disease // Parkinson’s Dis. 2016. V. 2016. Article ID 6067132, 8 p.
- Паркинсон Дж. Эссе о дрожательном параличе / Пер. с англ. М. В. Селиховой, ред. И. В. Литвиненко. СПб: ВМА, 2010. 82 с.
- Braak H., Del Tredici, K. Neuroanatomy and Pathology of Sporadic Parkinson’s Disease // Adv. Anat. Embryol. Cell Biol. 2009. V. 201. P. 1–119.
- Titova N. V., Padmakumar C., Lewis S. J. G., Chaudhuri K. R. Parkinson’s: a syndrome rather than a disease? // J. Neural. Transm. 2017. V. 124. № 8. P. 907–914.
- Titova N. V., Qamar M. A., Chaudhuri, K. R. Biomarkers of Parkinson’s disease: an introduction. In: International Review of Neurobiology: Parkinson’s Disease. K. Bhatia, K. R. Chaudhuri, M. Stamelou (eds). Elsevier, Academic Press (OX), 2017. P. 183–193.
- Титова Н. В., Чаудхари К. Рэй. Немоторные симптомы: «скрытое» лицо болезни Паркинсона // Болезнь Паркинсона и расстройства движений. Рук. для врачей: по матер. IV Нац. конгресса по болезни Паркинсона и расстройствам движений / Под ред. С. Н. Иллариошкина, О. С. Левина. М., 11–13 сентября 2017 г. 381 с.
- Ozturk E. A., Kocer B. G. Predictive risk factors for chronic low back pain in Parkinson’s disease // Clin. Neurol. Neurosurg. 2018. V. 164. № 1. P. 190–195.
- Махнев С. О., Левин О. С. Клинические варианты болевых синдромов при болезни Паркинсона // Жур. неврол. и психиатрии им. С. С. Корсакова. 2013. Т. 113. № 2. С. 39–44.
- Ford B. Pain in Parkinson’s disease // Clin. Neurosci. 1998. V. 5. № 2. P. 63–72.
- Махнев С. О. Болевые синдромы при болезни Паркинсона. Автореф. дис. … канд. мед. наук. М., 2011.
- Etchepare F., Rozenberg S., Mirault T. et al. Back problems in Parkinson’s disease: an underestimated problem // Joint Bone Spine. 2006. V. 73. № 3. P. 298–302.
- Broetz D., Eichner M., Gasser T. et al. Radicular and nonradicular back pain in Parkinson’s disease: a controlled study // Movement Disorders. 2007. V. 22. № 6. P. 853–856.
- Ozturk E. A., Gundogdu I., Kocer B., Comoglu S. et al. Chronic pain in Parkinson’s disease: Frequency, characteristics, independent factors, and relationship with health-related quality of life // J Back Musculoskelet Rehabil. V. 30. № 1. P. 101–108.
- Hughes A. J., Daniel S. E., Kilford L., Lees A. J. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases // J. Neurol. Neurosurg Psychiatry. 1992. V. 55. P. 181–184.
- Gibb W. R., Lees A. J. The relevance of the Lewy body to the pathogenesis of idio-pathic Parkinson’s disease // J. Neurol. Neurosurg Psychiatry. 1988. V. 51. P. 745–752.
- Левин, О. С. Диагностика и лечение деменции в клинической практике. М.: МЕДпресс-информ, 2010. 256 с.
- Кукушкин М. Л. Алгоритмы диагностики и лечения боли в спине // РМЖ. 2014. № 11. С. 844–848.
- Malanga G., Wolff E. Evidence-informed management of chronic low back pain with nonsteroidal anti-inflammatory drugs, muscle relaxants, and simple analgesics // Spine J. 2008. Vol. 8 (1). P. 173–184.
- Kuritzky L., Samraj G. P. Nonsteroidal anti-inflammatory drugs in the treatment of low back pain // J Pain Res. 2012. Vol. 5. P. 579–590.
- White A. P., Arnold P. M., Norvell D. C. et al. Pharmacologic management of chronic low back pain: synthesis of the evidence // Spine (Phila Pa 1976). 2011. Vol. 36 (21 Suppl). P. 131–143.
- Luyten F. P., Geusens P., Malaise M. et al. A prospective randomised multicentre study comparing continuous and intermittent treatment with celecoxib in patients with osteoarthritis of the knee or hip // Ann Rheum Dis. 2007. Vol. 66 (1). P. 99–106.
- Strand V., Simon L. S., Dougados M. et al. Treatment of osteoarthritis with continuous versus intermittent celecoxib // J Rheumatol. 2011. Vol. 38 (12). P. 2625–2634.
- Каратеев А. Е., Насонов Е. Л., Яхно Н. Н. и др. Рациональное применение нестероидных противовоспалительных препаратов (НПВП) в клинической практике. Клинические рекомендации. М.: ИМА-Пресс, 2015. 36 с.
- Lanas A., Tornero J., Zamorano J. L. Assessment of gastrointestinal and cardiovascular risk in patients with osteoarthritis who require NSAIDs: the LOGICA study // Ann Rheum Dis. 2010. Vol. 69 (8). P. 1453–1458.
- Conroy R. M., Pyorala K., Fitzgerald A. P. et al. SCORE project group. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project // Eur Heart J. 2003. Vol. 24 (11). P. 987-10-03.
- Каратеев А. Е. «Традиционные» нестероидные препараты: возрождение // Consilium medicum. Неврология. Ревматология. 2011. № 1. С. 13–20.
- Helin-Salmivaara et al. Risk of upper gastrointestinal events with the use ofvarious NSAIDs: A case-control study in a general population // Eur. J. Clin. Pharmacol. 2007. Vol. 4. Р. 403–408.
- Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in general practice // Int. J. Clin. Pract. (Suppl). 2004. Vol. 144. Р. 27–32.
- Conforti A. et al. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northern Italian area // Drug Saf. 2001. Vol. 24. Р. 1081–1090.
- Laporte J. R. et al. Upper gastrointestinal bleeding associated with the use of NSAIDs. Drug. Safety. 2004. Vol. 27 (6). Р. 411–420.
- Castellsague J. et al. Risk of upper gastrointestinal complications in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy // Pharmacoepidemiol Drug Saf. 2013. Vol. 22 (4). P. 365–375.
- Rainsford K. D. Nimesulide — a multifactorial approach to inflammation and pain: scientific and clinical consensus // Current medical research and opinion. 2006. Vol. 22 (6). Р. 1161–1170.
- Teoh N. C., Farrell G. C. Hepatotoxicity associated with non-steroidal anti-inflammatory drugs // Clin. Liver. Dis. 2003. Vol. 7. P. 401–413.
- Traversa G. et al. Cohort study of hepatotoxicity associated with nimesulide and other non-steroidal anti-inflammatory drugs // BMJ. 2003. Vol. 327 (7405). Р. 18–22.
- Европейские рекомендации по лечению неспецифической боли в пояснично-крестцовой области в условиях первичной медицинской помощи. Реферат под науч. ред. Яхно Н. Н., Подчуфаровой Е. В. М.: Практическая медицина, 2010. С. 24.
- Мареев В. Ю. и др. Применение диклофенака и целебрекса у пациентов с артериальной гипертонией, остеоартрозом и болями в нижней части спины на фоне гипотензивной терапии аккупро или норваском (исследование ДОЦЕНТ) // Серд. недостат. 2005. № 8. С. 204–208.
- Aw T. J. et al. Meta-analysis of cyclooxygenase-2 inhibitors and their effects on blood pressure // Arch. Intern. Med. 2005. Vol. 165. Р. 490–496.
- Curtis S. et al. Pooled analysis of thrombotic cardiovascular events in clinical trials of the COX–2 selective Inhibitor etoricoxib // Сurr Med Res Opin. 2006. Vol. 22. P. 2365–2374.
- Helin-Salmivaara A. et al. NSAID use and the risk of hospitalization for first myocardial infarction in the general population: a nationwide case-control study from Finland // Eur. Heart J. 2006. Vol. 27. P. 1657–1663.
- Aronoff G. R. Nonsteroidal anti-inflammatory drug induced renal syndromes // J Ky Med Assoc. 1992. Vol. 90 (7). Р. 336–339.
- https://grls.rosminzdrav.ru/Grls_View_v2.aspx? routingGuid=74e11cd9-d080-48ca-9f96-35b2f18e9fac&t=dd0bb6e4-2733-47d8-83dc-0b08c035f582.
- Famey J. P. In vitro and in vivo pharmacological evidence of selective cyclooxigenase-2 inhibition by nimesulide: an overview // Inflamm. Res. 1997. Vol. 46. P. 437–446.
- Di Battista J. A. et al. Differential regulation of interleukin-1 beta-induced cyclooxigenase-2 gene expression by nimesulide in human synovial fibroblast // Clin. Exp. Rheumatol. 2001. Vol. 19.
- Kullich W., Niksic F., Klein G. Effect of nimesulide on metalloproteinases and matrix degradation in osteoarthritis: a pilot clinical study // Int. J. Clin. Pract. 2002. Vol. 128 (Supp. l). P. 24–30.
- Mukherjee P. et al. Non-steroidal anti-inflammatory drugs protect against chondrocyte apoptotic death // Clin. Exp. Rheumatol. 2001. Vol. 19. P. 7–11.
- Masferrer J. L. et al. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors // Cancer Res. 2000. Vol. 60 (5). Р. 1306–1311.
- Gaur V., Kumar A. Effect of nonselective and selective COX-2 inhibitors on memory dysfunction, glutathione system, and tumor necrosis factor alpha level against cerebral ischemia reperfusion injury // Drug. Chem. Toxicol. 2012. Vol. 35 (2). P. 218–224.
- Wang Y., Deng X. L., Xiao X. H., Yuan B. X. A non-steroidal anti-inflammatory agent provides significant protection during focal ischemicstroke with decreased expression of matrix metalloproteinases // Curr. Neurovasc. Res. 2007. Vol. 4 (3). P. 176–183.
- Игнатов Ю. Д., Кукес В. Г., Мазуров В. И. Клиническая фармакология нестероидных противовоспалительных средств. М.: ГЭОТАР-Медиа, 2010.
- Davis R., Brogden R. N. Nimesulide. An update of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy // Drugs. 1994. Vol. 48. P. 431–454.
- Bennett A. Nimesulide a well-established cyclooxygenase-2 inhibitor with many other pharmacological properties relevant to inflammatory diseases/In: Therapeutic Roles of Selective COX-2 Inhibitors. Ed. Vein J. R., Botting R. M. William Harvey Press. Р. 524–540.
- Assessment report for Nimesulide containing medicinal products for systemic use. EMA/73856/2012, Procedure number: EMEA/H/A-31/1261 http://www.ema.europa.eu.
- Tavares I. A., Borrelli F., Welsh N. J. Inhibition of gastric acid secretion by nimesulide: a possible factor in its gastric tolerability // Clin. Exp. Rheumatol. 2001. Vol. 19 (Suppl. 22). P. 13–15.
- https://grls.rosminzdrav.ru/Grls_View_v2.aspx? routingGuid=d50a406f-3c03-4ffd-95e4-c28121f644b9&t=f756c481-0735-4177-ad09-d4e4ec2dc703.
- Hanna M., Moon J. Y. A review of dexketoprofen trometamol in acute pain // Curr Med Res Opin. 2018. 23: 1–32.
- Moore R. A., Gay-Escoda C., Figueiredo R. et al. Dexketoprofen/tramadol: randomised double-blind trial and confirmation of empirical theory of combination analgesics in acute pain // J Headache Pain. 2015. 16: 541.
- Колоколов О. В., Ситкали И. В., Колоколова А. М. Ноцицептивная боль в практике невролога: алгоритмы диагностики, адекватность и безопасность терапии // РМЖ. 2015. № 12. С. 664–667.
О. В. Колоколов1, доктор медицинских наук
Г. К. Юдина, кандидат медицинских наук
ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
1 Контактная информация: kolokolov@inbox.ru
Боль в спине у пациентов с коморбидной патологией центральной нервной системы: как правильно выбрать нестероидный противовоспалительный препарат/ В. В. Раздорская, О. В. Колоколов, Г. К. Юдина
Для цитирования: Лечащий врач № 7/2018; Номера страниц в выпуске: 72-79
Теги: воспаление, хроническая боль, купирование, комплаентность
Купить номер с этой статьей в pdf