В структуре подростковой гинекологической заболеваемости отмечается высокая встречаемость вульвовагинитов, по данным разных авторов от 42,3% до 93% [1, 2], особенностью которых в современных условиях является, во-первых, превалирование в этиологической структуре оппорту��истических микроорганизмов и наличие спровоцированных ими в системе противоинфекционной защиты организма дисбаланса и нарушений, а во-вторых, высокая частота (более 60%) хронизации процесса [1–3], ухудшающей прогноз в отношении генеративной функции девушки в будущем.
В последние годы значительно повысилось внимание исследователей к изучению микроорганизмов класса Mollicutes, порядка Mycoplasmatales и их роли в этиопатогенезе инфекционно-воспалительных заболеваний женской репродуктивной системы, в частности хронических вульвовагинитов (ХВВ) [3–7]. В это семейство входит род микоплазм (Mycoplasma spp.) и род уреаплазм (Ureaplasma spp.). Молликуты — свободноживущие прокариоты, не имеющие клеточной стенки, что сближает их с L-формами бактерий. Из-за отсутствия ригидной клеточной стенки микоплазмы способны демонстрировать пластичность и разнообразие форм (выраженный полиморфизм — от кокковидных телец до нитей), проходить через поры диаметром до 0,22 мкм, проявлять резистентность к фармакологическим препаратам, механизмом действия которых является нарушение синтеза пептидогликанов клеточной стенки, например, к бета-лактамным антибиотикам (пенициллины, цефалоспорины, карбапенемы, монобактамы).
Особый практический интерес ввиду наиболее частой встречаемости в клиническом материале урогенитального тракта вызывают Mycoplasma hominis, Mycoplasma genitalium, род уреаплазма, в котором из-за обнаруженных различий в генах уреазы, многополосного мембранного антигена (multiple-banded antigen, МВА), 16SрРНК и 16S-23SрРНК спейсерной области, выделяют два биовара: биовар 1 — Ureaplasma parvum, биовар 2 — Ureaplasma urealiticum.
В настоящее время Mycoplasma genitalium рассматривается как абсолютный патоген, а Ureaplasma spp. и Mycoplasma hominis определены как условно-патогенные микроорганизмы, присутствующие по данным разных авторов от 20% до 75% случаев в качестве комменсалов в нормальном вагинальном биоценозе, при этом патогенный потенциал определяется их концентрацией в организме (более 104 ГЭ/образец), наличием других, в том числе условно-патогенных бактерий и вирусов, изменением физиологического и иммунного статуса, соматическими заболеваниями и другими факторами [7].
К ведущим факторам патогенности генитальных молликутов относят адгезины, протеазу, фосфолипазы, а также уреазу для U. urealyticum. При этом их высокая адгезия к эпителиоцитам, лимфоцитам урогенитального тракта благоприятствует инфицированию и способствует восходящему интраканаликулярному, а возможно, и гематогенному распространению инфекции; протеазы уреамикоплазм, разрушая секреторный иммуноглобулин A, позволяют им преодолевать локальную защиту и способствуют быстрой колонизации эпителия микроорганизмами [8, 9]; уреазная активность U. urealyticum обуславливает образование аммиака при гидролизе мочевины, который в свою очередь способен оказывать токсический эффект на клетки-мишени и местную микрофлору мочеполовых путей [7, 10].
Некоторые исследователи считают, что колонизация генитальными уреамикоплазмами происходит только с началом половой жизни и коррелирует с числом половых партнеров, а отсутствие контрацепции, начало половой жизни ранее 18 лет являются факторами риска возникновения инфекций, ассоциированных с Mycoplasma spp. и Ureaplasma spp. [7, 11]. Наряду с этим установлено, что колонизация генитальными уреамикоплазмами возможна и новорожденных при прохождении через родовые пути, при этом у новорожденных женского пола они (в первую очередь — U. urealyticum, реже — M. hominis) выделяются значительно чаще, чем у мальчиков, а из глотки и носа — с одинаковой частотой, но преимущественно — U. urealyticum [7].
Показатели инфицированности микоплазмами населения разноречивы. В репродуктивном возрасте частота выявления M. hominis варьирует от 10% до 50%, Ureaplasma spp. — от 11% до 80%, а M. genitalium — от 3% до 27% [3, 7, 10–12]. Е. В. Уварова и соавт. [3], обследовав 503 девочек с ХВВ, обнаружили, что наиболее часто во влагалищном биотопе определялась уреаплазма (24,2%); О. В. Зубакова [3] приводит данные о выявлении при ХВВ уреа- и микоплазменной инфекции у 13,6% девочек.
Возросший в последние годы интерес исследователей к воспалительным заболеваниям, вызванным уреа-микоплазмами, обусловлен главным образом следующими особенностями: наличием стертой клинической симптоматики, отсутствием специфических симптомов, многоочаговостью инфицирования со склонностью поражения мочевыводящих путей, сочетанием мягкого клинического течения с поражением восходящих отделов мочеполового тракта и возрастающей частотой микст-инфицирования условно-патогенной флорой. Вышеперечисленные факторы в значительной степени затрудняют диагностику заболевания на ранних стадиях, увеличивая вероятность формирования хронических форм.
Обобщая фундаментальные знания, полагаем, что хронизация локального воспалительного процесса является результатом порочного круга событий, связанных с выделением провоспалительных цитокинов, протеаз, активных форм кислорода и других биоактивных веществ, углубляющих повреждение эпителия, что сопровождается активацией свободнорадикального окисления, в том числе активацией перекисного окисления липидов и ослаблением антиокислительной активности, и вовлекающих в процесс альтерации иммунокомпетентные клетки, что программирует развитие вторичного иммунодефицитного состояния.
Согласно вышесказанному, усовершенствование методов лечения ХВВ, ассоциированных с микроорганизмами класса молликуты, в свете современных представлений о микробиологии возбудителя, иммунопатогенезе заболевания, имеет высокую значимость в подростковой гинекологии и требует комплексного подхода.
Наибольшую эффективность в терапии хроничесих инфекционно-воспалительных заболеваний следует ожидать от препаратов, обладающих поливалентным действием и/или способных амплифицировать эффекты проводимых лечебных мероприятий.
В данном аспекте интерес представляет отечественный препарат рекомбинантного интерферона альфа-2b с высокоактивными антиоксидантами — альфа-токоферола ацетатом (витамин Е) и аскорбиновой кислотой (витамин С) — Виферон®, обладающий доказанным иммуномодулирующим действием и в комплексе с высокоактивными антиоксидантами имеющий ряд дополнительных эффектов: повышение в 10–14 раз активности рекомбинантного интерферона; усиление его иммуномодулирующего действия на Т-, В-лимфоциты и на синтез иммуноглобулинов; восстановление функционирования эндогенной системы интерферона альфа-2b; наличие антиоксидантантных, мембраностабилизирующих, регенерирующих свойств [13–16].
Вышесказанное позволило предположить, что включение препарата Виферон® в схемы стандартного лечения уреамикоплазменного ХВВ у подростков имеет хорошие предпосылки для решения этой проблемы, что и было предпринято нами в работе.
Цель исследования
Повышение эффективности лечения и профилактики хронических вульвовагинитов, ассоциированных с уреамикоплазменной инфекцией, с учетом коррекции выявленных иммунологических нарушений и системных метаболических расстройств в подростковом возрасте.
Материал и методы исследования
В проспективное исследование включены 97 девушек в возрасте от 12 до 16 лет 11 месяцев 29 дней (средний возраст — 14,9 ± 1,2 года), из которых у 82 подростков, составивших основную группу (n = 44) и группу сравнения (n = 38), отмечался ХВВ в стадии обострения, а 15 здоровых девушек без отклонений физического и полового развития были включены в контрольную группу.
Критериями включения являлись следующие параметры: выявление в биотопе влагалища микроорганизмов Mycoplasma spp. (M. hominis, M. genitalium) и/или Ureaplasma spp. (U. urealyticum, U. parvum) в диагностическом титре более чем 104 КОЕ (ГЭ)/мл (г); наличие клинических и/или лабораторных признаков воспалительного процесса мочеполовой системы; подростковый возраст, информированное согласие.
Критериями исключения были: наличие облигатно-патогенных возбудителей инфекций, передающихся половым путем (Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae), вирусных инфекций (вируса простого герпеса, цитомегаловируса, вируса папилломы человека), гепатитов, хронических (в стадии обострения) и острых воспалительных заболеваний верхних отделов органов малого таза; применение системной или местной антимикробной, антимикотической, иммуномодулирующей терапии в течение 4 недель до исследования.
На фоне циклической витаминотерапии девушки получали стандартное лечение обострения ХВВ, ассоциированного с уреамикоплазмозом [17], которое включало в себя пероральный прием 500 мг джозамицина 3 раза в сутки в течение 10 дней и последующее назначение лактосодержащих (Лактобактерин®, интравагинально по 1 супп. 1 раз в день в течение 10 суток) и бифидосодержащих (Бифидумбактерин®, перорально, по 2 пакетика 3 раза в сутки в течение 10 суток) пробиотиков.
Пациенткам основной группы (n = 44) в отличие от группы сравнения (n = 38) помимо вышеуказанного лечения проводилась системная иммунокорригирующая терапия в виде ректальных суппозиториев, содержащих 500 000 МЕ интерферона альфа-2b и мембраностабилизирующие антиоксиданты (альфа токоферола ацетат и аскорбиновая кислота) в терапевтически эффективных дозах (Виферон®, суппозитории ректальные 500 000 МЕ). Препарат Виферон® назначался ежедневно по 1 ректальному суппозиторию 2 раза в сутки с интервалом 12 часов в течение 10 дней во время проведения антибактериальной терапии, затем в двух последующих менструальных циклах с 5–7 дня (после менструации) — по 1 ректальному суппозиторию (500 000 МЕ) ежедневно 2 раза в сутки с интервалом 12 часов в течение 5 дней.
Назначение циклической витаминотерапии продолжалось на протяжении 6 месяцев, пробиотиков — 5-дневными курсами на протяжении следующих после антибиотикотерапии двух менструальных циклов.
Клинико-лабораторное обследование включало в себя: сбор и анализ анамнестических данных, жалоб пациентки, общий гинекологический осмотр, бимануальное гинекологическое исследование; бактериоскопическое исследование отделяемого влагалища, цервикального канала; молекулярно-генетический метод исследования — ПЦР-диагностика отделяемого влагалища на ИППП; молекулярно-биологический метод исследования — ПЦР в режиме реального времени.
Интерпретацию результатов ПЦР-исследования проводили на основании разработанных в НЦАГиП им. В. И. Кулакова и НИИАиГ им. Д. О. Отта (2011) рекомендаций «Применение метода полимеразной цепной реакции в реальном времени для оценки микробиоценоза урогенитального тракта у женщин (тест Фемофлор)» [18]. Состояние биоты влагалища в зависимости от количества Lactobacillus spp. относительно общей бактериальной массы (ОБМ) расценивалось следующим образом: «нормоценоз» — вариант биоценоза, при котором доля нормофлоры (Lactobacillus spp.) более 80%; «умеренный дисбиоз влагалища» — Lactobacillus spp. от 20% до 80%; «выраженный дисбиоз влагалища» — доля Lactobacillus spp. менее 20%. При этом в состоянии «нормоценоза» в зависимости от наличия и количества генитальных микоплазм, уреаплазм выделяли «абсолютный нормоценоз» — когда вышеупомянутые микроорганизмы в отделяемом влагалища отсутствуют либо их количество менее 10
Иммуноглобулины определяли методом простой радиальной иммунoдиффузии в геле с использованием монoспецифических стандаpтных сыворoток по Mancini [19].
Нами были изучены параметры интенсивности процессов перекисного окисления липидов (ПОЛ): уровень первичных продуктов ПОЛ — диеновых конъюгатов (ДК) и конечных — оснований Шиффа (ОШ); состояние антиоксидантной системы защиты (АОСЗ) — содержание супероксиддисмутазы (СОД) и каталазы (КАТ). Активность антиоксидантных ферментов в крови определяли на спектрофотометре (СФ-26), КАТ оценивали по убыли перекиси водорода в среде, а СОД — в тесте с нитросиним тетразолием, единицы измерения — Ед/г Нв в мин. Содержание ДК определяли спектрофотометрически в метанол-гексановой липидной фракции (5:1) при длине волны 233 нм и выражали в единицах оптической плотности относительно количества общих липидов (ед. опт. пл./мг ОЛ). Посредством флуориметрического метода D. L. Fletcher с соавт. (1973) определяли ОШ при длине волны возбуждения 365 нм и длине волны эмиссии 420 нм и выражали в условных единицах свечения на 1 мг общих липидов (отн. ед./мг ОЛ).
Контроль эффективности терапии проводился по клинико-лабораторным параметрам в следующие сроки: в течение 1–2 дней после терапии, через 1, 3, 6 месяцев после лечения.
Статистическую обработку результатов проводили с помощью пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
Согласно полученным результатам девушки основной группы и группы сравнения страдали вульвовагинитом в среднем 3,4 ± 0,9 года, в течение 12 месяцев рецидивы у них отмечались до 3,2 ± 1,4 раза (р > 0,05).
Нарушение менструального цикла у девушек при ХВВ в основной группе встречались в 86,4% случаев, в группе сравнения — в 86,8%, при этом с наибольшей частотой выявлялся гипоменструальный синдром (р > 0,05).
При изучении структуры уреамикоплазменного ХВВ в подростковом возрасте было установлено (рис. 1), что обнаружение условно-патогенных молликутов (Ureaplasma spp. и M. hominis) превалирует над выявлением абсолютного патогенного агента — M. genitalium (2,4%).
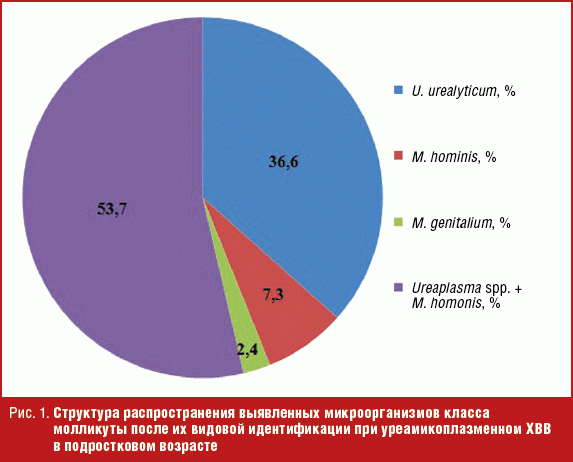
Обращает на себя внимание тот факт, что биоценоз влагалища у девушек с ХВВ имел полимикробную природу и уреаплазмы, микоплазмы не встречались в качестве моновозбудителей ХВВ, а входили в состав сложных микробных ассоциаций с участием 2–5 возбудителей аэробного и анаэробного происхождения.
При проведении видовой идентификации было установлено, что при уреамикоплазменном ХВВ у подростков в виде «моноагента» молликуты отмечались в 43,9% случаев (чаще — U. urealyticum (в 36,6% случаев), M. hominis (у 7,3%)), в виде ассоциации Ureaplasma spp. и M. hominis — в 53,7% случаев (рис. 1).
Согласно анализу микробиологической картины отделяемого влагалища у подростков с клиникой обострения ХВВ (n = 82) по данным теста Фемофлор (рис. 2), в 95,1% случаев установлены дисбиотические нарушения (при этом выраженные дисбиотические нарушения имели 22 (26,8%), умеренные — 56 (68,3%) пациенток), условный нормоценоз отмечался в 4,9% случаев, а сохранной нормальной микрофлоры влагалища — абсолютного нормоценоза — не выявлено ни в одном случае. Обращает на себя внимание то, что у девушек в формировании условного нормоценоза в 100% наблюдений принимали участие микроорганизмы рода Ureaplasma в количествах более 104 ГЭ; при этом доля условно-патогенных микроорганизмов по отношению к общей бактериальной массе не превышала 15%, а нормобиота (Lactobacillus spp.) была не ниже 80%.
При обострении ХВВ в подростковом возрасте групповой состав бактерий в пристеночном слое эпителия влагалищной стенки не отличался от такового у здоровых девушек, различия отмечались только в медианах количественного значения выявленных групп микроорганизмов. Структура дисбиоза, а также частотное (%) распределение микроорганизмов у девушек с уреамикоплазмозом представлены на рис. 3. Так, в ходе работы нами установлено (рис. 3), что у подростков при уреамикоплазмозах в формировании выраженных дисбиотических нарушений ведущую роль играют облигатно-анаэробные микроорганизмы, соответственно, превалирующим (в 62,5% случаев) в структуре является анаэробный дисбиоз (смешанный дисбиоз отмечается в 29,2% случаев, аэробный — в 8,3%), в то время как при умеренном дисбалансе чаще отмечается смешанный дисбиоз — в 51,7% случаев (анаэробный дисбиоз выявлен в 29,3%, аэробный — в 19% случаев). При умеренном дисбалансе наибольший «прирост» демонстрировали такие группы анаэробных бактерий, как Eubacterium spp., Megasphaera spp./Veillonella spp./Dialister spp., Lachnobacterium spp./Clostridium spp., а наименьший — группы аэробных микроорганизмов — семейства Enterobacteriaceae, Staphylococcus spp., Streptococcus spp. Выраженный дисбаланс в биотопе у девушек с ХВВ характеризовался преобладанием наряду с уреамикоплазмами микроорганизмов Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp., Atopobium vaginae.
Особенностью ХВВ бактериальной природы у подростков явилось отсутствие значимых различий со здоровыми сверстницами в количественном содержании микроорганизмов, которые традиционно [1, 2, 20] считаются основными возбудителями рассматриваемой патологии, а именно Enterobacterium spp., Staphylococcus spp., Streptococcus spp. Е. В. Уварова с соавт. (2017) также отметила этот факт в качестве современных характеристик вульвовагинита у детей [21].
При ХВВ в периоде обострения самой часто встречаемой являлась жалоба на выделения из половых путей (в основной группе — в 81,8% случаев, в группе сравнения — в 81,6%, р > 0,05), причем достоверно чаще она отмечалась у девушек, во влагалищном биоценозе которых присутствовали Gardnerella vaginalis, Atopobium vaginae или их сочетание как вместе, так и по отдельности с микроорганизмами Ureaplasma spp. или M. hominis (р = 0,01).
Обращает на себя внимание, что в 63,4% случаев выделения из влагалища расценивались подростками как вариант собственной физиологической нормы, а выявление данной жалобы явилось результатом активного клинического опроса. Исходя из вышесказанного, считаем этот аспект актуальным в практике детского гинеколога, на который следует уделять должное внимание при «прицельном опросе».
Второй по частоте встречаемости при обострении ХВВ у подростков была жалоба на ощущение зуда, жжения в области вульвы в покое или после мочеиспускания (в основной группе — в 52,3% случаев, в группе сравнения — в 52,6%, р > 0,05), при этом среди микрофлоры влагалища превалировали микроорганизмы Ureaplasma spp. или M. genitalium как изолированно, так и в сочетании с Candida spp. либо Gardnerella vaginalis (р = 0,01).
У девушек при уреамикоплазмозах по результатам клинического объективного обследования инфекционно-воспалительный процесс наиболее часто был локализован в области влагалища, вульвы и уретры, значительно реже — эндоцервикального канала шейки матки и ампулы прямой кишки, при этом наиболе часто (в 89% случаев) отмечалось вовлечение в воспалительный процесс двух и более очагов поражения.
Характерным для вульвовагинитов, ассоциированных с уреамикоплазменной моно- или микст-инфекцией, в подростковом возрасте явилось преобладание воспаления незначительной степени выраженности, так, в 85,4% случаев при вагините гиперемия стенок влагалища имела неяркий характер, отечность слизистой была мало выражена. Возможно, этим объясняется установленный нами факт отсутствия жалоб при обострении уреамикоплазменного ХВВ у 15 (18,3%) респонденток.
В ходе исследования нами выявлено, что обнаружение U. urealyticum в высоких титрах изолированно либо в сочетании с представителями семейства Enterobacteriaceae, Gardnerella vaginalis + Prevotella bivia + Porphyromonas spp., Atopobium vaginae характеризовалось наиболее частым поражением уретры. На патофизиологическую взаимосвязь рецидивирующих вульвовагинитов и урологической патологии у подростков указывают работы и других авторов [1–3, 5, 7].
Сопоставимость и клиническая однородность основной группы и группы сравнения по вышеописанным клинико-анамнестическим и лабораторным данным позволила провести оценку эффективности используемых в работе схем терапии ХВВ, ассоциированного с уреамикоплазменной инфекцией.
После проведенного лечения в основной группе по сравнению с группой сравнения произошло более частое уменьшение общего числа подростков с жалобами (в основной группе — в 4,5 раза, в группе сравнения — в 1,8 раза) и клиническими симптомами со стороны генитального тракта (соответственно в 3,8 и 1,7 раза), а также в большей степени сократилась частота жалоб на дизурию (в основной группе в 6 раз, в группе сравнения — в 2,1 раза). В целом разрешение клинических симптомов воспаления у девушек основной группы произошло в 2,2 раза чаще по сравнению с пациентками со стандартной терапией ХВВ, что, очевидно, объясняется иммуномодулирующим действием препарата Виферон®.
Несмотря на всю важность нивелирования клинических проявлений заболевания, важным критерием эффективного лечения уреамикоплазменного ХВВ является эрадикация облигатного патогена (M. genitalium) и нормализация нарушенного микробиоценоза влагалища, сопровождающиеся восстановлением нормального соотношения автохтонных (эндогенных, постоянных) и аллохтонных (транзиторных, случайных) микроорганизмов.
Так, после лечения ХВВ при оценке микроценоза влагалища (рис. 2) отмечено полное исчезновение состояния «выраженного дисбаланса» у пациенток рассматриваемых групп; «нормоценоз» был выявлен в 88,6% случаев в основной группе (показатель в 19,5 раза увеличился относительно исходных данных) и в 71,1% в группе сравнения (показатель в 13,5 раза увеличился относительно исходных данных); «умеренный дисбаланс» встречался в 2,5 раза чаще у пациенток группы сравнения (в основной группе в 11,4% случаев, в группе сравнения — в 28,9%).
Согласно результатам ПЦР real-time (Фемофлор®) при анализе микробиологической картины отделяемого влагалища спустя 1 месяц после лечения ХВВ у пациенток основной группы в 1,3 раза чаще отмечался «нормоценоз» (в основной группе — в 77,3%, в группе сравнения — в 60,5%), в 1,5 раза реже выявлен «умеренный дисбиоз» (в основной группе — в 22,7%, в группе сравнения — в 34,2%); «выраженный дисбиоз» не установлен ни в одном случае, в отличие от группы сравнения, где частота его обнаружения составила 5,3%.
Проведенное спустя 1 месяц после лечения ХВВ исследование на основании методов амплификации ДНК (ПЦР) установило полную эрадикацию M. genitalium у девушек рассматриваемых групп (р > 0,05). Данный подход к контролю излеченности заболеваний, вызванных облигатным патогеном M. genitalium, является общепринятым [17].
При анализе отдаленных результатов лечения нами также выявлены различия у пациенток рассматриваемых групп. Так, рецидив ХВВ, ассоциированного с уреамикоплазмозом, в основной группе возник в 9,1% случаев спустя 6 месяцев после терапии и ни в одном случае не был зафиксирован в сроки от одного до трех месяцев; в то время как в группе сравнения в 5,3% случаев выявлен рецидив заболевания в сроки до 3 месяцев после лечения, в 18,4% рецидив возник через полгода после терапии (р < 0,05) (рис. 4). Таким образом, за период наблюдения частота рецидивов заболевания у пациенток группы сравнения была в 2,6 раза выше, чем у девушек основной группы.
Исходно при оценке гуморальных факторов местного иммунного статуса выявлено снижение концентраций sIgA у пациенток основной группы до 4,4 ± 1,1 мг/л и группы сравнения до 4,6 ± 1,3 мг/л по сравнению с аналогичным показателем группы контроля 10,4 ± 1,2 мкг/мл (р < 0,05), а также повышение IgG и IgM (табл. 1).
Целесобразно дефицит sIgA рассматривать как проявление резкого угнетения местного иммунитета в хронической стадии воспаления влагалища [22].
Наблюдаемое нами снижение sIgA у подростков с ХВВ можно объяснить разными причинами: во-первых, наличием у уреамикоплазм протеолитической активности в отношении секреторного IgA [8, 9]; во-вторых, дисбалансом на фоне хронического инфекционно-воспалительного процесса клеточной дифференцировки В-лимфоцитов, которые секретируют IgA [14]; в-третьих, дефицит IgA или его секреторного компонента может быть вследствие нарушения его синтеза в слизистой оболочке репродуктивной системы в условиях хронического воспаления.
После лечения в основной группе наблюдался достоверный рост sIgA (табл. 1), увеличение показателя составило 56,4% (р < 0,05), в то время как в группе сравнения данный показатель увеличился на 35,2% (р < 0,05). У пациенток основной группы отмечалось значительное уменьшение концентраций IgG (на 66,6%) и IgM (на 62,5%) после терапии, в отличие от подростков группы сравнения, где показатели IgG и IgM снизились на 50,2% и 47,8% соответственно (табл. 1).
Таким образом, в основной группе у подростков, получавших препарат Виферон® в составе комплексной терапии ХВВ, ассоциированного с уреамикоплазмозом, наблюдалось выраженное снижение интенсивности воспалительного процесса (более низкие уровни IgG и IgM по сравнению с аналогичными показателями в группе сравнения, р < 0,05) и повышение активности локального иммунитета (более высокие уровни IgA и slgA в цервико-вагинальном секрете по сравнению с аналогичными показателями в группе сравнения, р < 0,05).
При оценке интенсивности ПОЛ установлено, что девушки при обострении уреамикоплазменного ХВВ испытывают умеренный перекисный стресс, в пользу которого свидетельствует повышение первичных (диеновых конъюгатов) и вторичных (оснований Шиффа) продуктов ПОЛ (табл. 2), при этом исходные уровни ДК и ОШ у пациенток основной группы и группы сравнения достоверно не отличались между собой (р > 0,05). Диеновые конъюгаты, образующиеся при свободнорадикальном окислении арахидоновой кислоты, способны оказывать повреждающее действие на липопротеиды, белки, ферменты и нуклеиновые кислоты [23]. Известно, что наиболее агрессивными являются конечные продукты ПОЛ, так, показано, что непрерывное накопление оснований Шиффа дестабилизирует мембраны и способствует деструкции клеток [23]. При проведении индивидуального анализа оценки интенсивности ПОЛ установлено, что ДК повышены в 79,5% случаев в основной группе и в 78,9% в группе сравнения, а ОШ в 40,9% и 42,1% случаев соответственно.
Оценка АОСЗ позволила выявить снижение относительно нормы антиоксидантных ферментов — СОД и КАТ (табл. 2) у подростков как в основной группе, так и в группе сравнения (р > 0,05). При проведении индивидуального анализа установлено, что СОД снижены у 24 (54,5%) пациенток основной группы и у 20 (52,6%) группы сравнения, а КАТ — у 27 (61,4%) и у 23 (60,5%) подростков соответственно.
Таким образом, у подростков при обострении уреамикоплазменных ХВВ установлено умеренное снижение антиокислительной активности плазмы крови и усиление перекисного окисления липидов, что создает предпосылки для снижения активности интерферона вследствие, во-первых, нарушения рецепции поврежденными мембранами клеток самих молекул интерферона и «сбоем» передачи их сигнала внутрь цитолеммы, а во-вторых, ускоренной инактивацией молекул интерферона из-за повышенного содержания протеолитических ферментов в плазме, вызванного нарушением липидного обмена клеток и повреждением мембран лизосом.
Применение предлагаемой нами схемы лечения подростков с ХВВ нормализует показатели ферментативного звена АОСЗ, повышая значения СОД и КАТ до уровня здоровых доноров, в то время как в группе сравнения после стандартных схем лечения ХВВ повышение СОД произошло на 6,1%, а КАТ — на 7,3%; а также способствует снижению ПОЛ, при этом у пациенток основной группы содержание ДК снизилось на 28,3%, ОШ — на 18,4%, в группе сравнения — на 15,4% и 12,9% соответственно.
Примечательным является то, что у подростков, получавших препарат Виферон® в составе комплексной терапии ХВВ, ассоциированного с уреамикоплазменной моно- или микст-инфекцией, одновременно с локальной иммунокоррекцией (возрастание уровня sIgA в цервико-вагинальном секрете) происходит нормализация окислительно-восстановительного метаболизма (уменьшение количества окисленных продуктов липидов (ДК, ОШ) при повышении активности ферментативного звена АОСЗ (СОД, КАТ). Данный факт делает патогенетически обоснованным включение препарата Виферон® в схемы лечения уреамикоплазменных ХВВ и свидетельствует о блокировании процессов мембранной альтерации (преодоление разрушительных последствий окислительного стресса за счет антиоксидантной активации и нормализации окислительно-восстановительного метаболизма), возобновлении каскада взаимодействия «клетка–интерферон», коррекции клеточных, гуморальных факторов иммунитета и неспецифической резистентности.
Известно, что рекомбинантный интерферон альфа-2b в составе препарата Виферон®, индуцируя экспрессию молекул MHC I класса (главного комплекса гистосовместимости) и стимулируя дифференцировку Т-хелперов в Th1-лимфоциты, обуславливает усиление либо восстановление нарушенной цитотоксической активности иммунокомпетентных клеток [13–16], что в конечном итоге способствует снижению рецидивов ХВВ. Наряду с этим существуют данные, что ИФН-α за счет стимуляции процессов фагоцитоза и повышения активности макрофагов, NK-клеток оказывает опосредованное антибактериальное действие в отношении как внутри-, так и внеклеточных возбудителей, а также способствует амплификации эффектов антибиотикотерапии [24, 25] и, возможно, согласно полученным результатам настоящего исследования, амплификации эффектов циклической витаминотерапии.
Таким образом, полученные в ходе исследования результаты позволяют предположить, что стандартная схема лечения уреамикоплазменного ХВВ является недостаточным условием обеспечения колонизационной резистентности влагалища и предотвращения рецидивов заболевания. Принимая во внимание, что пациентки обеих групп получали одинаковую базисную терапию уреамикоплазменного ХВВ, включая антибактериальный, пробиотический компоненты и циклическую витаминотерапию, различия клинических и микробиологических результатов объясняются особенностями иммунокорригирующего воздействия препарата Виферон®.
Включение в схему лечения ХВВ у подростков препарата Виферон® выгодно отличается от других интерферон-содержащих препаратов не только разноплановым комплексным действием всех входящих в него компонентов, но и потенциированием антиоксидантами активности интерферона альфа-2b. Так как хорошо известно, что интерфероногенез может быть угнетен при инфекционно-воспалительных процессах [19], а способность к продукции интерферонов значительно повышается при добавлении к интерферон-продуцирующим клеткам α-токоферола ацетата [14]. Более того, имеются сведения, что при инфекционно-воспалительных процессах α-токоферола ацетат частично окисляется активно образующимися в этих случаях продуктами ПОЛ и аскорбиновая кислота восстанавливает активный центр α-токоферола ацетата, пролонгируя его действие [14], что в итоге и обосновывает внесение двух антиоксидантов в состав препарата.
Заключение
Терапия хронических рецидивирующих вульвовагинитов, ассоциированных с уреамикоплазменной моно- или микст-инфекцией, учитывая, с одной стороны, особенности жизнедеятельности и функционирования микробных агентов, а с другой стороны, дефицит локальных факторов иммунитета, в частности секреторного IgA, активацию процессов свободнорадикального окисления, должна отличаться от стандартной и исключать эмпирический подход.
Клиническая эффективность комбинированного препарата Виферон® обусловлена всеми компонентами, входящими в его состав: рекомбинантного интерферона альфа-2b, антиоксидантов — альфа токоферола ацетата (витамин Е) и аскорбиновой кислоты (витамин С).
Включение препарата Виферон® в схему лечения ХВВ, ассоциированного с уреамикоплазменной моно- или микст-инфекцией, у лиц подросткового возраста является этиопатогенетически оправданным и позволяет в 2,2 раза чаще снизить клинические симптомы воспаления, в большем числе случаев нормализовать биотоп, обеспечить условия для колонизационной резистентности влагалища, увеличить межрецидивный промежуток и в 2,6 раза уменьшить число рецидивов заболевания по сравнению со стандартной терапией.
Литература
- Коколина В. Ф. Гинекология детского возраста: монография. Медпрактика-М, 2003. 268 с.
- Гуркин Ю. А. Детская и подростковая гинекология. Рук-во для врачей. М.: МИА. 2009. 268 с.
- Уварова Е. В., Султанова Ф. Ш. Влагалище как микроэкосистема в норме и при воспалительных процессах гениталий различной этиологии (обзор литературы) // Гинекология. 2002. № 4. С. 189–196.
- Кисина В. И. Генитальные микоплазмы: клинические и организационные вопросы // Consilium Medicum. Дерматология. (Прил.). 2010. № 2. С. 42–47.
- Харламова Ф. С., Шамшева О. В., Воробьева Д. А., Романова Ю. В., Вальтц Н. Л., Анджель А. Е., Денисова А. В. Микоплазменная инфекция у детей: современная диагностика и терапия // Детские инфекции. 2016. Т. 15. № 3. С. 50–56.
- Кисина В., Ширшова Е. Значение генитальных микоплазм в развитии клинических синдромов у женщин // Врач. 2006. № 2. С. 6–10.
- Савичева А., Шипицына Е. Генитальные микоплазмы // Врач. 2009. № 1. С. 9–12.
- Kilian M., Brown M. B., Brown T. A., Freundt E. A., Cassell G. H. Immunoglobulin A1 protease activity in strains of Ureaplasma urealyticum. Acta pathologica, microbiologica, et immunologica Scandinavica. Section B, Microbiology. 1984. Vol. 92. № 1. P. 61–64.
- Robertson J. A., Stemler M. E., Stemke G. W. Immunoglobulin A protease activity of Ureaplasma urealyticum // Journal of clinical microbiology. 1984. Vol. 19. № 2. P. 255–258.
- Баркалова Э. Л., Хамуди И., Зяблицев С. В., Центило С. В. Состояние микробиоценоза влагалища при урогенитальных заболеваниях, ассоциированных с Ureaplasma spp. // Дерматологiя та венерологiя. 2014. № 2 (64). С. 17–25.
- Заручейнова О. В. Методы лабораторной диагностики урогенитальных инфекций, ассоциированных с Mycoplasma hominis и Ureaplasma spp. // Инфекция и иммунитет. 2014. Т. 4, № 4. С. 331–338. DOI: 10. 15789/2220–7619–2014–4-331–338.
- Пандырева О. Н., Аршинский М. И. Частота выявления микоплазм в урогенитальном тракте у беременных женщин методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) // Здравоохранение Дальнего Востока. 2016. № 4 (70). С. 43–47.
- Полеско И. В., Малиновская В. В. В помощь практическому врачу: рекомбинантный интерферон альфа-2 в дерматовенерологии // Главный врач Юга России. 2012. № 2 (29). С. 26–28.
- Малиновская В. В. Новый комплексный препарат Виферон и его применение в иммунореабилитации в педиатрической и акушерской практике // Intern J Immunorehab. 1998. № 10. С. 76–85.
- Малиновская В. В., Деленян Н. В., Ариненко Р. Ю., Мешкова Е. Н. Виферон. Комплексный противовирусный и иммуномодулирующий препарат для детей и взрослых. Рук-во для врачей. М., 2005. 64 с.
- Малиновская В. В., Брагина Г. С., Иванова В. В., Ботвиньева В. В., Романцов М. Г. Экспериментально-клинические исследования применения рекомбинантного α2 В-интерферона (Виферона). Рук-во для врачей / Под ред. В. В. Малиновской, М. Г. Романцова. М., 1997. 75 с.
- Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. 5-е изд., перераб. и доп. М.: Деловой экспресс, 2016. 768 с.
- Сухих Г. Т., Прилепская В. Н., Трофимов Д. Ю., Донников А. Е., Айламазян Э. К., Савичева А. М., Шипицына Е. В. Применение метода полимеразной цепной реакции в реальном времени для оценки микробиоценоза урогенитального тракта у женщин (медицинская технология). М.: ФГБУ «НЦАГиП им. В. И. Кулакова» Минздрава России, СПб: НИИАГ им. Д. О. Отта СЗО РАМН, 2011. 38 c.
- Аллергология и иммунология: национальное руководство / Под ред. Р. М. Хаитова, Н. И. Ильиной. М.: ГЭОТАР-Медиа, 2009. 656 с.
- Московкина А. В., Бичуль O. K., Орлов В. И., Ефанова Е. А., Андреева В. О. Оценка инфекционного статуса методом полимеразной цепной реакции у девушек-virgo. Матер. научн.-практ. конф. «Актуальные вопросы акушерства и гинекологии». Ростов-на-Дону: РГМУ. 2003. С. 77–78.
- Уварова Е. В., Батырова З. К., Кумыкова З. Х., Донников А. Е., Бурменская О. В., Намазова-Баранова Л. С. Микробиоценоз и локальный иммунитет слизистой оболочки влагалища у девочек в раннем детстве: норма и патология // Доктор. Ру. 2017. № 3 (132). С. 59–65.
- Кононов А. В. Местный иммунитет и регенерация слизистых оболочек при хроническом воспалении (биопсийн. исслед.). Омск: Центр клинич. патологии, 1993. 318 с.
- Сазонтова Т. Г., Архипенко Ю. В. Значение баланса прооксидантов и антиоксидантов — равнозначных участников метаболизма // Патологическая физиология и экспериментальная терапия. 2007. № 3. С. 2–17.
- Ершов Ф. И., Григорян С. С., Готовцева Е. П. Система интерферона в норме и при патологии. М., 1996. 240 с.
- Петрунин Д. Д. Врожденное звено иммунитета при урогенитальной патологии: особенности иммунопатогенеза и подходы к фармакологической коррекции // Эффективная фармакотерапия. 2009. № 26. С. 18–25.
И. Е. Рогожина, доктор медицинских наук, профессор
И. Н. Скупова
Г. Н. Маслякова, доктор медицинских наук, профессор
М. В. Юрьева
ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
1 Контактная информация: iwn1812@yandex.ru
Патогенетические аспекты лечения и профилактики хронических вульвовагинитов у подростков И. В. Нейфельд, И. Е. Рогожина, И. Н. Скупова, Г. Н. Маслякова, М. В. Юрьева
Для цитирования: Лечащий врач № 6/2018; Номера страниц в выпуске: 7-14
Теги: инфекция, рецидив, микробиота, патогенез
Купить номер с этой статьей в pdf