Под термином «вегетососудистая дистония» (ВСД) часто понимают психогенно обусловленные полисистемные вегетативные нарушения, которые могут являться самостоятельной нозологией, а также выступать в качестве вторичных проявлений соматических или неврологических заболеваний. При этом тяжесть вегетативной патологии усугубляет течение основного заболевания. Синдром вегетососудистой дистонии существенным образом влияет на физическое и эмоциональное состояние пациентов, определяя направленность их обращения за медицинской помощью. В структуре общей заболеваемости расстройства вегетативной нервной системы занимают одно из ведущих мест (рубрика G90.8 по МКБ-10). Так, распространенность вегетососудистой дистонии в общей популяции, по данным различных авторов, составляет от 29,1% до 82,0% [1–3].
Одной из важнейших особенностей ВСД является полисистемность клинических проявлений. В составе вегетососудистой дистонии выделяют три обобщенных синдрома. Первый — психовегетативный синдром (ПВС), который проявляется перманентно-пароксизмальными нарушениями, обусловленными дисфункцией неспецифических систем мозга (надсегментарных вегетативных систем). Второй — синдром прогрессирующей вегетативной недостаточности и третий — вегетативно-сосудисто-трофический синдром [4].
Расстройства тревожного спектра наблюдаются более чем у половины пациентов с ВСД. Особую клиническую значимость они приобретают у больных соматического профиля, включая функциональную патологию, поскольку в этих случаях всегда имеют место тревожные переживания разной степени выраженности: от психологически понятной до панической либо до генерализованного тревожного расстройства (ГТР). Как свидетельствует повседневная практика, всем пациентам с подобного рода нарушениями назначают анксиолитическую или седативную терапию. В частности, используют различные транквилизаторы: бензодиазепиновые, небензодиазепиновые, антидепрессанты. Анксиолитическая терапия значительно улучшает качество жизни этих больных, способствует их лучшей компенсации в процессе лечения. Однако далеко не все пациенты хорошо переносят данные препараты в силу быстрого развития побочных эффектов в виде вялости, мышечной слабости, нарушения внимания, координации, а иногда и симптомов зависимости [5]. С учетом отмеченных проблем в последние годы все чаще возникает потребность в препаратах с анксиолитическим действием небензодиазепинового строения. К таковым может быть отнесен препарат Тенотен, в состав которого входят антитела к мозгоспецифическому белку S-100, прошедшие технологическую обработку в процессе производства. В результате в состав Тенотена входят релиз-активные антитела к мозгоспецифическому белку S-100 (РА-АТ S-100). Было показано, что релиз-активные препараты обладают рядом типичных характеристик, позволяющих интегрировать их в современную фармакологию (специфичность, отсутствие привыкания, безопасность, высокая эффективность) [8, 9].
Свойства и эффекты релиз-активных антител к специфическому для мозга белку S-100 были изучены во многих экспериментальных исследованиях. Созданные на их основе препараты применяются в клинической практике в качестве анксиолитических, вегетостабилизирующих, стресс-протекторных средств для терапии тревожных и вегетативных расстройств. Молекулярной мишенью РА-AT S-100 является кальций-связывающий нейроспецифический белок S-100, который участвует в сопряжении информационных и обменных процессов в нервной системе, передаче сигнала вторичными мессенджерами («посредниками»), процессах роста, дифференцировки, апоптоза нейронов и глиальных клеток [8]. В исследованиях на линиях клеток Jurkat и MCF-7 было показано, что РА-AT S-100 реализуют свое действие, в частности, через сигма1-рецептор и глициновый сайт NMDA-глутаматного рецептора. Наличие подобного взаимодействия может свидетельствовать о влиянии препарата Тенотен на различные медиаторные системы, в том числе на ГАМКергическую и серотонинергическую передачи [7, 10, 11].
Следует отметить, что в отличие от традиционных бензодиазепиновых анксиолитиков РА-AT S-100 не вызывают седации и миорелаксации. Кроме того, РА-AT S-100 способствуют восстановлению процессов нейрональной пластичности.
С. Б. Шварков и соавт. установили, что применение РА-АТ S-100 на протяжении 4 недель у больных с психовегетативными расстройствами, в том числе обусловленными хронической ишемией головного мозга, приводило не только к значительному уменьшению выраженности тревожных расстройств, но и заметному снижению вегетативных нарушений. Это дало авторам возможность рассматривать Тенотен не только как корректор настроения, но и как вегетостабилизатор [6].
М. Л. Амосов и соавт. [1] при наблюдении за группой из 60 пациентов с транзиторными ишемическими атаками в различных сосудистых бассейнах и сопутствующими эмоциональными нарушениями установили, что применение РА-АТ S-100 позволяет уменьшить тревожность. Анксиолитический эффект при этом практически не отличался от противотревожного действия феназепама, при том что переносимость препарата, содержащего РА-АТ S-100, оказалась значительно лучшей и, в отличие от использования бензодиазепиновых производных, не возникало побочных эффектов.
Тем не менее, работ, отражающих эффективность Тенотена в коррекции вегетативных нарушений у лиц молодого возраста, недостаточно.
Целью настоящей работы было оценить эффективность и безопасность применения препарата Тенотен в терапии вегетососудистой дистонии у пациентов молодого возраста (18–35 лет).
Материалы и методы исследования
Всего в исследование было включено 50 пациентов (8 мужского и 42 женского пола) в возрасте от 18 до 35 лет (средний возраст 25,6 ± 4,1 года), имеющих синдром вегетативной дистонии, эмоциональные нарушения, снижение работоспособности.
В исследование не включались пациенты, принимающие психотропные и вегетотропные препараты в течение предшествующего месяца; беременные в период лактации; с признаками тяжелых соматических заболеваний по данным анамнеза, физикального осмотра и/или лабораторно-инструментальных анализов, которые могли препятствовать участию в программе и оказать влияние на результаты.
Все пациенты получали Тенотен внутрь, согласно инструкции по медицинскому применению препарата, по 1 таблетке 3 раза в день в течение 4 недель (28–30 дней) вне связи с приемом пищи, сублингвально. На время проведения исследования был запрещен прием вегетотропных, снотворных, седативных препаратов, а также транквилизаторов и антидепрессантов.
Всем пациентам проводилось выявление вегетативных нарушений по таблице Вейна (более 25 баллов свидетельствует о наличии вегетососудистой дистонии); оценка уровня тревоги — по шкале тревоги НАDS (8–10 баллов — субклинически выраженная тревога; 11 и более баллов — клинически выраженная тревога); депрессии — по шкале депрессии НАDS (8–10 баллов — субклинически выраженная депрессия; 11 и более баллов — клинически выраженная депрессия). За период проведения исследования состояние пациентов оценивалось 4 раза: 1-й визит — перед началом приема препарата, 2-й визит — после 7 дней терапии, 3-й визит — после 28–30 дня лечения, 4-й визит — через 7 дней от окончания терапии (37-й день от начала терапии). На каждом этапе оценивались неврологический статус, вариабельность ритма сердца (ВРС) и состояние по шкалам: вегетативной дисфункции А. М. Вейна, HADS-тревога/депрессия, а также опроснику SF-36 (русскоязычная версия, созданная и рекомендованная МЦИКЖ), позволяющему определить уровень физического функционирования (PF) и психологического здоровья (MH). После 30-го дня приема Тенотена дополнительно определялась оценка эффективности проводимой терапии по шкале CGI-I.
Анализ ВРС проводился всем обследуемым исходно в положении лежа и в условиях активной ортостатической пробы (АОП) в соответствии с «Рекомендациями рабочей группы Европейского кардиологического общества и Североамериканского общества стимуляции и электрофизиологии» (1996) на аппарате ВНС-спектр. Исследование проводилось не ранее чем через 1,5 часа после еды, с обязательной отменой физиопроцедур и медикаментозного лечения с учетом сроков выведения препаратов из организма после 5–10-минутного отдыха. Вегетативный статус изучали по анализу ВРС по 5-минутным записям кардиоинтервалограммы (КИГ) в состоянии расслабленного бодрствования в положении лежа после 15 минут адаптации и при проведении ортостатической пробы. Учитывались только стационарные участки ритмограмм, т. е. к анализу допускались записи после устранения всех возможных артефактов и при наличии у пациента синусового ритма. Исследовались спектральные характеристики сердечного ритма, которые позволяют выделить периодические составляющие в колебаниях сердечного ритма и оценить количественно их вклад в общую динамику ритма. Спектры изменяемости интервалов R-R были получены при помощи преобразования Фурье. При проведении спектрального анализа оценивались следующие характеристики:
- TP «total power» — общая мощность спектра нейрогуморальной регуляции, характеризующая суммарное воздействие всех спектральных компонентов на синусовый ритм;
- HF «high frequency» — высокочастотные колебания, отражающие активность парасимпатического отдела вегетативной нервной системы;
- LF «low frequency» — низкочастотные колебания, отражающие активность симпатического отдела вегетативной нервной системы;
- VLF «very low frequency» — очень низкочастотные колебания, представляющие собой часть спектра нейрогуморальной регуляции, в состав которой входит комплекс различных факторов, влияющих на сердечный ритм (церебральные эрготропные, гуморально-метаболические влияния и др.);
- LF/HF — показатель, отражающий баланс симпатических и парасимпатических влияний, измеренных в нормализованных единицах;
- VLF%, LF%, HF% — относительные показатели, отражающие вклад каждого спектрального компонента в спектр нейрогуморальной регуляции.
Все вышеуказанные параметры фиксировались как в покое, так и при активной ортостатической пробе.
Статистический анализ результатов исследования проводился с помощью Statistics 6.0 с применением параметрического и непараметрического методов (критерии Стьюдента, Манна–Уитни). В качестве порогового уровня статистической значимости было принято значение р = 0,05.
Результаты и их обсуждение
Все пациенты жаловались на снижение работоспособности, общую слабость, утомляемость, колебания артериального давления (у 72% оно было сниженным и составило 90–100/55–65 мм рт. ст.; у 10% артериальное давление периодически повышалось до 130–140/90–95 мм рт. ст.). Головные боли у 72% пациентов были не постоянными и связаны с повышенными умственными или эмоциональными нагрузками. У 24% периодически отмечалась болезненность в области волосистой части головы и при пальпации перикраниальных мышц. Нарушения сна имели 72% пациентов, кардиалгии и ощущения перебоев в работе сердца — 18%. Гипергидроз ладоней, стоп, стойкий красный дермографизм, акроцианоз отмечали половина больных. Клинические проявления функциональных нарушений желудочно-кишечного тракта (ЖКТ) (запоры, метеоризм, боли в животе) были зафиксированы у 10% из общего числа обследованных пациентов.
Анализ анамнестических данных показал, что порядка 80% обследуемых имели стрессовый фактор. При опросе 30% пациентов связывали стресс с профессиональной деятельностью, 25% — с учебой, 10% — с семьей и детьми, 35% — с личными отношениями.
Анализ госпитальной шкалы тревоги и депрессии (HADS) выявил у 26% пациентов субклинически выраженную тревогу, у 46% — клинически выраженную тревогу. Половина пациентов (50%) часто испытывала напряжение и страх; 6% больных — постоянно ощущали чувство внутреннего напряжения и беспокойства. Панические атаки имели место быть у 16% респондентов. Субклинически и клинически выраженную депрессию имели 10% пациентов.
Значимыми по опроснику SF-36 явились нарушения со стороны психологического компонента здоровья (МН), и связаны они были с повышенным уровнем тревожности. При этом физическое функционирование (PF) не влияло на повседневную деятельность обследуемых.
Оценка эффективности и безопасности лечения показала четкое превалирование положительных результатов при использовании препарата Тенотен.
В дальнейшем по результатам проведенного динамического исследования вариабельности ритма сердца все пациенты были ретроспективно разделены на две группы.
Первую группу составили 45 человек (90%), изначально имеющие вегетативные нарушения с отчетливой положительной динамикой по результатам ВРС после 30-го дня приема препарата Тенотен. Ими оказались пациенты без признаков клинически выраженной депрессии. Исходные данные для этой группы пациентов составили: количество баллов по шкале Вейна — 25–64 (в среднем 41,05 ± 12,50); по шкале тревоги HADS — 4–16 (9,05 ± 3,43); по шкале депрессии HADS — 1–9 (5,14 ± 2,32). При оценке качества жизни по шкале SF-36 уровень физического здоровья (PF) составил 45,85 ± 7,31 и уровень психического здоровья (MH) 33,48 ± 12.
После семи дней приема препарата Тенотен все пациенты субъективно отметили улучшение самочувствия, однако средние числовые значения выявили в этой группе достоверные отличия только по шкале тревоги HADS (р < 0,05): больные стали меньше испытывать страх, внутреннее напряжение (рис. 1). У пациентов, имевших панические атаки, они не прекратились, однако, по субъективному отношению, самочувствие у них стало лучше.
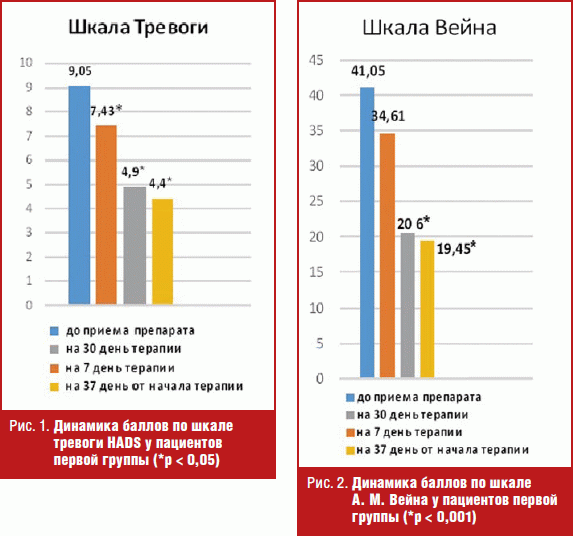
В дальнейшем анализ динамики показателей внутри шкал в первой группе показал, что наибольшие и достоверно значимые изменения в состоянии возникали после 30 дней от начала приема Тенотена. Наблюдалась положительная динамика в виде уменьшения количества и выраженности симптомов вегетососудистой дистонии: по шкале Вейна количество баллов достоверно уменьшилось до 8–38 (в среднем 20,61 ± 9,52) (р < 0,001) (рис. 2); значительно снизились баллы по шкале тревоги HADS 1–9 (4,91 ± 2,06) (р < 0,05) (рис. 1). Количество баллов по шкале депрессии HADS значимо не изменилось и составило 1–4 (2,48 ± 1,58), что изначально показало отсутствие клинически выраженной депрессии, а следовательно, и динамика показателя не была значимой.
В значительной степени возрос показатель психического здоровья (MH) до 54,6 ± 4,45 балла (р < 0,001), и незначительно увеличился показатель физического здоровья (PF) до 52,35 ± 7,18 балла (рис. 3). Следует отметить, что все пациенты были молодыми людьми, не имевшими хронических соматических заболеваний, и динамика этого показателя была ожидаема.
Анализ шкалы тревоги HADS показал, что совсем не испытывали состояние напряжения 68% против 100%, испытывающих напряжение до лечения; у 6% количество баллов осталось неизменным; у остальных 26% — количество баллов снизилось (пациенты перестали испытывать чувство страха). За время наблюдения у пациентов первой группы периодов повышения артериального давления не наблюдалось. Активных жалоб на болезненность в области перикраниальных мышц пациенты не предъявляли, однако после акцентуации внимания на данной области отмечали редкие головные боли. Дермографизм остался неизменным. Редкие перебои в работе сердца отмечали 4% пациентов. У 26 человек из 40 нормализовался сон.
Исследование, проведенное на 37-й день (через семь дней после отмены препарата), не выявило достоверных отличий от показателей на 30-й день приема Тенотена, т. е. полученный эффект от приема препарата сохранялся.
Во вторую группу вошли 5 человек со слабой положительной динамикой показателей исследования вариабельности ритма сердца. Ими оказались пациенты, исходно имевшие признаки клинически выраженной тревоги и депрессии.
Данные до начала терапии для этой группы пациентов составили: количество баллов по шкале Вейна 41–63 (в среднем 51,80 ± 8,70); по шкале тревоги HADS 9–18 (13,40 ± 3,36); по шкале депрессии HADS 7–16 (10,60 ± 3,78). При оценке качества жизни по шкале SF-36 у этих пациентов был значительно снижен уровень физического здоровья, который составлял 39,04 ± 7,88, а также уровень психического здоровья — 24,72 ± 14,57. Анализ динамики показателей во второй группе после 30 дней приема Тенотена выявил тенденцию к снижению вегетативной дисфункции по шкале Вейна — с 51,8 до 43,4 балла; тревожно-депрессивной симптоматики по шкале тревоги/депрессии HADS — с 13,4 до 10,4 балла и с 10,6 до 8,6 балла соответственно; по SF-36 показатель психического здоровья (MH) увеличился с 24,72 до 33,16, показатель физического здоровья (PF) — с 39,04 до 43,29. Однако данные значения не достигли статистически значимых различий, что свидетельствует о необходимости индивидуального подбора длительности и схемы терапии у пациентов с клинически выраженной тревогой и депрессией.
Таким образом, ретроспективное разделение пациентов на две группы при углубленном обследовании позволило выявить признаки клинически выраженной тревоги и депрессии в одной из групп, исходно значимо не отличавшейся от основной массы респондентов. Анализ динамики показателей по основным шкалам после месяца приема Тенотена по 1 таблетке 3 раза в день в этой группе не выявил достоверных отличий. Анксиолитический и вегетостабилизирующий эффекты Тенотена в группе клинически выраженной тревоги и депрессии при обычной (1 таблетка 3 раза в день) схеме терапии появились только в отдаленные сроки, что может служить обоснованием для коррекции схемы лечения и назначения по 2 таблетки 3 раза в день. Следовательно, полученные данные свидетельствуют о необходимости подбора различных схем применения Тенотена в зависимости от выраженности тревожно-депрессивной симптоматики, что обеспечивает индивидуальный подход для каждого пациента, формируя высокую приверженность к лечению.
Анализ показателей вариабельности ритма сердца у пациентов первой группы показал достоверно значимые изменения после 30 дней приема Тенотена, сохранившиеся через 7 дней после отмены препарата. При спектральном анализе по окончании месяца терапии абсолютные значения мощности LF- и НF-компонентов, а за счет этого и общей мощности спектра (ТР) были достоверно выше, чем при исследовании до приема препарата (с 1112,02 ± 549,20 до 1380,18 ± 653,80 и с 689,16 ± 485,23 до 1219,16 ± 615,75 соответственно, р < 0,05). То есть возросло вегетативное обеспечение регуляторных функций организма. Более высокие значения низкочастотных колебаний VLF, которые отражают степень активации церебральных эрготропных систем, наблюдались после 30 дней приема препарата: 1139,7 (199–2204) и 1503,6 (530–2270) соответственно (p < 0,05). Анализ в относительных единицах вклада в регуляцию ВРС при фоновой записи высокочастотного, низкочастотного и сверхнизкочастотного компонентов показал значительное преобладание активности симпатоадреналовой системы до проведения терапии и баланс симпатических, парасимпатических и эрготропных влияний после 30 дней приема препарата Тенотен. Следовательно, препарат оказал модулирующее влияние на регуляторные функции центральной нервной системы и, как следствие, на вегетативное обеспечение (рис. 4).
При спектральном анализе в процессе проведения активной ортостатической пробы после проводимой терапии отмечена более низкая реактивность симпатического отдела вегетативной нервной системы (ВНС) по сравнению с исходными данными, об этом свидетельствуют значения показателей LF/НF и %LF, а именно LF/НF — 5,89 (1,90–11,2) и 6,2 (2,1–15,1) соответственно, %LF — 51,6 (27–60) и 52,5 (28–69) (р < 0,05). Общая мощность спектра после применения препарата сохранила более высокие значения, чем до его применения: TP — 1997,0 (864–4181) и 3238,68 (1213–4563) соответственно (р < 0,05). Анализ вклада в обеспечение деятельности до лечения составил 32%, после лечения 19%, что позволяет говорить о возросшем адаптационном потенциале у пациентов первой группы. Все показатели, составляющие общую мощность спектра в процессе проведения активной ортостатической пробы, имели аналогичную тенденцию: HF — 248 (48–2346) и 350,2 (323–732), LF — 1101,0 (1094–1257) и 1739,7 (566–3677), VLF — 717 (373–1669) и 1149,4 (563–2205) соответственно (рис. 5).
Таким образом, в первой группе при проведении ВРС после 30 дней приема Тенотена имеется увеличение общей мощности спектра за счет усиления влияния в большей степени HF-компонента, а также нормализация симпатико-парасимпатических влияний при проведении фоновой пробы. В активной ортостатической пробе сохраняются те же тенденции, но выраженные в меньшей степени. Анализ динамики коэффициента 30/15 позволяет говорить о возросшей реактивности парасимпатического отдела ВНС и, следовательно, об увеличении адаптационного потенциала в результате проводимой терапии у пациентов первой группы (табл. 1).
У пациентов второй группы при спектральном анализе показателей вариабельности ритма сердца (фоновая запись и активная ортостатическая проба) по окончании месяца терапии не выявлено достоверно значимой динамики числовых значений показателей мощности LF- и НF-компонентов, а за счет этого и общей мощности спектра (ТР). У всех пациентов наблюдалась гиперсимпатикотония и высокая симпатическая реактивность до начала терапии и некоторое снижение числовых значений в конце терапии, однако процентный вклад симпатического отдела ВНС «до», «на протяжении терапии» и «после ее окончания» остался неизменным (рис. 6, 7).
Анализ динамики коэффициента 30/15 позволяет говорить о низкой парасимпатической реактивности и сниженном адаптационном потенциале до начала терапии препаратом Тенотен и о возросшей реактивности и, следовательно, об увеличении адаптационного потенциала в результате проводимого лечения у пациентов второй группы к концу терапии (табл. 2).
Таким образом, препарат Тенотен оказал положительное влияние на состояние вегетативной нервной системы у пациентов с ВСД в сочетании с клинически выраженной депрессией. Однако длительность лечения в 30 дней для данной группы пациентов является недостаточной, что служит основанием для продолжения лечения или использования альтернативной схемы по 2 таблетке 3 раза в день.
Заключение
Тенотен — успокаивающий и вегетостабилизирующий препарат с доказанным высоким уровнем безопасности. Использование Тенотена представляется чрезвычайно перспективным у пациентов молодого возраста с вегетососудистой дистонией.
- В ходе исследования зафиксировано, что Тенотен приводит к нормализации (стабилизации) вегетативного баланса при любом типе вегетососудистой дистонии (симпатико-тоническом, парасимпатико-тоническом), повышению вегетативного обеспечения регуляторных функций организма и увеличению адаптационного потенциала.
- Тенотен обладает выраженным противотревожным и вегетостабилизирующим действием.
- На фоне терапии Тенотеном уровень психического и физического здоровья (по опроснику SF-36) стал значительно выше, что свидетельствует об улучшении качества жизни пациентов.
- Прием Тенотена пациентами с клинически выраженными признаками тревоги и депрессии требует дифференцированного подхода к схеме терапии и ее длительности.
- В ходе исследования отмечено, что Тенотен не вызывает побочных эффектов и хорошо переносится пациентами.
- Тенотен может быть использован в качестве монотерапии вегетососудистой дистонии у пациентов молодого возраста (18–35 лет).
- Амосов М. Л., Салеев Р. А., Зарубина Е. В., Макарова Т. В. Применение препарата тенотен при лечении эмоциональных расстройств у пациентов с преходящими нарушениями мозгового кровообращения // Российский психиатрический журнал. 2008; 3: 86–91.
- Неврология. Национальное руководство / Под ред. Е. И. Гусева, А. Н. Коновалова, В. И. Скворцовой и др. М.: ГЭОТАР-Медиа, 2010.
- Вейн A. M. и др. Вегетативные расстройства.Клиника, лечение, диагностика. М.: Медицинское информационное агентство, 1998. 752 с.
- Воробьева О. В. Вегетативная дистония — что скрывается за диагнозом? // Трудный пациент. 2011; 10.
- Михайлов В. М. Вариабельность ритма сердца. Иваново, 2000. 200 с.
- Шварков С. Б., Ширшова Е. В., Кузьмина В. Ю. Сверхмалые дозы антител к белку S100 в терапии вегетативных расстройств и тревоги у больных с органическими и функциональными заболеваниями ЦНС // Лечащий Врач. 2008; 8: 18–23.
- Эпштейн О. И., Береговой Н. А., Сорокина Н. С. и др. Влияние различных разведений потенцированных антител к мозгоспецифическому белку S-100 на динамику посттетанической потенциации в переживающих срезах гиппокампа // Бюллетень экспериментальной биологии и медицины. 1999; 127 (3): 317–320.
- Эпштейн О. И., Штарк М. Б., Дыгай А. М. и др. Фармакология сверхмалых доз антител к эндогенным регуляторам функций: монография. М.: Издательство РАМН, 2005.
- Эпштейн О. И. Сверхмалые дозы (история одного исследования). Экспериментальное изучение сверхмалых доз антитнтел к белку S-100: монография. М.: Издательство РАМН, 2005. С. 126–172.
- Хейфец И. Л., Дугина Ю. Л., Воронина Т. А. и др. Участие серотонинергической системы в механизме действия антител к белку S-100 в сверхмалых дозах // Бюллетень экспериментальной биологии и медицины. 2007; 143 (5): 535–537.
- Хейфец И. А., Молодавкин Г. М., Воронина Т. А. и др. Участие ГАМК-В системы в механизме действия антител к белку S-100 в сверхмалых дозах // Бюллетень экспериментальной биологии и медицины. 2008; 145 (5): 552–554.
Е. Н. Дьяконова1, доктор медицинских наук, профессор
В. В. Макерова
ГБОУ ВПО ИвГМА МЗ РФ, Иваново
1 Контактная информация: dyael@mail.ru
Купить номер с этой статьей в pdf