Под пневмотораксом понимают скопление воздуха в плевральной полости с полным либо частичным коллапсом легкого, возникающее вследствие патологического сообщения плевральной полости с атмосферным воздухом. В зависимости от типа сообщения плевральной полости с внешней средой различают закрытый, открытый и клапанный пневмоторакс. Причиной пневмоторакса могут явиться травмы грудной клетки, а также диагностические или лечебные медицинские вмешательства, однако в большинстве случаев пневмоторакс развивается вследствие спонтанного разрыва висцеральной плевры [1]. В свою очередь, спонтанные пневмотораксы (СП) делятся на первичные, возникающие без видимых причин у практически здоровых людей, и вторичные, возникающие на фоне каких-либо заболеваний легких. Факторами риска первичного СП принято считать молодой возраст (до 30 лет), мужской пол, семейный анамнез, курение и астенический тип конституции [2].
По мнению большинства авторов, непосредственной причиной первичного СП является буллезная эмфизема с прогрессирующим истончением стенок и разрывом субплеврально расположенных воздушных образований легких. Принято различать буллы — воздушные пространства диаметром более 1 см и более мелкие образования — блебы. Данные образования удается обнаружить у 76–100% пациентов, перенесших первичный СП [3].
Представления об этиологии и патогенезе эмфиземы легких неоднозначны и противоречивы, несмотря на многочисленные исследования, посвященные этому вопросу. Одной из первых гипотез происхождения эмфиземы явилась сосудистая теория, объясняющая атрофию и деструкцию альвеолярных стенок наличием микротробозов капиллярного русла [4]. Сторонники механической теории предполагали, что эмфизема является следствием перерастяжения легочной ткани с разрывом внутриацинарных структур [5]. Была выдвинута любопытная гипотеза, объяснявшая образование булл травмированием легочной ткани острыми краями верхних ребер [6]. В середине прошлого века главенствующее положение заняла обструктивная теория, согласно которой по мере сужения бронхов формируется вентильный механизм, приводящий к компенсаторному перерастяжению альвеол и разрыву межальвеолярных перегородок [7]. Важным этапом в изучении заболевания стал 1963 год, когда шведские исследователи C. B. Laurell и S. Erickson впервые сообщили о раннем и быстром развитии эмфиземы у больных с тяжелым дефицитом альфа-1-антитрипсина [8]. В настоящее время теория антипротеазного и антиоксидантного дисбаланса приобрела более глобальный смысл, поскольку было доказано, что при эмфиземе происходят не только процессы повреждения компонентов экстрацеллюлярного матрикса, но и активный синтез нового материала. Данное положение получило название теории дисбаланса «повреждение/регенерация» и позволило рассматривать эмфизему как потенциально обратимое состояние с возможностью регенерации разрушенных тканевых структур [9].
Обращает на себя внимание, что все описанные выше патогенетические механизмы развития эмфиземы связаны с хроническим воспалением и не могут в полной мере объяснить появление булл и развитие СП у практически здоровых молодых людей с определенным типом телосложения. Между тем число больных с первичным СП с каждым годом увеличивается, и хирургические вмешательства по поводу данной патологии составляют около 50% от всех случаев неотложных состояний в торакальной хирургии.
В 80-х годах прошлого века изучение первичного СП получило новое направление, и астенический тип конституции, характерный для данной группы пациентов, стал рассматриваться как маркер генетически детерминированной слабости соединительной ткани. Согласно национальным рекомендациям Всероссийского научного общества кардиологов (ВНОК) наследственные нарушения соединительной ткани (ННСТ) представляют собой гетерогенную группу заболеваний, обусловленных мутациями генов белков внеклеточного матрикса или генов белков, участвующих в морфогенезе соединительной ткани. Термин «дисплазия соединительной ткани (ДСТ)», прочно вошедший в медицинский лексикон на постсоветском пространстве, в широком смысле слова является синонимом ННСТ, а в более узком смысле объединяет группу ННСТ с полигенно-мультифакториальным типом наследования [10].
Синдром Марфана является наиболее изученным моногенным заболеванием из группы ННСТ. Апикальные буллы и СП диагностируются у 5–10% пациентов с синдромом Марфана и рассматриваются как малые диагностические критерии, свидетельствующие о вовлеченности бронхолегочной системы [11]. В работах, посвященных ДСТ, также приводятся данные о высокой частоте встречаемости случаев СП у лиц молодого возраста. Так, в наблюдениях Г. И. Нечаевой у пациентов в возрасте 18–35 лет с признаками ДСТ распространенность СП составила около 10% [12]. С. М. Гавалов и В. В. Зеленская, наблюдая детей с бронхиальной астмой на фоне ДСТ, зарегистрировали развитие СП у 5% пациентов, причем в половине случаев осложнение не было связано с тяжелым приступом удушья [13]. Г. П. Василенко и Г. Н. Верещагина использовали термин «диспластическое легкое», основным проявлением которого считали спонтанный пневмоторакс [14]. В. И. Нечаев указывает, что генетические маркеры ДСТ среди больных с буллезной эмфиземой встречаются в 8,9 раза чаще, чем среди практически здоровых лиц [15]. К сожалению, наблюдения о роли ДСТ в генезе первичного СП не нашли должного отражения в современных руководствах по респираторной медицине. С нашей точки зрения это связано с недостаточным уровнем доказательности исследований и неоднозначностью их дизайна, в частности, с включением в выборку пациентов разного возраста, в том числе имеющих хронические заболевания органов дыхания.
Целью нашего исследования явился поиск доказательств гипотезы об этиологической значимости ДСТ в генезе буллезной эмфиземы и первичного спонтанного пневмоторакса у лиц молодого возраста, не имеющих хронической бронхолегочной патологии в анамнезе.
Материалы и методы
Для достижения поставленной цели было запланировано два этапа исследования. На первом этапе среди лиц молодого возраста с ДСТ определялась частота первичного СП по данным анамнеза и частота выявления буллезной эмфиземы легких по данным мультиспиральной компьютерной томографии органов грудной клетки (МСКТ ОГК). Задачей второго этапа явилось определение распространенности признаков ДСТ среди пациентов с первичным СП.
Во время первого этапа было обследовано 1250 студентов Омской медицинской академии в возрасте 18–22 лет, у которых активно выявлялись признаки ДСТ. Диагноз ДСТ устанавливался на основании комплексной оценки фенотипических критериев. Выделяли прогностически благоприятные (маловыраженные) и прогностически неблагоприятные (выраженные) варианты ДСТ, прогностическая значимость критериев оценивалась на основании анализа Вальда в модификации Генкина [16]. Частота первичного СП среди пациентов с ДСТ определялась при активном расспросе пациентов и анализе данных медицинской документации. Наличие буллезной эмфиземы устанавливалось по данным МСКТ ОГК, которая была проведена у 50 пациентов с ДСТ после исключения у них хронических заболеваний органов дыхания. Использовались методики высокого разрешения с функциональными пробами на аппарате AQUILION-64 (TOSHIBA, Япония), sl 0,5 мм, 120 кV, 200–300 mAs с обработкой данных на рабочей станции VITREA.
Второй этап исследования был проведен на базе двух клинических центров: отделения торакальной хирургии МУЗ ОГКБ № 1 им. А. Н. Кабанова, г. Омск и хирургической клиники Свердловского областного легочного центра, г. Екатеринбург. За период с 2006 по 2011 гг. в обоих центрах по единому алгоритму обследовано 642 пациента с первичным СП, верифицированным как диагноз исключения после тщательного анализа клинических и параклинических данных. У пациентов с первичным СП также проводился целенаправленный поиск внешних и висцеральных признаков ДСТ согласно общепринятому алгоритму. Частота встречаемости отдельных признаков ДСТ в группе пациентов с первичным СП сравнивалась с данными скринингового обследования 300 добровольцев без буллезной эмфиземы и эпизодов СП, сопоставимых по полу и возрасту.
Описание и статистическая обработка полученных результатов проводилась с учетом характера распределения и типа данных. Для описания количественных признаков использовали медиану (Me) и интерквартильный размах (LQ-HQ). Сравнение независимых выборок проводилось с использованием U-критерия Манна–Уитни. Для описания качественных признаков применяли относительную частоту (%) и 95% доверительный интервал (CI), рассчитанный по формуле Клоппера–Пирсона. Сравнение качественных признаков проводилось методом анализа таблиц сопряженности с использованием критерия χ
Результаты
Во время первого этапа по единому алгоритму было проведено сплошное обследование 1250 студентов Омской медицинской академии в возрасте 18–22 лет: 810 девушек (64,8%) и 440 юношей (35,2%).
В структуре всех проявлений ДСТ у обследованных лиц преобладали деформации грудной клетки и позвоночника. Обращали на себя внимание гендерные различия, которые имели статистическую значимость для большинства сравниваемых признаков. Так, у юношей скелетные проявления ДСТ диагностировались в 1,5–2 раза чаще, чем у девушек, пролапсы клапанов сердца, миопия и патология мышц — в три раза чаще.
При анализе информативности клинико-прогностических критериев ДСТ методом Вальда в модификации Генкина диагностический порог был достигнут в 255 случаях (20,4%), из них юноши составляли более 60%. Прогностически благоприятные варианты ДСТ были диагностированы у 202 человек (16,2), прогностически неблагоприятные — у 53 человек (4,2%). По сложившейся в отечественной научной литературе традиции прогностически благоприятные варианты принято расценивать как маловыраженные ДСТ, а прогностически неблагоприятные как выраженные ДСТ.
Среди 255 студентов с ДСТ указания на наличие эпизодов первичного СП в анамнезе имели только 5 юношей (1,9%).
Инспираторно-экспираторная МСКТ ОГК была проведена 50 пациентам с ДСТ в возрасте 18–30 лет; из них женщин 38% (n = 19), мужчин 62% (n = 31). Лица, включенные в данный этап исследования, были сопоставимы по возрасту и индексу массы тела, среди них одинаково часто встречались лица, выкуривающие более 1 сигареты в неделю (42% среди женщин и 67% среди мужчин), однако анамнез курения не превышал 3 пачек-лет, что можно объяснить молодым возрастом обследуемых. В то же время анамнез курения у мужчин был достоверно больше, чем у женщин (1,8 (0,9–2,1) и 2,3 (1,7–3,5) пачек-лет соответственно, p = 0,01).
Буллы и/или блебы были выявлены у 8 пациентов мужского пола (16%), во всех случаях они имели субплевральную локализацию и визуализировались в области верхушек легких. В 6 случаях (12%) размеры воздушных полостей не превышали 1 см (блебы), в 2 случаях (4%) размер полостей был более 1 см (буллы). Односторонний процесс отмечен в 5 случаях (10%), двусторонний в 3 случаях (6%). Таким образом, из 31 мужчины с ДСТ с небольшим стажем курения и без признаков хронической бронхолегочной патологии субплевральные буллы визуализировались у каждого четвертого (рис.).
На втором этапе были обследованы 642 пациента с первичным СП. В обеих клиниках среди пациентов с первичным СП преобладали мужчины в возрасте до 30 лет. Регулярными курильщиками являлись 68% пациентов, однако анамнез курения также был небольшим. Рецидивирующий СП наблюдался у 30% пациентов, правосторонняя локализация встречалась несколько чаще, чем левосторонняя.
Частота встречаемости основных признаков ДСТ среди пациентов с первичным СП приведена в таблице.
Как видно из таблицы, у пациентов с первичным СП доминировали признаки, связанные с костно-суставным синдромом. Более чем в половине случаев были диагностированы нарушения осанки за счет деформации позвоночника, у трети пациентов наблюдались различные варианты деформации грудной клетки, а также гипотония и гипотрофия мышц.
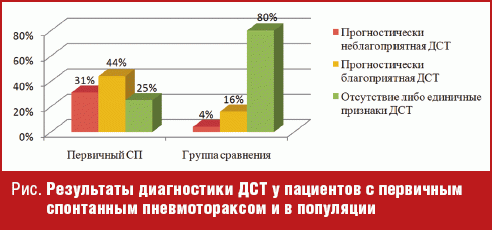
Распределение пациентов с первичным СП в зависимости от выраженности (прогностической значимости) ДСТ представлено на рисунке.
Как следует из данных рисунка, в группе пациентов с первичным СП выраженные и маловыраженные формы ДСТ были диагностированы в 75% случаев, что более чем в три раза превышает показатель группы сравнения. Обращало на себя внимание, что у пациентов с первичным СП доля выраженных и маловыраженных форм ДСТ была практически одинаковой (31,0% и 44% соответственно), в то время как в группе сравнения выраженные формы встречались гораздо реже и составили всего 4% от общего числа пациентов. Отметим, что за три года наблюдения мы зарегистрировали только два случая развития первичного СП у пациентов с моногенными синдромами (синдромом Марфана), что подтверждает относительную редкость встречаемости данной патологии в общей лечебной сети.
Обсуждение
Полученные нами данные достаточно убедительно подтверждают гипотезу об этиологической значимости ДСТ в генезе первичного СП. Отметим, что, следуя формальной логике, в случае возникновения «первичного» СП на фоне ДСТ его следовало бы расценивать как вторичный. Вопрос о «первичности» СП не стоит сводить только к терминологической дискуссии. С нашей точки зрения, гипотеза, объясняющая причину возникновения 75% случаев заболевания, этиология которого ранее была неизвестной, заслуживает внимания медицинского сообщества. Не менее важным представляются практические выводы, которые можно сделать на основании нашего исследования. Традиционно первичный СП рассматривается как исключительно хирургическая проблема и основное внимание исследователей направлено на совершенствование методов хирургического пособия. Для предотвращения рецидивов СП широко используются методы радикального лечения, при которых проводится индукция плевродеза. Однако отсутствие рецидивов пневмоторакса ни в коей мере не означает устранение буллезной эмфиземы как таковой, хотя и ведет к прекращению медицинского наблюдения. Данные о структурных и функциональных изменениях легких у пациента с буллезной эмфиземой после проведения плевродеза весьма немногочисленны и противоречивы [17]. С другой стороны, основываясь на положении, что первичный СП является лишь одним из проявлений системного генетически детерминированного процесса, не вызывает сомнения необходимость активной диагностики ДСТ и ее лечения. Наиболее оптимальным представляется направление пациента в лечебное учреждение, специализирующееся на проблемах ННСТ, после завершения этапа оказания неотложной хирургической помощи. В нашей клинике была апробирована программа реабилитации для пациентов с ДСТ после эпизода СП, рассчитанная на два 12-недельных курса в течение года [18]. Базисными методиками программы явились направления, традиционно использующиеся при реабилитации пациентов с ДСТ: обучение и информирование, дозированные физические нагрузки, респираторная гимнастика, рациональная психотерапия и метаболическая терапия.
Образовательные программы для пациентов включают в себя этапы информирования о сущности заболевания, индивидуальное консультирование по вопросам коррекции образа жизни, организации режима дня, двигательной активности, особенностей диеты и режима питания, противопоказанных и рекомендованных видах деятельности, возможностях медикаментозной коррекции, прогнозе трудоспособности. Особое внимание уделяется профилактике либо методам отказа от табакокурения. Физический компонент восстановительной программы состоит из общеразвивающих, коррекционных, дыхательных упражнений и аэробной части, включающей 15-минутный тренинг на велоэргометре. Интенсивность нагрузки — индивидуальная в зависимости от толерантности к физической нагрузке, контроль за переносимостью нагрузки ведется по частоте сердечных сокращений. Дыхательные упражнения предназначены для тренировки дыхательных мышц и увеличения подвижности грудной клетки. Курсы ручного массажа грудной клетки (12–15 процедур на курс) и физиотерапия выполняется в дни посещений Центра до или после тренировок. Физиотерапевтические процедуры назначаются индивидуализированно при наличии субъективной симптоматики до начала физических тренировок. Психокоррекционная терапия проводится врачом-психотерапевтом и построена на основе элементов когнитивно-бихевиоральной и рациональной психотерапии. Для коррекции вегетативной дисфункции, стабилизации синтеза коллагена и других компонентов соединительной ткани, стимуляции метаболических и коррекции биоэнергетических процессов целесообразны курсы метаболической терапии. Среди препаратов особое место занимают препараты магния (Магнерот, Магне-В6) и цинка (Цинкит), а также хондропротекторы (Структум), ноотропы и антиоксиданты (Актовегин, Мексидол, Мексикор, Рибоксин, Ноопепт), по показаниям назначаются анксиолитики и транквилизаторы (Афобазол, Атаракс), адаптогены. Для поддержания физического состояния между курсами пациентам рекомендуется амбулаторная физическая реабилитация, которая включает в себя ежедневную гимнастику и аэробные нагрузки. По нашим данным применение комплексной программы реабилитации для пациентов со СП на фоне ДСТ привело не только к улучшению качества жизни пациентов за счет нормализации функции респираторной и сердечно-сосудистой систем, но и к уменьшению риска прогрессирования буллезной эмфиземы и рецидива СП.
Заключение
- Получены данные, подтверждающие этиологическую значимость ННСТ (ДСТ) для возникновения первичного СП.
- Возникновение первичного СП является поводом для целенаправленной диагностики и лечения ДСТ.
- Лечение пациента с первичным СП не должно ограничиваться хирургическим пособием, т. к. даже радикальные методы лечения могут предотвратить рецидив пневмоторакса, но не влияют на прогрессирование буллезной эмфиземы и других проявлений ДСТ.
Литература
- Авдеев С. Н. Пневмоторакс // Consillium medicum. 2005. № 10. Т. 7. С. 874–882.
- Высоцкий А. Г. Буллезная эмфизема легких. Донецк: Схiдний видавничий дiм; 2007. 277 с.
- Филатова А. С., Гринберг Л. М. Патоморфология легочно-плевральных поражений при спонтанном пневмотораксе (по данным резекций) // Уральский медицинский журнал. 2009. № 4. С. 14–25.
- Изаксон Э. О патологоанатомических изменениях легочных сосудов при эмфизематозном процессе в легких (1870 г.) // Пульмонология. 2005. № 4. С. 41–52.
- Harris W. H., Chillingworth F. P. The experimental production in dogs of emphysema with associated asthmatic syndrome by means of an intratracheal ball valve // J Exp Med. 1919. V. 30. P. 75–85.
- Stephenson S. F. Spontaneous pneumothorax: the sharp rib syndrome // Thorax. 1976. V. 31. № 4. P. 369–72.
- Вотчал Б. Е. Значение механизма дыхания в клинике и патогенезе эмфиземы легких // Клиническая медицина. 1949. № 5. С. 14–22.
- Laurell C. B., Erickson S. The electrophoretic a1-globulin pattern of serum in a1-antitrypsin deficiency // Scan J Clin Lab Invest. 1963. V. 15. P. 132–140.
- Massaro G. D., Radaeva S, Clerch L. B., Massaro D. Lung alveoli: endogenous programmed destruction and regeneration // Am J Physiol Lung Cell Mol Physiol. 2002. V. 283. P. 305–309.
- Наследственные нарушения соединительной ткани. Российские рекомендации. М., 2012. 49 c.
- Loeys B. L. et al. The revised Ghent nosology for the Marfan syndrome // Am J Med Gen. 2010. V. 47. № 7. P. 476–485.
- Яковлев В. М., Нечаева Г. И. Кардиореспираторные синдромы при дисплазии соединительной ткани. Омск, 1994. 215 с.
- Гавалов С. М., Зеленская В. В. Особенности клинических проявлений и течения различных форм бронхолегочной патологии у детей с малыми формами дисплазии соединительной ткани // Педиатрия. 1999. № 1. С. 49–52.
- Василенко Г. П., Верещагина Г. Н., Долганова Д. Н. и др. Спонтанный пневмоторакс как проявление диспластического легкого // Сибирский консилиум. 2000. № 1. Т. 11. С. 33–36.
- Нечаев В. И. Эмфизема легких: системные проявления болезни // Пульмонология. 1999. № 1. С. 54–58.
- Викторова И. А., Нечаева Г. И., Конев В. П. и др. Клинико-прогностические критерии дисплазии соединительной ткани // Российские медицинские вести. 2009. T. XIV. № 1. С. 76–86.
- Харькин А. А. Оперативное лечение неспецифического спонтанного пневмоторакса и его отдаленные результаты: автореф. дис. … канд. мед. наук. М., 1999. 26 с.
- Вершинина М. В., Говорова С. Е., Нечаева Г. И., Ратынская И. А. Лечение пациентов с буллезной эмфиземой на фоне дисплазии соединительной ткани в первичном звене здравоохранения // Лечащий Врач. 2011. № 9. С. 14–16.
Г. И. Нечаева*, доктор медицинских наук, профессор
Л. М. Гринберг**, доктор медицинских наук, профессор
Д. А. Скрипкин***, кандидат медицинских наук
Ю. Т. Игнатьев*, доктор медицинских наук, профессор
С. Е. Говорова*
О. В. Дрокина*
*ГБОУ ВПО ОмГМА Минздравсоцразвития России, Омск
**ГБОУ ВПО УГМА Минздравсоцразвития России, Екатеринбург
***БУЗОО КДЦ, Омск
Контактная информация об авторах для переписки: Mver@yandex.ru
Купить номер с этой статьей в pdf