Анализ трофологического (нутритивного) статуса пациента, являющийся необходимым компонентом оценки как здоровья, так и тяжести болезни, складывается из анализа широкого спектра данных, включая клинические и соматометрические. К первым относятся психомоторное развитие, психоэмоциональный статус (настроение), аппетит, состояние кожных покровов и подкожного жирового слоя, слизистых оболочек, мышечного тонуса и мн. др., включая особенности полового развития.
Соматометрические показатели включают массу тела, рост, окружность головы и плеча, толщину кожно-жировой складки над трицепсом, величину окружности мышц плеча и некоторые другие. Их нормальные значения лежат в пределах среднего квадратичного отклонения (M ± 1σ) или 25–75 перцентилей при использовании центильных таблиц.
Расчетные соматометрические индексы также широко используются в клинической практике. Наиболее известным из них является показатель отклонения массы тела (ПОМТ), выраженный в % и равный
ПОМТ = ФМТ (кг)/РМТ (кг) × 100%,
где ФМТ — фактическая масса тела, а РМТ — расчетная масса тела. Нормальными значениями ПОМТ принимаются 90–110%.
Индекс массы тела (ИМТ) (индекс Quetelet) рассчитывается как отношение ФМТ в кг к значению роста (в метрах), взятом в квадрате. Нормальные значения ИМТ представлены ниже:
- < 18,5 — недостаточное питание;
- 18,5–24,9 — нормальное питание;
- 25,0–29,9 — повышенное питание;
- > 30 — ожирение.
Для оценки трофологического статуса используются также и специальные методы исследования, которые подразделяются на статические показатели и функциональные тесты. К последним относятся, в частности, определение аномальных метаболитов, активности ферментов, in vitro тесты, провокационные патофизиологические реакции.
Для оценки текущего питания могут быть использованы исследования кала (определение содержания минеральных веществ, липидов), мочи (витамины группы В, кроме В
Оценка среднесрочного и долгосрочного питания может быть проведена при исследовании эритроцитов (витамины В1, В2, В6, ниацин, фолацин, Se, Cu), лейкоцитов (витамин С, Zn), волос и ногтей (микроэлементы Zn, Cu и др.), жировой ткани (жирные кислоты) [1].
Маркерами белковой недостаточности являются показатели биохимического исследования крови. Определение уровня общего белка в крови и альбумина являются наиболее доступными из них, однако не самыми точными, что связано с относительно длительным периодом полураспада (в пределах 15–20 дней). Более точным является определение трансферрина (в норме: 2–4 г/л, Т1/2–8 дней) и транстиретина (в норме: 170–350 мг/л, Т1/2–2–3 дня).
По снижению белковых маркеров выделяют три степени белковой недостаточности: легкая — снижение показателей в пределах от 10% до 20%, средняя более 20% до 30%, тяжелая — более 30%.
Другими маркерами белковой недостаточности являются альфа1?кислый гликопротеин (орозомукоид), альфа1?
антитрипсин, С-реактивный белок (СРБ). При этом признаками белковой недостаточности считается повышение указанных показателей на 5% и выше.
Также может рассчитываться прогностический индекс воспаления и состояния питания (ПИВСП), предложенный Carpeintier и Ingenbleek, который опирается на концентрацию сывороточного альбумина и транстиретина, а также на активность воспалительного процесса [2, 3]:
ПИВСП = альфа-1 КГП × СРБ × Альб × ТТР,
где альфа-1 КГП — концентрация альфа-1 кислого гликопротеина (мг/л), СРБ — С-реактивный белок (мг/л), Альб — уровень альбумина (г/л), ТТР — уровень транстиретина (мг/л) [4].
Показателями трофологического статуса также являются абсолютное число лимфоцитов, фактический расход энергии и многие другие.
Коррекция нутритивного статуса представляет собой многоплановый процесс, включающий, помимо устранения основного патологического процесса, также коррекцию питания, процессов переваривания и всасывания и метаболических процессов.
Адекватная функция пищеварительных желез, очевидно, необходима для нормального течения метаболических процессов в организме, включая рост и развитие. Секреция панкреатических ферментов, обеспечивающих основные процессы переваривания белков, жиров и углеводов, приведена в табл. 1.
К протеолитическим ферментам поджелудочной железы относятся трипсин, химотрипсин, эластаза и многие другие. Все протеолитические ферменты поджелудочной железы продуцируются в неактивном виде, и в дальнейшем происходит их активация трипсином. Сам трипсин также секретируется в виде неактивного трипсиногена, и его активация происходит в двенадцатиперстной кишке кишечной энтерокиназой. В свою очередь неактивная энтерокиназа активируется дуоденазой, также продуцируемой клетками двенадцатиперстной кишки.
Протеолитическое действие панкреатического секрета обуславливается тремя эндопептидазами — трипсином, химотрипсином и эластазой, которые расщепляют белки и полипептиды, поступающие из желудка. Трипсин специфически действует на пептидные связи, образуемые основными аминокислотами, химотрипсин — на связи между остатками незаряженных аминокислот, в то время как эластаза расщепляет связи, примыкающие к остаткам малых аминокислот, таких как глицин, аланин и серин. Активация трипсиногена осуществляется энтерокиназой, которая гидролизует его лизиновую пептидную связь. Образовавшийся трипсин действует как на новые молекулы трипсиногена, так и на химотрипсиноген, проэластазу и прокарбоксипептидазу — с высвобождением соответственно химотрипсина, эластазы и карбоксипептидазы.
К липолитическим ферментам относятся триацилглицероллипаза (панкреатическая липаза, расщепляющая триглицериды), фосфолипазы и некоторые другие. Кроме того, желчные кислоты активируют липазы, а также предварительно эмульгируют жиры, облегчая воздействие на них ферментов. Амилолитическая активность (расщепление крахмала) панкреатического секрета определяется амилазой, единственным панкреатическим ферментом, который секретируется сразу в активной форме.
Таким образом, экзокринная панкреатическая секреция обеспечивает основные процессы переваривания нутриентов, в связи с чем функциональное состояние поджелудочной железы в значительной степени определяет характер трофологического статуса больного. Так, в экспериментальных исследованиях было показано, что прибавка массы молодых животных достоверно коррелирует с экзокринной функцией поджелудочной железы [5, 6]. Аналогичные закономерности выявлены и в клинической практике, в связи с чем важной составляющей процесса коррекции нутритивного статуса является терапия препаратами панкреатических ферментов.
Высокоактивные препараты панкреатических ферментов (такие как Креон®), характеризуются высоким качеством субстрата, защитой от преждевременной активации в полости рта и пищеводе (капсула), определенным размером минимикросфер (1,0–1,2 мм), обеспечивающим равномерное перемешивание с желудочным и кишечным содержимым, а также защитой от инактивации в желудке (рН-чувствительная оболочка минимикросфер).
Высокоактивные препараты пищеварительных ферментов широко используются для лечения заболеваний, сопровождающихся экзокринной панкреатической недостаточностью, как абсолютной, так и относительной. Высокая эффективность их как трофологического фактора была показана впервые при лечении больных с муковисцидозом. Применение этих препаратов не только эффективно корригировало тяжелую панкреатическую недостаточность, характерную для данного заболевания, но и позволило изменить характер питания, повысить усвоение всех нутриентов, существенно улучшить нутритивный статус и, в итоге, не только увеличить продолжительность жизни больных, но и повысить ее качество.
Панкреатическая недостаточность по данным Научно-клинического отдела муковисцидоза ГУ МГНЦ РАМН (Москва) наблюдается у 95,3% пациентов с манифестацией в первые дни жизни. Следствием ее является нарушение всасывания жиров и белков. При этом до 50% поступившего белка может быть потеряно со стулом. У больных муковисцидозом обычно отмечается хорошее всасывание углеводов, однако метаболизм их может быть нарушен, вплоть до развития в старшем возрасте сахарного диабета [7].
Так, по данным Н. И. Капранова и соавт. после введения в терапию детей с муковисцидозом препарата Креон® число госпитализаций уменьшилось примерно на 30%, также как и число курсов антибактериальной терапии, а качество и продолжительность жизни существенно повысились. Более того, в среднем суммарная стоимость лечения высокоактивными препаратами оказалась примерно в 2–3 раза ниже, по сравнению с применением препаратов средней степени активности, не говоря уже о более высокой фармакологической эффективности [8].
В работах Н. Ю. Каширской и соавт. было показано, что переход на диету без ограничения жиров у больных муковисцидозом возможен при условии адекватной заместительной терапии [7]. При этом достоверно меняется липидный спектр сыворотки крови. Высокожировая, высококалорийная диета в сочетании с приемом микросферических ферментов с рН-чувствительной оболочкой в состоянии поддерживать нормальный нутритивный статус и липидный состав плазмы крови больного муковисцидозом на нормальном уровне, что согласуется с данными зарубежных исследователей [9]. Кроме того, увеличение жирового состава пищи и применение новых форм панкреатических ферментов ведет к увеличению полиненасыщенных жирных кислот в составе фосфолипидов и их метаболитов. Последние работы в области повышения эффективности лечения больных муковисцидозом подтверждают и развивают эту концепцию [10].
Целиакия, наследственное заболевание, связанное с непереносимостью глютена, белка некоторых злаков, характеризуется синдромом мальабсорбции, при котором нарушеается кишечное всасывание практически всех нутриентов. Основой лечения целиакии является безглютеновая диета, которая дополняется посиндромной терапией, в т. ч. направленной на улучшение пищеварительных процессов в кишечнике. Практически обязательным компонентом этой терапии в последние годы стало применение высокоактивных препаратов панкреатических ферментов (Креон® 10 000 или Креон® 25 000).
По нашим данным, повышение экскреции триглицеридов с калом, указывающее на экзокринную недостаточность поджелудочной железы, наблюдается у 18% больных в активную стадию целиакии и у 52% — в стадию ремиссии. Механизм вовлечения поджелудочной железы в патологический процесс при целиакии, в первую очередь, связан с нарушением ее гуморальной регуляции со стороны кишечника на фоне атрофических изменений в слизистой оболочке, а также с неспецифическими метаболическими нарушениями у ребенка с тяжелой мальабсорбцией [11].
Исходя из этого, в план обследования больного целиакией должны входить ультразвуковое исследование поджелудочной железы, оценка ее экзокринной функции (оптимальным методом является определение эластазы-1 в кале, но могут быть использованы такие косвенные методы, как липидограмма кала), а также определение активности панкреатических ферментов в крови (трипсина, липазы или эластазы-1 в крови). В состав комплексной терапии целиакии должны входить препараты панкреатических ферментов (например, Креон
По данным ретроспективного анализа детей с целиакией в возрасте от 11 месяцев до 6 лет введение этих препаратов в состав терапии сокращает сроки купирования диарейного синдрома, а также интенсифицирует восстановление нутритивного статуса больных. Данные, касающиеся соматометрических показателей, а также динамики показателей белкового обмена, представлены в табл. 2 и 3).
Обращают внимание различия в итоговом значении ПОМТ через 2 месяца. В дальнейшем этот показатель, также как и другие, практически выравнивается. Эти изменения происходят на фоне нормализации стула — как его частоты, так и консистенции. Корреляция между частотой стула и ПОМТ — отрицательная сильная достоверная (r = 0,72; p < 0,05). При этом нормализация массы тела происходит не только в связи с восстановлением процессов всасывания (нормализация частоты стула как отражение этого процесса), т. к. восстановление ПОМТ несколько опережает таковое показателей стула.
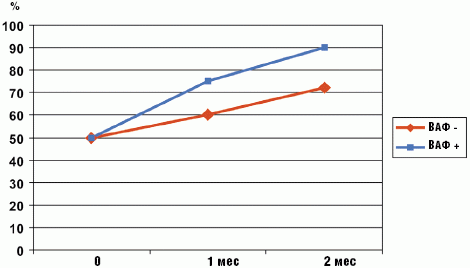
Положительная динамика наблюдается и для ключевых показателей белкового обмена: уровней общего белка, альбумина и трансферрина, что подтверждает положительную направленность трофологического статуса. Динамика трансферрина наиболее показательна, что указывает на реальный эффект от проводимой терапии. Различия в динамике общего белка у детей, получавших и не получавших ферментные препараты, также существенно различается (рис.). Эти показатели также связаны с частотой стула, хотя в данном случае можно говорить в большей степени о тенденции.
Полученные данные указывают на большое значение состояния экзокринной секреции поджелудочной железы для восстановления трофологического статуса при целиакии, а также на необходимость назначения высокоактивных препаратов панкреатических ферментов с целью сокращения сроков восстановительного процесса.
Таким образом, панкреатические ферменты — важные трофологические факторы, которые обеспечивают восстановление трофологического статуса пациента при самой разнообразной патологии, а препараты панкреатических ферментов должны использоваться в комплексных схемах их коррекции.
Литература
- Боровик Т. Э., Ладодо К. С., Семенова Н. Н., Степанова Т. Н., Рославцева Е. А., Скворцова В. А., Ерпулева Ю. В. Энтеральное питание тяжело больных детей с хирургической патологией. Инструкция. Департамент здравоохранения г. Москвы. М., 2004. 28 с.
- Попова Т. С., Шестопалов А. Е., Тамазашвили Т. Ш., Лейдерман И. Н. Нутритивная поддержка больных в критических состояниях. М.: Вести, 2002. 319 c.
- Berger M. M., Berger-Gryllaki M., Wiesel P. H. Intestinal absorption in patients after cardiac surgery // Crit. Care Med. 2000. Vol. 28. P. 2217–2223.
- Лейдерман И. Н., Хачатуров С. А., Левит А. Л. Особенности нутритивной поддержки в кардиологии и кардиохирургии: современное состояние проблемы // Тихоокеанский медицинский журнал. 2007. № 2. С. 28–33.
- Fedkiv O., Rengman S., Westrom B. R., Pierzynowski S. G. Growth is dependent on the exocrine pancreas function in young weaners but not in growing-finishing pigs // J Physiol Pharmacol. 2009. Vol.60. Suppl 3. P. 55–59.
- Botermans J. A., Pierzynowski S. G. Relations between body weight, feed intake, daily weight gain, and exocrine pancreatic secretion in chronically catheterized growing pigs // J Anim Sci. 1999. Vol. 77. № 2. P. 450–456.
- Каширская Н. Ю. Состояние желудочно-кишечного тракта, поджелудочной железы и гепатобилиарной системы у больных муковисцидозом. Автореф. дисс. докт. мед. наук. М.: 2001. 46 с.
- Капранов Н. И., Каширская Н. Ю. Новое в решении проблемы муковисцидоза // Российский педиатрический журнал. № 4. 1998. С. 53–60.
- Burdge G. C., Goodale A. J., Hill C. M. et al. Plasma lipid concentrations in children with cystic fibrosis: the value of high fat diet and pancreatic supplementation // Brit. J. Nutr. 1994. V. 71. 959–964.
- Van de Vijver E., Desager K., Mulberg A. E., Staelens S., Verkade H. J., Bodewes F. A., Malfroot A., Hauser B., Sinaasappel M., Van Biervliet S., Behm M., Pelckmans P., Callens D., Veereman-Wauters G. Treatment of infants and toddlers with cystic fibrosis-related pancreatic insufficiency and fat malabsorption with pancrelipase MT // J Pediatr Gastroenterol Nutr. 2011. Vol. 53. № 1. P. 61–64.
- С. В. Бельмер, А. А. Коваленко, Т. В. Гасилина. Врожденные причины экзокринной недостаточности поджелудочной железы // Русский медицинский журнал. Детская гастроэнтерология и нутрициология. 2004. Т. 12. № 16. С. 984–987.
С. В. Бельмер*, доктор медицинских наук, профессор
Е. В. Митина*
Н. А. Анастасевич*
Л. М. Карпина**
Н. С. Сметанина**, доктор медицинских наук, профессор
*ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития, **РДКБ, Москва
Контактная информация об авторах для переписки: belmersv@mail.ru
Купить номер с этой статьей в pdf