Поиск эффективных методов лечения острых и хронических бронхолегочных заболеваний остается весьма актуальной задачей педиатрии. Как известно, любое ирритативное, инфекционное либо аллергическое воспаление слизистой оболочки бронхов приводит к изменению продукции и реологических свойств мокроты, замедлению мукоцилиарного клиренса [1–5]. Поэтому одним из важнейших компонентов лечения бронхолегочных заболеваний является мукоактивная терапия. Она тем более значима, чем меньше возраст детей, т. к. соответствующие анатомо-физиологические особенности оказывают существенное влияние на течение заболевания (отсутствие кашлевого рефлекса у детей первых дней и недель жизни, склонность к экссудации и отеку слизистой оболочки бронхов, выраженная гиперпродукция и повышение вязкости слизи, узость дыхательных путей и проч.) [5]. Нарушение дренажной функции бронхиального дерева, скопление вязкого бронхиального секрета могут привести не только к вентиляционным нарушениям, но и к снижению местной иммунологической защиты дыхательных путей, что способствует колонизации патогенной микрофлорой с высоким риском развития затяжного воспалительного процесса [6, 7].
В педиатрической практике наряду с традиционными (рефлекторного действия) отхаркивающими средствами широко применяется целый ряд современных мукоактивных препаратов, включая муколитики, секретолитики, мукорегуляторы. Препараты этих групп наряду с общей муконаправленной активностью обладают своеобразными фармакологическими особенностями в связи с различающимися патогенетическими механизмами своего действия [1].
К отхаркивающим лекарственным средствам рефлекторного действия относятся препараты растительного происхождения (алтей, термопсис, мать-и-мачеха, солодка, багульник, терпингидрат, эфирные масла и др.). Они, как известно, многокомпонентны, содержат алкалоиды или сапонины, возбуждающие рецепторы нервных окончаний в желудке с последующей активацией центров рвоты и кашля в продолговатом мозге, стимулирующих гастропульмональный рефлекс. Ряд отхаркивающих медикаментов одновременно способствует некоторому усилению секреции бронхиальных желез, что увеличивает жидкий слой слизи (золь) и тем самым косвенно повышает активность мерцательного эпителия. Отметим, что у детей раннего возраста эти препараты нужно применять с осторожностью, т. к. избыточная стимуляция рвотного и кашлевого центров может привести к аспирации (особенно у пациентов с последствиями перинатального поражения ЦНС). Кроме того, пациентам с поллинозом, аллергической настроенностью отхаркивающие растительные препараты могут быть противопоказаны.
Мукоактивные препараты, безусловно, много эффективнее по сравнению с традиционными отхаркивающими средствами, но имеют свои особенности, которые необходимо учитывать при их назначении.
К муколитическим препаратам относят тиолики, в частности, производные N-ацетилцистеина. Широко известный муколитик — ацетилцистеин (АЦЦ) эффективно уменьшает вязкость и эластичность бронхиальной слизи, обладает более выраженной, чем у остальных муколитиков, способностью разжижать гнойную мокроту, лизировать фибрин и кровяные сгустки [2, 4, 8]. Показаниями для применения этого средства являются клинические состояния, при которых отмечается кашель с густой, вязкой, трудно отделяемой мокротой (чаще это обострение хронических инфекционно-воспалительных, наследственных и врожденных заболеваний легких). Доказано, что N-ацетилцистеин обладает выраженным антиоксидантным действием [2]. В то же время у ряда больных на фоне приема АЦЦ развивается избыточное разжижение мокроты, что требует тщательного контроля в динамике лечения этим препаратом [2, 9]. Не следует назначать АЦЦ пациентам с бронхообструктивным синдромом, с бронхиальной астмой, т. к. данный препарат может провоцировать усиление бронхоспазма.
К эффективным мукоактивным средствам относятся производные карбоцистеина, обладающие мукорегуляторными свойствами [10–12]. Мукорегуляторный эффект обусловлен нормализацией секреторной функции железистых клеток, причем независимо от их исходного состояния. Карбоцистеин активирует сиаловую трансферазу — фермент бокаловидных клеток слизистой оболочки бронхов, тем самым нормализуя количественное соотношение кислых и нейтральных сиаломуцинов бронхиального секрета. Он обладает муколитическим эффектом, т. к. разрывает дисульфидные мостики гликопротеинов, воздействуя на гелевую фазу мокроты. В то же время карбоцистеин плохо растворим в воде, обладает высокой кислотностью и плохими органолептическими свойствами, что существенно ограничивает его применение. В значительной мере избавлена от этих свойств водорастворимая лизиновая соль карбоцистеина (ЛКЦ), обладающая также эффектом «последействия», что позволяет рекомендовать этот препарат при хронических заболеваниях легких, требующих длительной мукоактивной терапии [10, 12]. Углубленный анализ данных клинических и экспериментальных исследований свидетельствует о выраженной противовоспалительной и антиоксидантной активности карбоцистеина [4, 12].
Среди секретолитиков особое место занимает амброксол, активный метаболит бромгексина, являющегося, в свою очередь, производным природного алкалоида вазицина. Амброксол обладает весьма комплексным действием, в основе которого лежит стимуляция выработки секрета бронхиальными железами; усиление секреции гликопротеинов; нормализация функции измененных серозных и мукозных желез слизистой оболочки бронхов; повышение синтеза и секреции сурфактанта и торможение его распада; разжижение трахеобронхиального секрета путем расщепления кислых мукополисахаридов и дезоксирибонуклеиновых кислот; активация реснитчатого эпителия; снижение бронхиальной гиперреактивности; местно-анальгезирующее действие [13–14]. Имеются экспериментальные данные, что амброксол регулирует уровень защитных факторов в дыхательных путях, стимулируя высвобождение ингибитора секреторной лейкопротеазы в раннюю фазу, а также выработку иммуноглобулина А в позднюю фазу при инфицировании вирусом гриппа А [15]. Выявлено, что данный препарат ингибирует секрецию иммуноглобулина Е тучными клетками и базофилами [16]. Ферментная антиоксидантная активность амброксола доказана в многочисленных экспериментальных исследованиях in vitro и in vivo на животных моделях [17]. Безусловно, клинически амброксол значительно более эффективен, чем бромгексин, и может назначаться детям, начиная с периода новорожденности [1, 16].
Перспективное направление в педиатрии представляет использование комбинации в одной лекарственной форме сразу нескольких средств, воздействующих на различные патогенетические механизмы воспаления и кашля. Их сочетание в одном препарате может более эффективно улучшать мукоцилиарный клиренс, одновременно избавляя от различных патологических симптомов и повышая приверженность терапии, что особенно актуально в амбулаторной педиатрической практике [18, 19].
Одним из таких комплексных мукоактивных препаратов сегодня является комбинированный муколитик Коделак Бронхо с чабрецом, имеющий в своем составе амброксол, натрия глицирризинат, экстракт травы тимьяна ползучего (чабрец). Амброксол оказывает секретомоторное, секретолитическое действие. О лекарственном применении солодки (лакричный корень) говорилось еще в древнем памятнике китайской медицины «Трактат о травах», написанном за 3000 лет до н. э. Натрия глицирризинат (производное солодки) обладает противовоспалительным и противовирусным действием; оказывает цитопротекторное действие благодаря антиоксидантной и мембраностабилизирующей активности; усиливает действие эндогенных глюкокортикостероидов, оказывая противовоспалительное и противоаллергическое действие. Имеется мнение, что глицирризин может быть дополнительным потенциальным препаратом для лечения гриппа А (H5N1), при котором развивается гиперцитокинемия [20]. Было доказано, что глицирризин имеет подобный глюкокортикостероидам противовоспалительный эффект в культивируемых эпителиальных клетках дыхательных путей, что является научным обоснованием его применения при лечении воспалительных респираторных заболеваний. В ходе экспериментальных исследований было выявлено подавление глицирризином гиперпродукции бронхиальной слизи, что, по мнению ряда авторов, обусловлено торможением транскрипции гена MUC5 AC [21]; стимулирует активацию лимфоцитов [22]; ингибирует генерацию активных форм кислорода нейтрофилами [23]; нормализует баланс в системе перекисного окисления липидов — антиоксидатной защиты и повышает уровень гамма-интерферона, снижает уровень интерлейкина-4 в крови и слизистой оболочке носа при аллергическом рините [24].
Экстракт травы чабреца содержит смесь эфирных масел, обладающих отхаркивающим и противовоспалительным действием. Кроме того, он обладает слабыми бронхолитическими (воздействие на бета2-рецепторы), секретомоторными и репаративными свойствами, улучшает мукоцилиарный клиренс [25]. Доказано, что тимоловое эфирное масло, а также сам тимол обладают антибактериальными, противогрибковыми и потенциальными антиоксидантными свойствами [26]. В ходе экспериментальных исследований было выявлено, что эфирное масло тимьяна способствовало ингибированию роста большинства инфекционных агентов дыхательных путей: Streptococcus pyogenes, S. agalactiae, S. pneumoniae, Klebsiella pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Stenotrophomonas maltophilia [27].
Эликсир Коделак Бронхо с чабрецом применяется у детей с 2-летнего возраста. Многокомпонентый состав обеспечивает препарату одновременно секретолитическое, противовоспалительное, противоаллергическое и спазмолитическое действие.
Цель исследования: на основе клинических и иммунологических критериев оценить эффективность комбинированного отхаркивающего средства Коделак Бронхо с чабрецом у детей с острыми и рецидивирующими респираторными инфекциями нижних дыхательных путей.
Материалы и методы
В поликлинических условиях нами обследовано 74 ребенка в возрасте от 2 до 16 лет с острыми респираторными инфекциями нижних дыхательных путей (острый трахеит, острый бронхит, пневмония). В возрасте от 2 до 6 лет было 50 детей, от 7 до 16 лет — 24 пациента. Дети были распределены на две клинически сходные группы методом попарного отбора («парного дизайна»). При этом для каждого пациента одной группы в другой группе подбирался эквивалентный ему субъект (или похожий на него) по полу, возрасту, нозологии и сопутствующей патологии (по принципу «копи-пара»).
Дети 1-й (основной) группы (36 человек) получали общепринятое лечение, включающее диетотерапию, лечебно-охранительный режим, по показаниям этиотропную терапию (противовирусные, антибактериальные препараты), в качестве отхаркивающего средства им был назначен комбинированный препарат Коделак Бронхо с чабрецом в возрастной дозировке, также по показаниям проводилась физиотерапия (ингаляции с беродуалом, физиологическим раствором), массаж и т. д.
Дети 2-й группы (сравнения) (38 человек) наряду с общепринятым лечением, вышеописанной физиотерапией и массажем получали отхаркивающую терапию с включением амброксола (Лазолван) в возрастной дозировке.
Назначение данной мукоактивной терапии проводилось на 3–5 день от начала заболевания. Длительность курса мукоактивной терапии составила 7–10 дней.
Методы исследования
Всем детям были проведены общеклинические обследования (сбор анамнеза, осмотр и др.). Динамический контроль выраженности клинических симптомов осуществлялся по специально разработанной шкале, которая включала: оценку (в баллах от 0 до 3) выраженности температуры, кашля, мокроты, разных хрипов, затруднения носового дыхания. Учет клинической симптоматики проводился в течение первых 10 дней наблюдения, на 1-й, 3-й, 5-й, 7-й и 10-й день от начала мукоактивной терапии.
Исследование местного иммунитета — определение уровня секреторного IgA (sIgA) слюны проводилось методом иммуноферментного анализа (ИФА) («Вектор-Бест», Россия) дважды: непосредственно перед началом лечения и через 2–3 недели после окончания лечения.
Полученные результаты обработаны с помощью пакета статистических компьютерных программ Statistica 7.0. Нормальность распределения проверялась с использованием критерия Шапиро–Уилка. Определялись средняя арифметическая (М), средняя ошибка (m), достоверность различия по непараметрическим критериям Wald–Wolfowitz, Mann–Whitney U, Вилкоксона, χ2.
У 3 детей на фоне терапии Коделаком Бронхо с чабрецом наблюдалась кратковременная аллергическая реакция в виде зуда полости рта, мелкопапуллезной кожной сыпи, быстро прошедших после перорального назначения антигистаминных средств и не потребовавших отмены препарата. Жалоб на органолептические свойства препарата не было. 1 ребенок выбыл из исследования в связи с госпитализацией по поводу тяжелой пневмонии.
Результаты исследования
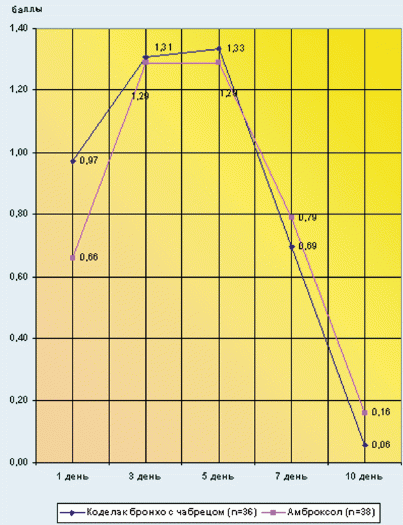
В ходе исследования было выявлено, что оба сравниваемых препарата обладают сходным терапевтическим эффектом на симптомы влажного кашля, степень продуцирования мокроты, длительность и интенсивность влажных хрипов в легких, длительность сухих хрипов в легких (p > 0,05) (рис. 1). Однако на фоне комбинированной мукоактивной терапии длительность и интенсивность сухого кашля снижалась более значительно, т. е. быстрее осуществлялся переход сухого кашля в продуктивный влажный кашель (р < 0,05) (рис. 2). Так, на 5-й день терапии амброксолом (А) у 6 детей (у 15,7%) еще отмечался сухой кашель, в отличие от основной группы, в которой данный симптом отсутствовал к этому времени у всех детей. Выявлено также, что на 10-й день лечения с включением Коделака Бронхо с чабрецом симптомы влажного кашля и степень продуцирования мокроты были минимальными, чем достоверно отличались от группы сравнения (р < 0,001). Следует отметить, что снижение интенсивности сухих хрипов на фоне применения Коделака Бронхо с чабрецом было более значимым, чем при терапии А (соответственно на 3-й день лечения: 0,03 ± 0,03 и 0,29 ± 0,09 балла; на 5-й день лечения: 0,0 ± 0,0 и 0,05 ± 0,04 балла; р < 0,001). У детей, получавших Коделак Бронхо с чабрецом, наблюдалось более быстрое купирование синдрома интоксикации в виде нормализации температуры тела, начиная с 3-го дня лечения (р < 0,05), что по мнению авторов связано с синергизмом в отношении противовоспалительных свойств входящих в состав Коделака Бронхо с чабрецом компонентов. После лечения КМ отмечена более выраженная положительная динамика показателей местного иммунитета в виде повышения уровня sIgA слюны (р = 0,01) (рис. 3).
При сравнительном анализе эффективности мукоактивных препаратов в зависимости от возраста выявлено, что максимальная клиническая эффективность, как при лечении КМ, так и А, была характерна для детей более старшего возраста (7–16 лет). В младшей возрастной группе Коделак Бронхо с чабрецом оказался более эффективным по сравнению с А, что подтверждалось более быстрым уменьшением сухого и влажного кашля (рис. 4), интенсивности продуцирования мокроты (p < 0,05). При исследовании в динамике состояния местной иммунологической защиты у большинства детей (у 45 из 67) всех возрастных групп отмечалось увеличение уровня sIgА слюны, более выраженное у пациентов 7–16 лет, получавших КМ (p < 0,05) (рис. 5).
При назначении мукоактивных препаратов важен динамический контроль за их эффективностью и учет разнообразных влияющих на нее факторов, в частности, воздействия табачного дыма. Табакокурение, особенно активное, является серьезным негативным фактором, отягощающим течение острых и хронических бронхолегочных заболеваний в детском возрасте [28]. Наши данные также свидетельствуют о том, что табачный дым усиливает продукцию мокроты, снижает уровень местной иммунологической защиты, что следует учитывать при подборе мукоактивной терапии [12]. При лечении Коделаком Бронхо с чабрецом нами выявлено более выраженное повышение sIgA слюны у детей, неподверженных пассивному курению (р = 0,02), в то же время уровень прироста данного показателя в обеих терапевтических группах достоверно не отличался (табл.). Кроме того, отмечено, что в обеих группах пациентов, подверженных пассивному курению, прирост sIgA слюны был минимальным (р > 0,05), но более существенным на фоне терапии комплексным муколитиком (р > 0,05).
| | |
| Рис. 3. Динамика уровня секреторного иммуноглобулина А слюны в зависимости от вида мукоактивной терапии. Достоверность различия показателей по критерию Вилкоксона: * p < 0,05 | Рис. 4. Динамика интенсивности влажного кашля у детей от 2 до 6 лет в зависимости от вида терапии. Достоверность различия показателей между группами детей, получавших разные виды лечения, по критерию Wald–Wolfowitz Runs Test: * p < 0,05 |
Выводы
- Коделак Бронхо с чабрецом высокоэффективен в качестве комбинированного мукоактивного средства у детей, способствует более быстрому переходу непродуктивного сухого кашля в продуктивный влажный, быстрому купированию сухих хрипов, особенно у пациентов дошкольного возраста.
- На фоне лечения этим препаратом эффективно повышается местная иммунологическая защита у детей школьного возраста, быстрее происходит купирование синдрома интоксикации.
- Пассивное табакокурение является серьезным негативным фактором в лечении детей с острой инфекцией нижних дыхательных путей, что проявляется снижением резервных возможностей иммунологической защиты, в отличие от неэкспонированных детей, однако на фоне комбинированной мукоактивной терапии отмечается существенный прирост секреторного иммуноглобулина А.
Полученные данные могут быть обусловлены наличием как синергизма компонентов, входящих в состав Коделак Бронхо с чабрецом, так и их дополнительными фармакологическими свойствами: чабрец (противовоспалительное, антибактериальное, спазмолитическое действие), натрия глицирризинат (противовоспалительные, противовирусные свойства), наряду с этим у всех составляющих препарата имеется антиоксидантная активность.
В заключение подчеркнем, что в целом назначение мукоактивной терапии должно опираться на знание фармакологических свойств препарата, быть дифференцированным и определяться: индивидуальными особенностями больного; видом, тяжестью и течением бронхолегочной патологии; возрастом ребенка; сочетанием поражения верхних и нижних дыхательных путей; характером и выраженностью кашля; качеством и количеством отделяемой мокроты; наличием неблагоприятных факторов внешней среды (пассивное табакокурение); необходимостью комплаенса с пациентом. В связи с этим современная мукоактивная терапия все чаще становится комплексной, воздействующей на различные патогенетические механизмы кашля, и все большей популярностью пользуются комбинированные средства, в частности Коделак Бронхо с чабрецом.
Литература
- Мизерницкий Ю. Л. Отхаркивающие и муколитические средства в терапии бронхолегочных заболеваний у детей / Руководство по фармакотерапии в педиатрии и детской хирургии (под общ. ред. А. Д. Царегородцева, В. А. Таболина). Т. 1. Фармакотерапия в педиатрической пульмонологии (под ред. С. Ю. Каганова). М.: Медпрактика-М, 2002. С. 123–140.
- Геппе Н. А., Снегоцкая М. Н., Никитенко А. А. Ацетилцистеин в лечении кашля у детей // Сonsilium Medicum. Педиатрия. 2007. № 2. С. 35–40.
- Каширская Н. Ю., Толстова В. Д., Капранов Н. И. Муковисцидоз — национальная приоритетная программа в Российской Федерации — 2008 // Педиатрия. 2008. 87 (4). С. 6–14.
- Duijvestijn Y. C., Mourdi N., Smucny J. et al. Acetylcysteine and carbocysteine for acute upper and lower respiratory tract infections in paediatric patients without chronic broncho-pulmonary disease // Cochrane Database Syst Rev. 2009, Jan 21; (1): CD003124.
- Косенко И. М. О рациональном выборе фармакотерапии при заболеваниях, сопровождающихся кашлем // Consilium Medicum. Педиатрия. 2010. № 3. С. 33–40.
- Волков И. К., Давыдова И. В., Куличихин В. Г., Лукина О. Ф. Новые возможности муколитической терапии при хронических и рецидивирующих заболеваниях легких у детей // Consilium Medicum. Пульмонология. 2006. 8 (1). http://www.consilium-medicum.com/pylmo/article/9559/.
- Зайцева О. В., Барденикова С. И., Зайцева С. В. и др. Современные аспекты патогенетической терапии кашля у детей // Лечащий Врач. 2010. № 2. http://www.lvrach.ru/2010/02/12158998/.
- Новиков Ю. К. Мукоцилиарный транспорт как основной механизм защиты легких // РМЖ. 2007. 15 (5). С. 357–360.
- Мельникова И. М., Мизерницкий Ю. Л., Батожаргалова Б. Ц., Логиневская Я. В. Современные принципы муколитической терапии у детей с острыми и хроническими бронхолегочными заболеваниями // Рос. вестник перинат. и педиатрии. 2011. Т. 56. № 2. С. 45–50.
- Богданова А. В. Эффективность препарата Флуифорт в лечении рецидивирующего и хронического бронхитов у детей / Пульмонология детского возраста: проблемы и решения. Вып. 5. М., 2005. С. 77–79.
- Maccio A., Madeddu C., Panzone F., Mantovani G. Carbocysteine: clinical experience and new perspectives in the treatment of chronic inflammatory diseases // Expert Opin Pharmacother. 2009; Mar 10 (4). Р. 693–703.
- Мизерницкий Ю. Л., Мельникова И. М., Батожаргалова Б. Ц. и др. Муколитическая терапия при заболеваниях нижних дыхательных путей // Врач. 2009. № 12. С. 78–82.
- Зыков К. А. Перспективы применения амброксола в пульмонологии // Consilium Medicum. Справочник поликлинического врача 2009. № 3. http://www.consilium–medicum.com/handbook/article/18284/.
- Beeh K. M., Beier J., Esperester A., Paul L. D. Antiinflammatory properties of ambroxol // Eur J Med Res. 2008, Dec 3; 13 (12). Р. 557–562.
- Kido H., Okumura Y., Yamada H. et al. Secretory leukoprotease inhibitor and pulmonary surfactant serve as principal defenses against influenza A virus infection in the airway and chemical agents up-regulating their levels may have therapeutic potential // Biol Chem. 2004, Nov; 385 (11). Р. 1029–1034.
- Gibbs B. F. Differential modulation of IgE-dependent activation of human basophils by ambroxol and related secretolytic analogues // Int J Immunopathol Pharmacol. 2009, Oct-Dec; 22 (4). Р. 919–927.
- Клячкина И. Л. Муколитик амброксол в программе лечения заболеваний нижних дыхательных путей // Consilium Medicum. Справочник поликлинического врача. 2010. № 10. http://www.consilium-medicum.com/handbook/article/20320.
- Зайцев А. А., Синопальников А. И. Рациональная фармакотерапия острых респираторных вирусных инфекций // Consilium Medicum. 2008. № 10. С. 80–86.
- Мизерницкий Ю. Л., Мельникова И. М., Батожаргалова Б. Ц., Логиневская Я. В. Современная мукоактивная терапия у детей с острыми и хроническими бронхолегочными заболеваниями // РМЖ. Мать и дитя. Педиатрия. 2011. Т. 19. № 3. С. 150–155.
- Michaelis M., Geiler J., Naczk P. et al. Glycyrrhizin inhibits highly pathogenic H5N1 influenza A virus-induced pro-inflammatory cytokine and chemokine expression in human macrophages // Med Microbiol Immunol. 2010, Nov; 199 (4). Р. 291–297.
- Nishimoto Y., Hisatsune A., Katsuki H. et al. Glycyrrhizin attenuates mucus production by inhibition of MUC5 AC mRNA expression in vivo and in vitro // J Pharmacol Sci. 2010, 113, 76–83.
- Cheel J., Onofre G., Vokurkova D. et al. Licorice infusion: Chemical profile and effects on the activation and the cell cycle progression of human lymphocytes // Pharmacogn Mag. 2010, Jan; 6 (21). Р. 26–33.
- Akamatsu H., Komura J., Asada Y., Niwa Y. Mechanism of anti-inflammatory action of glycyrrhizin: effect on neutrophil functions including reactive oxygen species generation // Planta Med. 1991, Apr; 57 (2). Р. 119–121.
- Li X. L., Zhou A. G., Zhang L., Chen W. J. Antioxidant status and immune activity of glycyrrhizin in allergic rhinitis mice // Int J Mol Sci. 2011, Jan 26; 12 (2). Р. 905–916.
- Wienkotter N., Begrow F., Kinzinger U. et al. The effect of thyme extract on beta2-receptors and mucociliary clearance // Planta Med. 2007, Jun; 73 (7). Р. 629–635.
- Braga P. C., Dal Sasso M., Culici M. et al. Antioxidant potential of thymol determined by chemiluminescence inhibition in human neutrophils and cell-free systems // Pharmacology. 2006; 76 (2). Р. 61–68.
- Fabio A., Cermelli C., Fabio G. et al. Screening of the antibacterial effects of a variety of essential oils on microorganisms responsible for respiratory infections // Phytother Res. 2007, Apr; 21 (4). Р. 374–377.
- Dove M. S., Dockery D. W., Connolly G. N. Smoke-free air laws and asthma prevalence, symptoms, and severity among nonsmoking youth // Pediatrics. 2011, Jan; 127 (1). Р. 102–109.
Ю. Л. Мизерницкий*, доктор медицинских наук, профессор
И. М. Мельникова**, доктор медицинских наук, доцент
Я. В. Логиневская***
Б. Ц. Батожаргалова****, кандидат медицинских наук
Л. А. Козлова*****
* НИИ педиатрии и детской хирургии, *** Городская поликлиника №208, Москва
**ЯрГМА, ***** Клиническая больница №8, Ярославль
**** Детская поликлиника №2, Чита
Контактная информация об авторах для переписки: yulmiz@mail.ru
Купить номер с этой статьей в pdf