Спонтанный пневмоторакс (СП) — состояние, возникающее в результате скопления воздуха в плевральной полости вследствие возникновения патологического сообщения плевральной полости с воздухоносными путями, не связанное с травмами или лечебными воздействиями [1]. По мнению большинства авторов, непосредственной причиной СП является буллезная эмфизема с прогрессирующим истончением стенок и разрывом субплеврально расположенных эмфизематозных булл и субплевральных пузырей [3, 6, 9].
В современной литературе исследователи рассматривают буллезную эмфизему легких и СП как одно из многочисленных проявлений прогредиентного системного процесса, обусловленного наследственным поражением соединительной ткани. Не вызывает сомнения и отражена в соответствующих диагностических алгоритмах высокая вероятность развития буллезной эмфиземы и спонтанного пневмоторакса при относительно редко встречающихся генетических синдромах, например, синдроме Марфана и Элерса–Данло [10]. Однако гораздо большее практическое значение имеет высокий риск возникновения СП при недифференцированных формах дисплазии соединительной ткани (ДСТ), признаки которой широко распространены в популяции и являются предметом изучения специалистов самого разного профиля.
В работах, посвященных ДСТ, есть сообщения о высокой частоте встречаемости случаев спонтанного пневмоторакса у лиц молодого возраста. Так, в наблюдениях Г. И. Нечаевой у пациентов в возрасте 18–35 лет с признаками ДСТ распространенность спонтанного пневмоторакса составила около 10% [7], С. М. Гавалов и В. В. Зеленская, наблюдая детей с бронхиальной астмой на фоне ДСТ, зарегистрировали развитие СП у 5% пациентов, причем в половине случаев осложнение не было связано с тяжелым приступом удушья [4]. Г. П. Василенко и Г. Н. Верещагина использовали термин «диспластическое легкое», основным проявлением которого считали спонтанный пневмоторакс, причем отмечали склонность к рецидивирующему течению и большой вероятности послеоперационных осложнений [2]. Имеются данные, подтверждающие значение генетически обусловленной «слабости» соединительной ткани в развитии буллезной эмфиземы. Так, В. И. Нечаев указывает, что генетические маркеры ДСТ среди больных с буллезной эмфиземой встречаются в 8,9 раз чаще, чем среди практически здоровых лиц [5]. По нашим данным среди пациентов с первичным СП признаки ДСТ диагностируются в 75% случаев. Доминирующими являются признаки, связанные с нарушениями формообразования костного скелета, которые характеризуются как костно-суставной синдром. Почти 70% пациентов имеют астенический тип конституции, более чем в половине случаев диагностируются нарушения осанки за сч��т деформации позвоночника, у трети пациентов наблюдаются различные варианты деформации грудной клетки, а также гипотония и гипотрофия мышц [8].
Задачи по восстановительному лечению пациентов с ДСТ после перенесенного первичного СП и профилактике прогрессирования буллезных изменений в легких не могут быть решены в полной мере, если во внимание не будет принято наличие других проявлений системного диспластического процесса, требующих индивидуального дифференцированного подхода.
Пациентам с ДСТ после перенесенного эпизода первичного СП проводится программа реабилитации, рассчитанная на два 12?недельных курса при посещении занятий 3 раза в неделю. Комплексное восстановительное лечение включает образовательные программы, дозированные физические нагрузки, респираторную гимнастику, рациональную психотерапию. Для коррекции вегетативной дисфункции, стабилизации синтеза коллагена и других компонентов соединительной ткани, стимуляции метаболических и коррекции биоэнергетических процессов пациентам с ДСТ проводится метаболическая терапия по следующим направлениям: стимуляция коллагенообразования (аскорбиновая кислота, витамины группы В, препараты меди, цинка, магния, кальция, антигипоксанты); коррекция нарушений синтеза и катаболизма гликозаминогликанов (хондроитинсульфат (Хондроксид), глюкозамина сульфат (ДОНА)), стабилизация минерального обмена (витамин D2 и его активные формы, препараты кальция); коррекция уровня свободных аминокислот крови (метионин, глутаминовая кислота, глицина); улучшение биоэнергетического состояния организма (Рибоксин, Милдронат и Мексидол).
Назначение препаратов магния у пациентов с буллезной эмфиземой легких на фоне признаков ДСТ имеет важное значение для достижения сбалансированной активности коллагеназ и эластаз, а также биосинтетических ферментов глюкозаминогликанов с целью уменьшения прогрессирования буллезных изменений в легких.
Магнерот® — препарат магния. Действующее вещество магния оротат. В состав препарата входит оротовая кислота, которая способствует росту клеток, участвует в процессе обмена веществ. Оротовая кислота (которую называют также витамином В13), помимо участия в обмене магния, обладает собственной метаболической активностью: соединение является одним из метаболических предшественников пиримидиновых нуклеотидов, что необходимо для нормального хода анаболических процессов. Магнерот® назначается пациентам по 2 таблетки 3 раза/сутки в течение 7 дней, затем — по 1 таблетке 2–3 раза/сутки ежедневно. Продолжительность курса лечения — не менее 4–6 недель.
Для оценки эффективности восстановительного лечения с использованием препарата Магнерот® проведено проспективное сравнительное исследование, в которое включено 45 пациентов с ДСТ после перенесенного эпизода первичного СП (39 мужчин и 6 женщин, средний возраст 22 (19–26) года). В качестве группы сравнения были привлечены результаты обследования 34 пациентов с буллезной эмфиземой и ДСТ после эпизода СП, по каким-либо причинам отказавшихся от реабилитационных мероприятий. Основная группа и группа сравнения были сопоставимы по полу, возрасту и характеру хирургического пособия.
У пациентов с ДСТ после перенесенного первичного СП, которые прошли комплексную программу реабилитации, реже наблюдались жалобы на ограничение физической активности и значительно уменьшилась одышка по шкале MRS (табл. 1).
Как следует из табл. 2, у пациентов основной группы после восстановительного лечения значительно увеличились скоростные и объемные показатели функции внешнего дыхания (жизненная емкость легких (ЖЕЛ), объем форсированного выдоха за первую секунду (ОФВ1), отношение ОФВ1 к форсированной ЖЕЛ (ОФВ1/ФЖЕЛ), мгновенная объемная скорость после выдоха 50% ФЖЕЛ (МОС50%) и средняя объемная скорость середины выдоха (СОС25–75%)) и статистически значимо превышали аналогичные показатели контрольной группы.
У пациентов после прохождения восстановительного лечения статистически значимо увеличились показатели силы дыхательных мышц по сравнению с группой сравнения (табл. 3).
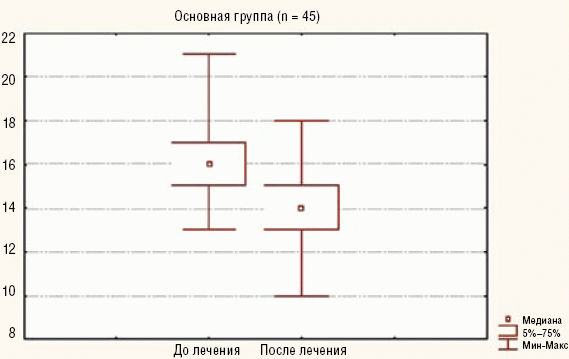
Как видно из рис. 1, после курса реабилитации улучшились показатели гемодинамики малого круга кровообращения: уменьшилось систолическое давление в легочной артерии (СДЛА) в основной группе (Z = 5,54; р < 0,05). У пациентов, которые не участвовали в программе реабилитации, СДЛА достоверно не изменилось (Z = 1,153; р = 0,249). При сравнении СДЛА в основной группе после лечения и в группе сравнения разница статистически достоверная (U = 380; р < 0,05).
У пациентов, которые прошли комплексную программу реабилитации, не произошло прогрессирование буллезных изменений в легких по данным компьютерной томографии (КТ) органов грудной клетки. В группе сравнения увеличилось количество пациентов с двусторонней локализацией буллезной эмфиземы легких с 55,9% до 73,5%, также увеличились размеры булл. В основной группе снизилось число пациентов с участками фиброза по данным КТ органов грудной клетки, в группе сравнения количество таких пациентов увеличилось с 41,2% до 50%.
| |
| Рис. 2. Сравнительная характеристика качества жизни в исследуемых группах |
Как следует из рис. 2, у пациентов после перенесенного спонтанного пневмоторакса снижен уровень качества жизни по всем показателям опросника SF-36. После прохождения программы реабилитации степень выраженности жалоб у пациентов меньше выражена по сравнению с теми, кто отказался от участия в программе.
Основным показателем, позволяющим оценить эффективность программы реабилитации, являлся риск возникновения рецидивов в течение года наблюдения в сопоставимых по методам хирургического лечения группах больных (рис. 3).
| |
| Рис. 3. Частота рецидивов первичного спонтанного пневмоторакса в исследуемых группах |
В основной группе за год наблюдения произошло два рецидива первичного СП, в группе сравнения семь рецидивов, разница между основной группой и группой сравнения по общему числу рецидивов была статистически достоверной (р = 0,034).
У пациентов основной группы и группы сравнения не произошло ни одного рецидива пневмоторакса на стороне, где было проведено радикальное хирургическое лечение. Однако у пациентов, которые не участвовали в программе, было два эпизода спонтанного пневмоторакса на контрлатеральной стороне. У пациентов, которым не проводилось хирургическое лечение, в основной группе произошло два рецидива пневмоторакса на той же стороне, а в группе сравнения у четырех пациентов был рецидив спонтанного пневмоторакса на той же стороне и у одного пациента рецидив на противоположной стороне.
Таким образом, сочетание физической реабилитации, психокоррекционных методов восстановления, физиотерапии и метаболической терапии дает отчетливое улучшение клинического, вегетативного и психологического состояния. Повышение уровня толерантности к физическим нагрузкам при создании новых, экономически более выгодных условий деятельности сердца и системы дыхания у пациентов с ДСТ находит закономерное отражение в положительной динамике клинических показателей, уменьшении прогрессирования буллезных изменений в легких и снижении количества рецидивов у пациентов с первичным спонтанным пневмотораксом.
Литература
- Авдеев С. Н. Пневмоторакс // Consillium medicum. 2005. № 10, том 7. С. 874–882.
- Василенко Г. П., Верещагина Г. Н., Долганова Д. Н. Спонтанный пневмоторакс как проявление диспластического легкого // Сибирский консилиум. 2000. № 1 (11). С. 33–36.
- Высоцкий А. Г. Буллезная эмфизема легких. Донецк: «Схiдний видавничий дiм, 2007. 277 с.
- Гавалов С. М., Зеленская В. В. Особенности клинических проявлений и течения различных форм бронхолегочной патологии у детей с малыми формами дисплазии соединительной ткани // Педиатрия. 1999. № 1. С. 49–52.
- Нечаев В. И., Хованов А. В., Крылов В. В. Современный взгляд на проблему спонтанного пневмоторакса // Проблемы туберкулеза. 2002. № 4. С. 50–53.
- Филатова А. С., Гринберг Л. М. Эмфизема и воздушные кисты легких // Пульмонология. 2008. № 5. С. 80–86.
- Яковлев В. М., Нечаева Г. И. Кардиореспираторные синдромы при дисплазии соединительной ткани. Омск, 1994. 215 с.
- Vershinina M. V., Govorova S. E., Netchaeva G. I. Spontaneous pneumothorax and Marfanoid phenotype // Eur. Resp. J. European Respiratory Journal. Abstracts 21 st Annual Congress. Amsterdam, The Netherlands 24–28 September. 2011. P. 2431.
- Kolekar S., Sandaram P. Bullous lungs: diverse aetiology // Postgrad Med J. 2002. Vol. 78. P. 689–692.
- Rigante D., Segni G., Bush A. Persistent spontaneous pneumothorax in an adolescent with Marfan’s syndrome and pulmonary bullous dysplasia // Respiration. 2001. Vol. 68, № 6. P. 621–624.
М. В. Вершинина*, кандидат медицинских наук, доцент
С. Е. Говорова*, доктор медицинских наук, профессор
Г. И. Нечаева*, доктор медицинских наук, профессор
И. А. Ратынская**
*ОмГМА, **ФГУ «Западно-Сибирский медицинский центр ФМБА России», Омск
Контактная информация об авторах для переписки: Mver@yandex.ru
Купить номер с этой статьей в pdf