Коринн Джоффре (Corinne Joffre)1,* , Анн-Лора Динель (Anne-Laure Dinel)2, Матильда Шатенье (Mathilde Chataigner)1,3, Вероника Палле (Véronique Pallet)1 и Софи Лейе (Sophie Layé)1
1 Университет Бордо, INRAE, Bordeaux INP, NutriNeuro, 146 rue Léo Saignat, 33076 Бордо, Франция
2 NutriBrain Research and Technology Transfer, NutriNeuro, 146 rue Léo Saignat, 33076 Бордо, Франция
3 Abyss Ingredients, 56850 Кодан, Франция
*Автор, ответственный за корреспонденцию.
Nutrients 2020, 12(3), 647; https://doi.org/10.3390/nu12030647
Получено: 27 января 2020 г. / Пересмотрено: 25 февраля 2020 г. / Принято: 26 февраля 2020 г. / Опубликовано: 28 февраля 2020 г.
Оригинал статьи распространяется по лицензии CC BY 4.0
Перевод статьи: ©2023 ООО «Издательство «Открытые системы», распространяется по лицензии CC BY-NC-ND 4.0
(Эта статья включена в специальный выпуск «Пищевые жиры и здоровье человека»)
Реферат
Старение сопровождается ухудшением когнитивных функций, что может привести к снижению качества жизни, личным страданиям и, в конечном счете, нейродегенеративным заболеваниям. Нейровоспаление является одним из механизмов, объясняющих нарушение когнитивных функций. Старение сопровождается активацией воспалительных сигнальных путей, которые могут воздействовать на специфические питательные вещества с противовоспалительным действием. Пищевые омега-3 полиненасыщенные жирные кислоты (ПНЖК) представляют особый интерес, поскольку они присутствуют в головном мозге, обладают иммуномодулирующими свойствами и являются предшественниками липидных производных, называемых специализированными про-разрешающими медиаторами (СПМ). СПМ играют решающую роль в разрешении воспаления, которое протекает иначе во время старения и приводит к хроническому воспалению. В этом обзоре рассматривается влияние старения на нейровоспаление и потенциальное благотворное влияние омега-3 ПНЖК как предшественников биологически активных производных соединений на разрешение воспаления, особенно во время старения, а также роль омега-3 ПНЖК в процессах старения.
Ключевые слова: старение; снижение когнитивных функций; омега-3 полиненасыщенные жирные кислоты; специализированные про-решающие медиаторы; разрешение воспаления; нейровоспаление
Введение
Старение является проблемой мирового масштаба, поскольку доля пожилого население увеличилась за прошлый век втрое с 4 % до 13 % и, как ожидается, резко возрастет и достигнет 20 % населения в 2025 году и 33 % в 2050 году [1]. Старение сопровождается снижением когнитивных функций у 15–20 % пожилых людей старше 65 лет [2,3,4]. Эти когнитивные изменения могут привести к возрастной патологии, такой как нейродегенеративные заболевания. Самой распространенной из них является болезнь Альцгеймера, которой страдают 24 миллиона человек по всему миру [5]. Таким образом, обеспечение здорового старения представляет собой трудную задачу для реальной экономики всего мира в XXI веке. Механизмы, объясняющие этот процесс, до сих пор не полностью изучены, однако, по-видимому, значительную роль играет нейровоспаление. Следовательно, целесообразна разработка и применение стратегий, направленных на быстрое уменьшение и устранение нейровоспаления. Недавние исследования показывают, что некоторые продукты питания, в частности, рыбий жир, обладают перспективным противовоспалительным эффектом. Рыбий жир содержит омега-3 длинноцепочечные полиненасыщенные жирные кислоты (ДЦ-ПНЖК), представляющие собой предшественников биоактивных липидов, называемых специализированными про-разрешающими медиаторами (СПМ), которые в значительной степени способствуют реализации данного полезного эффекта. В данном обзоре мы рассмотрим влияние старения на нейровоспаление, в частности активность микроглии и снижение когнитивных функций, и то, как омега-3 ДЦ-ПНЖК и их производные влияют на нейровоспаление, особенно в процессе старения. Также обсуждается ключевая роль питания как фактора окружающей среды, которому люди подвергаются на протяжении всей жизни, в предотвращении или отсрочке развития нейровоспаления в ходе старения.
Старение и нейровоспаление
Старение мозга сопровождается хроническим низкоактивным воспалением в центральной нервной системе (ЦНС) [6]. Клетки микроглии являются резидентными клетками в ЦНС, опосредующими врожденный иммунитет, и участвуют в различных физиологических и патофизиологических процессах [7, 8]. Эти клетки инициируют иммунный ответ при распознавании молекулярных паттернов, ассоциированных с повреждением (damage-associated molecular patterns — DAMP) и патоген-ассоциированных молекулярных паттернов (pathogen-associated molecular patterns — PAMP), благодаря различным рецепторам распознавания паттернов (pattern recognition receptor — PRR), включая толл-подобные рецепторы (toll-like receptor — TLR) и рецепторы, подобные нуклеотидным доменам олигомеризации (nucleotide oligomerization domain — NOD) [9]. Данные клетки строго регулируются сигналами из ЦНС [10], и с возрастом меняется их морфология, снижается степень разветвления и подвижность у человека, нечеловекообразных приматов и грызунов, а затем эти клетки стареют [11,12,13,14,15,16,17,18]. Стареющая микроглия предрасположена к развитию воспаления, характеризуется как фоновой повышенной продукцией воспалительных маркеров, так и в ответ на иммунный стимул, а также сниженной способностью возвращаться к гомеостазу [19,20,21]. Кроме того, стареющая микроглия не разрушает миелиновые фрагменты, в результате чего накапливаются гранулы липофусцина — маркеры старения микроглии [22,23,24]. Таким образом, в процессе старения изменяются функции микроглии, что приводит к усилению иммунных возрастных реакций, стимулирующих развитие когнитивного дефицита, нарушения синаптической пластичности и прогрессирование нейродегенеративных заболеваний [25,26]. Эти изменения в основном являются результатом обусловленных старением дефектных механизмов, провоцирующих воспалительную реакцию [21,27].
В процессе старения в крови и головном мозге наблюдается повышение базового уровня провоспалительных цитокинов, включая фактор некроза опухоли α (ФНО-α), интерлейкин-6 (ИЛ-6), интерлейкин-1β (ИЛ-1β) и интерлейкин-18 (ИЛ-18), и снижение уровня противовоспалительных факторов, таких как интерлейкин-10 (ИЛ-10), интерлейкин-4 (ИЛ-4) или нейротрофический фактор головного мозга (НФГМ) [28,29]. По сравнению с молодыми мышами у пожилых особей отмечается более высокая экспрессия ИЛ-6 в гиппокампе, коре и мозжечке [30,31] и более низкая экспрессия ИЛ-10 [32]. В стареющих клетках микроглии наблюдается постоянная продукция ядерного фактора-каппа B (NFκB), фактора транскрипции, участвующего в активации воспалительных путей, что приводит к увеличению выработки ИЛ-6 [33]. Стареющие клетки микроглии грызунов продуцируют больше ИЛ-1β и ИЛ-6, чем молодые [22,34,35,36]. Более того, уровень ИЛ-6 в сыворотке крови у пожилых людей был взаимосвязан с частотой дефицита подвижности и скоростью ходьбы [37,38,39]. Уровни некоторых маркеров активации микроглии также повышены при старении: главный комплекс гистосовместимости II (ГКГС-II) [40,41], CD68 [42,43], каспаза-1, а также CD11b [44]. Действительно, у пожилых людей без неврологической патологии экспрессия ГКГС-II связана с повышенной экспрессией ИЛ-1β в головном мозге [45]. Точно так же исследования ex vivo и in situ показали, что по сравнению с клетками более молодых животных в микроглиальных клетках старых крыс и мышей отмечается более высокая экспрессия ГКГС-II, CD11b и CD68 — всех маркеров активации микроглиальных клеток [42,43]. Количество клеток микроглии, экспрессирующих ГКГС-II, также увеличивается с возрастом у нечеловекообразных приматов [15] и у крыс [18]. В гиппокампе количество клеток микроглии увеличивается на 20 % у пожилых мышей по сравнению с молодыми особями [46].
Потеря гомеостатических функций микроглии является ключевым признаком нездорового старения головного мозга и нейродегенеративных нарушений [47]. Интересно, что недавние исследования с использованием одноклеточного картирования высокого разрешения или одноклеточного секвенирования РНК показали, что молекулярные сигнатуры микроглии изменяются с возрастом под действием некоторых сходных генов у грызунов и людей [48,49,50]. Идентификация стареющих подтипов микроглии позволяет выявлять специфические маркеры, связанные с нездоровым старением. Последние данные указывают на то, что мутации в инициирующем рецепторе, экспрессируемом на миелоидных клетках 2 (Trem2) и рецепторе колониестимулирующего фактора 1 (Csf1r) в микроглии, приводят к развитию нейродегенеративных заболеваний, что дополнительно указывает на ведущую роль микроглии в здоровом старении. У пожилых людей обнаружение растворимой формы Trem2 в спинномозговой жидкости сопровождалось замедленным снижением когнитивных функций [51].
Увеличение выработки цитокинов в крови и головном мозге было связано с возрастным снижением когнитивных функций. Уровни ИЛ-6 в плазме крови пожилых людей положительно коррелируют со снижением когнитивных функций, в частности со снижением скорости обработки информации [52,53,54]. Это согласуется с тем фактом, что мыши с дефицитом ИЛ-6 защищены от возрастного снижения когнитивных функций после введения бактериального эндотоксина в отличие от мышей дикого типа [55,56]. У этих мышей также наблюдаются меньшие уровни провоспалительных цитокинов в гиппокампе. Более того, у пожилых грызунов именно ИЛ-1β в гиппокампе связан с нарушением обучения и памяти [57,58,59,60]. Фармакологическое ингибирование ИЛ-1β, а также его превращающего фермента (ICE), который имеет важное значение для высвобождения ИЛ-1β, позволило уменьшить нарушения памяти, вызванные инфекцией или стрессом у пожилых мышей [61,62], и улучшило физический статус пожилых крыс [63]. Другие исследования показали повышенную экспрессию NOD-подобного рецепторного белка 3 (NLRP3) в гиппокампе возрастных мышей, который регулирует активацию каспазы-1 и, таким образом, созревание и секрецию ИЛ-1β и ИЛ-18 [64,65,66]. Эта активация DAMP NLRP3, а также выработка активных форм кислорода (АФК) были связаны с возрастным снижением когнитивных функций и патологическими изменениями тканей нервной системы [67,68,69].
Все эти исследования показывают, что воспаление во время старения, характеризующееся активацией микроглии и выработкой провоспалительных цитокинов, частично отвечает за возрастное снижение когнитивных функций. Следовательно, уменьшение этого низкоактивного воспаления представляет собой перспективную стратегию предотвращения возрастного снижения когнитивных функций и развития нейродегенеративных заболеваний.
Омега-3 ПНЖК в качестве предшественников липидных медиаторов, участвующих в разрешении воспаления
В головном мозге основной омега-3 ДЦ-ПНЖК является докозагексаеновая кислота (ДГК), которая составляет 12–14 % от общего содержания жирных кислот в головном мозге [70,71,72,73,74,75] и выполняет ключевые регуляторные функции при воспалении. Эйкозапентаеновая кислота (ЭПК) — еще одна омега-3 ДЦ-ПНЖК, имеющая большое значение, несмотря на ее низкий уровень в головном мозге вследствие бета-окисления [76]. Она является предшественником многих биологически активных производных соединений. Омега-3 ДЦ-ПНЖК могут быть синтезированы из предшественника омега-3 ПНЖК альфа-линоленовой кислоты (АЛК), но скорость конверсии у человека очень низкая [77,78] и снижается с возрастом [79,80]. Поэтому рекомендуется употреблять рыбу, которая является основным источником омега-3 ДЦ-ПНЖК [80]. Отсутствие в рационе омега-3 ДЦ-ПНЖК и/или дефект метаболизма данных соединений приводят к усилению нейровоспаления и, как следствие, к неврологическим нарушениям [81]. В многочисленных обзорах описан мощный противовоспалительный эффект омега-3 ДЦ-ПНЖК [82,83,84,85,86].
Предложено несколько механизмов для объяснения иммуномодулирующих свойств омега-3 ДЦ-ПНЖК. Одним из наиболее правдоподобных является синтез биоактивных липидных медиаторов или оксилипинов. Оксилипины синтезируются последовательно: сначала участвующие в регуляции воспаления, такие как эйкозаноиды (простагландины, лейкотриены, тромбоксан), а затем участвующие в разрешении воспаления, называемые СПМ (резольвины, протектины, марезины). СПМ обладают противовоспалительными свойствами, способствуют разрешению воспаления без иммуносупрессии, индуцируют гомеостаз [87,88,89,90], а также активно координируют и осуществляют тонкую регуляцию воспалительной реакции. Они снижают продукцию провоспалительных цитокинов и стимулируют выработку противовоспалительных цитокинов, способствуют фагоцитозу клеточных остатков и погибших клеток, не вызывая иммуносупрессии, конкурируют с провоспалительными оксилипинами, образующимися из омега-6 ПНЖК, а также снижают их концентрацию. Кроме того, они опосредуют большинство положительных эффектов, приписываемых их предшественникам [84,91,92,93]. В их синтезе принимают участие несколько ферментов: фосфолипазы A2 (ФЛA2), высвобождающие жирные кислоты из мембран, а также циклооксигеназы (ЦОГ)-2, липоксигеназы (ЛОГ) и монооксигеназы семейства цитохрома P450 (CYP450) [94]. Они превращают ДГК и ЭПК в биоактивные липидные медиаторы. В сыворотке крови человека производные ДГК и ЭПК составляют 30,7 % и 25,9 % идентифицированных СПМ соответственно [95,96]. Упомянутые выше ферменты экспрессируются в головном мозге [97,98,99,100]. После воспалительного стимула, такого как липополисахарид (ЛПС), быстро запускается экспрессия ЦОГ-2 в гиппокампе [100,101]. Показано, что ингибирование ЦОГ-2 замедляет разрешение острого воспаления [102]. 15-ЛОГ и 5-ЛОГ являются наиболее широко представленными ЛОГ в головном мозге [97]. 15-ЛОГ оказывает нейротоксичные эффекты из-за запускаемого ею окислительного стресса [103], но также обладает и нейропротекторными свойствами за счет синтеза СПМ [104,105]. Установлено, что снижение активности 15-ЛОГ (вследствие делеции гена или фармакологического ингибирования) уменьшает выработку СПМ в головном мозге и сопровождается развитием когнитивных изменений [97]. CYP450 участвует в реакциях синтеза противовоспалительных эпоксидов из омега-6 ПНЖК [106,107,108,109]. Эти ферменты также были идентифицированы в клетках головного мозга, таких как микроглия, астроциты, олигодендроциты и нейроны [110,111,112,113].
СПМ, образующиеся из ДГК
Из ДГК могут синтезироваться различные СПМ (рисунок 1): моногидрокси-ДГК (17-ГДГК) с участием ацетилированной ЦОГ-2, CYP450 и 15-ЛОГ [114,115] и резольвин D1 (RvD1) путем синтеза 17-HДГК, опосредованного 5-ЛОГ [116,117]. Эти биологически активные производные в основном присутствуют в периферических тканях, но также были обнаружены в головном мозге. Уровень RvD1 измеряли в головном мозге мыши после церебральной ишемии [118]. Его уровень модулируется при внутривенном введении ДГК [119] и во время воспаления: сначала он снижается, а затем увеличивается в фазе разрешения [120]. RvD1 действует в пикомолярном диапазоне концентраций, но биологические эффекты реализуются в наномолярном диапазоне [117,121]. Рецептор RvD1 представляет собой рецептор липоксина A4/формилпептидный рецептор 2 (ALX/FPR2) у грызунов и сцепленный с G-белком рецептор 32 (GPR32) у человека [116]. ALX/FPR2 экспрессируется в нескольких структурах: ствол головного мозга, спинной мозг, гипоталамус, кора головного мозга, гиппокамп, мозжечок и полосатое тело [122]. На клеточном уровне эти рецепторы экспрессируются в клетках микроглии [123], нейронах [122,124] и астроцитах [125,126]. Посредством этих рецепторов RvD1 регулирует микроРНК, которая играет ключевую роль в модуляции экспрессии генов-мишеней, таких как воспалительные гены [123,125,127,128,129].
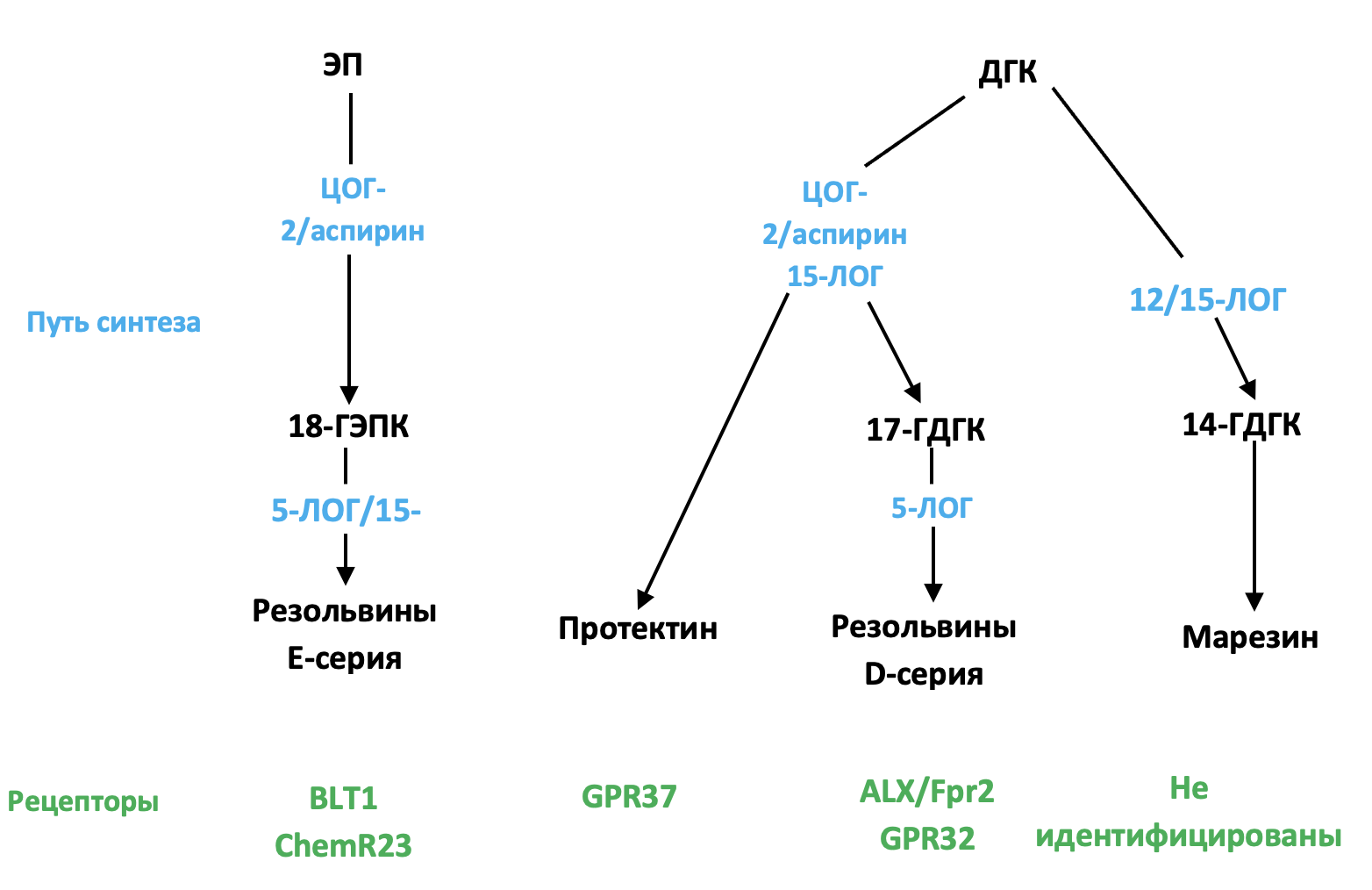
Рисунок 1. Путь синтеза и рецепторы специализированных про-разрешающих медиаторов (СПМ). ЭПК — эйкозапентаеновая кислота; ДГК — докозагексаеновая кислота; ЛОГ — липоксигеназа; ЦОГ — циклооксигеназа; ALX/Fpr2 — рецептор липоксина A4/формилпептидный рецептор 2; GPR32 — сцепленный с G-белком рецептор 32; BLT1 — рецептор лейкотриена B4; ГДГК — моногидрокси-ДГК; CYP450 — моноксигеназы семейства цитохрома P450
Другие СПМ образуются из ДГК: дигидрокси-ДГК, называемый протектином D1 (PD1) или нейропротектином D1 (NPD1) образуется в ЦНС с участием 5-ЛОГ и 15-ЛОГ [130,131,132,133], а также марезин 1-2 (MaR1-2), синтезируемый 12/15-ЛОГ [114,115,134]. Уровни NPD1, MaR1 и его предшественника 14-ГДГК определены в гиппокампе [135]. Уровни NPD1 и MaR1 в гиппокампе снижаются у пациентов с болезнью Альцгеймера [136,137], а уровень NPD1 значительно увеличивается после ишемии головного мозга или инъекции ЛПС в ЦНС [118,135]. Рецептор NPD1 идентифицирован только в макрофагах периферических тканей, но не в микроглии [138], тогда как рецептор MaR1 еще не идентифицирован [136]. NPD1 регулирует экспрессию NFκB и, следовательно, экспрессию провоспалительных генов [118,139,140]. MaR1 уменьшает провоспалительные сигнальные каскады и меняет фенотип макрофагов в направлении фенотипа восстановления M2 после ишемии головного мозга или повреждения спинного мозга [141,142,143].
СПМ, образующиеся из ЭПК
ЭПК под действием ацетилированной ЦОГ-2 или CYP450 превращается в 18R-гидроксиэйкозапентаеновую кислоту (18R-ГЭПК), которая затем преобразуется в резольвины E1, E2 и E3 с участием 5-ЛОГ или 15-ЛОГ (рисунок 1) [114,144,145]. Эти производные обнаруживаются в гиппокампе [135,146,147]. RvE1 снижает экспрессию генов индуцируемых ЛПС провоспалительных цитокинов (ФНО-α, ИЛ-6, ИЛ-1β) в клетках микроглии путем ингибирования сигнального пути NFκB [123]. Рецепторы RvE1 включают сцепленный с G-белком рецептор ChemR23 или хемокиноподобный рецептор 1 (CMKLR1) [144] и рецептор лейкотриена B4 (BLT1) [148]. ChemR23 обнаруживается в префронтальной коре, гиппокампе и стволе мозга [149]. Эти рецепторы также экспрессируются в клетках микроглии [123,150], нейронах [122,124] и астроцитах [126].
Роль липидных медиаторов в разрешении воспаления
Большое количество исследований подтверждает позитивную роль омега-3 ДЦ-ПНЖК в воспалении на моделях острого и хронического воспаления у человека и животных, в том числе в головном мозге (последние обзоры см. в [82,83]). Здесь мы рассмотрим биологические роли на уровне головного мозга двух различных липидных медиаторов, RvD1 и RvE1, образующихся из омега-3 ДЦ-ПНЖК ДГК и ЭПК, известных своими мощными противовоспалительными свойствами и способностью индуцировать разрешение воспаления.
Исследования у человека
Эффекты RvD1 в основном изучали у пациентов с болезнью Альцгеймера и Паркинсона (таблица 1). У пациентов с деменцией уровни RvD1 в спинномозговой жидкости положительно коррелируют с улучшением когнитивных функций [126]. RvD1 способствует фагоцитозу Aβ макрофагами, выделенными у пациентов с болезнью Альцгеймера, снижая амилоидную нагрузку [151,152]. Кроме того, Krashia и соавт. описали снижение уровня эндогенного RvD1 у пациентов с ранней болезнью Паркинсона [153]. Снижение уровня RvD1 в головном мозге при болезни Альцгеймера и Паркинсона может способствовать развитию и прогрессированию заболевания. И наоборот, описана повышенная противовоспалительная активность RvD1 у пациентов с манией и депрессией, что позволяет предположить, что RvD1 может способствовать купированию воспалительного дисбаланса [154].
Таблица 1. Роль липидных медиаторов в разрешении воспаления у человека.
| Ссылка | Авторы | Год | Пациенты / объект исследования | Дополнение | Основные выводы |
| 126 | Wang и соавт. | 2015 | Пациенты с БА, ЛКН и СКН; 57–68 лет | - | Уровни RvD1 в СМЖ коррелируют с показателями MMSE |
| 151 | Famenini и соавт. | 2017 | ЛКН, СКН с генотипом E3/E3 или E3/E4 | 1000 мг ДГК + 1000 мг ЭПК/сут в течение 35 месяцев | RvD1 снижает соотношение M1/M2 у пациентов с генотипом ApoE E3/E3, улучшая фагоцитоз Aβ |
| 152 | Mizwicki и соавт. | 2013 | Пациенты со спорадической БА и контрольная группа | - | RvD1 изменяет баланс воспаления в сторону стимулирования фагоцитоза Aβ |
| 153 | Krashia и соавт. | 2019 | Пациенты с ранней болезнью Паркинсона | Снижение эндогенного уровня RvD1 коррелирует с повышенным уровнем провоспалительных факторов в СМЖ | |
| 154 | Kok Kendirlioglu и соавт. | 2019 | Пациенты с биполярным расстройством-I | - | Увеличение RvD1 при маниакальных и депрессивных состояниях частично купирует воспалительный дисбаланс |
| 155 | Uno и соавт | 2016 | Пациенты, перенесшие резекцию печени | Пероральные пищевые добавки Oral Impact (Nestlé Health Science), 1000 ккал/сут, содержащие ЭПК и аргинин, в течение 5 дней подряд до операции | Повышенный уровень RvE1 в плазме крови подавляет острое воспаление, вызванное хирургическим вмешательством |
| 156 | Hiram и соавт. | 2015 | Легочные артерии человека | - | RvE1 снижает гиперреактивность артерий человека путем устранения маркеров воспаления |
БА — болезнь Альцгеймера; ApoE — аполипопротеин E; СМЖ — спинномозговая жидкость; ЭПК — эйкозапентаеновая кислота; ЛКН — легкие когнитивные нарушения; MMSE — краткая шкала оценки психического статуса; RvD1 — резольвин D1; RvE1 — резольвин E1; СКН — субъективные когнитивные нарушения.
Эффект RvE1 у пациентов описан в периферических тканях (таблица 1) [155,156,157], но не в головном мозге. Следовательно, необходимы дополнительные исследования для развития этого направления.
Исследования у животных
В нескольких исследованиях на моделях воспаления у грызунов показано, что RvD1 и RvE1 проявляют противовоспалительную активность в ЦНС (таблица 2). Так, у крыс с геморрагическим шоком или диабетической ретинопатией, индуцированной стрептозотоцином (STZ), RvD1 снижает активацию NFκB и экспрессию провоспалительных факторов, таких как ИЛ-1β, ИЛ-6, ФНО-α и индуцибельная синтаза оксида азота (iNOS) [158,159].
RvD1 ослабляет нейровоспаление путем воздействия на рецептор ALX-FPR2 через микроРНК у моделей детенышей крыс с неонатальной гипоксией-ишемией или в модели отдаленного повреждения [125,160]. Кроме того, RvD1 индуцирует поляризацию макрофагов и микроглии в направлении фагоцитарного фенотипа M2 [161,162,163]. На крысиной модели болезни Паркинсона показано, что длительное и раннее введение RvD1 предотвращает центральное и периферическое воспаление, а также дисфункцию нейронов и двигательные нарушения [153]. Кроме того, предшественники RvD1, 17R-ГДГК и 17S-ГДГК снижают выработку провоспалительных цитокинов в спинном мозге и в гиппокампе [135,164].
Таблица 2. Роль липидных медиаторов в разрешении воспаления у животных
| Ссылка | Авторы | Год | Лечение | Основные выводы |
| 97 | Shalini и соавт. | 2018 | Нокдаун гена Alox15 | Снижение содержания RvD1 в префронтальной коре связано с изменением эффективности кратковременной памяти |
| 125 | Bisicchia и соавт. | 2018 | Внутрибрюшинная инъекция RvD1 (0,4 мкг/кг) через 3, 5 и 7 дней после ГЦЭ | RvD1 снижает глиальную активацию и предотвращает гибель нейронов, способствуя функциональному восстановлению |
| 135 | Orr и соавт. | 2013 | Интрацеребровентрикулярное введение 17S-ГПДГК (1 мкг) в течение 24 ч с помощью осмотического насоса | 17S-ГПДГК снижает уровень маркеров нейровоспаления в гиппокампе |
| 153 | Krashia и соавт. | 2019 | Внутрибрюшинная инъекция RvD1 (0,2 мкг/кг) два раза в неделю в течение 8 недель | RvD1 предотвращает активацию микроглии, снижает экспрессию ИФН-γ и ГКГС-II в СМЖ, а также нейрональный и моторный дефицит |
| 158 | Sordi и соавт. | 2019 | Внутривенная инъекция RvD1 (0,3 или 1 мкг/кг) | Введение RvD1 во время реанимации ингибирует активацию NFκB и снижает экспрессию провоспалительных факторов |
| 159 | Yin и соавт. | 2017 | Интравитреальное введение RvD1 (1000 нг/кг) | RvD1 ингибирует активацию инфламмасомы NLRP3 и связанную с ней продукцию цитокинов |
| 160 | Liu и соавт. | 2019 | Внутрибрюшинная инъекция RvD1 (5 мкг/кг) за 1 час до гипоксии-ишемии | Введение RvD1 уменьшает относительную площадь инфаркта, активацию микроглии и уровень провоспалительных факторов |
| 161 | Rossi и соавт. | 2015 | Интравитреальное введение RvD1 (10, 100, 1000 нг/кг) | RvD1 уменьшает повреждение глаз, снижая количество B- и T-лимфоцитов, изменяя экспрессию микроРНК и поляризацию резидентных макрофагов и уменьшая локальные уровни убиквитин-протеасомной системы |
| 162 | Titos и соавт. | 2011 | 10 нМ RvD1 | RvD1 поляризует макрофаги в направлении фенотипа M2 и усиливает фагоцитоз макрофагами |
| 164 | Abdelmoaty и соавт. | 2013 | Интратекальное введение 17R-RvD1 (300 нг) | 17R-RvD1 снижал индуцированное каррагинаном высвобождение ФНО-α в спинном мозге |
| 165 | Kantarci и соавт. | 2018 | Внутрибрюшинная инъекция RvE1 (1,5 мкг/кг) три раза в неделю в течение 2 месяцев | RvE1 восстанавливает экспрессию трех СПМ и уровни цитокинов в префронтальной коре |
| 166 | Harrison и соавт. | 2015 | Внутрибрюшинная инъекция RvE1 или 17R-RvD1 (100 нг) в течение 7 дней подряд с первой инъекцией за 3 дня до индукции ЧМТ | RvE1 и 17R-RvD1 снижают активацию и способствуют разветвлению микроглии. 17R-RvD1, но не RvE1, уменьшает когнитивный дефицит. |
| 167 | Terrando и соавт. | 2013 | Внутрибрюшинная инъекция 17R-RvD1 (100 нг) перед операцией | 17R-RvD1 снижает уровни ИЛ-6 в плазме крови через 6 ч и через 24 ч после операции |
| 168 | Delpech и соавт. | 2015 | Увеличение количества ПНЖК омега-3 в головном мозге снижает выработку провоспалительных цитокинов, индуцированных ЛПС, и последующее нарушение пространственной памяти | |
| 169 | Luo и соавт. | 2014 | Подавление активации NFκB, снижение уровня провоспалительных медиаторов, снижение активации микроглии и повышение уровня RvD1 в гиппокампе. Менее выраженная гибель нейронов CA1 гиппокампа и менее тяжелый когнитивный дефицит | |
| 171 | Deyama и соавт. | 2017 | Интрацеребровентрикулярная инфузия RvD1 (10 нг) и RvD2 (10 нг) через 22 часа после введения ЛПС | Антидепрессивный эффект RvD1 и RvD2, реализуемый через сигнальный путь mTORC1 |
| 172 | Deyama и соавт. | 2018 | Интрацеребровентрикулярные инфузии RvE1 (1 нг) или RvE2 (10 нг) через 22 часа после введения ЛПС | Антидепрессивный эффект RvE1 и RvE2, опосредованный ChemR23 в префронтальной коре и гиппокампе |
| 173 | Deyama и соавт. | 2018 | Интрацеребровентрикулярные инфузии RvE3 (10 или 100 нг) через 22 часа после введения ЛПС | Антидепрессивное действие RvE3 |
| 174 | Klein и соавт. | 2014 | Внутривенное введение RvD1, 17R-RvD1 или RvD2 (300 нг/особь) через 30 мин после индукции фибромиалгии и затем через 4 дня, за 30 мин до оценки поведения | 17R-RvD1 и RvD2 (но не RvD1) уменьшают симптомы боли и депрессии |
| 175 | Gilbert и соавт. | 2014 | Диета, богатая омега-3 ПНЖК, за 10 дней до инфаркта миокарда + инъекция RvD1 в левый желудочек на 10 день за 5 мин до ишемии | RvD1 восстанавливает кардиопротекцию при использовании одновременно с ингибиторами 15-липоксигеназы и циклоксигеназы-2 |
| 176 | Ishikawa и соавт. | 2017 | Интрацеребровентрикулярная инфузия RvD1 или RvD2 (10 нг) | RvD1 и RvD2 уменьшают проявления депрессивного поведения |
ChemR23 — рецептор хемерина 23; ЦСЖ — спинномозговая жидкость; ГЦЭ — гемицеребеллэктомия; ГПДГК — гидропероксил-докозагексаеновая кислота; ЛПС — липополисахарид; ГКГС-II — главный комплекс гистосовместимости II; mRORC1 — комплекс мишени рапамицина в клетках млекопитающих 1; NlRP3 — NOD-подобное семейство рецепторов, домен, содержащий пирин, 3; ПНЖК — полиненасыщенная жирная кислота; RvD — резольвин D; RvE — резольвин E; СПМ — специализированные про-разрешающие медиаторы; STZ — стрептозотоцин; ЧМТ — черепно-мозговая травма.
RvE1 снижает экспрессию провоспалительных цитокинов ИЛ-1β и ИЛ-6 в префронтальной коре и уменьшает нейропатологические признаки нарушений, связанных с Aβ, в мышиной модели болезни Альцгеймера [165]. Кроме того, многократное введение RvE1 замедляет активацию микроглии путем стимулирования ее разветвления после черепно-мозговой травмы или повреждения периферических отделов нервной системы [166].
Влияние RvD1 на нейровоспаление связано с влиянием на когнитивные функции. Кроме того, RvD1 предотвращает когнитивные нарушения. В модели системного воспаления или черепно-мозговой травмы у грызунов внутрибрюшинное введение 17R-RvD1 предотвращает снижение когнитивных функций [166,167]. Следует отметить, что более высокие уровни RvD1 в головном мозге у мышей Fat-1 из-за более высокого содержания омега-3 ДЦ-ПНЖК в головном мозге, обусловленного генетическими механизмами, связаны с меньшим когнитивным дефицитом, менее выраженной активацией микроглии и сниженным провоспалительным статусом после ишемии головного мозга [168,169]. И наоборот, более низкие уровни RvD1 в головном мозге из-за ингибирования 15-ЛОГ сопровождаются изменениями кратковременной памяти и синаптической пластичности у крыс [97].
В обзоре Furuyashiki и соавт. показано, что RvD и RvE предотвращают изменения эмоционального поведения в моделях расстройств настроения у грызунов [170]. Эти СПМ оказывают положительное влияние на депрессию, индуцированную ЛПС, хроническим стрессом или обусловленную перенесенным инфарктом миокарда [164,171,172,173,174,175,176].
Исследования in vitro
Эффекты RvD1 и RvE1 изучены на разных клетках головного мозга и показана их способность индуцировать разрешение воспаления (таблица 3). В клетках микроглии RvD1 усиливает действие противовоспалительных цитокинов ИЛ-4, Arg1 и Ym1 и снижает активацию микроглии за счет снижения экспрессии CD11b, что приводит к более противовоспалительному фенотипу микроглии [163,177,178]. Кроме того, RvD1 снижает экспрессию гена ЛПС-индуцированных провоспалительных цитокинов (ФНО-α, ИЛ-6 и ИЛ-1β) в клетках BV2 микроглии путем регулирования экспрессии микроРНК [123]. Также сообщалось, что RvD1 подавляет индуцированное Aβ воспаление в микроглии человека [136]. RvD2 снижает экспрессию толл-подобного рецептора 4 (TLR4, рецептор ЛПС) после введения ЛПС и, следовательно, подавляет его последующий сигнальный путь NFκB [179]. RvE1 также снижает активацию микроглии и высвобождение провоспалительных цитокинов в клетках микроглии [123,177]. В астроцитах RvD1 снижает индуцированную ЛПС продукцию ФНО-α [164]. В нейронах из спинальных ганглиев RvD1 увеличивает рост аксонов [180]. В нейронах PC12, используемых в качестве модели болезни Паркинсона in vitro, RvD1 снижает экспрессию мРНК ФНО-α и ИЛ-6 [181]. Противовоспалительные свойства RvD1 также исследовали на макрофагах. RvD1 снижает экспрессию провоспалительных маркеров (цитокинов, ПГЕ2) и увеличивает уровень противовоспалительного цитокина ИЛ-10 в мышиных макрофагах, стимулируемых ЛПС [182]. RvD1 посредством рецептора GPR32 поляризует первичные макрофаги человека в направлении фенотипа, способствующего разрешению воспаления [183].
Таблица 3. Роль липидных медиаторов в разрешении воспаления in vitro.
| Ссылка | Год | Клетки | Лечение | Основные выводы |
| 123 | 2016 | Клетки микроглии BV-2 | 10 нМ RvD1 или RvE1, за 30 мин до обработки ЛПС и далее в течение 24 ч | И RvD1, и RvE1 снижали экспрессию гена ЛПС-индуцированных провоспалительных цитокинов (ФНО-α, ИЛ-6 и ИЛ-1β) посредством микроРНК для RvD1 и путем воздействия на сигнальный путь NFκB для RvE1 |
| 136 | 2016 | Клетки микроглии CHME3 человека | 0–0,5 мкМ RvD1 в течение 1 ч и 6 ч | RvD1 подавляет воспаление, вызванное Aβ42, за счет снижения активации микроглии |
| 163 | 2014 | Клетки микроглии BV-2 | 1, 10 или 100 нМ RvD1 в течение 30 минут перед добавлением 10 нг/мл ИЛ-4 | RvD1 усиливает индуцированную ИЛ-4 поляризацию M2 |
| 164 | 2013 | Первичные астроциты крысы | 500 нМ 17-R-RvD1, за 30 мин до стимуляции ИФН-γ или ЛПС и далее в течение 24 ч | 17-R-RvD1 ослабляет выработку ИФН-γ или ЛПС-индуцированного ФНО-α |
| 177 | 2013 | Первичные клетки микроглии | 1, 10, 100 нг/мл RvE1, за 15 минут до обработки ЛПС и на протяжении обработки ЛПС продолжительностью 24 ч | RvE1 подавляет ЛПС-индуцированный микроглиоз и предотвращает высвобождение ФНО-α |
| 179 | 2015 | Первичные клетки микроглии крысы | 1,25, 2,5, 5, 10, 20 мкМ RvD2 за 2 часа до обработки ЛПС и на протяжении обработки ЛПС продолжительностью 2 ч | RvD2 снижает уровень маркеров воспаления, индуцированных ЛПС (ФНО-α, ИЛ-6, ИЛ-1β, ИЛ-18, NO, TLR4, NFκB, IκB), и маркеров активации микроглии (Iba1, CD11b) |
| 180 | 2015 | Первичные нейроны мыши | 50 нМ RvD1 в течение 24 ч | RvD1 стимулирует рост аксонов |
| 181 | 2017 | Модель болезни Паркинсона на клетках PC12 | 50, 100, 200 нМ RvD1 за 2 часа до обработки MPP+ | RvD1 ослабляет активацию экспрессии мРНК ФНО-α и ИЛ-6 под действием MPP+ посредством ингибирования активации сигнальных путей p38/ERK и NFκB |
| 182 | 2019 | Макрофаги RAW 264.7 мыши | 100, 200, 500 нМ RvD1 в течение 72 ч | RvD1 снижает индуцированную ЛПС продукцию ПГЕ2 и ФНО-α и увеличивает выработку ИЛ-10 |
| 183 | 2016 | Первичные макрофаги человека | 10 нМ RvD1 в течение 48 ч | RvD1 снижает секрецию ИЛ-1β и ИЛ-8 и демонстрирует тенденцию к снижению MCP-1 посредством активации GPR32 |
RvD1 — резольвин D1; RvE1 — резольвин E1; GPR32 — сцепленный с G-белком рецептор 32; MPP+ — 1-метил-4-фенилпиридиний-ион; ПГЕ2 — простагландин Е2.
Дефекты липидного обмена и выработка липидных медиаторов в процессе старения
В процессе старения снижаются уровни омега-3 ДЦ-ПНЖК, хотя в разных структурах мозга данные процессы выражены в разной степени [30,32,70,184]. Данное снижение описано у человека [185,186], особенно в коре, гиппокампе и мозжечке [73,187,188,189], а также у грызунов [30,32,190,191], в частности, в гиппокампе [191] и коре [73], которые являются ключевыми структурами в процессах, связанных с памятью. Это снижение происходит главным образом из-за изменений в метаболизме липидов: нарушение всасывания незаменимых жирных кислот в кишечнике [192,193,194], снижение активности ферментов синтеза фосфолипидов [195], снижение скорости превращения предшественников в ДЦ-ПНЖК из-за снижения активности ферментов, участвующих в их синтезе, в частности Δ6-десатуразы [186,196,197], а также изменение экспрессии генов, участвующих в метаболизме ПНЖК. Так, однонуклеотидные полиморфизмы (SNP) в генах десатуразы FADS1 (Δ5-десатураза), FADS2 (Δ6-десатураза), а также ELOVL2 (элонгаза 2) связаны с более высокими уровнями АЛК и более низкими уровнями фосфолипидов ЭПК в плазме крови по мере старения, что позволяет предположить различные скорости конверсии [198]. Кроме того, еще одной возможной причиной снижения содержания омега-3 ДЦ-ПНЖК в мембранах является их высокая склонность к окислению с образованием продуктов перекисного окисления, таких как малональдегид (MDA), 4-гидрокси-2-ноненал (4-HNE) или 4-гидрокси-2-гексенал (4-HHE). Показано, что уровни MDA и 4-HNE повышаются с возрастом в головном мозге людей и грызунов [199,200].
Нарушение метаболизма ДГК, связанное со старением, может играть роль в снижении когнитивных функций (рисунок 2). Это было продемонстрировано как на людях, так и на животных. У пожилых людей снижение потребления омега-3 ПНЖК, сопровождающееся снижением уровня ДГК в эритроцитах, обратно коррелирует с возрастным снижением когнитивных функций [201,202,203]. У крыс диета с низким содержанием ДГК в течение одного или нескольких поколений приводит к изменениям когнитивных функций [204,205,206]. Также удалось показать, что диета с дефицитом омега-3 ПНЖК у пожилых мышей ухудшает память, синаптическую пластичность, а также способствует развитию нейровоспаления [32,207,208,209,210]. Кроме того, снижение содержания ДГК в головном мозге, вызванное диетой с дефицитом омега-3 ПНЖК, повышает предрасположенность к воспалению, которое приводит к синаптическим изменениям и нарушениям памяти [211,212]. Напротив, применение добавок омега-3 ДЦ-ПНЖК в течение 2 месяцев у пожилых мышей (в возрасте от 20 до 22 месяцев) устраняет возрастной дефицит пространственной памяти [30].
Рисунок 2. Влияние старения на липидный обмен. АЛК — альфа-линоленовая кислота; ПНЖК — полиненасыщенная жир��ая кислота; СПМ — специализированный про-разрешающий медиатор.
Возрастное изменение метаболизма омега-3 ПНЖК способствует снижению содержания омега-3 ДЦ-ПНЖК в фосфолипидах головного мозга. Поскольку омега-3 ДЦ-ПНЖК являются предшественниками биоактивных медиаторов, участвующих в разрешении воспаления, это может влиять на профиль и продукцию СПМ. Так, недавно было показано, что профиль оксилипинов в крови изменяется у здоровых мужчин и женщин в возрасте 45–64 лет по сравнению с молодыми людьми в возрасте 19–28 лет [213,214]. Более того, Gangemi и соавт. (2005) продемонстрировали, что старение сопровождается снижением уровня LxA4/лейкотриена в моче и соотношения противовоспалительных/провоспалительных медиаторов, синтезированных из арахидоновой кислоты. Данное соотношение рассматривается в качестве показателя эндогенного противовоспалительного потенциала [215]. Кроме того, уровень LxA4 значительно ниже в спинномозговой жидкости (СМЖ) пациентов с болезнью Альцгеймера по сравнению с пациентами с легкими когнитивными нарушениями или субъективными когнитивными нарушениями, с положительной корреляцией между уровнем LxA4 в СМЖ и когнитивными функциями [126].
У животных также описана модификация профиля оксилипинов при старении. У пожилых грызунов наблюдаются более высокие уровни TxB2, 6-кето-PGF1α и подобных PD1 метаболитов [214]. В модели мышей, предрасположенных к ускоренному старению (SAMP8), в коре головного мозга обнаруживаются более высокие уровни ПГЕ2, TxB2 и 9,10-DiHOME и более низкие уровни медиаторов, образующихся из 20-гидроксиэйкозатетраеновой кислоты (20-ГЭТК) и ДГК (11-, 14- и 20-HDoHE) [214]. Однако по сравнению с мышами того же возраста, устойчивыми к ускоренному старению 1 (SAMR1), у мышей SAMP8 не обнаружено каких-либо различий в уровнях LXA4 или RvD1, несмотря на более выраженное воспаление у мышей SAMP8 [216]. Кроме того, у пожилых мышей BalbC определяются более высокие уровни провоспалительных LTB4 и ПГ и более низкие уровни противовоспалительные RvD1 и MaR1 в перитонеальных макрофагах по сравнению с молодыми мышами [217].
Модификации профиля оксилипинов связаны с изменениями экспрессии ферментов, участвующих в их синтезе. По результатам посмертных исследований головного мозга показано, что у людей экспрессия PLA2 и ЛОГ увеличивается с возрастом [214]. Аналогичные результаты были получены при сравнении пациентов в возрасте 70 лет и 41 года в отношении PLA2 и CYP [214]. У пациентов с болезнью Альцгеймера уровень 15-ЛОГ также повышен в гиппокампе [126].
У животных экспрессия 5-ЛОГ увеличивается с возрастом [214], тогда как экспрессия 12-ЛОГ снижена у мышей SAMP8 в возрасте 9 месяцев [216].
Изменения профиля оксилипинов могут приводить к компенсаторным изменениям для их рецепторов. Так, у людей уровни ALX/FPR2 и ChemR23 выше в гиппокампе пациентов с болезнью Альцгеймера по сравнению с контрольной группой [126]. Аналогичный результат был получен для ALX/FPR2 у мышей SAMP8, несмотря на то, что уровень сходен с таковым у контрольных мышей SAMR1 [216].
Все эти результаты свидетельствуют об изменении разрешении воспаления в процессе старения, что может способствовать возрастному снижению когнитивных функций, поскольку высокая степень воспаления сопровождается изменением когнитивных функций.
Данные, подтверждающие роль поступающих с пищей омега-3 ПНЖК в процессе старения
Биоактивные питательные вещества, такие как омега-3 ПНЖК, представляют собой интересный потенциальный способ предотвращения или замедления развития нейровоспаления, возникающего в процессе старения. Данный обзор будет сосредоточен на поступающих с пищей омега-3 ПНЖК, поскольку они модифицируют уровни омега-3 ДЦ-ПНЖК в головном мозге [83,84,218], которые обладают одновременно противовоспалительными свойствами, способствуют разрешению воспаления и предотвращают снижение когнитивных функций, связанное со старением.
Данные, полученные в исследованиях на человеке (таблица 4) и животных (таблица 5) подтверждают значимую роль омега-3 ДЦ-ПНЖК в регуляции обоих воспалительных путей и в конечном итоге в разрешении воспаления, в том числе в головном мозге (недавний обзор представлен в [83]). Здесь будет рассмотрено применение пищевых добавок на основе омега-3 ДЦ-ПНЖК в процессе старения. Barberger-Gateau показал, что чем больше потребление омега-3 ПНЖК у пожилых людей, тем меньше риск снижения когнитивных функций [219]. Tan и соавт. в исследовании Framingham также продемонстрировали, что более низкие уровни ДГК в эритроцитах связаны с когнитивными нарушениями [220]. Кроме того, в проспективном наблюдательном исследовании показано, что исходные уровни потребления ДГК с пищей в возрасте 70 лет положительно коррелируют с лучшими показателями теста на эксплицитную память в возрасте 75 лет у здоровой популяции [221]. Применение пищевых добавок с омега-3 ПНЖК у людей основано на наблюдательных исследованиях, в которых была выявлена связь между потреблением ДГК с пищей и улучшением когнитивной функции и/или менее выраженным снижением когнитивных функций у пожилых людей. Так, потребление рыбьего жира, приводящее к повышению уровня ДГК в эритроцитах, было связано с улучшением когнитивных функций у пожилых людей [222] и с более низким риском развития неврологических расстройств [223,224,225]. Добавление ДГК в рацион сопровождается более высокой результативностью и скоростью в тесте вербального обучения в когорте здоровых людей в возрасте 45–70 лет [226] и улучшением баллов по краткой шкале оценки психического статуса (MMSE) при их использовании для оценки когнитивных функций и способностей памяти в когорте пожилых людей в возрасте 75 лет [227]. Yurko-Mauro и соавт. показали в систематическом мета-анализе, что прием ДГК улучшает эпизодическую, кратковременную и семантическую память [228]. В более новом исследовании McNamara и соавт. продемонстрировали, что потребление рыбьего жира снижает выраженность нарушений в повседневной деятельности, а также улучшает познавательные способности у пожилых людей с когнитивными жалобами [229]. Кроме того, показана обратно пропорциональная зависимость уровня цитокинов от уровня циркулирующих омега-3 ПНЖК (включая ДГК) [230,231,232].
Таблица 4. Данные, подтверждающие роль поступающих с пищей омега-3 ПНЖК в процессе старения у людей
| Ссылка | Год | Пациенты / объект исследования | Дополнение | Основные выводы |
| 219 | 2009 | Участники когорты из трех городов (75,9 лет) | Средиземноморская диета в течение 5 лет | Более высокая приверженность средиземноморской диете связана с улучшением когнитивных функций |
| 220 | 2012 | Участники когорты исследования Framingham без деменции (67 лет) | Пищевые привычки | Более низкий уровень ДГК в эритроцитах связан с более низкими баллами в тестах на зрительную память, исполнительную функцию и абстрактное мышление |
| 221 | 2013 | Участники когорты исследования PIVUS (70 лет) | Пищевые привычки за 5 лет | Потребление с пищей ЭПК и ДГК в течение 7 дней сопровождается улучшением общего когнитивного функционирования |
| 222 | 2004 | Участники из Абердина (64 года) | Пищевая добавка рыбьего жира | Использование пищевых добавок рыбьего жира и содержание омега-3 ПНЖК в эритроцитах связано с повышенным когнитивным функционированием в процессе старения |
| 223 | 2003 | Участники проекта «Здоровье и старение в Чикаго» (73 года) | Пищевые привычки | Общее потребление омега-3 ПНЖК (и ДГК) связано со снижением риска развития болезни Альцгеймера |
| 224 | 2007 | Участники когорты из трех городов (75,9 лет) | Средиземноморская диета в течение 4 лет | Еженедельное потребление рыбы или регулярное потребление масел, богатых омега-3 ПНЖК, связано со снижением риска развития болезни Альцгеймера |
| 225 | 2009 | Участники когорты Роттердамского исследования (> 55 лет) | Умеренное потребление рыбы | Умеренное потребление рыбы не связано с риском развития деменции |
| 226 | 2004 | Участники когорты из Дутинхема (45–70 лет) | Пищевые привычки | Потребление омега-3 ПНЖК из морепродуктов (жирной рыбы) обратно пропорционально риску нарушения общей когнитивной функции и скорости |
| 227 | 2010 | Пожилое население Астурии (75 лет) | Пищевые привычки | Потребление ЭПК и ДГК (потребление рыбы) обратно пропорционально выраженности когнитивных нарушений |
| 229 | 2018 | Участники из Цинциннати (62–80 лет) | Дополнительное потребление 1,6 г/сут ЭПК + 0,8 г/сут ДГК в течение 24 недель | Дополнительное потребление ЭПК и ДГК сопровождается снижением симптомов когнитивных нарушений в повседневной деятельности |
| 230 | 2006 | Участники из Кьянти (20–98 лет) | Пищевые привычки | Более высокие уровни омега-3 ПНЖК в плазме крови связаны с более низкими уровнями провоспалительных маркеров (ИЛ-6, ИЛ-1ra, ФНО-α, СРБ) и более высокими уровнями противовоспалительных маркеров (растворимый ИЛ-6r, ИЛ-10, ТФР-β) |
| 231 | 2012 | Участники когорты исследования «Здоровье, питание, активность и образ жизни» (> 29 лет) | Пищевые привычки | Более высокое потребление омега-3 ПНЖК связано со снижением выраженности воспаления (уровень СРБ) и утомляемости |
| 232 | 2009 | Участники когорты исследования «Сердце и душа» (> 64 лет) | Пищевые привычки | Обратная связь между уровнями омега-3 ПНЖК в эритроцитах и воспалительными маркерами СРБ и ИЛ-6 |
СРБ — С-реактивный белок; ДГК — докозагексаеновая кислота; ЭПК — эйкозапентаеновая кислота; PIVUS — проспективное исследование сосудистой системы у пожилых жителей Уппсалы (Prospective Investigation of the Vasculature in Uppsala Seniors); ПНЖК — полиненасыщенные жирные кислоты.
Таблица 5. Данные, подтверждающие роль поступающих с пищей омега-3 ПНЖК в процессе старения у животных.
| Ссылка | Год | Животные | Лечение | Основные выводы |
| 30 | 2012 | Мыши C57BL/6J в возрасте 20 мес | Дополнительное введение ЭПК и ДГК в период с 20 до 22 месяцев (25 мг/сут и 15 мг/сут) | Добавка омега-3 ПНЖК снижает экспрессию цитокинов в гиппокампе и выраженность изменений морфологии астроцитов, а также устраняет дефицит пространственной памяти |
| 233 | 2001 | Крысы линии Вистар в возрасте 100 нед | Дополнительно введение ДГК (300 мг/кг/сут) в течение 5 недель | Дополнительное введение омега-3 ПНЖК уменьшает количество ошибок долговременной и кратковременной памяти |
| 234 | 2008 | Мыши SAMP8 в возрасте 10 месяцев | Дополнительное введение ЭПК и ДГК в течение 8 недель (11,7 % ЭПК и 14,3 % ДГК в рационе) | Дополнительное введение омега-3 ПНЖК замедляет снижение когнитивных функций за счет включения омега-3 ПНЖК в фосфолипиды головного мозга |
| 235 | 2007 | Мыши C57BL/6 в возрасте 6 недель | Дополнительное введение ЭПК и ДГК (400–600 мг/сут) в течение 8 недель | Дополнительное введение омега-3 ПНЖК снижает выработку провоспалительных цитокинов (ИЛ-6, ИЛ-1β, ФНО-α) перитонеальными макрофагами |
| 236 | 2006 | Мыши B6C3F1 в возрасте 7 недель | Дополнительное введение ЭПК и ДГК в течение 4 недель (35 мг/сут и 150 мг/сут) | Дополнительное введение омега-3 ПНЖК подавляет транскрипцию ИЛ-6 в макрофагах на модели нефропатии |
| 237 | 1995 | Мыши MF1, получающие корм с высоким содержанием жиров | Дополнительное введение ЭПК и ДГК (120 мг/сут и 50 мг/сут) в течение 8 недель | Дополнительное введение омега-3 ПНЖК снижает выработку макрофагами ФНО-α и ИЛ-6 |
| 238 | 1999 | Взрослые мыши C57BL/6, получающие корм с высоким содержанием жиров (20 %) | Дополнительное введение ЭПК и ДГК в течение 5 недель (100 мг/сут и 100 мг/сут) | Дополнительное введение омега-3 ПНЖК снижает концентрации ФНО-α, ИЛ-6 и ИЛ-1β в плазме крови после введения ЛПС |
| 239 | 1995 | Серые крысы в возрасте 5 недель | Дополнительное введение в рацион 14 % рыбьего жира в течение 6 недель | Дополнительное введение омега-3 ПНЖК снижает продукцию ИЛ-1β в макрофагах |
| 240 | 2006 | Взрослые крысы Спрег-Доули | Дополнительное введение ЭПК и ДГК в течение 6 недель | Дополнительное введение омега-3 ПНЖК снижает уровни ИЛ-6 в плазме после однократного введения экзогенного ИЛ-1β человека |
| 241 | 2007 | Крысы линии Вистар в возрасте 22 мес | Дополнительное введение ЭПК в течение 4 недель (125 мг/сут) | Дополнительное введение ЭПК снижает концентрацию ИЛ-1β и ИФН-γ и экспрессию JNK в гиппокампе, что сопровождается снижением возрастного и Aβ-индуцированного дефицита ДВП |
ДГК — докозагексаеновая кислота; ЭПК — эйкозапентаеновая кислота; ДВП — долгосрочная потенциация; ПНЖК — полиненасыщенные жирные кислоты.
Положительные эффекты омега-3 ДЦ-ПНЖК также были обнаружены у животных. Применение диеты с повышенным содержанием ДГК/ЭПК у пожилых мышей защищает их от нейровоспаления и когнитивных нарушений [30] и улучшает пространственное восприятие, способность к обучению и память [233,234]. Интервенционные исследования на пожилых грызунах показали, что потребление корма, обогащенного рыбьим жиром, снижает продукцию ИЛ-1β, ФНО-α и ИЛ-6 ex vivo моноцитами и макрофагами [235,236,237]. Кроме того, концентрации ИЛ-1β, ФНО-α и ИЛ-6 в циркулирующей крови после введения ЛПС ниже у крыс и мышей, получавших корм, обогащенный рыбьим жиром [238,239,240]. Также показано, что связанная с возрастом экспрессия провоспалительных цитокинов в головном мозге грызунов снижается при высоких уровнях ДГК [241].
Кроме того, можно модулировать профиль оксилипинов путем изменения рациона. Так, в обзоре Caligiuri и соавт. показано, что профиль оксилипинов в крови человека изменяется в сторону менее выраженного воспаления после потребления омега-3 ДЦ-ПНЖК [214]. Мы обнаружили, что после введения ЛПС у мышей увеличение уровня омега-3 ДЦ-ПНЖК в головном мозге при приеме пищевых добавок способствует синтезу СПМ из омега-3 ПНЖК и уменьшает уровни СПМ из омега-6 ПНЖК, что соответствует противовоспалительному профилю [100]. Кроме того, повышенное содержание провоспалительных оксилипинов в плазме крови у пожилых людей купируется при введении в рацион омега-3 ПНЖК (альфа-линоленовой кислоты, предшественника омега-3 ДЦ-ПНЖК) [213]. Исследование OmegAD показало, что у пациентов с болезнью Альцгеймера, получавших омега-3 ПНЖК, сохраняются уровни RvD1 в отличие от пациентов, получавших плацебо [242]. У пожилых крыс добавление омега-3 ДЦ-ПНЖК увеличивает уровень образующихся из ДГК оксилипинов в коре головного мозга и улучшает способность к обучению, связанную с памятью [243].
Изменение уровня СПМ в крови и клетках головного мозга пожилых людей и грызунов сопровождается некоторым изменением экспрессии ферментов, участвующих в их синтезе. Экспрессия мРНК 15-ЛОГ увеличивается в группе, получавшей добавки омега-3 ДЦ-ПНЖК, и снижается при диете с дефицитом омега-3 ДЦ-ПНЖК [100,244,245]. 15-ЛОГ синтезирует как 15-ГЭТК, которая ингибирует NFκB [103], так и RvD1, что способствует сохранению когнитивных функций [97].
Эти результаты свидетельствуют о том, что пищевые привычки могут быть важными регуляторами профиля оксилипинов и подчеркивают важность соблюдения диеты, богатой омега-3 ПНЖК.
Выводы
Старение характеризуется низкоактивным нейровоспалением, в частности, активацией клеток микроглии и увеличением выработки провоспалительных факторов в головном мозге, таких как цитокины. Это нейровоспаление связано со снижением когнитивных функций (у 15–20 % пожилых людей старше 65 лет), что влияет на качество жизни и оказывает серьезный экономический и социальный эффект. В данном контексте приоритетным является поиск стратегий для замедления развития нейродегенеративных заболеваний. Омега-3 ДЦ-ПНЖК и их биоактивные липидные производные (СПМ) являются многообещающими вариантами, поскольку они уменьшают и устраняют воспаление. СПМ меняются в процессе старения и при определенных особенностях рациона, что подчеркивает важность питания в регуляции воспаления. Изменения баланса омега-3 ПНЖК в рационе могут оказывать значительное влияние на метаболизм ПНЖК в головном мозге и, в конечном итоге, на реакцию на нейровоспаление, особенно в процессе старения. Для подтверждения роли СПМ в возрастных изменениях необходимы дополнительные исследования, причем это направление еще мало изучено. Необходимо исследовать комбинации различных оксилипинов для усиления их положительного влияния на процесс старения, а также определение клинической лекарственной формы (инкапсулированные СПМ или более стабильные аналоги СПМ), дозы и способа введения.
Вклад авторов
Все авторы (C.J., A.-L.D., M.C., V.P., S.L.) внесли свой вклад в написание рукописи. Все авторы прочитали и согласовали опубликованную версию рукописи.
Финансирование
Финансирование APC осуществлялось за счет Programme FUI, проект BrainBooster, номер гранта DOS0049628/00.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
- Camfield, D.A.; Owen, L.; Scholey, A.B.; Pipingas, A.; Stough, C. Dairy constituents and neurocognitive health in ageing. Br. J. Nutr. 2011, 106, 159–174. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Bousquet, J.; Kuh, D.; Bewick, M.; Standberg, T.; Farrell, J.; Pengelly, R.; Joel, M.E.; Rodriguez Mañas, L.; Mercier, J.; Bringer, J.; et al. Operational Definition of Active and Healthy Ageing (AHA): A Conceptual Framework. J. Nutr. Health Aging 2015, 19, 955–960. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Perez, S.D.; Du, K.; Rendeiro, C.; Wang, L.; Wu, Q.; Rubakhin, S.S.; Vazhappilly, R.; Baxter, J.H.; Sweedler, J.V.; Rhodes, J.S. A unique combination of micronutrients rejuvenates cognitive performance in aged mice. Behav. Brain Res. 2017, 320, 97–112. [Google Scholar] [CrossRef] [PubMed]
- Erickson, C.A.; Barnes, C.A. The neurobiology of memory changes in normal aging. Exp. Gerontol. 2003, 38, 61–69. [Google Scholar] [CrossRef]
- Blennow, K.; de Leon, M.J.; Zetterberg, H. Alzheimer’s disease. Lancet 2006, 368, 387–403. [Google Scholar] [CrossRef]
- Di Benedetto, S.; Müller, L.; Wenger, E.; Düzel, S.; Pawelec, G. Contribution of neuroinflammation and immunity to brain aging and the mitigating effects of physical and cognitive interventions. Neurosci. Biobehav. Rev. 2017, 75, 114–128. [Google Scholar] [CrossRef][Green Version]
- Spittau, B. Aging Microglia-Phenotypes, Functions and Implications for Age-Related Neurodegenerative Diseases. Front. Aging Neurosci. 2017, 9, 194. [Google Scholar] [CrossRef]
- Salter, M.W.; Stevens, B. Microglia emerge as central players in brain disease. Nat. Med. 2017, 23, 1018–1027. [Google Scholar] [CrossRef]
- Heneka, M.T.; Carson, M.J.; El Khoury, J.; Landreth, G.E.; Brosseron, F.; Feinstein, D.L.; Jacobs, A.H.; Wyss-Coray, T.; Vitorica, J.; Ransohoff, R.M.; et al. Neuroinflammation in Alzheimer’s disease. Lancet Neurol. 2015, 14, 388–405. [Google Scholar] [CrossRef][Green Version]
- Biber, K.; Neumann, H.; Inoue, K.; Boddeke, H.W.G.M. Neuronal “On” and “Off” signals control microglia. Trends Neurosci. 2007, 30, 596–602. [Google Scholar] [CrossRef]
- Streit, W.J. Microglial senescence: Does the brain’s immune system have an expiration date? Trends Neurosci. 2006, 29, 506–510. [Google Scholar] [CrossRef] [PubMed]
- Davies, D.S.; Ma, J.; Jegathees, T.; Goldsbury, C. Microglia show altered morphology and reduced arborization in human brain during aging and Alzheimer’s disease. Brain Pathol. 2017, 27, 795–808. [Google Scholar] [CrossRef] [PubMed]
- Streit, W.J.; Mrak, R.E.; Griffin, W.S.T. Microglia and neuroinflammation: A pathological perspective. J. Neuroinflammation 2004, 1, 14. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Hefendehl, J.K.; Neher, J.J.; Sühs, R.B.; Kohsaka, S.; Skodras, A.; Jucker, M. Homeostatic and injury-induced microglia behavior in the aging brain. Aging Cell 2014, 13, 60–69. [Google Scholar] [CrossRef]
- Sheffield, L.G.; Berman, N.E. Microglial expression of MHC class II increases in normal aging of nonhuman primates. Neurobiol. Aging 1998, 19, 47–55. [Google Scholar] [CrossRef]
- Sloane, J.A.; Hollander, W.; Moss, M.B.; Rosene, D.L.; Abraham, C.R. Increased microglial activation and protein nitration in white matter of the aging monkey. Neurobiol. Aging 1999, 20, 395–405. [Google Scholar] [CrossRef]
- Perry, V.H.; Matyszak, M.K.; Fearn, S. Altered antigen expression of microglia in the aged rodent CNS. Glia 1993, 7, 60–67. [Google Scholar] [CrossRef]
- Ogura, K.; Ogawa, M.; Yoshida, M. Effects of ageing on microglia in the normal rat brain: Immunohistochemical observations. NeuroReport 1994, 5, 1224–1226. [Google Scholar] [CrossRef]
- Domínguez-González, M.; Puigpinós, M.; Jové, M.; Naudi, A.; Portero-Otín, M.; Pamplona, R.; Ferrer, I. Regional vulnerability to lipoxidative damage and inflammation in normal human brain aging. Exp. Gerontol. 2018, 111, 218–228. [Google Scholar] [CrossRef]
- Esiri, M.M. Ageing and the brain. J. Pathol. 2007, 211, 181–187. [Google Scholar] [CrossRef]
- Matt, S.M.; Johnson, R.W. Neuro-immune dysfunction during brain aging: New insights in microglial cell regulation. Curr. Opin. Pharmacol. 2016, 26, 96–101. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Sierra, A.; Gottfried-Blackmore, A.C.; McEwen, B.S.; Bulloch, K. Microglia derived from aging mice exhibit an altered inflammatory profile. Glia 2007, 55, 412–424. [Google Scholar] [CrossRef] [PubMed]
- Eichhoff, G.; Busche, M.A.; Garaschuk, O. In vivo calcium imaging of the aging and diseased brain. Eur. J. Nucl. Med. Mol. Imaging 2008, 35 (Suppl. S1), S99–S106. [Google Scholar] [CrossRef] [PubMed]
- Safaiyan, S.; Kannaiyan, N.; Snaidero, N.; Brioschi, S.; Biber, K.; Yona, S.; Edinger, A.L.; Jung, S.; Rossner, M.J.; Simons, M. Age-related myelin degradation burdens the clearance function of microglia during aging. Nat. Neurosci. 2016, 19, 995–998. [Google Scholar] [CrossRef] [PubMed]
- Norden, D.M.; Muccigrosso, M.M.; Godbout, J.P. Microglial priming and enhanced reactivity to secondary insult in aging, and traumatic CNS injury, and neurodegenerative disease. Neuropharmacology 2015, 96, 29–41. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Streit, W.J.; Braak, H.; Xue, Q.-S.; Bechmann, I. Dystrophic (senescent) rather than activated microglial cells are associated with tau pathology and likely precede neurodegeneration in Alzheimer’s disease. Acta Neuropathol. 2009, 118, 475–485. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Andraka, J.M.; Sharma, N.; Marchalant, Y. Can krill oil be of use for counteracting neuroinflammatory processes induced by high fat diet and aging? Neurosci. Res. 2019. [Google Scholar] [CrossRef]
- Von Bernhardi, R.; Tichauer, J.E.; Eugenín, J. Aging-dependent changes of microglial cells and their relevance for neurodegenerative disorders. J. Neurochem. 2010, 112, 1099–1114. [Google Scholar] [CrossRef]
- Cribbs, D.H.; Berchtold, N.C.; Perreau, V.; Coleman, P.D.; Rogers, J.; Tenner, A.J.; Cotman, C.W. Extensive innate immune gene activation accompanies brain aging, increasing vulnerability to cognitive decline and neurodegeneration: A microarray study. J. Neuroinflammation 2012, 9, 179. [Google Scholar] [CrossRef][Green Version]
- Labrousse, V.F.; Nadjar, A.; Joffre, C.; Costes, L.; Aubert, A.; Grégoire, S.; Bretillon, L.; Layé, S. Short-Term Long Chain Omega3 Diet Protects from Neuroinflammatory Processes and Memory Impairment in Aged Mice. PLoS ONE 2012, 7, e36861. [Google Scholar] [CrossRef]
- Ye, S.M.; Johnson, R.W. An age-related decline in interleukin-10 may contribute to the increased expression of interleukin-6 in brain of aged mice. Neuroimmunomodulation 2001, 9, 183–192. [Google Scholar] [CrossRef] [PubMed]
- Moranis, A.; Delpech, J.-C.; De Smedt-Peyrusse, V.; Aubert, A.; Guesnet, P.; Lavialle, M.; Joffre, C.; Layé, S. Long term adequate n-3 polyunsaturated fatty acid diet protects from depressive-like behavior but not from working memory disruption and brain cytokine expression in aged mice. Brain Behav. Immun. 2012, 26, 721–731. [Google Scholar] [CrossRef] [PubMed]
- Ye, S.M.; Johnson, R.W. Regulation of interleukin-6 gene expression in brain of aged mice by nuclear factor kappaB. J. Neuroimmunol. 2001, 117, 87–96. [Google Scholar] [CrossRef]
- Rozovsky, I.; Finch, C.E.; Morgan, T.E. Age-related activation of microglia and astrocytes: In vitro studies show persistent phenotypes of aging, increased proliferation, and resistance to down-regulation. Neurobiol. Aging 1998, 19, 97–103. [Google Scholar] [CrossRef]
- Ye, S.M.; Johnson, R.W. Increased interleukin-6 expression by microglia from brain of aged mice. J. Neuroimmunol. 1999, 93, 139–148. [Google Scholar] [CrossRef]
- Yu, W.H.; Go, L.; Guinn, B.A.; Fraser, P.E.; Westaway, D.; McLaurin, J. Phenotypic and functional changes in glial cells as a function of age. Neurobiol. Aging 2002, 23, 105–115. [Google Scholar] [CrossRef]
- Soysal, P.; Stubbs, B.; Lucato, P.; Luchini, C.; Solmi, M.; Peluso, R.; Sergi, G.; Isik, A.T.; Manzato, E.; Maggi, S.; et al. Inflammation and frailty in the elderly: A systematic review and meta-analysis. Ageing Res. Rev. 2016, 31, 1–8. [Google Scholar] [CrossRef]
- Ferrucci, L.; Harris, T.B.; Guralnik, J.M.; Tracy, R.P.; Corti, M.C.; Cohen, H.J.; Penninx, B.; Pahor, M.; Wallace, R.; Havlik, R.J. Serum IL-6 level and the development of disability in older persons. J. Am. Geriatr. Soc. 1999, 47, 639–646. [Google Scholar] [CrossRef][Green Version]
- Ferrucci, L.; Cavazzini, C.; Corsi, A.; Bartali, B.; Russo, C.R.; Lauretani, F.; Ferrucci, L.; Cavazzini, C.; Corsi, A.M.; Bartali, B.; et al. Biomarkers of frailty in older persons. J. Endocrinol. Investig. 2002, 25, 10–15. [Google Scholar]
- Henry, C.J.; Huang, Y.; Wynne, A.M.; Godbout, J.P. Peripheral lipopolysaccharide (LPS) challenge promotes microglial hyperactivity in aged mice that is associated with exaggerated induction of both pro-inflammatory IL-1beta and anti-inflammatory IL-10 cytokines. Brain Behav. Immun. 2009, 23, 309–317. [Google Scholar] [CrossRef][Green Version]
- VanGuilder, H.D.; Bixler, G.V.; Brucklacher, R.M.; Farley, J.A.; Yan, H.; Warrington, J.P.; Sonntag, W.E.; Freeman, W.M. Concurrent hippocampal induction of MHC II pathway components and glial activation with advanced aging is not correlated with cognitive impairment. J. Neuroinflammation 2011, 8, 138. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Wong, A.M.; Patel, N.V.; Patel, N.K.; Wei, M.; Morgan, T.E.; de Beer, M.C.; de Villiers, W.J.S.; Finch, C.E. Macrosialin increases during normal brain aging are attenuated by caloric restriction. Neurosci. Lett. 2005, 390, 76–80. [Google Scholar] [CrossRef] [PubMed]
- Griffin, R.; Nally, R.; Nolan, Y.; McCartney, Y.; Linden, J.; Lynch, M.A. The age-related attenuation in long-term potentiation is associated with microglial activation. J. Neurochem. 2006, 99, 1263–1272. [Google Scholar] [CrossRef] [PubMed]
- Harry, G.J. Microglia during development and aging. Pharmacol. Ther. 2013, 139, 313–326. [Google Scholar] [CrossRef][Green Version]
- Sheng, J.G.; Mrak, R.E.; Griffin, W.S. Enlarged and phagocytic, but not primed, interleukin-1 alpha-immunoreactive microglia increase with age in normal human brain. Acta Neuropathol. 1998, 95, 229–234. [Google Scholar] [CrossRef]
- Mouton, P.R.; Long, J.M.; Lei, D.-L.; Howard, V.; Jucker, M.; Calhoun, M.E.; Ingram, D.K. Age and gender effects on microglia and astrocyte numbers in brains of mice. Brain Res. 2002, 956, 30–35. [Google Scholar] [CrossRef]
- Krasemann, S.; Madore, C.; Cialic, R.; Baufeld, C.; Calcagno, N.; El Fatimy, R.; Beckers, L.; O’Loughlin, E.; Xu, Y.; Fanek, Z.; et al. The TREM2-APOE Pathway Drives the Transcriptional Phenotype of Dysfunctional Microglia in Neurodegenerative Diseases. Immunity 2017, 47, 566–581. [Google Scholar] [CrossRef][Green Version]
- Mrdjen, D.; Hartmann, F.J.; Becher, B. High Dimensional Cytometry of Central Nervous System Leukocytes During Neuroinflammation. Methods Mol. Biol. 2017, 1559, 321–332. [Google Scholar]
- Hammond, T.R.; Dufort, C.; Dissing-Olesen, L.; Giera, S.; Young, A.; Wysoker, A.; Walker, A.J.; Gergits, F.; Segel, M.; Nemesh, J.; et al. Single-Cell RNA Sequencing of Microglia throughout the Mouse Lifespan and in the Injured Brain Reveals Complex Cell-State Changes. Immunity 2019, 50, 253–271. [Google Scholar] [CrossRef][Green Version]
- Sankowski, R.; Böttcher, C.; Masuda, T.; Geirsdottir, L.; Sagar; Sindram, E.; Seredenina, T.; Muhs, A.; Scheiwe, C.; Shah, M.J.; et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nat. Neurosci. 2019, 22, 2098–2110. [Google Scholar] [CrossRef]
- Ewers, M.; Franzmeier, N.; Suárez-Calvet, M.; Morenas-Rodriguez, E.; Caballero, M.A.A.; Kleinberger, G.; Piccio, L.; Cruchaga, C.; Deming, Y.; Dichgans, M.; et al. Increased soluble TREM2 in cerebrospinal fluid is associated with reduced cognitive and clinical decline in Alzheimer’s disease. Sci. Transl. Med. 2019, 11, eaav6221. [Google Scholar] [CrossRef] [PubMed]
- Rafnsson, S.B.; Deary, I.J.; Smith, F.B.; Whiteman, M.C.; Rumley, A.; Lowe, G.D.O.; Fowkes, F.G.R. Cognitive decline and markers of inflammation and hemostasis: The Edinburgh Artery Study. J. Am. Geriatr. Soc. 2007, 55, 700–707. [Google Scholar] [CrossRef] [PubMed]
- Weaver, J.D.; Huang, M.-H.; Albert, M.; Harris, T.; Rowe, J.W.; Seeman, T.E. Interleukin-6 and risk of cognitive decline: MacArthur studies of successful aging. Neurology 2002, 59, 371–378. [Google Scholar] [CrossRef]
- Schram, M.T.; Euser, S.M.; de Craen, A.J.M.; Witteman, J.C.; Frölich, M.; Hofman, A.; Jolles, J.; Breteler, M.M.B.; Westendorp, R.G.J. Systemic markers of inflammation and cognitive decline in old age. J. Am. Geriatr. Soc. 2007, 55, 708–716. [Google Scholar] [CrossRef][Green Version]
- Braida, D.; Sacerdote, P.; Panerai, A.E.; Bianchi, M.; Aloisi, A.M.; Iosuè, S.; Sala, M. Cognitive function in young and adult IL (interleukin)-6 deficient mice. Behav. Brain Res. 2004, 153, 423–429. [Google Scholar] [CrossRef] [PubMed]
- Sparkman, N.L.; Buchanan, J.B.; Heyen, J.R.R.; Chen, J.; Beverly, J.L.; Johnson, R.W. Interleukin-6 facilitates lipopolysaccharide-induced disruption in working memory and expression of other proinflammatory cytokines in hippocampal neuronal cell layers. J. Neurosci. 2006, 26, 10709–10716. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Sparkman, N.L.; Johnson, R.W. Neuroinflammation associated with aging sensitizes the brain to the effects of infection or stress. Neuroimmunomodulation 2008, 15, 323–330. [Google Scholar] [CrossRef][Green Version]
- Buchanan, J.B.; Sparkman, N.L.; Chen, J.; Johnson, R.W. Cognitive and neuroinflammatory consequences of mild repeated stress are exacerbated in aged mice. Psychoneuroendocrinology 2008, 33, 755–765. [Google Scholar] [CrossRef][Green Version]
- Barrientos, R.M.; Higgins, E.A.; Biedenkapp, J.C.; Sprunger, D.B.; Wright-Hardesty, K.J.; Watkins, L.R.; Rudy, J.W.; Maier, S.F. Peripheral infection and aging interact to impair hippocampal memory consolidation. Neurobiol. Aging 2006, 27, 723–732. [Google Scholar] [CrossRef]
- Barrientos, R.M.; Frank, M.G.; Hein, A.M.; Higgins, E.A.; Watkins, L.R.; Rudy, J.W.; Maier, S.F. Time course of hippocampal IL-1 beta and memory consolidation impairments in aging rats following peripheral infection. Brain Behav. Immun. 2009, 23, 46–54. [Google Scholar] [CrossRef][Green Version]
- Gibertini, M.; Newton, C.; Friedman, H.; Klein, T.W. Spatial learning impairment in mice infected with Legionella pneumophila or administered exogenous interleukin-1-beta. Brain Behav. Immun. 1995, 9, 113–128. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Pugh, C.R.; Kumagawa, K.; Fleshner, M.; Watkins, L.R.; Maier, S.F.; Rudy, J.W. Selective effects of peripheral lipopolysaccharide administration on contextual and auditory-cue fear conditioning. Brain Behav. Immun. 1998, 12, 212–229. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Gemma, C.; Fister, M.; Hudson, C.; Bickford, P.C. Improvement of memory for context by inhibition of caspase-1 in aged rats. Eur. J. Neurosci. 2005, 22, 1751–1756. [Google Scholar] [CrossRef] [PubMed]
- Wang, Z.; Wang, N.; Zheng, Y.; Wang, S. Inflammasome and Cancer. Exp. Suppl. 2018, 108, 281–302. [Google Scholar]
- Sutterwala, F.S.; Haasken, S.; Cassel, S.L. Mechanism of NLRP3 inflammasome activation. Ann. N. Y. Acad. Sci. 2014, 1319, 82–95. [Google Scholar] [CrossRef]
- Lamkanfi, M.; Dixit, V.M. Mechanisms and functions of inflammasomes. Cell 2014, 157, 1013–1022. [Google Scholar] [CrossRef]
- Youm, Y.-H.; Grant, R.W.; McCabe, L.R.; Albarado, D.C.; Nguyen, K.Y.; Ravussin, A.; Pistell, P.; Newman, S.; Carter, R.; Laque, A.; et al. Canonical Nlrp3 inflammasome links systemic low-grade inflammation to functional decline in aging. Cell Metab. 2013, 18, 519–532. [Google Scholar] [CrossRef][Green Version]
- Guo, H.; Callaway, J.B.; Ting, J.P.-Y. Inflammasomes: Mechanism of action, role in disease, and therapeutics. Nat. Med. 2015, 21, 677–687. [Google Scholar] [CrossRef][Green Version]
- Abais, J.M.; Xia, M.; Zhang, Y.; Boini, K.M.; Li, P.-L. Redox regulation of NLRP3 inflammasomes: ROS as trigger or effector? Antioxid. Redox Signal. 2015, 22, 1111–1129. [Google Scholar] [CrossRef][Green Version]
- Joffre, C.; Grégoire, S.; De Smedt, V.; Acar, N.; Bretillon, L.; Nadjar, A.; Layé, S. Modulation of brain PUFA content in different experimental models of mice. Prostaglandins Leukot. Essent. Fatty Acids 2016, 114, 1–10. [Google Scholar] [CrossRef]
- Carrie, I.; Clement, M.; de Javel, D.; Frances, H.; Bourre, J.M. Specific phospholipid fatty acid composition of brain regions in mice. Effects of n-3 polyunsaturated fatty acid deficiency and phospholipid supplementation. J. Lipid Res. 2000, 41, 465–472. [Google Scholar] [PubMed]
- Chung, W.L.; Chen, J.J.; Su, H.M. Fish oil supplementation of control and (n-3) fatty acid-deficient male rats enhances reference and working memory performance and increases brain regional docosahexaenoic acid levels. J. Nutr. 2008, 138, 1165–1171. [Google Scholar] [CrossRef] [PubMed]
- Little, S.J.; Lynch, M.A.; Manku, M.; Nicolaou, A. Docosahexaenoic acid-induced changes in phospholipids in cortex of young and aged rats: A lipidomic analysis. Prostaglandins Leukot Essent Fatty Acids 2007, 77, 155–162. [Google Scholar] [CrossRef] [PubMed]
- McNamara, R.K.; Carlson, S.E. Role of omega-3 fatty acids in brain development and function: Potential implications for the pathogenesis and prevention of psychopathology. Prostaglandins Leukot Essent Fatty Acids 2006, 75, 329–349. [Google Scholar] [CrossRef]
- Xiao, Y.; Huang, Y.; Chen, Z.Y. Distribution, depletion and recovery of docosahexaenoic acid are region-specific in rat brain. Br. J. Nutr. 2005, 94, 544–550. [Google Scholar] [CrossRef][Green Version]
- Chen, C.T.; Bazinet, R.P. beta-oxidation and rapid metabolism, but not uptake regulate brain eicosapentaenoic acid levels. Prostaglandins Leukot Essent Fatty Acids 2015, 92, 33–40. [Google Scholar] [CrossRef]
- Kidd, P.M. Omega-3 DHA and EPA for cognition, behavior, and mood: Clinical findings and structural-functional synergies with cell membrane phospholipids. Altern. Med. Rev. 2007, 12, 207–227. [Google Scholar]
- Plourde, M.; Cunnane, S.C. Extremely limited synthesis of long chain polyunsaturates in adults: Implications for their dietary essentiality and use as supplements. Appl. Physiol. Nutr. Metab. 2007, 32, 619–634. [Google Scholar] [CrossRef][Green Version]
- Burdge, G.C.; Calder, P.C. Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults. Reprod. Nutr. Dev. 2005, 45, 581–597. [Google Scholar] [CrossRef]
- Nichols, P.D.; Petrie, J.; Singh, S. Long-chain omega-3 oils-an update on sustainable sources. Nutrients 2010, 2, 572–585. [Google Scholar] [CrossRef][Green Version]
- Dantzer, R.; O’Connor, J.C.; Freund, G.G.; Johnson, R.W.; Kelley, K.W. From inflammation to sickness and depression: When the immune system subjugates the brain. Nat. Rev. Neurosci. 2008, 9, 46–56. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Joffre, C.; Rey, C.; Layé, S. N-3 Polyunsaturated Fatty Acids and the Resolution of Neuroinflammation. Front. Pharmacol. 2019, 10, 1022. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Laye, S.; Nadjar, A.; Joffre, C.; Bazinet, R.P. Anti-inflammatory effects of omega-3 fatty acids in the brain: Physiological mechanisms and relevance to pharmacology. Pharmacol. Rev. 2018. [Google Scholar] [CrossRef] [PubMed]
- Bazinet, R.P.; Layé, S. Polyunsaturated fatty acids and their metabolites in brain function and disease. Nat. Rev. Neurosci. 2014, 15, 771–785. [Google Scholar] [CrossRef]
- Calder, P.C. Polyunsaturated fatty acids and inflammation. Biochem. Soc. Trans. 2005, 33, 423–427. [Google Scholar] [CrossRef][Green Version]
- Calder, P.C. Omega-3 fatty acids and inflammatory processes: From molecules to man. Biochem. Soc. Trans. 2017, 45, 1105–1115. [Google Scholar] [CrossRef][Green Version]
- Serhan, C.N.; Clish, C.B.; Brannon, J.; Colgan, S.P.; Chiang, N.; Gronert, K. Novel functional sets of lipid-derived mediators with antiinflammatory actions generated from omega-3 fatty acids via cyclooxygenase 2-nonsteroidal antiinflammatory drugs and transcellular processing. J. Exp. Med. 2000, 192, 1197–1204. [Google Scholar] [CrossRef][Green Version]
- Serhan, C.N.; Hong, S.; Gronert, K.; Colgan, S.P.; Devchand, P.R.; Mirick, G.; Moussignac, R.L. Resolvins: A family of bioactive products of omega-3 fatty acid transformation circuits initiated by aspirin treatment that counter proinflammation signals. J. Exp. Med. 2002, 196, 1025–1037. [Google Scholar] [CrossRef][Green Version]
- Serhan, C.N.; Chiang, N.; Van Dyke, T.E. Resolving inflammation: Dual anti-inflammatory and pro-resolution lipid mediators. Nat. Rev. Immunol. 2008, 8, 349–361. [Google Scholar] [CrossRef][Green Version]
- Serhan, C.N. Pro-resolving lipid mediators are leads for resolution physiology. Nature 2014, 510, 92–101. [Google Scholar] [CrossRef][Green Version]
- Calder, P.C. n-3 fatty acids, inflammation and immunity: New mechanisms to explain old actions. Proc. Nutr. Soc. 2013, 72, 326–336. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Headland, S.E.; Norling, L.V. The resolution of inflammation: Principles and challenges. Semin. Immunol. 2015, 27, 149–160. [Google Scholar] [CrossRef] [PubMed]
- Serhan, C.N.; Chiang, N. Resolution phase lipid mediators of inflammation: Agonists of resolution. Curr. Opin. Pharmacol. 2013, 13, 632–640. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Massey, K.A.; Nicolaou, A. Lipidomics of oxidized polyunsaturated fatty acids. Free Radic. Biol. Med. 2013, 59, 45–55. [Google Scholar] [CrossRef]
- Colas, R.A.; Shinohara, M.; Dalli, J.; Chiang, N.; Serhan, C.N. Identification and signature profiles for pro-resolving and inflammatory lipid mediators in human tissue. Am. J. Physiol. Cell Physiol. 2014, 307, C39–C54. [Google Scholar] [CrossRef][Green Version]
- Serhan, C.N.; Chiang, N.; Dalli, J. New pro-resolving n-3 mediators bridge resolution of infectious inflammation to tissue regeneration. Mol. Aspects Med. 2018, 64, 1–17. [Google Scholar] [CrossRef]
- Shalini, S.-M.; Ho, C.F.-Y.; Ng, Y.-K.; Tong, J.-X.; Ong, E.-S.; Herr, D.R.; Dawe, G.S.; Ong, W.-Y. Distribution of Alox15 in the Rat Brain and Its Role in Prefrontal Cortical Resolvin D1 Formation and Spatial Working Memory. Mol. Neurobiol. 2018, 55, 1537–1550. [Google Scholar] [CrossRef][Green Version]
- Nadjar, A.; Tridon, V.; May, M.J.; Ghosh, S.; Dantzer, R.; Amedee, T.; Parnet, P. NFkappaB activates in vivo the synthesis of inducible Cox-2 in the brain. J. Cereb. Blood Flow Metab. 2005, 25, 1047–1059. [Google Scholar] [CrossRef][Green Version]
- Navarro-Mabarak, C.; Camacho-Carranza, R.; Espinosa-Aguirre, J.J. Cytochrome P450 in the central nervous system as a therapeutic target in neurodegenerative diseases. Drug Metab. Rev. 2018, 50, 95–108. [Google Scholar] [CrossRef]
- Rey, C.; Delpech, J.C.; Madore, C.; Nadjar, A.; Greenhalgh, A.D.; Amadieu, C.; Aubert, A.; Pallet, V.; Vaysse, C.; Layé, S.; et al. Dietary n-3 long chain PUFA supplementation promotes a pro-resolving oxylipin profile in the brain. Brain Behav. Immun. 2019, 76, 17–27. [Google Scholar] [CrossRef]
- Czapski, G.A.; Gajkowska, B.; Strosznajder, J.B. Systemic administration of lipopolysaccharide induces molecular and morphological alterations in the hippocampus. Brain Res. 2010, 1356, 85–94. [Google Scholar] [CrossRef]
- Schwab, J.M.; Chiang, N.; Arita, M.; Serhan, C.N. Resolvin E1 and protectin D1 activate inflammation-resolution programmes. Nature 2007, 447, 869–874. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Sun, L.; Xu, Y.W.; Han, J.; Liang, H.; Wang, N.; Cheng, Y. 12/15-Lipoxygenase metabolites of arachidonic acid activate PPARgamma: A possible neuroprotective effect in ischemic brain. J. Lipid Res. 2015, 56, 502–514. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Pratico, D.; Zhukareva, V.; Yao, Y.; Uryu, K.; Funk, C.D.; Lawson, J.A.; Trojanowski, J.Q.; Lee, V.M. 12/15-lipoxygenase is increased in Alzheimer’s disease: Possible involvement in brain oxidative stress. Am. J. Pathol. 2004, 164, 1655–1662. [Google Scholar] [CrossRef]
- Yigitkanli, K.; Zheng, Y.; Pekcec, A.; Lo, E.H.; van Leyen, K. Increased 12/15-Lipoxygenase Leads to Widespread Brain Injury Following Global Cerebral Ischemia. Transl. Stroke Res. 2017, 8, 194–202. [Google Scholar] [CrossRef][Green Version]
- Bystrom, J.; Wray, J.A.; Sugden, M.C.; Holness, M.J.; Swales, K.E.; Warner, T.D.; Edin, M.L.; Zeldin, D.C.; Gilroy, D.W.; Bishop-Bailey, D. Endogenous epoxygenases are modulators of monocyte/macrophage activity. PLoS ONE 2011, 6, e26591. [Google Scholar] [CrossRef][Green Version]
- Fleming, I. Cytochrome P450-dependent eicosanoid production and crosstalk. Curr. Opin. Lipidol. 2011, 22, 403–409. [Google Scholar] [CrossRef]
- Gilroy, D.W.; Edin, M.L.; De Maeyer, R.P.; Bystrom, J.; Newson, J.; Lih, F.B.; Stables, M.; Zeldin, D.C.; Bishop-Bailey, D. CYP450-derived oxylipins mediate inflammatory resolution. Proc. Natl. Acad. Sci. USA 2016, 113, E3240–E3249. [Google Scholar] [CrossRef][Green Version]
- Nebert, D.W.; Wikvall, K.; Miller, W.L. Human cytochromes P450 in health and disease. Philos. Trans. R. Soc. Lond. B Biol. Sci. 2013, 368, 20120431. [Google Scholar] [CrossRef]
- Levi, G.; Minghetti, L.; Aloisi, F. Regulation of prostanoid synthesis in microglial cells and effects of prostaglandin E2 on microglial functions. Biochimie 1998, 80, 899–904. [Google Scholar] [CrossRef]
- Farooqui, A.A.; Horrocks, L.A.; Farooqui, T. Modulation of inflammation in brain: A matter of fat. J. Neurochem. 2007, 101, 577–599. [Google Scholar] [CrossRef] [PubMed]
- Meyer, R.P.; Gehlhaus, M.; Knoth, R.; Volk, B. Expression and function of cytochrome p450 in brain drug metabolism. Curr. Drug Metab. 2007, 8, 297–306. [Google Scholar] [CrossRef] [PubMed]
- Volk, B.; Hettmannsperger, U.; Papp, T.; Amelizad, Z.; Oesch, F.; Knoth, R. Mapping of phenytoin-inducible cytochrome P450 immunoreactivity in the mouse central nervous system. Neuroscience 1991, 42, 215–235. [Google Scholar] [CrossRef]
- Barden, A.E.; Mas, E.; Mori, T.A. n-3 Fatty acid supplementation and proresolving mediators of inflammation. Curr. Opin. Lipidol. 2016, 27, 26–32. [Google Scholar] [CrossRef]
- Halade, G.V.; Black, L.M.; Verma, M.K. Paradigm shift - Metabolic transformation of docosahexaenoic and eicosapentaenoic acids to bioactives exemplify the promise of fatty acid drug discovery. Biotechnol. Adv. 2018, 36, 935–953. [Google Scholar] [CrossRef]
- Recchiuti, A. Resolvin D1 and its GPCRs in resolution circuits of inflammation. Prostaglandins Other Lipid Mediat. 2013, 107, 64–76. [Google Scholar] [CrossRef]
- Sun, Y.P.; Oh, S.F.; Uddin, J.; Yang, R.; Gotlinger, K.; Campbell, E.; Colgan, S.P.; Petasis, N.A.; Serhan, C.N. Resolvin D1 and its aspirin-triggered 17R epimer. Stereochemical assignments, anti-inflammatory properties, and enzymatic inactivation. J. Biol. Chem. 2007, 282, 9323–9334. [Google Scholar] [CrossRef][Green Version]
- Marcheselli, V.L.; Hong, S.; Lukiw, W.J.; Tian, X.H.; Gronert, K.; Musto, A.; Hardy, M.; Gimenez, J.M.; Chiang, N.; Serhan, C.N.; et al. Novel docosanoids inhibit brain ischemia-reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression. J. Biol. Chem. 2003, 278, 43807–43817. [Google Scholar] [CrossRef][Green Version]
- Mulik, R.S.; Bing, C.; Ladouceur-Wodzak, M.; Munaweera, I.; Chopra, R.; Corbin, I.R. Localized delivery of low-density lipoprotein docosahexaenoic acid nanoparticles to the rat brain using focused ultrasound. Biomaterials 2016, 83, 257–268. [Google Scholar] [CrossRef][Green Version]
- Sun, W.; Wang, Z.P.; Gui, P.; Xia, W.; Xia, Z.; Zhang, X.C.; Deng, Q.Z.; Xuan, W.; Marie, C.; Wang, L.L.; et al. Endogenous expression pattern of resolvin D1 in a rat model of self-resolution of lipopolysaccharide-induced acute respiratory distress syndrome and inflammation. Int. Immunopharmacol. 2014, 23, 247–253. [Google Scholar] [CrossRef]
- Krishnamoorthy, S.; Recchiuti, A.; Chiang, N.; Yacoubian, S.; Lee, C.H.; Yang, R.; Petasis, N.A.; Serhan, C.N. Resolvin D1 binds human phagocytes with evidence for proresolving receptors. Proc. Natl. Acad. Sci. USA 2010, 107, 1660–1665. [Google Scholar] [CrossRef][Green Version]
- Ho, C.F.-Y.; Ismail, N.B.; Koh, J.K.-Z.; Gunaseelan, S.; Low, Y.-H.; Ng, Y.-K.; Chua, J.J.-E.; Ong, W.-Y. Localisation of Formyl-Peptide Receptor 2 in the Rat Central Nervous System and Its Role in Axonal and Dendritic Outgrowth. Neurochem. Res. 2018, 43, 1587–1598. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Rey, C.; Nadjar, A.; Buaud, B.; Vaysse, C.; Aubert, A.; Pallet, V.; Laye, S.; Joffre, C. Resolvin D1 and E1 promote resolution of inflammation in microglial cells in vitro. Brain Behav. Immun. 2016, 55, 249–259. [Google Scholar] [CrossRef] [PubMed]
- Xu, Z.Z.; Zhang, L.; Liu, T.; Park, J.Y.; Berta, T.; Yang, R.; Serhan, C.N.; Ji, R.R. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat. Med. 2010, 16, 592–597, 1p following 597. [Google Scholar] [CrossRef][Green Version]
- Bisicchia, E.; Sasso, V.; Catanzaro, G.; Leuti, A.; Besharat, Z.M.; Chiacchiarini, M.; Molinari, M.; Ferretti, E.; Viscomi, M.T.; Chiurchiù, V. Resolvin D1 Halts Remote Neuroinflammation and Improves Functional Recovery after Focal Brain Damage Via ALX/FPR2 Receptor-Regulated MicroRNAs. Mol. Neurobiol. 2018, 55, 6894–6905. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Wang, X.; Zhu, M.; Hjorth, E.; Cortes-Toro, V.; Eyjolfsdottir, H.; Graff, C.; Nennesmo, I.; Palmblad, J.; Eriksdotter, M.; Sambamurti, K.; et al. Resolution of inflammation is altered in Alzheimer’s disease. Alzheimers Dement 2015, 11, 40–50. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Fredman, G.; Serhan, C.N. Specialized proresolving mediator targets for RvE1 and RvD1 in peripheral blood and mechanisms of resolution. Biochem. J. 2011, 437, 185–197. [Google Scholar] [CrossRef] [PubMed]
- Krishnamoorthy, S.; Recchiuti, A.; Chiang, N.; Fredman, G.; Serhan, C.N. Resolvin D1 receptor stereoselectivity and regulation of inflammation and proresolving microRNAs. Am. J. Pathol. 2012, 180, 2018–2027. [Google Scholar] [CrossRef][Green Version]
- Recchiuti, A.; Krishnamoorthy, S.; Fredman, G.; Chiang, N.; Serhan, C.N. MicroRNAs in resolution of acute inflammation: Identification of novel resolvin D1-miRNA circuits. FASEB J. 2011, 25, 544–560. [Google Scholar] [CrossRef][Green Version]
- Aursnes, M.; Tungen, J.E.; Vik, A.; Colas, R.; Cheng, C.-Y.C.; Dalli, J.; Serhan, C.N.; Hansen, T.V. Total synthesis of the lipid mediator PD1n-3 DPA: Configurational assignments and anti-inflammatory and pro-resolving actions. J. Nat. Prod. 2014, 77, 910–916. [Google Scholar] [CrossRef]
- Doyle, R.; Sadlier, D.M.; Godson, C. Pro-resolving lipid mediators: Agents of anti-ageing? Semin. Immunol. 2018, 40, 36–48. [Google Scholar] [CrossRef] [PubMed]
- Hong, S.; Gronert, K.; Devchand, P.R.; Moussignac, R.L.; Serhan, C.N. Novel docosatrienes and 17S-resolvins generated from docosahexaenoic acid in murine brain, human blood, and glial cells. Autacoids in anti-inflammation. J. Biol. Chem. 2003, 278, 14677–14687. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kuda, O. Bioactive metabolites of docosahexaenoic acid. Biochimie 2017, 136, 12–20. [Google Scholar] [CrossRef] [PubMed]
- Serhan, C.N.; Yang, R.; Martinod, K.; Kasuga, K.; Pillai, P.S.; Porter, T.F.; Oh, S.F.; Spite, M. Maresins: Novel macrophage mediators with potent antiinflammatory and proresolving actions. J. Exp. Med. 2009, 206, 15–23. [Google Scholar] [CrossRef][Green Version]
- Orr, S.K.; Palumbo, S.; Bosetti, F.; Mount, H.T.; Kang, J.X.; Greenwood, C.E.; Ma, D.W.; Serhan, C.N.; Bazinet, R.P. Unesterified docosahexaenoic acid is protective in neuroinflammation. J. Neurochem. 2013, 127, 378–393. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Zhu, M.; Wang, X.; Hjorth, E.; Colas, R.A.; Schroeder, L.; Granholm, A.C.; Serhan, C.N.; Schultzberg, M. Pro-Resolving Lipid Mediators Improve Neuronal Survival and Increase Abeta42 Phagocytosis. Mol. Neurobiol. 2016, 53, 2733–2749. [Google Scholar] [CrossRef] [PubMed]
- Lukiw, W.J.; Cui, J.G.; Marcheselli, V.L.; Bodker, M.; Botkjaer, A.; Gotlinger, K.; Serhan, C.N.; Bazan, N.G. A role for docosahexaenoic acid-derived neuroprotectin D1 in neural cell survival and Alzheimer disease. J. Clin. Investig. 2005, 115, 2774–2783. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Qu, L.; Caterina, M.J. Accelerating the reversal of inflammatory pain with NPD1 and its receptor GPR37. J. Clin. Investig. 2018, 128, 3246–3249. [Google Scholar] [CrossRef][Green Version]
- Bazan, N.G.; Eady, T.N.; Khoutorova, L.; Atkins, K.D.; Hong, S.; Lu, Y.; Zhang, C.; Jun, B.; Obenaus, A.; Fredman, G.; et al. Novel aspirin-triggered neuroprotectin D1 attenuates cerebral ischemic injury after experimental stroke. Exp. Neurol. 2012, 236, 122–130. [Google Scholar] [CrossRef][Green Version]
- Yao, C.; Zhang, J.; Chen, F.; Lin, Y. Neuroprotectin D1 attenuates brain damage induced by transient middle cerebral artery occlusion in rats through TRPC6/CREB pathways. Mol. Med. Rep. 2013, 8, 543–550. [Google Scholar] [CrossRef] [PubMed]
- Xian, W.; Wu, Y.; Xiong, W.; Li, L.; Li, T.; Pan, S.; Song, L.; Hu, L.; Pei, L.; Yao, S.; et al. The pro-resolving lipid mediator Maresin 1 protects against cerebral ischemia/reperfusion injury by attenuating the pro-inflammatory response. Biochem. Biophys. Res. Commun. 2016, 472, 175–181. [Google Scholar] [CrossRef] [PubMed]
- Xian, W.; Li, T.; Li, L.; Hu, L.; Cao, J. Maresin 1 attenuates the inflammatory response and mitochondrial damage in mice with cerebral ischemia/reperfusion in a SIRT1-dependent manner. Brain Res. 2019, 1711, 83–90. [Google Scholar] [CrossRef] [PubMed]
- Francos-Quijorna, I.; Santos-Nogueira, E.; Gronert, K.; Sullivan, A.B.; Kopp, M.A.; Brommer, B.; David, S.; Schwab, J.M.; López-Vales, R. Maresin 1 Promotes Inflammatory Resolution, Neuroprotection, and Functional Neurological Recovery After Spinal Cord Injury. J. Neurosci. 2017, 37, 11731–11743. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Ohira, T.; Arita, M.; Omori, K.; Recchiuti, A.; Van Dyke, T.E.; Serhan, C.N. Resolvin E1 receptor activation signals phosphorylation and phagocytosis. J. Biol. Chem. 2010, 285, 3451–3461. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Isobe, Y.; Arita, M.; Matsueda, S.; Iwamoto, R.; Fujihara, T.; Nakanishi, H.; Taguchi, R.; Masuda, K.; Sasaki, K.; Urabe, D.; et al. Identification and structure determination of novel anti-inflammatory mediator resolvin E3, 17,18-dihydroxyeicosapentaenoic acid. J. Biol. Chem. 2012, 287, 10525–10534. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Chen, C.T.; Liu, Z.; Bazinet, R.P. Rapid de-esterification and loss of eicosapentaenoic acid from rat brain phospholipids: An intracerebroventricular study. J. Neurochem. 2011, 116, 363–373. [Google Scholar] [CrossRef]
- Siegert, E.; Paul, F.; Rothe, M.; Weylandt, K.H. The effect of omega-3 fatty acids on central nervous system remyelination in fat-1 mice. BMC Neurosci. 2017, 18, 19. [Google Scholar] [CrossRef][Green Version]
- Arita, M.; Ohira, T.; Sun, Y.P.; Elangovan, S.; Chiang, N.; Serhan, C.N. Resolvin E1 selectively interacts with leukotriene B4 receptor BLT1 and ChemR23 to regulate inflammation. J. Immunol. 2007, 178, 3912–3917. [Google Scholar] [CrossRef][Green Version]
- Guo, X.; Fu, Y.; Xu, Y.; Weng, S.; Liu, D.; Cui, D.; Yu, S.; Liu, X.; Jiang, K.; Dong, Y. Chronic mild restraint stress rats decreased CMKLR1 expression in distinct brain region. Neurosci. Lett. 2012, 524, 25–29. [Google Scholar] [CrossRef]
- Graham, K.L.; Zabel, B.A.; Loghavi, S.; Zuniga, L.A.; Ho, P.P.; Sobel, R.A.; Butcher, E.C. Chemokine-like receptor-1 expression by central nervous system-infiltrating leukocytes and involvement in a model of autoimmune demyelinating disease. J. Immunol. 2009, 183, 6717–6723. [Google Scholar] [CrossRef]
- Famenini, S.; Rigali, E.A.; Olivera-Perez, H.M.; Dang, J.; Chang, M.T.; Halder, R.; Rao, R.V.; Pellegrini, M.; Porter, V.; Bredesen, D.; et al. Increased intermediate M1-M2 macrophage polarization and improved cognition in mild cognitive impairment patients on omega-3 supplementation. FASEB J. 2017, 31, 148–160. [Google Scholar] [CrossRef] [PubMed]
- Mizwicki, M.T.; Liu, G.; Fiala, M.; Magpantay, L.; Sayre, J.; Siani, A.; Mahanian, M.; Weitzman, R.; Hayden, E.Y.; Rosenthal, M.J.; et al. 1alpha,25-dihydroxyvitamin D3 and resolvin D1 retune the balance between amyloid-beta phagocytosis and inflammation in Alzheimer’s disease patients. J. Alzheimers Dis. 2013, 34, 155–170. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Krashia, P.; Cordella, A.; Nobili, A.; La Barbera, L.; Federici, M.; Leuti, A.; Campanelli, F.; Natale, G.; Marino, G.; Calabrese, V.; et al. Blunting neuroinflammation with resolvin D1 prevents early pathology in a rat model of Parkinson’s disease. Nat. Commun. 2019, 10, 3945. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kok Kendirlioglu, B.; Unalan Ozpercin, P.; Yuksel Oksuz, O.; Sozen, S.; Cihnioglu, R.; Kalelioglu, T.; Ilnem, M.C.; Karamustafalioglu, N. Resolvin D1 as a novel anti-inflammatory marker in manic, depressive and euthymic states of bipolar disorder. Nord. J. Psychiatry 2020, 74, 83–88. [Google Scholar] [CrossRef] [PubMed]
- Uno, H.; Furukawa, K.; Suzuki, D.; Shimizu, H.; Ohtsuka, M.; Kato, A.; Yoshitomi, H.; Miyazaki, M. Immunonutrition suppresses acute inflammatory responses through modulation of resolvin E1 in patients undergoing major hepatobiliary resection. Surgery 2016, 160, 228–236. [Google Scholar] [CrossRef] [PubMed]
- Hiram, R.; Rizcallah, E.; Marouan, S.; Sirois, C.; Sirois, M.; Morin, C.; Fortin, S.; Rousseau, E. Resolvin E1 normalizes contractility, Ca2+ sensitivity and smooth muscle cell migration rate in TNF-α- and IL-6-pretreated human pulmonary arteries. Am. J. Physiol. Lung Cell Mol. Physiol. 2015, 309, L776–L788. [Google Scholar] [CrossRef] [PubMed]
- Gyurko, R.; Van Dyke, T.E. The role of polyunsaturated ω-3 fatty acid eicosapentaenoic acid-derived resolvin E1 (RvE1) in bone preservation. Crit. Rev. Immunol. 2014, 34, 347–357. [Google Scholar] [CrossRef]
- Sordi, R.; Chiazza, F.; Collotta, D.; Migliaretti, G.; Colas, R.A.; Vulliamy, P.; Brohi, K.; Dalli, J.; Collino, M.; Thiemermann, C. Resolvin D1 Attenuates the Organ Injury Associated With Experimental Hemorrhagic Shock. Ann. Surg. 2019. [Google Scholar] [CrossRef]
- Yin, Y.; Chen, F.; Wang, W.; Wang, H.; Zhang, X. Resolvin D1 inhibits inflammatory response in STZ-induced diabetic retinopathy rats: Possible involvement of NLRP3 inflammasome and NF-κB signaling pathway. Mol. Vis. 2017, 23, 242–250. [Google Scholar]
- Liu, W.; Huang, J.; Doycheva, D.; Gamdzyk, M.; Tang, J.; Zhang, J.H. RvD1binding with FPR2 attenuates inflammation via Rac1/NOX2 pathway after neonatal hypoxic-ischemic injury in rats. Exp. Neurol. 2019, 320, 112982. [Google Scholar] [CrossRef]
- Rossi, S.; Di Filippo, C.; Gesualdo, C.; Potenza, N.; Russo, A.; Trotta, M.C.; Zippo, M.V.; Maisto, R.; Ferraraccio, F.; Simonelli, F.; et al. Protection from endotoxic uveitis by intravitreal Resolvin D1: Involvement of lymphocytes, miRNAs, ubiquitin-proteasome, and M1/M2 macrophages. Mediat. Inflamm. 2015, 2015, 149381. [Google Scholar] [CrossRef]
- Titos, E.; Rius, B.; Gonzalez-Periz, A.; Lopez-Vicario, C.; Moran-Salvador, E.; Martinez-Clemente, M.; Arroyo, V.; Claria, J. Resolvin D1 and its precursor docosahexaenoic acid promote resolution of adipose tissue inflammation by eliciting macrophage polarization toward an M2-like phenotype. J. Immunol. 2011, 187, 5408–5418. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Li, L.; Wu, Y.; Wang, Y.; Wu, J.; Song, L.; Xian, W.; Yuan, S.; Pei, L.; Shang, Y. Resolvin D1 promotes the interleukin-4-induced alternative activation in BV-2 microglial cells. J. Neuroinflammation 2014, 11, 72. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Abdelmoaty, S.; Wigerblad, G.; Bas, D.B.; Codeluppi, S.; Fernandez-Zafra, T.; El-Awady el, S.; Moustafa, Y.; Abdelhamid Ael, D.; Brodin, E.; Svensson, C.I. Spinal actions of lipoxin A4 and 17(R)-resolvin D1 attenuate inflammation-induced mechanical hypersensitivity and spinal TNF release. PLoS ONE 2013, 8, e75543. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kantarci, A.; Aytan, N.; Palaska, I.; Stephens, D.; Crabtree, L.; Benincasa, C.; Jenkins, B.G.; Carreras, I.; Dedeoglu, A. Combined administration of resolvin E1 and lipoxin A4 resolves inflammation in a murine model of Alzheimer’s disease. Exp. Neurol. 2018, 300, 111–120. [Google Scholar] [CrossRef] [PubMed]
- Harrison, J.L.; Rowe, R.K.; Ellis, T.W.; Yee, N.S.; O’Hara, B.F.; Adelson, P.D.; Lifshitz, J. Resolvins AT-D1 and E1 differentially impact functional outcome, post-traumatic sleep, and microglial activation following diffuse brain injury in the mouse. Brain Behav. Immun. 2015, 47, 131–140. [Google Scholar] [CrossRef][Green Version]
- Terrando, N.; Gomez-Galan, M.; Yang, T.; Carlstrom, M.; Gustavsson, D.; Harding, R.E.; Lindskog, M.; Eriksson, L.I. Aspirin-triggered resolvin D1 prevents surgery-induced cognitive decline. FASEB J. 2013, 27, 3564–3571. [Google Scholar] [CrossRef][Green Version]
- Delpech, J.-C.; Madore, C.; Joffre, C.; Aubert, A.; Kang, J.X.; Nadjar, A.; Layé, S. Transgenic increase in n-3/n-6 fatty acid ratio protects against cognitive deficits induced by an immune challenge through decrease of neuroinflammation. Neuropsychopharmacology 2015, 40, 525–536. [Google Scholar] [CrossRef][Green Version]
- Luo, C.; Ren, H.; Wan, J.B.; Yao, X.; Zhang, X.; He, C.; So, K.F.; Kang, J.X.; Pei, Z.; Su, H. Enriched endogenous omega-3 fatty acids in mice protect against global ischemia injury. J. Lipid Res. 2014, 55, 1288–1297. [Google Scholar] [CrossRef][Green Version]
- Furuyashiki, T.; Akiyama, S.; Kitaoka, S. Roles of multiple lipid mediators in stress and depression. Int. Immunol. 2019, 579–587. [Google Scholar] [CrossRef]
- Deyama, S.; Ishikawa, Y.; Yoshikawa, K.; Shimoda, K.; Ide, S.; Satoh, M.; Minami, M. Resolvin D1 and D2 Reverse Lipopolysaccharide-Induced Depression-Like Behaviors Through the mTORC1 Signaling Pathway. Int. J. Neuropsychopharmacol 2017, 20, 575–584. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Deyama, S.; Shimoda, K.; Suzuki, H.; Ishikawa, Y.; Ishimura, K.; Fukuda, H.; Hitora-Imamura, N.; Ide, S.; Satoh, M.; Kaneda, K.; et al. Resolvin E1/E2 ameliorate lipopolysaccharide-induced depression-like behaviors via ChemR23. Psychopharmacology (Berl.) 2018, 235, 329–336. [Google Scholar] [CrossRef] [PubMed]
- Deyama, S.; Shimoda, K.; Ikeda, H.; Fukuda, H.; Shuto, S.; Minami, M. Resolvin E3 attenuates lipopolysaccharide-induced depression-like behavior in mice. J. Pharmacol. Sci. 2018, 138, 86–88. [Google Scholar] [CrossRef] [PubMed]
- Klein, C.P.; Sperotto, N.D.; Maciel, I.S.; Leite, C.E.; Souza, A.H.; Campos, M.M. Effects of D-series resolvins on behavioral and neurochemical changes in a fibromyalgia-like model in mice. Neuropharmacology 2014, 86, 57–66. [Google Scholar] [CrossRef] [PubMed]
- Gilbert, K.; Bernier, J.; Godbout, R.; Rousseau, G. Resolvin D1, a metabolite of omega-3 polyunsaturated fatty acid, decreases post-myocardial infarct depression. Mar. Drugs 2014, 12, 5396–5407. [Google Scholar] [CrossRef][Green Version]
- Ishikawa, Y.; Deyama, S.; Shimoda, K.; Yoshikawa, K.; Ide, S.; Satoh, M.; Minami, M. Rapid and sustained antidepressant effects of resolvin D1 and D2 in a chronic unpredictable stress model. Behav. Brain Res. 2017, 332, 233–236. [Google Scholar] [CrossRef]
- Xu, Z.Z.; Bertz, T.; Ji, R.R. Resolvin E1 inhibits neuropathic pain and spinal cord microglial activation following peripheral nerve injury. J. Neuroimmune Pharmacol. 2013, 8, 37–41. [Google Scholar] [CrossRef][Green Version]
- Zhu, M.; Wang, X.; Schultzberg, M.; Hjorth, E. Differential regulation of resolution in inflammation induced by amyloid-β42 and lipopolysaccharides in human microglia. J. Alzheimers Dis. 2015, 43, 1237–1250. [Google Scholar] [CrossRef][Green Version]
- Tian, Y.; Zhang, Y.; Zhang, R.; Qiao, S.; Fan, J. Resolvin D2 recovers neural injury by suppressing inflammatory mediators expression in lipopolysaccharide-induced Parkinson’s disease rat model. Biochem. Biophys. Res. Commun. 2015, 460, 799–805. [Google Scholar] [CrossRef]
- Shevalye, H.; Yorek, M.S.; Coppey, L.J.; Holmes, A.; Harper, M.M.; Kardon, R.H.; Yorek, M.A. Effect of enriching the diet with menhaden oil or daily treatment with resolvin D1 on neuropathy in a mouse model of type 2 diabetes. J. Neurophysiol. 2015, 114, 199–208. [Google Scholar] [CrossRef][Green Version]
- Xu, J.; Gao, X.; Yang, C.; Chen, L.; Chen, Z. Resolvin D1 Attenuates Mpp+-Induced Parkinson Disease via Inhibiting Inflammation in PC12 Cells. Med. Sci. Monit. 2017, 23, 2684–2691. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Benabdoun, H.A.; Kulbay, M.; Rondon, E.-P.; Vallières, F.; Shi, Q.; Fernandes, J.; Fahmi, H.; Benderdour, M. In vitro and in vivo assessment of the proresolutive and antiresorptive actions of resolvin D1: Relevance to arthritis. Arthritis Res. Ther. 2019, 21, 72. [Google Scholar] [CrossRef][Green Version]
- Schmid, M.; Gemperle, C.; Rimann, N.; Hersberger, M. Resolvin D1 Polarizes Primary Human Macrophages toward a Proresolution Phenotype through GPR32. J. Immunol. 2016, 196, 3429–3437. [Google Scholar] [CrossRef] [PubMed][Green Version]
- McNamara, R.K.; Able, J.; Jandacek, R.; Rider, T.; Tso, P. Inbred C57BL/6J and DBA/2J mouse strains exhibit constitutive differences in regional brain fatty acid composition. Lipids 2009, 44, 1–8. [Google Scholar] [CrossRef] [PubMed]
- Söderberg, M.; Edlund, C.; Kristensson, K.; Dallner, G. Fatty acid composition of brain phospholipids in aging and in Alzheimer’s disease. Lipids 1991, 26, 421–425. [Google Scholar] [CrossRef] [PubMed]
- McNamara, R.K.; Liu, Y.; Jandacek, R.; Rider, T.; Tso, P. The aging human orbitofrontal cortex: Decreasing polyunsaturated fatty acid composition and associated increases in lipogenic gene expression and stearoyl-CoA desaturase activity. Prostaglandins Leukot. Essent. Fatty Acids 2008, 78, 293–304. [Google Scholar] [CrossRef][Green Version]
- Barceló-Coblijn, G.; Högyes, E.; Kitajka, K.; Puskás, L.G.; Zvara, A.; Hackler, L.; Nyakas, C.; Penke, Z.; Farkas, T. Modification by docosahexaenoic acid of age-induced alterations in gene expression and molecular composition of rat brain phospholipids. Proc. Natl. Acad. Sci. USA 2003, 100, 11321–11326. [Google Scholar] [CrossRef][Green Version]
- Dyall, S.C.; Michael, G.J.; Whelpton, R.; Scott, A.G.; Michael-Titus, A.T. Dietary enrichment with omega-3 polyunsaturated fatty acids reverses age-related decreases in the GluR2 and NR2B glutamate receptor subunits in rat forebrain. Neurobiol. Aging 2007, 28, 424–439. [Google Scholar] [CrossRef]
- Latour, A.; Grintal, B.; Champeil-Potokar, G.; Hennebelle, M.; Lavialle, M.; Dutar, P.; Potier, B.; Billard, J.-M.; Vancassel, S.; Denis, I. Omega-3 fatty acids deficiency aggravates glutamatergic synapse and astroglial aging in the rat hippocampal CA1. Aging Cell 2013, 12, 76–84. [Google Scholar] [CrossRef][Green Version]
- Arranz, L.; Naudí, A.; De la Fuente, M.; Pamplona, R. Exceptionally old mice are highly resistant to lipoxidation-derived molecular damage. Age (Dordr.) 2013, 35, 621–635. [Google Scholar] [CrossRef][Green Version]
- Favrelière, S.; Perault, M.C.; Huguet, F.; De Javel, D.; Bertrand, N.; Piriou, A.; Durand, G. DHA-enriched phospholipid diets modulate age-related alterations in rat hippocampus. Neurobiol. Aging 2003, 24, 233–243. [Google Scholar] [CrossRef]
- Drozdowski, L.; Thomson, A.B.R. Aging and the intestine. World J. Gastroenterol. 2006, 12, 7578–7584. [Google Scholar] [CrossRef] [PubMed]
- Kuo, Y.-T.; So, P.-W.; Parkinson, J.R.; Yu, W.S.; Hankir, M.; Herlihy, A.H.; Goldstone, A.P.; Frost, G.S.; Wasserfall, C.; Bell, J.D. The combined effects on neuronal activation and blood-brain barrier permeability of time and n-3 polyunsaturated fatty acids in mice, as measured in vivo using MEMRI. Neuroimage 2010, 50, 1384–1391. [Google Scholar] [CrossRef] [PubMed]
- Yehuda, S.; Rabinovitz, S.; Mostofsky, D.I. Essential fatty acids and the brain: From infancy to aging. Neurobiol. Aging 2005, 26 (Suppl. S1), 98–102. [Google Scholar] [CrossRef]
- Ilincheta de Boschero, M.G.; Roque, M.E.; Salvador, G.A.; Giusto, N.M. Alternative pathways for phospholipid synthesis in different brain areas during aging. Exp. Gerontol. 2000, 35, 653–668. [Google Scholar] [CrossRef]
- Bourre, J.M.; Piciotti, M. Delta-6 desaturation of alpha-linolenic acid in brain and liver during development and aging in the mouse. Neurosci. Lett. 1992, 141, 65–68. [Google Scholar] [CrossRef]
- Kumar, V.B.; Vyas, K.; Buddhiraju, M.; Alshaher, M.; Flood, J.F.; Morley, J.E. Changes in membrane fatty acids and delta-9 desaturase in senescence accelerated (SAMP8) mouse hippocampus with aging. Life Sci. 1999, 65, 1657–1662. [Google Scholar] [CrossRef]
- Lemaitre, R.N.; Tanaka, T.; Tang, W.; Manichaikul, A.; Foy, M.; Kabagambe, E.K.; Nettleton, J.A.; King, I.B.; Weng, L.-C.; Bhattacharya, S.; et al. Genetic loci associated with plasma phospholipid n-3 fatty acids: A meta-analysis of genome-wide association studies from the CHARGE Consortium. PLoS Genet. 2011, 7, e1002193. [Google Scholar] [CrossRef][Green Version]
- Cini, M.; Moretti, A. Studies on lipid peroxidation and protein oxidation in the aging brain. Neurobiol. Aging 1995, 16, 53–57. [Google Scholar] [CrossRef]
- Dei, R.; Takeda, A.; Niwa, H.; Li, M.; Nakagomi, Y.; Watanabe, M.; Inagaki, T.; Washimi, Y.; Yasuda, Y.; Horie, K.; et al. Lipid peroxidation and advanced glycation end products in the brain in normal aging and in Alzheimer’s disease. Acta Neuropathol. 2002, 104, 113–122. [Google Scholar] [CrossRef]
- Beydoun, M.A.; Kaufman, J.S.; Satia, J.A.; Rosamond, W.; Folsom, A.R. Plasma n-3 fatty acids and the risk of cognitive decline in older adults: The Atherosclerosis Risk in Communities Study. Am. J. Clin. Nutr. 2007, 85, 1103–1111. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Heude, B.; Ducimetière, P.; Berr, C. EVA Study Cognitive decline and fatty acid composition of erythrocyte membranes—The EVA Study. Am. J. Clin. Nutr. 2003, 77, 803–808. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Solfrizzi, V.; Colacicco, A.M.; D’Introno, A.; Capurso, C.; Torres, F.; Rizzo, C.; Capurso, A.; Panza, F. Dietary intake of unsaturated fatty acids and age-related cognitive decline: A 8.5-year follow-up of the Italian Longitudinal Study on Aging. Neurobiol. Aging 2006, 27, 1694–1704. [Google Scholar] [CrossRef] [PubMed]
- Suzuki, H.; Hayakawa, S.; Wada, S. Effect of age on the modification of brain polyunsaturated fatty acids and enzyme activities by fish oil diet in rats. Mech. Ageing Dev. 1989, 50, 17–25. [Google Scholar] [PubMed]
- Lim, S.Y.; Suzuki, H. Intakes of dietary docosahexaenoic acid ethyl ester and egg phosphatidylcholine improve maze-learning ability in young and old mice. J. Nutr. 2000, 130, 1629–1632. [Google Scholar] [CrossRef] [PubMed]
- Catalan, J.; Moriguchi, T.; Slotnick, B.; Murthy, M.; Greiner, R.S.; Salem, N. Cognitive deficits in docosahexaenoic acid-deficient rats. Behav. Neurosci. 2002, 116, 1022–1031. [Google Scholar] [CrossRef]
- Lafourcade, M.; Larrieu, T.; Mato, S.; Duffaud, A.; Sepers, M.; Matias, I.; De Smedt-Peyrusse, V.; Labrousse, V.F.; Bretillon, L.; Matute, C.; et al. Nutritional omega-3 deficiency abolishes endocannabinoid-mediated neuronal functions. Nat. Neurosci. 2011, 14, 345–350. [Google Scholar] [CrossRef][Green Version]
- Thomazeau, A.; Bosch-Bouju, C.; Manzoni, O.; Layé, S. Nutritional n-3 PUFA Deficiency Abolishes Endocannabinoid Gating of Hippocampal Long-Term Potentiation. Cereb. Cortex 2017, 27, 2571–2579. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Manduca, A.; Bara, A.; Larrieu, T.; Lassalle, O.; Joffre, C.; Layé, S.; Manzoni, O.J. Amplification of mGlu5-Endocannabinoid Signaling Rescues Behavioral and Synaptic Deficits in a Mouse Model of Adolescent and Adult Dietary Polyunsaturated Fatty Acid Imbalance. J. Neurosci. 2017, 37, 6851–6868. [Google Scholar] [CrossRef][Green Version]
- Larrieu, T.; Hilal, M.L.; Hilal, L.M.; Fourrier, C.; De Smedt-Peyrusse, V.; Sans, N.N.S.; Capuron, L.; Layé, S. Nutritional omega-3 modulates neuronal morphology in the prefrontal cortex along with depression-related behaviour through corticosterone secretion. Transl. Psychiatry 2014, 4, e437. [Google Scholar] [CrossRef][Green Version]
- Mingam, R.; Moranis, A.; Bluthé, R.-M.; De Smedt-Peyrusse, V.; Kelley, K.W.; Guesnet, P.; Lavialle, M.; Dantzer, R.; Layé, S. Uncoupling of interleukin-6 from its signalling pathway by dietary n-3-polyunsaturated fatty acid deprivation alters sickness behaviour in mice. Eur. J. Neurosci. 2008, 28, 1877–1886. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Delpech, J.-C.; Thomazeau, A.; Madore, C.; Bosch-Bouju, C.; Larrieu, T.; Lacabanne, C.; Remus-Borel, J.; Aubert, A.; Joffre, C.; Nadjar, A.; et al. Dietary n-3 PUFAs Deficiency Increases Vulnerability to Inflammation-Induced Spatial Memory Impairment. Neuropsychopharmacology 2015, 40, 2774–2787. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Caligiuri, S.P.B.; Aukema, H.M.; Ravandi, A.; Pierce, G.N. Elevated levels of pro-inflammatory oxylipins in older subjects are normalized by flaxseed consumption. Exp. Gerontol. 2014, 59, 51–57. [Google Scholar] [CrossRef] [PubMed]
- Caligiuri, S.P.B.; Parikh, M.; Stamenkovic, A.; Pierce, G.N.; Aukema, H.M. Dietary modulation of oxylipins in cardiovascular disease and aging. Am. J. Physiol. Heart Circ. Physiol. 2017, 313, H903–H918. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Gangemi, S.; Pescara, L.; D’Urbano, E.; Basile, G.; Nicita-Mauro, V.; Davì, G.; Romano, M. Aging is characterized by a profound reduction in anti-inflammatory lipoxin A4 levels. Exp. Gerontol. 2005, 40, 612–614. [Google Scholar] [CrossRef]
- Wang, X.; Puerta, E.; Cedazo-Minguez, A.; Hjorth, E.; Schultzberg, M. Insufficient resolution response in the hippocampus of a senescence-accelerated mouse model--SAMP8. J. Mol. Neurosci. 2015, 55, 396–405. [Google Scholar] [CrossRef][Green Version]
- Arnardottir, H.H.; Dalli, J.; Norling, L.V.; Colas, R.A.; Perretti, M.; Serhan, C.N. Resolvin D3 Is Dysregulated in Arthritis and Reduces Arthritic Inflammation. J. Immunol. 2016, 197, 2362–2368. [Google Scholar] [CrossRef][Green Version]
- Joffre, C. Polyunsaturated fatty acid metabolism in the brain and brain cells. In Feed Your Mind. How Does Nutrition Modulate Brain Function Throughout Life; IntechOpen: London, UK, 2019; pp. 13–36. [Google Scholar]
- Barberger-Gateau, P. Association between Mediterranean Diet and late-life cognition. JAMA 2009, 302, 2433, author reply 2433. [Google Scholar] [CrossRef]
- Tan, Z.S.; Harris, W.S.; Beiser, A.S.; Au, R.; Himali, J.J.; Debette, S.; Pikula, A.; Decarli, C.; Wolf, P.A.; Vasan, R.S.; et al. Red blood cell ω-3 fatty acid levels and markers of accelerated brain aging. Neurology 2012, 78, 658–664. [Google Scholar] [CrossRef][Green Version]
- Titova, O.E.; Sjögren, P.; Brooks, S.J.; Kullberg, J.; Ax, E.; Kilander, L.; Riserus, U.; Cederholm, T.; Larsson, E.-M.; Johansson, L.; et al. Dietary intake of eicosapentaenoic and docosahexaenoic acids is linked to gray matter volume and cognitive function in elderly. Age (Dordr.) 2013, 35, 1495–1505. [Google Scholar] [CrossRef][Green Version]
- Whalley, L.J.; Fox, H.C.; Wahle, K.W.; Starr, J.M.; Deary, I.J. Cognitive aging, childhood intelligence, and the use of food supplements: Possible involvement of n-3 fatty acids. Am. J. Clin. Nutr. 2004, 80, 1650–1657. [Google Scholar] [CrossRef] [PubMed]
- Morris, M.C.; Evans, D.A.; Bienias, J.L.; Tangney, C.C.; Bennett, D.A.; Wilson, R.S.; Aggarwal, N.; Schneider, J. Consumption of fish and n-3 fatty acids and risk of incident Alzheimer disease. Arch. Neurol. 2003, 60, 940–946. [Google Scholar] [CrossRef] [PubMed]
- Barberger-Gateau, P.; Raffaitin, C.; Letenneur, L.; Berr, C.; Tzourio, C.; Dartigues, J.F.; Alpérovitch, A. Dietary patterns and risk of dementia: The Three-City cohort study. Neurology 2007, 69, 1921–1930. [Google Scholar] [CrossRef] [PubMed]
- Devore, E.E.; Grodstein, F.; van Rooij, F.J.A.; Hofman, A.; Rosner, B.; Stampfer, M.J.; Witteman, J.C.M.; Breteler, M.M.B. Dietary intake of fish and omega-3 fatty acids in relation to long-term dementia risk. Am. J. Clin. Nutr. 2009, 90, 170–176. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kalmijn, S.; van Boxtel, M.P.J.; Ocké, M.; Verschuren, W.M.M.; Kromhout, D.; Launer, L.J. Dietary intake of fatty acids and fish in relation to cognitive performance at middle age. Neurology 2004, 62, 275–280. [Google Scholar] [CrossRef]
- González, S.; Huerta, J.M.; Fernández, S.; Patterson, A.M.; Lasheras, C. The relationship between dietary lipids and cognitive performance in an elderly population. Int. J. Food Sci. Nutr. 2010, 61, 217–225. [Google Scholar] [CrossRef]
- Yurko-Mauro, K.; Alexander, D.D.; Van Elswyk, M.E. Docosahexaenoic acid and adult memory: A systematic review and meta-analysis. PLoS ONE 2015, 10, e0120391. [Google Scholar] [CrossRef][Green Version]
- McNamara, R.K.; Kalt, W.; Shidler, M.D.; McDonald, J.; Summer, S.S.; Stein, A.L.; Stover, A.N.; Krikorian, R. Cognitive response to fish oil, blueberry, and combined supplementation in older adults with subjective cognitive impairment. Neurobiol. Aging 2018, 64, 147–156. [Google Scholar] [CrossRef]
- Ferrucci, L.; Cherubini, A.; Bandinelli, S.; Bartali, B.; Corsi, A.; Lauretani, F.; Martin, A.; Andres-Lacueva, C.; Senin, U.; Guralnik, J.M. Relationship of plasma polyunsaturated fatty acids to circulating inflammatory markers. J. Clin. Endocrinol. Metab. 2006, 91, 439–446. [Google Scholar] [CrossRef]
- Alfano, C.M.; Imayama, I.; Neuhouser, M.L.; Kiecolt-Glaser, J.K.; Smith, A.W.; Meeske, K.; McTiernan, A.; Bernstein, L.; Baumgartner, K.B.; Ulrich, C.M.; et al. Fatigue, inflammation, and ω-3 and ω-6 fatty acid intake among breast cancer survivors. J. Clin. Oncol. 2012, 30, 1280–1287. [Google Scholar] [CrossRef]
- Farzaneh-Far, R.; Harris, W.S.; Garg, S.; Na, B.; Whooley, M.A. Inverse association of erythrocyte n-3 fatty acid levels with inflammatory biomarkers in patients with stable coronary artery disease: The Heart and Soul Study. Atherosclerosis 2009, 205, 538–543. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Gamoh, S.; Hashimoto, M.; Hossain, S.; Masumura, S. Chronic administration of docosahexaenoic acid improves the performance of radial arm maze task in aged rats. Clin. Exp. Pharmacol. Physiol. 2001, 28, 266–270. [Google Scholar] [CrossRef] [PubMed]
- Petursdottir, A.L.; Farr, S.A.; Morley, J.E.; Banks, W.A.; Skuladottir, G.V. Effect of dietary n-3 polyunsaturated fatty acids on brain lipid fatty acid composition, learning ability, and memory of senescence-accelerated mouse. J. Gerontol. A Biol. Sci. Med. Sci. 2008, 63, 1153–1160. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Bhattacharya, A.; Sun, D.; Rahman, M.; Fernandes, G. Different ratios of eicosapentaenoic and docosahexaenoic omega-3 fatty acids in commercial fish oils differentially alter pro-inflammatory cytokines in peritoneal macrophages from C57BL/6 female mice. J. Nutr. Biochem. 2007, 18, 23–30. [Google Scholar] [CrossRef]
- Jia, Q.; Zhou, H.-R.; Shi, Y.; Pestka, J.J. Docosahexaenoic acid consumption inhibits deoxynivalenol-induced CREB/ATF1 activation and IL-6 gene transcription in mouse macrophages. J. Nutr. 2006, 136, 366–372. [Google Scholar] [CrossRef][Green Version]
- Yaqoob, P.; Calder, P. Effects of dietary lipid manipulation upon inflammatory mediator production by murine macrophages. Cell. Immunol. 1995, 163, 120–128. [Google Scholar] [CrossRef]
- Sadeghi, S.; Wallace, F.A.; Calder, P.C. Dietary lipids modify the cytokine response to bacterial lipopolysaccharide in mice. Immunology 1999, 96, 404–410. [Google Scholar] [CrossRef]
- Vreden, S.G.; Blok, W.L.; Sauerwein, R.W.; Oettinger, M.C.; Verhave, J.P.; Meuwissen, J.E.; Van der Meer, J.W.; Van den Broek, M.F. Inhibition of Plasmodium berghei liver schizont development and reduction of cytokine production capacity in rats by dietary fish oil supplementation. Am. J. Trop. Med. Hyg. 1995, 53, 206–210. [Google Scholar] [CrossRef][Green Version]
- Miguelez, M.; Anisman, H.; Weber, J.-M.; Merali, Z. Effects of acute or chronic omega-3 and omega-6 polyunsaturated fatty acid treatment on behavioral, neuroendocrine and cytokine changes elicited by exogenous interleukin-1beta challenge. J. Neuroimmunol. 2006, 181, 19–28. [Google Scholar] [CrossRef]
- Minogue, A.M.; Lynch, A.M.; Loane, D.J.; Herron, C.E.; Lynch, M.A. Modulation of amyloid-beta-induced and age-associated changes in rat hippocampus by eicosapentaenoic acid. J. Neurochem. 2007, 103, 914–926. [Google Scholar] [CrossRef]
- Wang, L.; Yuan, R.; Yao, C.; Wu, Q.; Christelle, M.; Xie, W.; Zhang, X.; Sun, W.; Wang, H.; Yao, S. Effects of resolvin D1 on inflammatory responses and oxidative stress of lipopolysaccharide-induced acute lung injury in mice. Chin. Med. J. (Engl.) 2014, 127, 803–809. [Google Scholar]
- Hashimoto, M.; Katakura, M.; Tanabe, Y.; Al Mamun, A.; Inoue, T.; Hossain, S.; Arita, M.; Shido, O. n-3 fatty acids effectively improve the reference memory-related learning ability associated with increased brain docosahexaenoic acid-derived docosanoids in aged rats. Biochim. Biophys. Acta 2015, 1851, 203–209. [Google Scholar] [CrossRef] [PubMed]
- Rao, J.S.; Ertley, R.N.; DeMar, J.C., Jr.; Rapoport, S.I.; Bazinet, R.P.; Lee, H.J. Dietary n-3 PUFA deprivation alters expression of enzymes of the arachidonic and docosahexaenoic acid cascades in rat frontal cortex. Mol. Psychiatry 2007, 12, 151–157. [Google Scholar] [CrossRef] [PubMed]
- Kim, H.W.; Rao, J.S.; Rapoport, S.I.; Igarashi, M. Dietary n-6 PUFA deprivation downregulates arachidonate but upregulates docosahexaenoate metabolizing enzymes in rat brain. Biochim. Biophys. Acta 2011, 1811, 111–117. [Google Scholar] [CrossRef] [PubMed][Green Version]