Резюме
Введение. Благодаря научно-техническому прогрессу и достижениям общественного здравоохранения продолжительность жизни на планете продолжает увеличиваться, что приводит к смене доминирующих заболеваний от инфекционных к хроническим неинфекционным, проявляющимся системным воспалением. С помощью современных методов биотехнологий и инженерии удалось синтезировать генно-инженерные биологические препараты, способствующие увеличению продолжительности и качества жизни, улучшению прогноза многих нозологий, в том числе онкологических и иммуноопосредованных заболеваний. К сожалению, некоторые представители данной группы препаратов продемонстрировали кардиотоксический эффект, что у ряда пациентов становится причиной их отмены. Под кардиотоксичностью понимают различные нежелательные явления на фоне лекарственной терапии, связанные с воздействием на сердечно-сосудистую систему. Медикаментозная кардиотоксичность может появиться как во время, так и по окончании лечения. Эффективные стратегии прогнозирования и профилактики кардиотоксичности генно-инженерных биологических препаратов имеют большое значение. Одним из возможных способов профилактики является мультидисциплинарный подход к курации больных, получающих генно-инженерную биологическую терапию, а также их динамическое наблюдение и обследование. Вместе с тем некоторые исследования продемонстрировали кардиопротективный эффект некоторых представителей генно-инженерных биологических препаратов.
Заключение. В представленном литературном обзоре мы акцентировали внимание на том, как генно-инженерная биологическая терапия может негативно влиять на сердечно-сосудистую систему, способствуя развитию и прогрессированию кардиоваскулярных заболеваний, либо, напротив, оказывать кардиопротективное действие. Рассмотрев перспективы как ранней диагностики, так и профилактики кардиотоксичности генно-инженерны�� биологических препаратов, мы сосредоточили внимание на эффективных и доступных возможностях решения этой важной проблемы.
Конфликт интересов. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
В последнее столетие благодаря научно-техническому прогрессу произошло перераспределение профиля доминирующих заболеваний, и инфекционная патология постепенно вытеснялась неинфекционными хроническими болезнями, в частности сердечно-сосудистой патологией, онкологическими и иммуноопосредованными заболеваниями. Генно-инженерные биологические препараты (ГИБП) – это группа лекарственных средств, полученная современными биотехнологическими методами и представляющая собой моноклональные антитела (МАТ). Механизм действия МАТ направлен против провоспалительных цитокинов, их рецепторов и сигнальных путей с целью устранения дисбаланса цитокинов [1]. ГИБТ способствует улучшению прогноза, в том числе при наиболее распространенных причинах заболеваний [2], однако ее применение может приводить к кардиотоксичности, то есть вызывать ятрогению [3].
В представленном литературном обзоре мы сосредоточили внимание на том, как ГИБТ влияет на риск возникновения кардиоваскулярных заболеваний (КВЗ), а также на ранней диагностике и профилактике кардиотоксичности. Нами проведен поиск литературы в базе данных PubMed и eLibrary до ноября 2023 г. Ключевыми поисковыми запросами были «генно-инженерная биологическая терапия», «кардиотоксичность», «моноклональные антитела», «сердечно-сосудистые заболевания», «ГИБТ онкологических и иммуноопосредованных заболеваний».
ИСТОРИЧЕСКАЯ СПРАВКА
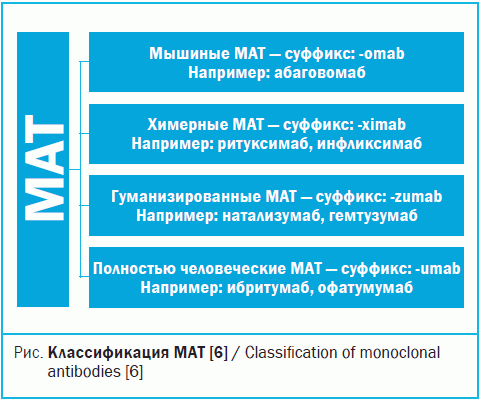
В 1908 г. И. И. Мечников и П. Эрлих стали Нобелевскими лауреатами по физиологии и медицине за открытие клеточного и гуморального иммунитета, именно отсюда начался путь моноклональных препаратов [4]. Колер и Мильштейн произвели революцию в иммунологии, разработав в 1975 г. первые MAТ, но лицензированы они были лишь в 1986 г. [5]. Первые МАТ были разработаны в виде мышиных белков, вследствие чего обладали повышенной иммуногенностью у человека, что делало их непригодными для длительного лечения. С того момента, как стало известно, что терапевтическое применение МАТ вызывает иммуногенные реакции у людей, была проделана большая работа по получению химерных и гуманизированных антител с целью продолжительного применения. Снизить иммуногенность МАТ получилось в начале 1990-х, когда с помощью методов генной инженерии были созданы химерные МАТ: константные участки мышиного иммуноглобулина были заменены участками иммуноглобулина человеческого. Новые технологии позволяют получать сегодня полностью человеческие антитела. Современная классификация ГИБП представлена на рис. [6].
СЕРДЕЧНО-СОСУДИСТАЯ ПАТОЛОГИЯ У ПАЦИЕНТОВ С АУТОИММУННОЙ И ОНКОЛОГИЧЕСКОЙ ПАТОЛОГИЕЙ: ПАТОГЕНЕТИЧЕСКИЕ СВЯЗИ И ВЛИЯНИЕ ЛЕЧЕНИЯ ГИБП
В настоящее время существуют различные гипотезы в отношении риска развития КВЗ у больных с иммуноопо-средованной и онкологической патологией.
Одна из них основана на том, что хроническое системное воспаление увеличивает риск сердечно-сосудистых заболеваний (ССЗ): наиболее весомые доказательства этого утверждения имеются для ревматоидного артрита, воспалительных заболеваний кишечника (ВЗК), псориаза и анкилозирующего спондилита [7]. Онкологические заболевания и сердечно-сосудистая патология также продемонстрировали общие механизмы развития. Поэтому снижение степени активности аутоиммунных заболеваний, профилактика и лечение онкопатологии целесообразны для снижения риска возникновения ССЗ у этой категории пациентов.
Другая гипотеза сводится к тому, что ГИБТ представляет собой кардиотоксическую группу препаратов при лечении иммуно-опосредованных и онкологических заболеваний [8] и их применение приводит к появлению сердечно-сосудистой патологии.
И, наконец, третья концепция сводится к тому, что ГИБТ представляет собой кардиопротективную группу препаратов и их своевременное назначение снижает риск развития КВЗ за счет уменьшения степени активности системного воспаления, возникающего на фоне аутоиммунной и онкологической патологии [9].
КАРДИОТОКСИЧНОСТЬ ГИБП
Под кардиотоксичностью предполагаются различные нежелательные явления (НЯ), связанные с сердечно-сосудистой системой (ССС) на фоне лекарственной терапии. По виду повреждающего действия клеток принято выделять два типа кардиотоксичности. Первый возникает в результате гибели кардиомиоцитов, что приводит к необратимой дисфункции миокарда, а при втором типе развивается обратимая дисфункция миокарда, когда непосредственной гибели кардиомиоцитов не происходит [10]. Однако приведенная классификация имеет серьезный недочет – она не учитывает все возможные факторы, способствующие прогрессированию или развитию кардиотоксичности. Так, препарат трастузумаб, использу-емый для лечения рака молочной железы, по классификации относится ко второму типу, но при наличии сопутствующей патологии сердца у пациентки он способствует развитию повреждения первого типа [11].
Кардиотоксическое действие ГИБТ характеризуется гетерогенностью проявлений, а именно поражением клапанов сердца, сердечной недостаточностью (СН), тромбоэмболией, дисфункцией левого желудочка, нарушениями ритма и проводимости сердечной мышцы, но самыми распространенными проявлениями являются артериальная гипертензия (АГ) и острый коронарный синдром [12]. С другой стороны, некоторые ученые пришли к выводу, что на фоне ГИБТ не только не увеличивается риск возникновения и прогрессирования КВЗ, а напротив, эти препараты способны осуществлять их профилактику или оказывать нейтральное действие [13].
Например, терапия устекинумабом, ингибитором интерлейкина (ИЛ) 12/23, успешно применяемым для лечения ВЗК и других иммуноопосредованных заболеваний, привела к развитию явлений кардиотоксичности [14]. В метаанализе [15] продемонстрировано, что использование устекинумаба у пациентов с псориазом привело к значительному увеличению основных нежелательных сердечно-сосудистых событий (major adverse cardiovascular events – MACE). Однако в ходе другого исследования [16], где также был использован устекинумаб, препарат не приводил к побочным реакциям со стороны ССС.
COVID-19 – инфекция, еще совсем недавно погрузившая мир в пандемию и унесшая жизни около 7 миллионов человек (по данным Всемирной организации здравоохранения), не осталась без внимания ГИБТ. Было доказано, что синтезированные МАТ нацелены на спайк-белок коронавируса SARS-CoV-2, который помогает последнему прикрепляться и проникать в клетки человека. Связываясь с белком, препараты блокируют проникновение вируса в клетку. Перечень МАТ для лечения COVID-19 довольно широк, однако препараты разделили на две группы по наиболее часто вызываемым побочным эффектам со стороны ССС. Так, на фоне лечения казиривимабом в комбинации с имдевимабом, бамланивимабом в комбинации с этесевимабом, сотровимабом и бебтеловимабом наиболее часто возникала АГ, тогда как эмболические и тромботические осложнения наиболее часто регистрировались среди побочных эффектов для тоцилизумаба и комбинации тиксагевимаба с цилгавимабом [17].
Трастузумаб – гуманизированное моноклональное антитело (monoclonal antibody, mAb), направленное против рецептора эпидермального фактора роста человека-2 (HER2). Препарат успешно применяют для терапии HER2-положительных злокачественных новообразований (ЗНО) молочной железы и желудка. Многие авторы утверждают, что именно рецепторы ErbB/HER, на которые действует трастузумаб, играют важную роль не только в развитии, но и выживании кардиомиоцитов. A. Negro вместе с соавт. [18], используя мышиную модель с дефицитом HER2-рецепторов, выяснили, что у таких особей отмечается расширение камер сердца и истончение стенок миокарда. Таким образом, ученые пришли к выводу, что HER2 необходимы для профилактики дилатационной кардиомиопатии.
Несмотря на то, что все основные молекулярные механизмы повреждения, вызываемые трастузумабом, остаются загадкой для ученых, имеются данные о нарушении экспрессии генов, которые играют ключевую роль в развитии митохондриальной дисфункции и цепного процесса, при котором повреждение митохондрий влечет за собой дополнительное нарушение адаптации к стрессу и репарации ДНК [19]. Данные механизмы повреждения связывают с нарушением передачи сигналов HER2, что приводит к усилению окислительного и нитратного стресса путем снижения активации путей выживания [20]. Все эти механизмы в основном приводят к бессимптомному снижению фракции выброса левого желудочка (ФВЛЖ) и его дисфункции. Примечательно, что на фоне отмены препарата и/или лечении СН происходит регрессия этих проявлений [21].
Спорным остается мнение о действии ингибиторов фактора некроза опухоли-альфа (ФНО-α) на кардиомиоциты. Например, рассмотрим адалимумаб – рекомбинантное моноклональное антитело, которое селективно связывается с ФНО-α, нейтрализуя его биологические функции за счет блокады взаимодействия с поверхностными клеточными рецепторами р55 и р75 к ФНО-α. Однако авторы некоторых исследований пришли к противоположным выводам. S. Durmaz с соавт. провел эксперимент [22] с участием крыс, одним из которых вводили липополисахарид (Lps), а другим липополисахарид и адалимумаб (Lps + Ada). Крыс умертвляли через 24 часа после последней инъекции и исследовали кровь на биохимические маркеры повреждения миокарда, циркулирующие уровни ФНО-α и ИЛ-6. Также проводилось гистологическое исследование образцов миокарда. Авторы отметили, что у крыс с Lps + Ada уровни маркеров повреждения миокарда, гистологические показатели его некроза, периваскулярной клеточной инфильтрации и воспаления были значительно снижены в отличие от группы животных, получающих только Lps. Ученые сделали вывод, что адалимумаб уменьшает индуцированное эндотоксином поражение миокарда у крыс, положительный эффект связывают со снижением высвобождения цитокинов.
С другой стороны, в исследовании [23] у пациентов с болезнью Крона отмечается кардиотоксичный эффект адалимумаба: у женщины 42 лет после назначения второй дозы препарата стали отмечаться клинические проявления СН и отека легких. По данным эхокардиографии обнаружили выраженное диагностически значимое снижение сократительной функции миокарда ЛЖ с фракцией выброса 35%. Лечение адалимумабом было прекращено и назначена обоснованная терапия СН. Через 2 месяца сердечная функция восстановилась. Таким образом, авторы отметили, что адалимумаб высокоэффективен в терапии многих воспалительных заболеваний, но при этом обладает кардиотоксичностью.
ЗНО легких, молочных желез и колоректальный рак – ведущие причины смертности среди онкологических нозологий. В их лечении применяется бевацизумаб – ингибитор рецепторов фактора роста эндотелия сосудов (VEGF). Препарат способен вызывать АГ у 35% пациентов, что заставляет применять его с осторожностью. Ингибируя рецепторы VEGF, препарат снижает продукцию оксида азота, являющегося мощным депрессором сосудов (сосудорасширяющее действие), что приводит к АГ [24].
Существуют препараты из группы ГИБП с кардиопротективным действием, снижающие кардиотоксичность, вызванную другими лекарствами. Эволокумаб, ингибитор пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9), используется для лечения гиперхолестеринемии, снижает риск сердечно-сосудистых осложнений (ССО) у пациентов с атеросклеротическими сердечно-сосудистыми заболеваниями. В серии экспериментов V. Quagliariello и соавт. [25] кардиомиоциты плода подвергались воздействию доксорубицина и трастузумаба, также исследователи покрыли клетки эволокумабом и после 48 часов провели такие тесты, как определение жизнеспособности клеток посредством анализа активности митохондриальной дегидрогеназы, изучение перекисного окисления липидов, внутриклеточный гомеостаз Ca2+. Кроме того, были проведены исследования провоспалительных факторов. Проанализировав полученные результаты, ученые отметили, что эволокумаб, совместно инкубированный с доксорубицином и трастузумабом, оказывает кардиопротективное действие, повышая жизнеспособность клеток на 35-43% по сравнению с необработанными клетками. Помимо этого, эволокумаб значительно снижал кардиотоксичность через ось MyD88/ NF-ΚB/и механизмы, опосредованные mTORC1 Fox01/3α.
ЗАКЛЮЧЕНИЕ
ГИБТ играет ключевую роль в лечении широкого спектра заболеваний и приходит на помощь в самых тяжелых ситуациях. Такое НЯ, как кардиотоксичность, нередко становится причиной отмены лекарственного препарата. Эффективные стратегии прогнозирования кардиотоксичности имеют решающее значение для разработки профилактических мероприятий. Благодаря современным исследованиям появляются новые данные, например, ученые отмечают снижение кардиотоксичности при замене или сокращении длительности применения медикаментов из группы ГИБП, избегают комбинации лекарств, увеличивающих риск возникновения патологии сердца и сосудов. Например, трастузумаб, применяемый более короткими курсами, имеет меньший риск возникновения соответствующих ССО [26]. Также имеются данные о более редко возникающей кардиотоксичности на фоне терапии небивололом, препарат защищает от изменений ФВЛЖ, диаметра желудочков и повышения уровней мозгового натрийуретического пептида (NT-pro-BNP) по сравнению с плацебо [27].
Одной из возможных профилактических стратегий является ведение пациентов, получающих ГИБП, мультидисцип-линарной командой, а также проведение систематического регулярного контроля биомаркеров повреждения миокарда и СН (cTnI, BNP, D-димер, CRP, MPO и Gal-3) с целью их ранней диагностики еще на доклиническом этапе и свое-временного лечения любых кардиотоксических эффектов [28].
Таким образом, благодаря полученным исследованиям уже сейчас существуют эффективные и доступные методы решения проблемы кардиотоксичности. Но накопленный опыт показал, что по мере появления новых знаний появляются и новые запросы на проведение дальнейших исследований в этой области. Одним из наиболее актуальных вопросов без ответа является повреждение эндотелиальных клеток сосудов (ЭКС) на фоне терапии ГИБТ. Важным фактором поддержания сократительной функции кардиомиоцитов является наличие целостности ЭКС, а также выработка сигнальных молекул для регуляции систолического ответа кардиомиоцитов. Следовательно, поражение ЭКС может быть одной из причин сердечной дисфункции, вызванной ГИБП [29], и эта проблема также требует дальнейшего изучения.
Вклад авторов:
Авторы внесли равный вклад на всех этапах работы и написания статьи.
Contribution of authors:
All authors contributed equally to this work and writing of the article at all stages.
Литература/References
- Картышева К. Ю., Оконенко Т. И., Румянцев Е. Е. и др. Значение генно-инженерных препаратов в терапии новой коронавирусной инфекции и ревматоидного артрита. Вестник Новгородского государственного университета им. Ярослава Мудрого. 2022; 2 (127): 76-79. Kartysheva K. Ju., Okonenko T. I., Rumjancev E. E., et al. The importance of genetic engineered drugs in the treatment of new coronavirus infection and rheumatoid arthritis. Vestnik Novgorodskogo gosudarstvennogo universiteta im. Jaroslava Mudrogo. 2022; 2 (127): 76-79.) (In Russ.) DOI: 10.34680/2076-8052.2022.2.
- Adao R., de Keulenaer G., Leite-Moreira A., Bras-Silva C. Cardiotoxicity associated with cancer therapy: pathophysiology and prevention strategies. Rev Port Cardiol. 2013; 32 (5): 395-409. DOI: 10.1016/j.repc.2012.11.002.
- Авагимян А. А., Мкртчян Л. Г., Геворкян А. А. и др. Взаимосвязь между химиотерапией и фибрилляцией предсердий: клиническое наблюдение. Рациональная фармакотерапия в кардиологии. 2021; 17 (5): 785-791. Avagimjan A. A., Mkrtchjan L. G., Gevorkjan A. A., et al. The relationship between chemotherapy and atrial fibrillation: a clinical observation. Racional'naja farmakoterapija v kardiologii. 2021; 17 (5): 785-791). (In Russ.) DOI: 10.20996/1819-6446-2021-10-17.
- Petrikovsky B., Nemova Y., Petrikovsky E. Russian Leaders and their Foreign Doctors: A Historical Review. LOJ Medical Sciences. 2019; 4 (1): 337-343. DOI: 10.32474/LOJMS.2019.04.000178.
- Dodd R., Schofield D., Wilkinson T., Britton Z. Generating therapeutic monoclonal antibodies to complex multi-spanning membrane targets: overcoming the antigen challenge and enabling discovery strategies. Methods. 2020; 1 (180): 111-126. DOI: 10.1016/j.ymeth.2020.05.006.
- Sadeghalvad M., Rezaei N. Introduction on monoclonal antibodies. Monoclonal Antibodies. 2021. DOI: 10.5772/intechopen.98378.
- Frank L., Visseren J., Francois M., 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: developed by the task force for cardiovascular disease prevention in clinical practice with representatives of the european society of cardiology and 12 medical societies with the special contribution of the european association of preventive cardiology (EAPC). European Heart Journal. 2021; 42 (34): 3227–3337. DOI: 10.1093/eurheartj/ehab484.
- Kumar M., Thangavel C., Becker R., Sadayappan S. Monoclonal antibody-based immunotherapy and its role in the development of cardiac toxicity. Cancers (Basel). 2020; 13 (1): 86. DOI: 10.3390/cancers13010086.
- Clark J., Dudler T, Marber M., Schwaeble W. Cardioprotection by an anti-MASP-2 antibody in a murine model of myocardial infarction. Open Heart. 2018; 5 (1): e000652. DOI: 10.1136/openhrt-2017-000652.
- Varricchi G., Galdiero M., Marone G., et al. Cardiotoxicity of immune checkpoint inhibitors. ESMO Open. 2017; 2 (4): e000247. DOI: 10.1136/esmoopen-2017-000247.
- Селиверстова Д. В., Евсина О. В. Кардиотоксичность химиотерапии. Сердце: журнал для практикующих врачей. 2016; 15 (1): 50-57. Seliverstova D. V., Evsina O. V. Cardiotoxicity of chemotherapy. Serdce: zhurnal dlja praktikujushhih vrachej. 2016; 15 (1): 50-57. (In Russ.) DOI: 10.18087/rhj.2016.1.2115]
- Alhussein M., Mokbel A., Cosman T., et al. Pertuzumab cardiotoxicity in patients with her2-positive cancer: a systematic review and meta-analysis. CJC Open. 2021; 14 (3): 1372-1382. DOI: 10.1016/j.cjco.2021.06.019.
- Новикова Д. С., Удачкина Е. В., Кириллова И. Г., Попкова Т. В. Хроническая сердечная недостаточность у больных ревматоидным артритом (часть III): влияние противоревматической терапии. Рациональная фармакотерапия в кардиологии. 2019; 15 (6): 820-830. Novikova D. S., Udachkina E. V., Kirillova I. G., Popkova T. V. Chronic heart failure in patients with rheumatoid arthritis (Part III): the effect of antirheumatic therapy. Racional'naja farmakoterapija v kardiologii. 2019; 15 (6): 820-830. (In Russ.) DOI: 10.20996/1819-6446-2019-15-6-820-830.
- Sadeghalvad M., Rezaei N. Introduction on monoclonal antibodies. Monoclonal Antibodies. 2021. DOI: 10.5772/intechopen.98378.
- Van Taunay J., Albelda M., Frias J., Lipinski M. Biologics and cardiovascular disease. J Cardiovasc Pharmacol. 2018; 72 (2): 77-85. DOI: 10.1097/FJC.0000000000000595.
- Guillermet A., Geneste M., Combe C., et al. CPC-149 Trimebutine: a case of abuse and possible dependence. European Journal of Hospital Pharmacy: Science and Practice. 2013; 20: A219. DOI: 10.1136/ejhpharm-2013-000276.606.
- Zou J., Jing F. Cardiovascular adverse events associated with monoclonal antibody products in patients with covid-19. Pharmaceuticals (Basel). 2022; 15 (12): 1472. DOI: 10.3390/ph15121472.
- Negro A., Brar B., Lee K. Essential roles of Her2/erbB2 in cardiac development and function. Recent Prog Horm Res. 2004; 59: 1-12. DOI: 10.1210/rp.59.1.1.
- ElZarrad M., Mukhopadhyay P., Mohan N., et al. Correction: Trastuzumab alters the expression of genes essential for cardiac function and induces ultrastructural changes of cardiomyocytes in mice. PLoS One. 2014; 9 (1): e79543. DOI: 10.1371/annotation/3ba18ef8-8c9c-45ab-9bc5-ad571a54a28c.
- Nemeth B., Varga Z., Wu W., Pacher P. Trastuzumab cardiotoxicity: from clinical trials to experimental studies. Br J Pharmacol. 2017; 174 (21): 3727-3748. DOI: 10.1111/bph.13643.
- Park J., Youn J., Shim C., et al. Cardiotoxicity of trastuzumab in patients with HER2-positive gastric cancer. Oncotarget. 2017; 8 (37): 61837-61845. DOI: 10.18632/oncotarget.18700.
- Durmaz S., Kurtoglu T., Barbarus E., et al. TNF-alpha inhibitor adalimumab attenuates endotoxin induced cardiac damage in rats. Acta Cir Bras. 2020; 35 (2): e202000202. DOI: 10.1590/s0102-865020200020000002.
- Toufaily A. Severe cardiomyopathy induced by adalimumab administration for crohn’s disease. Austin Cardio & Cardiovasc Case Rep. 2020; 5 (1): 1035. DOI: 10.15761/JCCR.1000129.
- Pai V., Nahata M. Cardiotoxicity of chemotherapeutic agents: incidence, treatment and prevention. Drug Saf. 2000; 22 (4): 263-302. DOI: 10.2165/00002018-200022040-00002.
- Quagliariello V., Buccolo S., Iovine M., et al. PCSK9 inhibitor evolocumab reduces cardiotoxicity of doxorubicin and trastuzumab sequential treatment through myd88/nf-kb/mtorc1 pathways. Journal of the American College of Cardiology. 2021; 32 (5): 362. DOI: 10.1016/S0735-1097(21)04629-5.
- Eiger D., Franzoi M. A., Ponde N., et al. Cardiotoxicity of trastuzumab given for 12 months compared to shorter treatment periods: a systematic review and meta-analysis of six clinical trials. ESMO Open. 2020; 5 (1): e000659. DOI: 10.1136/esmoopen-2019-000659.
- Avila M. S., Siqueira S. R. R., Ferreira S. M. A., Bocchi E. A. Prevention and treatment of chemotherapy-induced cardiotoxicity. Methodist Debakey Cardiovasc J. 2019; 15 (4): 267-273. DOI: 10.14797/mdcj-15-4-267.
- Balmagambetova S., Tlegenova Z., Zholdin B., et al. Early diagnosis of chemotherapy-linked cardiotoxicity in breast cancer patients using conventional biomarker panel: a prospective study protocol. Diagnostics (Basel). 2022; 6 (12): 2714. DOI: 10.3390/diagnostics12112714.
- Zhifei Xu, Zizheng Gao, Huangxi Fu, et al. PTX3 from vascular endothelial cells contributes to trastuzumab-induced cardiac complications. Cardiovascular Research. 2023; 119 (5): 1250-1264. DOI: 10.1093/cvr/cvad012.
Г. Р. Бикбавова1, https://orcid.org/0000-0001-9252-9152, galiya1976@mail.ru
В. Е. Тимофеев1, https://orcid.org/0009-0006-1727-0244, t1mofeevv1ctor@yandex.ru
Л. В. Михалева2, https://orcid.org/0000-0003-0331-1640, lyubov5.04@mail.ru
1 Федеральное государственное бюджетное образовательное учреждение высшего образования Омский государственный медицинский университет Министерства здравоохранения Российской Федерации; 644037, Россия, Омск, ул. Петра Некрасова, 5
2 Бюджетное учреждение здравоохранения Омской области Областная клиническая больница; 644111, Россия, Омск, ул. Березовая, 3
Сведения об авторах:
Ахмедов Вадим Адильевич, д.м.н., профессор, заведующий кафедрой медицинской реабилитации дополнительного профессионального образования Федерального государственного бюджетного образовательного учреждения высшего образования Омский государственный медицинский университет Министерства здравоохранения Российской Федерации; 644037, Россия, Омск, ул. Петра Некрасова, 5; v_akhmedov@mail.ru
Бикбавова Галия Равильевна, к.м.н., доцент кафедры госпитальной терапии, эндокринологии Федерального государственного бюджетного образовательного учреждения высшего образования Омский государственный медицинский университет Министерства здравоохранения Российской Федерации; 644037, Россия, Омск, ул. Петра Некрасова, 5;
Тимофеев Виктор Евгеньевич, студент 6-го курса лечебного факультета Федерального государственного бюджетного образовательного учреждения высшего образования Омский государственный медицинский университет Министерства здравоохранения Российской Федерации; 644037, Россия, Омск, ул. Петра Некрасова, 5; t1mofeevv1ctor@yandex.ru.
Михалева Любовь Викторовна, врач отделения гастроэнтерологии Бюджетного учреждения здравоохранения Омской области Областная клиническая больница; 644111, Россия, Омск, ул. Березовая, 3; lyubov5.04@mail.ru
Information about the authors:
Vadim A. Akhmedov, Dr. of Sci. (Med.), Professor, Head of the Department of Medical Rehabilitation of Additional Professional Education at the Federal State Budgetary Educational Institution of Higher Education Omsk State Medical University of the Ministry of Health of the Russian Federation; 5 Petr Nekrasov str., Omsk, 644037, Russia; v_akhmedov@mail.ru
Galiya R. Bikbavova, Cand. of Sci. (Med.), Associate professor of the Department of Hospital Therapy, Endocrinology at the Federal State Budgetary Educational Institution of Higher Education Omsk State Medical University of the Ministry of Health of the Russian Federation; 5 Petr Nekrasov str., Omsk, 644037, Russia; galiya1976@mail.ru
Viktor E. Timofeev, student of the Medical Faculty at the Federal State Budgetary Educational Institution of Higher Education Omsk State Medical University of the Ministry of Health of the Russian Federation; 5 Petr Nekrasov str., Omsk, 644037, Russia;
Lyubov M. Mikhalevа, Head of the Department of Gastroenterology at the Budgetary healthcare institution of the Omsk region Regional Clinical Hospital; 3 Berezovaya str., Omsk, 644111, Russia; lyubov5.04@mail.ru
Кардиотоксичность генно-инженерной биологической терапии при иммуноопосредованных и онкологических заболеваниях/ В. А. Ахмедов, Г. Р. Бикбавова, В. Е. Тимофеев, Л. В. Михалева
Для цитирования: Ахмедов В. А., Бикбавова Г. Р., Тимофеев В. Е., Михалева Л. В. Кардиотоксичность генно-инженерной биологической терапии при иммуноопосредованных и онкологических заболеваниях. Лечащий Врач. 2024; 3 (27): 54-58. https://doi.org/10.51793/OS.2024.27.3.008
Теги: иммуногенность, гуманизированные антитела, генно-инженерные биологические препараты
Купить номер с этой статьей в pdf