Резюме
Цель работы. Изучение влияния иммуносупрессивной терапии, основанной на снижении стандартных дозировок и целевых показателей концентраций такролимуса, на результаты послеоперационного периода у реципиентов с пересаженной почкой.
Материалы и методы. В исследование включено 176 реципиентов почки. В соответствии с целью и задачами исследования реципиенты были разделены на две группы. В первую группу (контрольную) включено 78 пациентов, получающих стандартную иммуносупрессивную терапию ингибиторами кальциневрина (такролимус пролонгированного действия) в сочетании со стандартными дозировками микофеноловой кислоты. Целевая концентрация такролимуса в указанной группе составила 7-8 нг/мл. Во вторую группу (основную) включено 98 пациентов, которые получали иммуносупрессивную терапию по схеме – такролимус пролонгированного действия в уменьшенных дозировках в сочетании с микофеноловой кислотой. Целевая концентрация такролимуса в указанной группе составила 5-6 нг/мл. Обе группы были сопоставимы по полу, возрасту, виду и сроку нахождения на заместительной почечной терапии, а также по основному диагнозу, приведшему к терминальной хронической почечной недостаточности. Оценку уровня качества жизни проводили с помощью опросника SF-36.
Результаты. В ходе исследования было выявлено, что минимизация иммуносупрессивной терапии приводит к улучшению отдаленных результатов трансплантации. В позднем послеоперационном периоде, в группе со снижением доз и целевых значений концентрации такролимуса, показатель уровня креатинина оставался достоверно более низким, чем в контрольной подгруппе. Также отмечалось значимое различие в показателях скорости клубочковой фильтрации – в исследуемой группе она была достоверно выше на 20%, чем в контрольной. Снижение целевых концентраций такролимуса в послеоперационном периоде достоверно привело к снижению частоты дозозависимых побочных эффектов, что впоследствии вылилось в значительное улучшение качества жизни реципиентов в контрольной группе.
Конфликт интересов. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
Та��ролимус – ингибитор кальциневрина, широко используемый для предотвращения острого отторжения после трансплантации почки. Использование иммуносупрессивной терапии (ИСТ) на базе такролимуса – зачастую компромисс между эффективностью и нежелательными побочными эффектами. С одной стороны, высокие дозы такролимуса обеспечивают надежность иммуносупрессии, однако они могут обладать высокой нефротоксичностью, что может привести к неблагоприятным исходам для почечного аллотрансплантата [1, 2]. Также имеют место тяжелые дозозависимые побочные эффекты, что в значительной степени отражается на качестве жизни реципиентов. В то же время низкая доза такролимуса обес-печивает минимизацию неблагоприятных эффектов, однако увеличивает риск острого отторжения и иммунологической сенсибилизации [3]. Современные тенденции поддерживающей иммуносупрессии нацелены на ее минимизацию, однако оптимальный минимальный уровень такролимуса для разных временных точек после трансплантации почки для предотвращения как рисков острого отторжения, так и токсичности препарата еще не установлен [1].
Целью данного исследования было изучить влияние ИСТ, основанной на снижении стандартных дозировок и целевых показателей концентраций такролимуса, на результаты послеоперационного периода у реципиентов с пересаженной почкой.
Материалы и методы исследования
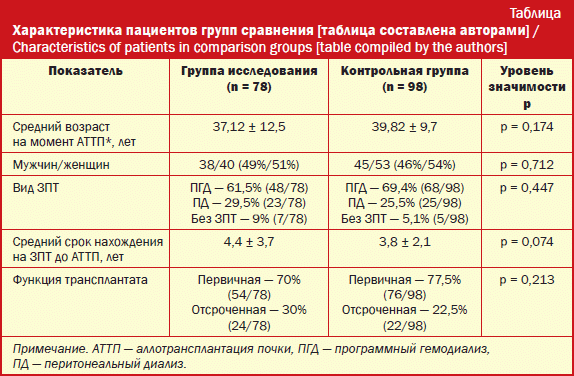
В исследование включено 176 реципиентов почки, которые находятся на амбулаторном наблюдении нефролога в Самарском центре трансплантации органов и тканей. В соответствии с целью и задачами исследования реципиентов разделили на две группы. В первую (контрольную) включено 78 получающих стандартную ИСТ ингибиторами кальциневрина (такролимус пролонгированного действия) в сочетании со стандартными дозировками микофеноловой кислоты. Целевая концентрация такролимуса в указанной группе составила 7-8 нг/мл. Во вторую группу (основную) включено 98 пациентов, которые получали ИСТ по схеме – такролимус пролонгированного действия в уменьшенных дозировках в сочетании с микофеноловой кислотой. Целевая концентрация такролимуса в указанной группе составила 5-6 нг/мл. Обе группы были сопоставимы по полу, возрасту, виду и сроку нахождения на заместительной почечной терапии (ЗПТ, табл.).
Обе группы были сопоставимы по основному диагнозу, приведшему к терминальной хронической почечной недостаточности (ТХПН) (рис. 1). В обеих группах преобладающим диагнозом был морфологически верифицированный гломерулонефрит, который встречался в 75,6% наблюдений у реципиентов контрольной группы и у 72,4% реципиентов основной группы.
Для определения статистической значимости различий средних величин при сравнении двух групп рассчитывали t-критерий Стьюдента в случае, если показатели распределены по нормальному закону. Для определения статистической значимости различий средних величин при сравнении двух групп, в случае отсутствия нормального распределения анализируемых показателей, был использован непараметрический U-критерий Манна – Уитни. Статистические различия признавались значимыми при значении уровня p < 0,05.
Результаты
В послеоперационном периоде схемы ИСТ в группах сравнения отличалась. В контрольной группе целевая концентрация такролимуса составляла 7-8 нг/мл. В основной группе применялась схема с минимизацией дозировок такролимуса. Целевая концентрация такролимуса в указанной группе составила 5-6 нг/мл. Первый прием такролимуса у всех пациентов был через сутки после операции. Стартовая доза препарата в обеих группах исследования составляла 0,2 мг/кг/сут. Целевая концентрация такролимуса в раннем послеоперационном периоде была 9-10 нг/мл. На момент включения пациентов в исследование средние дозы такролимуса достоверно не отличались (p > 0,05) и составили 13,25 (12; 15,5) мг/сут в контрольной группе и 13 (11,75; 15) мг/сут – в основной (рис. 2). Также на момент включения в исследование не отличались и средние концентрации препарата в группах сравнения – 9,55 (8,7; 10,35) нг/мл и 9,35 (8,6; 10,1) нг/мл соответственно (рис. 3).
В отдаленном послеоперационном периоде в обеих группах происходило снижение суточной дозы такролимуса. Так, в первой группе к 60-му месяцу после аллотрансплантации почки (АТТП) дозировка такролимуса снизилась в среднем на 28% и достигла 7,85 (8; 11) мг/сут. В группе исследования дозировка такролимуса за 5 лет наблюдения уменьшилась на 50% и к 60-му месяцу наблюдения составила 6,5 (6; 10) мг/сут и была достоверно ниже на 32%, чем в контрольной группе. Несмотря на значительное снижение дозировки такролимуса, концентрация препарата в крови реципиентов оставалась стабильной. Представленные в диаграмме колебания концентрации были статистически незначимые.
Одним из основных показателей функции трансплантата является уровень креатинина сыворотки крови. В контрольной группе средний уровень креатинина на момент включения в исследование составил 112 (96,5; 126,5) мкмоль/л и статистически не отличался от среднего уровня креатинина в группе 2 – 111 (101; 125) (p > 0,05) (рис. 4).
Начиная с 12-го месяца наблюдения у реципиентов обеих групп отмечается повышение среднего уровня креатинина, отличия этого показателя между группами были незначительными. С 36-го месяца наблюдается прогрессивное повышение среднего уровня креатинина сыворотки крови у пациентов обеих групп, при этом его средний уровень через 36, 48 и 60 месяцев после АТТП у пациентов контрольной группы был достоверно выше. К 60-му месяцу наблюдения средний уровень креатинина у реципиентов контрольной группы повысился более чем на 26% и достиг 151,5 (117,75; 197,5) мкмоль/л. Во второй группе уровень креатинина к 60-му месяцу наблюдения повысился на 17% и достиг уровня 134,45 (102; 166) мкмоль/л, при этом данный показатель был достоверно более чем на 10% ниже по сравнению с таковым у реципиентов контрольной группы.
Другим не менее значимым парамет-ром функции трансплантата является показатель скорости клубочковой фильтрации (СКФ), рассчитанный по формуле CKD-EPI. На момент начала исследования СКФ в группах сравнения достоверно не отличалась (p > 0,05). Указанный параметр в контрольной группе в начале исследования составил 58 (51,25; 64,75) мл/мин/1,73 м2, в исследуемой группе – 58,5 (44; 68) мл/мин/1,73 м2 (рис. 5).
Через 12 месяцев после АТТП СКФ у реципиентов первой группы составила 53,1 (43,7; 56,3) мл/мин/1,73 м2 и была на 4% ниже, чем у реципиентов исследуемой группы – 55,39 (47,3; 58,3) мл/мин/1,73 м2, но эта разница была статистически недостоверной. Однако к 60-му месяцу наблюдения разница в показателях СКФ в группах сравнения достигала 20% и была достоверно ниже у реципиентов первой группы – 40 (33,4; 42,3) мл/мин/1,73 м2 и 50 (41,0; 53,2) мл/мин/1,73 м2 соответственно. Стоит отметить, что за пятилетний срок наблюдения СКФ у реципиентов исследуемой группы уменьшилась на 15%, в то время как у реципиентов первой группы – более чем на 30%.
Наши наблюдения показали, что прием такролимуса в дозировках ниже стандартных не привел к статистически значимым результатам в частоте возникновения кризов отторжения трансплантатов у реципиентов сравниваемых групп. Так, в течение пятилетнего наблюдения в контрольной группе частота кризов отторжения составила 15,3% (12/78), а в исследуемой группе – 17,3% (17/98) (р = 0,728, рис. 6). В обеих группах кризы отторжения наблюдались в течение первых 36 месяцев наблюдения. Отторжение купировано консервативно. За период пятилетнего наблюдения у реципиентов первой и второй групп отторжение не привело к потере трансплантата.
Нами установлено, что у пациентов в основной группе отмечалось снижение частоты наиболее часто возникающих дозозависимых побочных эффектов такролимуса (рис. 7).
Как видно из диаграммы, у пациентов, принимающих такролимус в уменьшенных дозах, не отмечалось таких побочных эффектов, как миалгии, артралгии и кожный зуд, хотя в контрольной группе указанные побочные эффекты такролимуса встречались в 17,9% и 11,5% соответственно. В основной группе отмечалось достоверное снижение частоты развития диареи более чем в три раза по сравнению с контрольной группой. Достоверно снизилась частота астении (с 7,7% до 1%) и шума в ушах (с 8,9% до 1%). Однако, несмотря на общее снижение частоты побочных эффектов, частота возникновения тошноты и развития такролимус-ассоциированного сахарного диабета в группах сравнения достоверно не различалась.
Нами была изучена пятилетняя выживаемость реципиентов и трансплантатов в группах исследования, которая рассчитывалась по формуле Kaplan – Maier.
В основной группе пятилетняя выживаемость реципиентов составила 100%, а в контрольной она была достоверно ниже (p = 0,047) и составила 92%. Результаты пятилетней выживаемости реципиентов представлены на рис. 8.
В основной группе за пятилетний период наблюдения летальных исходов не было, а в контрольной в течение 5 лет после АТТП их зафиксировано шесть. Причинами смерти реципиентов указанной группы в двух случаях был сепсис на фоне бактериально-вирусной пневмонии, в двух случаях – острое нарушение мозгового кровообращения, в одном случае – суицид и еще в одном случае – цирроз печени в исходе вирусного гепатита С.
Результаты пятилетней выживаемости почечных трансплантатов в группах исследования представлены на рис. 9.
Пятилетняя выживаемость почечных трансплантатов во второй группе исследования была достоверно выше, чем в первой (p = 0,034). В первой группе за указанный период вернулись на ЗПТ 12 пациентов, из них двое в течение первых 12 месяцев после АТТП. Пятилетняя выживаемость почечного трансплантата в этой группе составила 85%, а во второй – 97%. Вернулись на ЗПТ 3 пациента, из них двое в течение первых 12 месяцев после АТТП. Большинство потерь трансплантатов в контрольной группе было связано с нефротоксическим действием такролимуса, что подтверждено морфологически.
Обсуждение
Нефротоксичность такролимуса является одной из важнейших проблем ИСТ реципиентов почечного трансплантата и побуждает исследователей и клиницистов постоянно искать методы, позволяющие снизить риск ее развития [4].
В отсутствие точных рекомендаций для определения оптимального уровня иммуносупрессии, необходимого каждому отдельному пациенту, трудно объективно дать определение минимальной иммуносупрессии. Обычно используемое определение – это наименьшее количество иммуносупрессии, которое не приведет к отторжению. Однако уровни иммуносупрессии, необходимой для предотвращения отторжения, сильно различаются не только у разных людей, но и у одних и тех же пациентов с течением времени. Таким образом, чтобы соответствовать этому определению, потребуется снижать дозы реципиентам, пока не произойдет отторжение. Более полезным определением минимизации ИСТ является достижение состояния, при котором количество иммуносупрессивных препаратов снижается до уровней, которые не вызывают клинически значимых побочных эффектов, но в то же время предотвращают отторжение [5].
Для решения проблемы снижения нефротоксичности ингибиторов кальциневрина предложены различные стратегии. Одной из них является назначение низких доз такролимуса (с достижением целевой концентрации вплоть до 3 нг/мл) в комбинации с ингибиторами mTOR сразу после трансплантации [6-8]. При этом, по данным одних авторов, снижение концентрации такролимуса не приводит к повышению частоты развития острого отторжения [9, 10], по другим данным – риск отторжения значительно повышается [11, 12]. Наше исследование не выявило частоту кризов отторжения при назначении ИСТ в минимизированных дозах.
Иммуносупрессия на основе такролимуса очень эффективна в предотвращении отторжения у реципиентов почечного трансплантата. Однако она может быть связана с нефротоксичностью, которую можно снизить, избегая слишком высоких уровней препарата. И наоборот, не следует пытаться проводить ультраминимизацию такролимусом [13].
Выводы
- Уменьшение дозы принимаемого такролимуса приводит к уменьшению необратимых нефротоксических повреждений донорского органа, что в конечном итоге обеспечивает более длительное функционирование трансплантата без снижения его функции.
- Снижение дозы такролимуса достоверно приводит к снижению частоты развития дозозависимых побочных эффектов.
- Снижение частоты и тяжести нефротоксичности увеличивает выживаемость трансплантата.
Вклад авторов:
Авторы внесли равный вклад на всех этапах работы и написания статьи.
Contribution of authors:
All authors contributed equally to this work and writing of the article at all stages.
Литература/References
- Jung H. Y., Cho S. Y., Choi J. Y., et al. Comparison of transplant outcomes for low-level and standard-level tacrolimus at different time points after kidney transplantation. Journal of Korean medical science. 2019; 34 (12): e103. DOI: 10.3346/jkms.2019.34.e103.
- Пинчук А. В. Современные возможности индивидуализации иммуносупрессивной терапии. Трансплантология. 2012; (4): 52-55. DOI: 10.23873/2074-0506-2012-0-4-52-55. [Pinchuk A. V. Up-to-date potential of individualized immune suppression therapies. Transplantologiya. 2012; (4): 52-55. (In Russ.) DOI: 10.23873/2074-0506-2012-0-4-52-55.]
- Томилина Н. А., Столяревич Е. С., Ким И. Г., Артюхина Л. Ю. Отдаленные результаты трансплантации почки в аспекте разных вариантов поддерживающей иммуносупрессии. Трансплантология. 2014; (3): 6-16. [Tomilina N. A., Stolyarevich E. S., Kim I. G., Artyukhina K. Yu. Long-term outcomes of kidney transplantation in terms of different variants of maintenance immunosuppression. Transplantologiya. 2014; (3): 6-16. (In Russ.)]
- Шабунин А. В., Дроздов П. А., Макеев Д. А., Нестеренко И. В. и др. Персонализированный протокол назначения пролонгированной формы такролимуса реципиентам почечного трансплантата в раннем послеоперационном периоде. Вестник трансплантологии и искусственных органов. 2023; 25 (1): 52-61. DOI: 10.15825/1995-1191-2023-1-52-61. [Shabunin A. V., Drozdov P. A., Makeev D. A., Nesterenko I. V., et al. Personalized dosing protocol for extended-release tacrolimus in kidney transplant recipients in the early postoperative period. Vestnik transplantologii i iskusstvennykh organov. 2023; 25 (1): 52-61. (In Russ.) DOI: 10.15825/1995-1191-2023-1-52-61. (In Russ.)]
- Orlando G. Finding the right time for weaning off immunosuppression in solid organ transplant recipients. Expert Review of Clinical Immunology. 2010; 6: 879-892. DOI: 10.1586/eci.10.71.
- Thölking G., Schütte-Nütgen K., Schmitz J., Rovas A., et al. A low tacrolimus concentration/ dose ratio increases the risk for the development of acute calcineurin inhibitor-induced nephrotoxicity. J Clin Med. 2019; 8 (10): 1586. DOI: 10.3390/jcm8101586.
- El-Agroudy A. E., Alarrayed S. M., Al-Ghareeb S. M., Farid E., et al. Efficacy and safety of early tacrolimus conversion to sirolimus after kidney transplantation: Long-term results of a prospective randomized study. Indian journal of nephrology. 2017; 27 (1): 28-36. DOI: 10.4103/0971-4065.176146.
- Ульянкина И. В., Резник О. Н., Мойсюк Я. Г. Применение эверолимуса при трансплантации почек от доноров с расширенными критериями. Вестник трансплантологии и искусственных органов. 2009; 11 (4): 103-109. DOI: 10.15825/1995-1191-2009- 4-103-109. [Ulyankina I. V., Reznik O. N., Moysyuk Y. G. The use of everolimus in kidney transplantation from expanded criteria donors. Vestnik transplantologii i iskusstvennykh organov. 2009; 11 (4): 103-109. (In Russ, English abstract). DOI: 10.15825/1995-1191-2009- 4-103-109. (In Russ.)]
- Галеев Ш. Р., Галеев Р. Х., Хасанова М. И., Готье С. В. Сравнительный анализ протоколов индукции иммуносупрессивной терапии у реципиентов почечных трансплантатов (ретроспективный обзор). Вестник трансплантологии и искусственных органов. 2020; 22 (2): 44-52. DOI: 10.15825/1995-1191-2020-2-44-52. [Galeev S. R., Galeev R. K., Khasanova M. I., Gautier S. V. Comparative analysis of induction immunosuppressive therapy protocols in renal transplant recipients (retrospective review). Vestnik transplantologii i iskusstvennykh organov. 2020; 22 (2): 44-52. (In Russ, English abstract). DOI: 10.15825/1995-1191-2020-2-44-52. (In Russ.)]
- Ghadimi M., Dashti-Khavidaki S., Khatami M. R., Mahdavi-Mazdeh M., et al. Comparing the effect of immediate versus delayed initiation of tacrolimus on delayed graft function in Kidney transplant recipients: A randomized open-label clinical trial. Journal of research in pharmacy practice. 2018; 7 (2): 69-76. DOI: 10.4103/jrpp.jrpp_17_90.
- Liu Y., Liu H., Shen Y., Chen Y., Cheng Y. Delayed initiation of tacrolimus is safe and effective in renal transplant recipients with delayed and slow graft function. Transplant Proc. 2018; 50 (8): 2368-2370. DOI: 10.1016/j.transproceed.2018.03.101.
- Park W. Y., Paek J. H., Jin K., Park S. B., Han S. Long-term Clinical Significance of Tacrolimus Trough Level at the Early Period After Kidney Transplantation. Transplant Proc. 2019; 51 (8): 2643-2647. DOI: 10.1016/j.transproceed.2019.03.065.
- Jouve T., Rostaing L., Malvezzi P. New formulations of tacrolimus and prevention of acute and chronic rejections in adult kidney-transplant recipients. Expert Opin Drug Saf. 2017; 16 (7):845-855. DOI: 10.1080/14740338.2017.1328051.
О. В. Фатенков, https://orcid.org/0000-0002-4928-5989, o.v.fatenkov@samsmu.ru
М. Н. Мякотных, https://orcid.org/0000-0003-0166-6878, maksim_miakotnykh@mail.ru
А. А. Миронов, https://orcid.org/0000-0002-3811-5802, alexey.a.mironov@gmail.com
А. Г. Додонов, a.g.dodonov@samsmu.ru
Федеральное государственное бюджетное образовательное учреждение высшего образования Самарский государственный медицинский университет Министерства здравоохранения Российской Федерации; 443099, Россия, Самара, ул. Чапаевская, 89
Сведения об авторах:
Парабина Елена Валерьевна, нефролог, заведующая нефрологическим отделением Клиник Федерального государственного бюджетного образовательного учреждения высшего образования Самарский государственный медицинский университет Министерства здравоохранения Российской Федерации; 443099, Россия, Самара, ул. Чапаевская, 89; parabinaev@mail.ru
Фатенков Олег Вениаминович, д.м.н., доцент, заведующий кафедрой факультетской терапии Федерального государственного бюджетного образовательного учреждения высшего образования Самарский государственный медицинский университет Министерства здравоохранения Российской Федерации; 443099, Россия, Самара, ул. Чапаевская, 89; o.v.fatenkov@samsmu.ru
Мякотных Максим Николаевич, к.м.н., хирург Самарского центра трансплантации органов и тканей Клиник Федерального государственного бюджетного образовательного учреждения высшего образования Самарский государственный медицинский университет Министерства здравоохранения Российской Федерации; 443099, Россия, Самара, ул. Чапаевская, 89;
Миронов Алексей Александрович, к.м.н., доцент, руководитель Самарского центра трансплантации органов и тканей Клиник Федерального государственного бюджетного образовательного учреждения высшего образования Самарский государственный медицинский университет Министерства здравоохранения Российской Федерации; 443099, Россия, Самара, ул. Чапаевская, 89; alexey.a.mironov@gmail.com
Додонов Александр Геннадьевич, к.м.н., заместитель главного врача по клинико-экспертной работе Клиник Федерального государственного бюджетного образовательного учреждения высшего образования Самарский государственный медицинский университет Министерства здравоохранения Российской Федерации; 443099, Россия, Самара, ул. Чапаевская, 89; a.g.dodonov@samsmu.ru
Information about the authors:
Elena V. Parabina, nephrologist, Head of the Nephrology Department of the Clinics at the Federal State Budgetary Educational Institution of Higher Education Samara State Medical University of the Ministry of Health of the Russian Federation; 89 Chapaevskaya str., Samara, 443099, Russia; parabinaev@mail.ru
Oleg V. Fatenkov, Dr. of Sci. (Med.), Associate Professor, Head of the Department and Clinic of Faculty therapy at the Federal State Budgetary Educational Institution of Higher Education Samara State Medical University of the Ministry of Health of the Russian Federation; 89 Chapaevskaya str., Samara, 443099, Russia;
Maksim N. Myakotnykh, Cand. of Sci. (Med.), surgeon of the Samara Center for Organ and Tissue Transplantation of the Clinics at the Federal State Budgetary Educational Institution of Higher Education Samara State Medical University of the Ministry of Health of the Russian Federation; 89 Chapaevskaya str., Samara, 443099, Russia; maksim_miakotnykh@mail.ru
Aleksey A. Mironov, Cand. of Sci. (Med.), Associate Professor, Head of the Samara Center for Organ and Tissue Transplantation Clinics at the Federal State Budgetary Educational Institution of Higher Education Samara State Medical University of the Ministry of Health of the Russian Federation; 89 Chapaevskaya str., Samara, 443099, Russia; alexey.a.mironov@gmail.com
Aleksandr G. Dodonov, Cand. of Sci. (Med.), Deputy Chief Physician for Clinical and Expert Work of the Clinics at the Federal State Budgetary Educational Institution of Higher Education Samara State Medical University of the Ministry of Health of the Russian Federation; 89 Chapaevskaya str., Samara, 443099, Russia; a.g.dodonov@samsmu.ru
Оценка результатов лечения реципиентов почки на амбулаторном этапе на фоне минимизации иммуносупрессивной терапии/ Е. В. Парабина, О. В. Фатенков, М. Н. Мякотных, А. А. Миронов, А. Г. Додонов
Для цитирования: Парабина Е. В., Фатенков О. В., Мякотных М. Н., Миронов А. А., Додонов А. Г. Оценка результатов лечения реципиентов почки на амбулаторном этапе на фоне минимизации иммуносупрессивной терапии. Лечащий Врач. 2023; 9 (26): 15-21. https://doi.org/10.51793/OS.2023.26.9.002
Теги: реципиенты почки, ингибироры кальциневрина, заместительная почечная терапия
Купить номер с этой статьей в pdf