Резюме. В работе представлены два клинических кейса, демонстрирующих современные подходы и возможности персонификации лечебной тактики хирургической реабилитации пациентов с дефект-псевдоартрозом длинных костей. Оба пациента имели сложный коморбидный статус и ранее неоднократно безуспешно оперированы. Целью работы было продемонстрировать персонификацию подхода к возмещению дефектов длинных костей с учетом предшествующих этапов лечения и сопутствующей патологии. Проведено комплексное изучение материалов амбулаторной и стационарной карт пациентов, результатов клинико-инструментальных и лабораторных методов исследований, подробно описываются предлагаемые оперативные пособия. Полипрофильный состав врачебной команды участников реабилитации, взвешенный и сбалансированный в аспекте «риски/возможный результат» тактико-технологический подход в каждом из приведенных наблюдений позволили рассчитывать и добиться хорошего анатомо-функционального исхода. Оценивая тактику и этапы остеосинтеза в данном кейсе, заметим, что до возникновения осложнения на фоне СOVID-19 в виде рецидива псевдоартроза луча предпринятые лечебные меры носили достаточно стандартный характер, поскольку использование возможностей остеосинтеза в подобных ситуациях является практически рутинным. Однако возникшая неудача потребовала разработки персонифицированной тактики для нового этапа лечения. Авторы надеются, что избранные неординарная тактика и технология принесут долгожданный успех в лечении, первым свидетельством чего можно рассматривать начало остеогенеза в зоне стыка отломков уже через 2,5 месяцев после оперативного вмешательства. Основными факторами достижения успеха представляются персонификация подхода, основанная на учете как местных особенностей, так и имеющейся коморбидности, а также социальных аспектов, обоснованный выбор последовательности и объема хирургических приемов и средств фиксации, командный подход с привлечением пластических хирургов, реабилитологов и специалистов других заинтересованных профилей. В отдельных случаях при наличии серьезных рисков и угроз стремлением достичь максимально возможного восстановления следует обдуманно поступаться в пользу клинического компромисса, функционально устраивающего пациента.
Устранение дефектов длинных трубчатых костей до настоящего времени представляет собой весьма трудноразрешимую лечебную задачу. Подходы к тактике и выбору лечебных средств для возмещения дефектов с целью достижения сращения и восстановления двигательной и опорной функций конечности менялись долгие десятилетия. Ортопеды из разных стран пытались использовать ауто- и аллотрансплантаты, свободно взимаемые либо на «питающей ножке», причем достижения микрохирургии последних десятилетий значительно увеличили шансы на выживание трансплантатов, перемещаемых в дефект с созданием сосудистых артериовенозных шунтов [3, 4, 8]. Использование микрохирургической техники для устранения дефектов костей предплечья широко применяется в ортопедической практике и отмечено положительными результатами в ряде публикаций [7, 9].
Для устранения костных дефектов используется широкое разнообразие микрохирургических лоскутов, выбор которых определяется особенностями конкретного клинического случая. Лоскут латерального края лопаточной кости на сосудах, огибающих лопатку, имеет преимущества в виде низкого донорского ущерба, удобства формирования, постоянной анатомии сосудистой ножки. Однако чаще всего использование лопаточного лоскута можно обнаружить в работах, посвященных реконструкции в области головы [6].
С целью фиксации донорской кости используются погружные конструкции (внутрикостные стержни, в том числе с памятью формы, пластины и т. д.), ряд авторов предлагает с этой целью применять стержневые и спице-стержневые внеочаговые аппараты. Для замещения дефекта (диастаза) все эти подходы предусматривают использование свободной костной пластики в том или ином варианте.
Новым словом в решении этой весьма нетривиальной лечебный задачи явилось предложение академика Г. А. Илизарова возмещать имеющийся дефект путем остео-томии и низведения в диастаз одного из отломков, как правило, более длинного и сохранного в плане трофики. Метод получил название билокального чрескостного дистракционно-компрессионного остеосинтеза. Разработанный подход позволил в показанных случаях отказаться от забора аутотрансплантата, тем самым избежать связанных с этим рисков и, используя местные костные ресурсы, замещать дефекты на протяжении 2-10 см и более. Тем не менее при очевидной привлекательности данная методика имеет и свои ограничения, в первую очередь связанные с состоянием мягких тканей оперируемого сегмента, а также с длительностью срока достижения результата (8-10 мес и более) [1, 2].
Перечисленные технологии представляют собой базовые лечебные подходы к возмещению костных дефектов длинных трубчатых костей. Однако, как известно, спектр рассматриваемой патологии настолько разнообразен, что часто требует от хирурга персонификации тактики и стратегии лечения. Наличие обширных рубцовых изменений мягких тканей, сочетание укорочения конечности, нарушения нервной и сосудистой трофики, латентной или активной костной инфекции существенно усложняют клиническую ситуацию и требуют от хирурга обоснованного и индивидуализированного плана лечения практически каждого пациента.
Цель настоящего исследования состояла в том, чтобы на примере двух клинических кейсов продемонстрировать преимущество персонифицированного подхода к возмещению дефектов длинных костей с учетом предшествующих этапов лечения и сопутствующей патологии.
ПЕРВЫЙ КЕЙС
Материал и методика
Пациент А., 58 лет, в ДТП получил открытую травму голени в виде фрагментарного перелома обеих ее костей на уровне средненижней трети. При поступлении в центральную районную больницу одного из районов области ему произведены первичная хирургическая обработка раны с удалением части нежизнеспособных отломков кости и по заживлении раны – накостный остеосинтез пластиной с блокированием винтов.
В послеоперационном периоде несмотря на проводившуюся антикоагулянтную профилактику у больного развился тромбоз глубоких вен поврежденной конечности, осложнившийся тромбоэмболией мелких ветвей легочной артерии. Это потребовало дополнительных усилий по спасению жизни пациента в условиях реанимации (тромболизис с восстановлением проходимости бронхиального сосудистого дерева). Вместе с тем в районе послеоперационной раны возникла гематома, инфицировавшаяся с последующим образованием остеомиелита концов отломков. Это потребовало удаления пластины и наложения аппарата внешний фиксации.
Пациент на данном этапе лечения 16.10.2018 г. обратился за помощью в нашу клинику. При поступлении ходил с костылями, не нагружая травмированную конечность, на голени аппарат Илизарова из трех опор, укорочение сегмента на 4,5 см, ось ровная, выражен лимфовенозный стаз на стопе и голени. По передней поверхности в нижней трети сегмента имелся дефект мягких тканей с признаками гнойного воспаления, дном которого являлся нежизнеспособный участок кости проксимального отломка. Отмечалось снижение чувствительности по тыльной поверхности нижней трети голени и стопы (рис. 1).
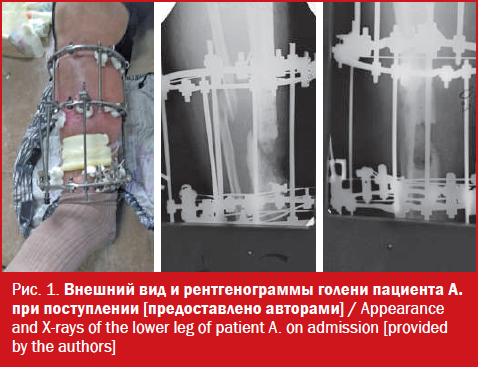
Было принято решение провести экономную резекцию кости на дне раны и компрессию на стыке отломков по типу встречно-боковой после перемонтажа аппарата. Обоснование данного подхода изложено в обсуждении результатов кейса. Вмешательство, произведенное 18.10.2018 г., рентгенологически иллюстрируется на рис. 2.
После косой остеотомии малоберцовой кости и встречного сближения фрагментов большеберцовой кости для создания большего их контакта на стыке задана периодически поддерживаемая встречно-боковая компрессия. В итоге после шести месяцев фиксации в аппарате на рентгенограмме обнаружено сращение на стыке отломков, а также сращение малоберцовой кости (рис. 3).
С целью защиты вновь образованного регенерата наложена циркулярная полиуретановая повязка-тутор от нижней трети бедра до пальцев стопы, в которой конечность при возрастающей нагрузке фиксировали еще два месяца.
Результаты и их обсуждение
При осмотре через пять месяцев отмечено формирование опорного регенерата на стыке отломков, очаг инфекции ликвидирован. Больной полностью восстановил опороспособность конечности и вернулся к труду (индивидуальный предприниматель). Ходит, пользуясь обувью с набойкой 5 см, результатом проведенного лечения доволен (рис. 4).
В рассмотренном наблюдении при оценке клинической ситуации и перспектив хирургической реабилитации учитывались следующие обстоятельства. На первый взгляд, очевидным представлялось решение о реализации в данной ситуации методики билокального последовательного дистракционно-компрессионного остеосинтеза по Илизарову. Однако состояние мягких тканей голени, наличие очага костной инфекции, а также тромбоэмболические события в анамнезе ставили успех подобной тактики под большой вопрос. Очевидный травматизм подобного вмешательства на фоне дискредитированного каскада гемокоагуляции и местных гнойно-трофических изменений угрожал рецидивом тромбоза глубоких вен и тромбоэмболией легочной артерии, распространением инфекции вплоть до ее генерализации. В этой связи была избрана изложенная выше лечебная тактика. Как показал опыт, она оказалась оправданной, поскольку позволила восстановить опороспособность конечности, ликвидировать очаг костной инфекции, обеспечить возврат к трудовой деятельности и избежать при этом ряда весьма вероятных грозных осложнений.
ВТОРОЙ КЕЙС
Материалы и методы
Пациентка Ч., 57 лет, обратилась в клинику с псевдоартрозом средней трети обеих костей левого предплечья, сформировавшимся в результате неоднократного оперативного лечения закрытого поперечного перелома обеих костей левого предплечья. Проведенный вскоре после травмы бытового характера отсроченный накостный остеосинтез свежего перелома закончился несращением костей с формированием псевдоартроза. Повторная попытка сращения с применением погружного остеосинтеза пластинами и свободной аутопластикой трансплантатом из крыла подвздошной кости также оказалась безуспешной.
При поступлении имелись вальгусно-рекурвационная деформация предплечья в средней трети со слабо определяемой подвижностью на вершине деформации, болевой синдром в указанной локализации. На рентгенограмме (рис. 5) отмечалось наличие металлоконструкции на обеих костях левого предплечья с диастазом на стыке отломков до 5-6 мм. Мягкие ткани предплечья – с обширными рубцовыми изменениями после предшествующих этапов лечения в других стационарах.
С учетом клинической картины и анамнеза заболевания принято решение о проведении раздельного последовательного чрескостного остеосинтеза (ЧКДО) каждой из костей. Первым этапом произведено удаление металлоконструкции с локтевой кости, остеосинтез ее аппаратом Илизарова (рис. 5). После фиксации в течение семи месяцев в аппарате и последующей иммобилизации предплечья и кисти в течение двух месяцев полиуретановым тутором от пальцев кисти до средней трети плеча достигнуто сращение локтевой кости.
Вторым этапом предпринята попытка сращения лучевой кости по аналогичной схеме: удалена пластина с лучевой кости, произведен ее остеосинтез аппаратом Илизарова. После восьми месяцев фиксации на контрольном снимке (рис. 6) визуализировано сращение, аппарат демонтирован, наложен пластиковый тутор от пястных костей до средней трети плеча. Через 10 дней после наложения тутора у больной развился СOVID-19 в тяжелой форме, потребовавший госпитализации с нахождением в палате реанимации и интенсивной терапии (РИТ). По действовавшим клиническим рекомендациям проводилась массивная глюкокортикостероидная терапия, респираторная поддержка в виде высокопоточной кислородотерапии и другие активные лечебные мероприятия в течение более трех недель.
После явки на контроль через два месяца на рентгенографии обнаружен лизис в зоне сращения с формированием рецидива дефект-псевдоартроза (рис. 7, позиция слева). Принято решение выполнить повторное вмешательство с использованием свободного реваскуляризированного костного лоскута для достижения сращения с сохранением нормальных взаимоотношений в смежных суставах. Ход его выглядел следующим образом.
Из зигзагообразного доступа на волярной поверхности предплечья осуществлен доступ к лучевой артерии, а также мобилизована латеральная подкожная вена руки,
Трансплантат уложен на подготовленные концы отломков лучевой кости, освеженные до «кровавой росы», и шурупами фиксирован к каждому из них. Поверх трансплантата отломки лучевой кости фиксированы пластиной с блокированием таким образом, что в каждый из них бикортикально введено по два винта. С учетом особенностей биомеханики и анатомии предплечья для исключения ротационного смещения наложена примитивная конструкция аппарата Илизарова из кольцевой опоры в нижней трети сегмента. После этого под увеличением операционного микроскопа выполнен анастомоз по типу «конец в конец» между лучевой артерией и артерией лоскута, а также между головной веной и веной лоскута. После выполнения анастомозов проведен тест Акланда – анастомозы состоятельны. Раны на предплечье и в области лопатки зашиты над выпускниками.
Результаты
Непосредственный результат в ходе оперативного вмешательства представлен на рис. 7 (позиция в центре). Послеоперационный период протекал без осложнений. Кольцо на дистальной трети, фиксирующее обе кости предплечья, оставлено предположительно на 2-3 месяца после операции. При осмотре через месяц ультразвуковой контроль кровообращения в зоне соустья обнаружил хорошую проходимость питающих трансплантат сосудов, на рентгенограммах при сроке после операции 2,5 мес констатированы первые признаки формирования регенерата в межфрагментарном пространстве и на стыках аутотрансплантата с материнскими фрагментами (рис. 7, позиция справа). Наблюдение за пациенткой продолжается. Окончательные результаты будут доложены в последующих сообщениях.
Обсуждение
Оценивая тактику и этапы остеосинтеза в данном кейсе, заметим, что до возникновения осложнения на фоне СOVID-19 в виде рецидива псевдоартроза лучевой кости предпринятые лечебные меры носили достаточно стандартный характер, поскольку, как было сказано выше, использование возможностей ЧКДО в подобных ситуациях является практически рутинным. Однако возникшая неудача потребовала разработки персонифицированной тактики для нового этапа. В этом аспекте рассматривалась возможность повторного внеочагового остеосинтеза лучевой кости, однако в сложившихся условиях вторая попытка представлялась более сложной, нежели первая. Причиной тому являлся сформировавшийся в результате лизиса диастаз на стыке отломков в 3-3,5 мм, который после обработки концов фрагментов до уверенного их контакта увеличился бы настолько, что обусловил необходимость своего возмещения ради сохранения соотношений в дистальном лучелоктевом и лучезапястном суставах. Это, в свою очередь, потребовало бы либо реализации весьма непростой для неоднократно оперированного сегмента билокальной версии ЧКДО с заведомо длительным сроком нахождения в аппарате. При принятии решения мы вынуждены были учесть также и пожелание пациентки избежать повторного длительного применения внешней конструкции с учетом сложностей быта (проживает в сельской местности в частном доме).
Исходя из вышесказанного, было решено осуществить комбинированный подход к лечению, основанный на современных технологиях реконструктивно-пластической хирургии. В его схему, как упоминалось выше, включили костный васкуляризированный аутотрансплантат, причем избран вариант его забора из наружного края лопатки с огибающими ее артерией и веной (несмотря на более частое, по мнению S. R. Baker с соавт. (1988), использование такого лоскута в хирургии черепа) и погружной остеосинтез винтами и пластиной с временным (1,5-2 мес) блокированием ротационных движений кольцевой опорой аппарата Илизарова на дистальном отделе оперированного сегмента [5]. Мы надеемся, что избранные нами неординарные тактика и технология принесут долгожданный успех в лечении пациентки, в качестве первого свидетельства которого можно рассматривать начало остеогенеза в зоне стыка отломков уже после 2,5 месяцев лечения.
Заключение
Проблема реабилитации больных с дефектами длинных костей сохраняет актуальность в силу комплекса имеющихся у большинства из них патологических изменений (дефект костной и мягких тканей, сосудистый и неврологический дефицит, латентная или активная инфекция и др.). Несмотря на возрастающие возможности восстановительной хирургии, она остается сложной для решения этих задач. Основными факторами достижения успеха представляются персонификация подхода, основанная на учете как местных особенностей, так и имеющейся коморбидности, а также анамнеза и социальных аспектов, обоснованный выбор последовательности и объема хирургических приемов и средств фиксации, командный подход с привлечением пластических хирургов, реабилитологов и специалистов других заинтересованных профилей. В отдельных случаях при наличии серьезных рисков и угроз следует обдуманно поступаться стремлением достичь максимально возможного восстановления в пользу клинического компромисса, функционально устраивающего пациента.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- Ладутько Д., Подгайский В., Ладутько Ю. и др. Выбор методов фиксации костных фрагментов при аутопластике дефектов длинных трубчатых костей // Наука и инновации. 2021; 3 (217): 72-79. DOI: 10.29235/1818-9857-2021-3-72-79. [Ladut'ko D., Podgayskiy V., Ladut'ko Yu. i dr. The choice of methods for fixing bone fragments in autoplasty of defects in long tubular bones // Nauka i innovatsii. 2021; 3 (217): 72-79. DOI: 10.29235/1818-9857-2021-3-72-79.]
- Камеры В. К., Дьячков А. И., Гордиевских Н. И., Свешников А. А. Замещение дефектов длинных костей в эксперименте // Пермский медицинский журнал. 2007; 4 (24): 5-12. [Kamery V. K., D'yachkov A. I., Gordiyevskikh N. I., Sveshnikov A. A. Replacement of long bone defects in experiment // Permskiy meditsinskiy zhurnal. 2007; 4 (24): 5-12.]
- Белобратова Л. Н., Яковлев В. С., Воловик В. Е. и др. Замещение дефектов длинных трубчатых костей // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2007; S4 (56): 23-24. [Belobratova L. N., Yakovlev V. S., Volovik V. Ye. i dr. Replacement of defects in long tubular bones // Byulleten' Vostochno-Sibirskogo nauchnogo tsentra Sibirskogo otdeleniya Rossiyskoy akademii meditsinskikh nauk. 2007; S4 (56): 23-24.]
- Chalak A., Singh S., Shetty S., et al. A Novel technique of three-ring Ilizarov fixator frame in gap nonunion of tibia // Journal of Clinical Orthopaedics and Trauma. 2021; 23: 101639. DOI: https://doi.org/10.1016/j.jcot.2021.101639.
- Baker S. R., Sullivan M. J. Osteocutaneous free scapular flap for one-stage mandibular reconstruction // Arch Otolaryngol Head Neck Surg. 1988; 114 (3): 267-277. DOI: 10.1001/archotol.1988.01860150049015. PMID: 3342119.
- Jacobson Lia, et al. Scapular osteocutaneous free flap for total lower lip and mandible reconstruction // Microsurgery 36.6. 2016: 480-484.
- Jupiter J. B., Gerhard H. J., Guerrero J., Nunley J. A., Levin L. S. Treatment of Segmental Defects of the Radius with Use of the Vascularized Osteoseptocutaneous Fibular Autogenous Graft // J Bone Joint Surg. 1997; 79 (4): 542-550.
- Siebelt M., de Vos-Jakobs S., Koenrades N., van Nieuwenhoven C. Congenital Forearm Pseudarthrosis, a Systematic Review for a Treatment Algorithm on a Rare Condition // Journal of Pediatric Orthopaedics. 2019; 40 (5): 1. DOI: 10.1097/BPO.0000000000001417.
- Safoury Y. Free vascularized fibula for the treatment of traumatic bone defects and nonunion of the forearm bones // J Hand Surg Br. 2005; 30 (1): 67-72. DOI: 10.1016/j.jhsb.2004.09.007.
С. А. Демкин1, 2, ORCID: 0000-0002-2914-5807, demkin@vlg.sovamed.ru
К. О. Каплунов1, ORCID: 0000-0002-4758-917X, kkaplunovtmss@yandex.ru
Е. Ю. Некрасов2, freagrence@yandex.ru
1 Федеральное государственное бюджетное образовательное учреждение высшего образования Волгоградский государственный медицинский университет Министерства здравоохранения Российской Федерации; 400131, Россия, Волгоград, пл. Павших Борцов, 1
2 Центр травматологии и ортопедии сети клиник Акционерного общества «ММЦ», 400005, Россия, Волгоград, пр. им. В. И. Ленина, 59б
Сведения об авторах:
Олег Анатольевич Каплунов, д.м.н., профессор кафедры травматологии, ортопедии и военно-полевой хирургии Федерального государственного бюджетного образовательного учреждения высшего образования Волгоградский государственный медицинский университет Министерства здравоохранения Российской Федерации; 400131, Россия, Волгоград, пл. Павших Борцов, 1; руководитель Центра травматологии и ортопедии сети клиник Акционерного общества «ММЦ», 400005, Россия, Волгоград, пр. им. В. И. Ленина, 59б; volortho@mail.ru
Cергей Анатольевич Дёмкин, к.м.н., старший преподаватель кафедры общественного здоровья и здравоохранения Федерального государственного бюджетного образовательного учреждения высшего образования Волгоградский государственный медицинский университет Министерства здравоохранения Российской Федерации; 400131, Россия, Волгоград, пл. Павших Борцов, 1; старший ординатор Центра травматологии и ортопедии сети клиник Акционерного общества «ММЦ», 400005, Россия, Волгоград, пр. им. В. И. Ленина, 59б;
Кирилл Олегович Каплунов, к.м.н., доцент кафедры педиатрии и неонатологии Института непрерывного медицинского и фармацевтического образования Федерального государственного бюджетного образовательного учреждения высшего образования Волгоградский государственный медицинский университет Министерства здравоохранения Российской Федерации; 400131, Россия, Волгоград, пл. Павших Борцов, 1; kkaplunovtmss@yandex.ru
Евгений Юрьевич Некрасов, ординатор Центра травматологии и ортопедии сети клиник Акционерного общества «ММЦ», 400005, Россия, Волгоград, пр. им. В. И. Ленина, 59б; freagrence@yandex.ru
Information about the authors:
Oleg A. Kaplunov, Dr. of Sci. (Med.), Professor of the Department of Traumatology, Orthopedics and military field surgery at the Federal State Budgetary Educational Institution of Higher Education Volgograd State Medical University of the Ministry of Health of the Russian Federation; 1 Pavshikh Bortsov Square, Volgograd, 400131, Russia; Head of the Center for traumatology and orthopedics of the «MMC» Joint-Stock Company Clinic Network, 59b V. I. Lenin Ave., Volgograd, 400005, Russia; volortho@mail.ru
Sergey A. Demkin, MD, Senior Lecturer of the Department of Public Health and Healthcare at the Federal State Budgetary Educational Institution of Higher Education Volgograd State Medical University of the Ministry of Health of the Russian Federation; 1 Pavshikh Bortsov Square, Volgograd, 400131, Russia; Senior resident of the Center for traumatology and orthopedics of the «MMC» Joint-Stock Company Clinic Network, 59b V. I. Lenin Ave., Volgograd, 400005, Russia;
Kirill O. Kaplunov, MD, Associate Professor of the Department of Pediatrics and Neonatology of the Institute of Continuing Medical and Pharmaceutical Education at the Federal State Budgetary Educational Institution of Higher Education Volgograd State Medical University of the Ministry of Health of the Russian Federation; 1 Pavshikh Bortsov Square, Volgograd, 400131, Russia; kkaplunovtmss@yandex.ru
Evgeniy Yu. Nekrasov, resident of the Center for traumatology and orthopedics of the «MMC» Joint-Stock Company Clinic Network, 59b V. I. Lenin Ave., Volgograd, 400005, Russia; freagrence@yandex.ru
Хронический болевой синдром и ожирение: ассоциации маркеров воспаления с характеристиками болевого синдрома/ Т. Е. Морозова, О. В. Воробьева, А. А. Герцог
Для цитирования: Морозова Т. Е., Воробьева О. В., Герцог А. А. Хронический болевой синдром и ожирение: ассоциации маркеров воспаления с характеристиками болевого синдрома // Лечащий Врач. 2023; 2 (26): 7-11. DOI: 10.51793/OS.2023.26.2.001
Теги: индекс массы тела, избыточный вес, боль в спине
Купить номер с этой статьей в pdf