Резюме. С ежегодным ростом числа пациентов с сахарным диабетом (СД) во всем мире растет и число женщин репродуктивного возраста с нарушениями углеводного обмена (НУО). Рост распространенности НУО при беременности обусловлен изменением критериев диагностики с 2012 г. и увеличением числа пациентов с ожирением, а также улучшением качества диагностики. Трудности диагностики НУО, связанные с отсутствием явных клинических признаков и невысокой гипергликемией при гестационном сахарном диабете (ГСД), обуславливают его позднюю выявляемость. В качестве скринингового метода для диагностики возможных НУО у женщин во время беременности проводится пероральный глюкозотолерантный тест. ГСД является серьезной медико-социальной проблемой. Он представляет собой одну из частых экстрагенитальных патологий беременности, которая увеличивает число неблагоприятных исходов как для матери, так и для плода и в последующем отрицательно влияет на развитие новорожденного. Известно, что у женщин с СД и предиабетом чаще выявляются нарушения течения пре- и постгравидарного периодов, а также аномалии роста и развития плода. Осложнения у плода при НУО у матери можно разделить на две группы: диабетическая эмбриопатия и диабетическая фетопатия. В настоящее время наиболее актуальным является вопрос профилактики осложнений НУО во время гестации. Планирование и правильное ведение беременности у женщин с прегестационным СД играет основную роль в предотвращении рисков и для матери, и для плода и является основой рождения здорового ребенка. В статье описываются клинические случаи ведения пациенток с прегестационным и манифестным СД.
Ведущими мировыми медицинскими ассоциациями сахарный диабет (СД) признан глобальной эпидемией XXI века. На сегодня 463 млн человек в мире имеют диагноз СД, из них 60 млн – женщины репродуктивного возраста [1]. С ежегодным ростом числа пациентов с СД во всем мире растет и число женщин репродуктивного возраста с нарушениями углеводного обмена (НУО). По данным Международной диабетической федерации (IDF) одна из шести женщин, родивших живого ребенка, страдает гипергликемией во время беременности, среди них в 84% случаев диагностирован гестационный сахарный диабет (ГСД) [1]. Таким образом, ГСД – это наиболее частое НУО у беременных, встречающееся в практике эндокринологов и акушеров-гинекологов.
ГСД является серьезной медико-социальной проблемой. Несмотря на современные возможности диагностики и лечения СД, выявление НУО и тактика ведения беременных женщин с СД остается сложной задачей для врача-эндокринолога [2].
Рост распространенности НУО при беременности обусловлен двумя основными причинами: изменением критериев диагностики и увеличением числа женщин репродуктивного возраста с ожирением и другими факторами риска СД. Так, встречаемость ГСД (при первом обращении и после 24 недель беременности) составляет 43,4%, причем преимущественно за счет диагностики по гликемии натощак при первом обращении по беременности [3, 4]. Согласно статистическим данным, частота ожирения среди беременных женщин составляет от 18,5% до 38,3%, а распространенность НУО при беременности более выражена в странах с высокой распространенностью ожирения и СД 2 типа [5]. В Российской Федерации ожирение среди женщин репродуктивного возраста регистрируется в 15-28% [6]. В то же время ГСД является фактором риска развития ожирения, СД и сердечно-сосудистых заболеваний у матери в будущем [7]. C. Kim с соавт. (2007) доказали близость молекулярно-генетических механизмов развития ГСД и СД. В пользу этой патогенетической близости свидетельствует и то, что через несколько лет после родов 14,7% женщин с ГСД во время беременности заболевают СД 1 типа и более 20% – СД 2 типа [8]. Поэтому своевременное выявление НУО во время беременности может рассматриваться как первичная профилактика и предупреждение прогрессирования НУО в будущем у таких женщин.
Среди НУО у беременных выделяют ГСД и манифестный СД (МСД). ГСД – это нарушение толерантности к глюкозе, впервые выявленное во время беременности. При этом не исключается, что НУО предшествовало беременности, но не было установлено, особенно у лиц, имеющих факторы риска СД. МСД – это впервые выявленная гипергликемия во время беременности, не соответствующая критериям ГСД. Уточнение типа СД должно проводиться согласно существующим алгоритмам [9]. Также выделяют термин прегестационный СД – это диабет, возникший до беременности.
В настоящее время для диагностики НУО у женщин во время беременности исследуется уровень глюкозы венозной плазмы натощак и как скрининговый метод проводится пероральный глюкозотолерантный тест (ПГТТ) в сроке 24-28 недель при нормогликемии до этого срока гестации.
На сегодняшний день остается нерешенным вопрос о целесообразности определения уровня HbAlc при ГСД, так как при беременности данный показатель снижается так же, как и средний уровень глюкозы венозной плазмы. Это объясняется тем, что у женщин во время гестации усиливается обмен эритроцитов, а плод утилизирует глюкозу в 2-3 раза интенсивнее, чем организм матери. Средний уровень HbAlc у беременных без диагностированного до беременности НУО составил 4,79 ± 0,4%, согласно исследованиям НАРО [10]. Поэтому HbAlc не является заменой определения уровня глюкозы венозной плазмы или проведения ПГТТ, что очень часто наблюдается в рутинной практике.
Определение уровня HbAlc имеет значение при выявлении МСД с целью уточнения сроков появления гипергликемии у матери. При показателе HbAlc ≤ 6,0% можно предположить, что именно беременность стала причиной НУО. Уровень HbAlc ≥ 6,0 предполагает наличие НУО до беременности. По мнению Э. К. Айламазяна и соавт. (2019), эндокринолог может использовать уровень данного показателя у беременной как критерий эффективности лечения. Так, повышение HbAlc > 5,6% на фоне диетотерапии может быть основанием для начала инсулинотерапии [4].
Известно, что НУО являются факторами риска неблагоприятных исходов как для плода, так и для матери [7]. НУО у беременных способствуют самопроизвольным абортам, родовому травматизму, развитию многоводия и появлению мочеполовой инфекции. При наличии прегестационного СД возможны прогрессирование сосудистых осложнений (ретинопатии, нефропатии, ишемической болезни сердца), увеличение количества гипогликемий, развитие кетоацидоза, а также поздний гестоз, рецидивирующие генитальные инфекции. Беременность может закончится преждевременными и/или оперативными родами (кесарево сечение, вакуум-экстракция плода) [2, 9].
Осложнения у плода при НУО у матери можно разделить на диабетическую эмбриопатию (ДЭ) и диабетическую фетопатию (ДФ). Многочисленные исследования показали, что гипергликемия и другие метаболиты (кетоновые тела, конечные продукты окисления глюкозы и др.) во время беременности у женщин с прегестационным СД являются значимыми тератогенными факторами развития эмбриона [11, 12]. ДЭ может сформироваться на сроке 8-12 недель гестации. Наиболее часто встречающимися врожденными пороками развития (ВПР) при СД являются пороки центральной нервной системы (1,21%) – анэнцефалия, микроцефалия, энцефалоцеле, гидроцефалия; сердечно-сосудистой системы (3,2%) – транспозиция магистральных сосудов, тетрада Фалло, дефекты межжелудочковой перегородки; краниофасциальной и скелетной систем (0,67%) – макростомия, микрогнатия, дефекты позвонков, дефекты нижних конечностей [4]. При ГСД также диагностируются случаи ВПР плода, но четкая связь между этими двумя состояниями отсутствует [13].
На более поздних сроках беременности у плода может развиться ДФ. Так, при НУО у матери происходит более активный перенос глюкозы через гематоплацентарный барьер к плоду. Гипергликемия способствует повышенному синтезу инсулина в поджелудочной железе плода, что приводит к гиперинсулинемии [14]. В свою очередь высокий уровень инсулина стимулирует анаболические механизмы в тканях плода и ускоряет его рост [15]. Это приводит к развитию ДФ (макросомия), которая может быть причиной перинатальных травм и постнатальной гибели новорожденного. Основными признаками ДФ при ультразвуковом исследовании (УЗИ) являются: крупный плод (диаметр живота плода ≥ 90 перцентилей), гепатоспленомегалия, кардиомегалия, кардиопатия, двуконтурность головки плода, отек и утолщение подкожно-жирового слоя, утолщение шейной складки; впервые выявленное или нарастающее многоводие при установленном диагнозе ГСД (в случае исключения других причин многоводия). У таких детей высока вероятность развития постнатальной гипогликемии, полицитемии и гипербилирубинемии [16].
Макросомия плода, определяемая как вес при рождении ≥ 4000 г, является распространенной причиной родового травматизма как у матери (травмы мягких тканей, послеродовое кровотечение), так и у ребенка. Увеличивается риск развития дистоции плечиков, которая отмечается у 6,3% новорожденных, перелома ключицы (19%), паралича Эрба (7,8%), тяжелой асфиксии (5,3%). Травматические нарушения мозгового кровообращения у новорожденных встречаются в 20% случаев, а респираторный дистресс-синдром – в 3-5 раз чаще, чем в общей популяции [17].
Известно, что гипергликемия увеличивает переход глюкозы через плаценту, что вызывает гиперплазию ß-клеток островкового аппарата поджелудочной железы и гиперинсулинемию, которая за счет увеличения синтеза инсулиноподобного фактора роста 1 (ИФР-1) способствует формированию макросомии плода [14, 15, 21]. Кроме того, при НУО у матери избыток глюкозы, проходя через плацентарный барьер, попадает в околоплодные воды, вызывает реакцию водной оболочки плода, что приводит к развитию многоводия [22]. Гипергликемия у матери в 89% случаев сопровождается изменением функции амниотического эпителия, при этом в амниотической жидкости обнаруживаются в повышенных концентрациях глюкокортикостероиды. Многоводие у беременных с СД также связывают с нарушением глотательных движений у плода, которое появляется в условиях хронической гипоксии [23].
В настоящее время наиболее актуальным является вопрос профилактики осложнений НУО во время гестации. В комплекс мероприятий по планированию входит надлежащее обследование и подготовка к беременности. Женщины проходят обучение в школе диабета, где получают информацию о возможных рисках развития осложнения для матери и плода при отсутствии частого самоконтроля гликемии и декомпенсации СД. Беременность без осложнений для плода и матери возможна только при достижении идеальной компенсации за 4-6 месяцев до зачатия, при этом глюкоза плазмы натощак должна быть < 6,1 ммоль/л, а через 2 ч после еды – < 7,8 ммоль/л, уровень HbA
Представляем истории болезни женщин, поступивших в стационар с декомпенсацией СД 1 типа на фоне беременности и с манифестацией СД, диагностированного во время беременности.
Клинический случай № 1
Пациентка П., 26 лет, поступила в эндокринологическое отделение Городской клинической больницы (ГКБ) № 52 в январе 2018 г. на сроке 23-24 недели беременности с жалобами на нестабильные показатели уровня гликемии, тянущие боли в нижней части живота, тахикардию, одышку,
Из анамнеза известно, что СД 1 типа диагностирован в 19 лет (длительность заболевания 7 лет). До беременности посещение и обследование у эндокринолога нерегулярное. Уровень HbA1c составил 7,2%. Данная беременность третья, самопроизвольная, предстоящие роды вторые. При поступлении получала инсулинотерапию в базис-болюсном режиме: Детемир 28 ЕД утром, 28 ЕД в 22 часа и инсулин Лизпро, доза которого зависела от количества употребляемых хлебных единиц (ХЕ), в среднем по 5-10 ЕД на прием пищи. На этом фоне уровень гликемии в течение дня колебался от 10 до 32 ммоль/л. Госпитализирована в эндокринологическое отделение с целью компенсации СД.
При поступлении состояние пациентки относительно удовлетворительное. При осмотре: рост 165 см, вес до беременности – 52 кг, исходный индекс массы тела (ИМТ) – 19,1 кг/м2, вес при поступлении – 58,8 кг, общая прибавка в весе – 6,8 кг. По данным лабораторных методов исследования концентрации глюкозы венозной плазмы натощак составила 11,4 ммоль/л, HbAlc – 7,6%, уровень гликемии при самоконтроле в течение суток колебался от 8 до 22 ммоль/л (рис. 1). Альбумин-креатининовое соотношение в анализе мочи – 1,2 мг/мл.
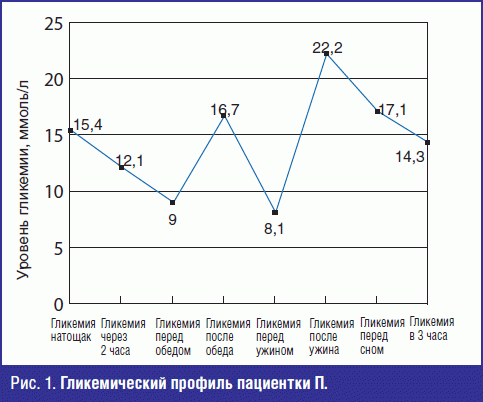
По данным УЗИ плода признаков ДЭ не обнаружено: визуализируется один живой плод, в головном предлежании, с ЧСС 164 удара в минуту, количество вод нормальное, индекс амниотической жидкости (ИАЖ) – 12 см (в норме 10-24 см). Фетометрические показатели соответствуют сроку беременности 23 недели.
В течение трех дней проводилась коррекция инсулинотерапии с целью стабилизации показателей гликемического профиля. Суточная доза базального инсулина доведена до 90 ЕД/сут, болюсного – до 36 ЕД/сут. На этом фоне гликемия в течение суток колебалась от 3,6 до 23 ммоль/л. Компенсация углеводного обмена не была достигнута, вариабельность гликемии сохранялась, в связи с чем пациентка переведена на режим постоянного введения инсулина ультракороткого действия (УКД) Аспарт с помощью помпы Medtronic 722. Для подбора дозы инсулина и контроля уровня гликемии использовался метод непрерывного суточного мониторирования.
Суточная доза базального инсулина пересчитана и снижена до 39 ЕД/сут, а болюсного – 18-25 ЕД/сут, из расчета (ХЕ/ЕД) 1:1,5 на завтрак, 1:2 на обед и 1:2,5 на ужин. В первые сутки на данной терапии сохранялась постпрандиальная гипергликемия, проведено обучение пациентки правильному подсчету ХЕ и расчету адекватной болюсной дозы с учетом коэффициента чувствительности. На третьи сутки достигнуты практически целевые показатели уровня гликемии (рис. 2). По достижении компенсации углеводного обмена на помповой инсулинотерапии пациентка выписана под наблюдение эндокринолога и акушера-гинеколога клинико-диагностического отделения больницы.
До родов пациентка посещала эндокринолога нерегулярно, диетические рекомендации и режим питания строго не соблюдала, коррекцию инсулинотерапии самостоятельно не проводила. Несмотря на это, отмечается снижение вариабельности гликемии (4,7-9,0 ммоль/л в течение суток). На сроке гестации 34-35 недель плановая госпитализация в роддом стационара. В связи с данными фетометрии: масса плода – 3989 г, нарастанием многоводия (ИАЖ – 35 см при норме для данного срока беременности до 24 см), – пациентка оперативно родоразрешена на 35-36 неделе. Родился живой недоношенный мальчик с признаками выраженной макросомии: весом 4200 г, длиной тела 53 см, что явилось результатом длительного некомпенсированного углеводного обмена у матери.
Таким образом, своевременный перевод женщин с СД 1 типа на инсулинотерапию в режиме постоянной инфузии поддерживает уровень инсулинемии, который максимально приближен к постоянно меняющимся потребностям организма женщины во время беременности, что в свою очередь позволяет достигнуть стабильной компенсации СД на протяжении всего срока гестации и предотвращает развитие возможных осложнений как для матери, так и для плода.
Остается интересным вопрос, почему доза инсулина при подкожном (п/к) введении до перевода на помповую инсулинотерапию, доведенная до 126 ЕД/сут, не позволяла стабилизировать гликемию. Известно, что во время беременности в организме женщины происходят важные изменения метаболизма. В начале беременности до формирования плаценты повышается секреция эстрогенов и прогестерона. В гипофизе увеличивается секреция пролактина и меланоцитстимулирующего гормона. Все это необходимо для обеспечения правильного роста и развития плода. Также к концу беременности в крови в 3 раза возрастает уровень кортизола [20]. Во второй половине беременности усиливается инсулинорезистентность, которая связана с повышенной секрецией плацентарных гормонов, в большей степени с плацентарным лактогенным гормоном. Это приводит к нарушению связывания инсулина с рецепторами, что в свою очередь вызывает каскад реакций в организме беременной женщины: увеличивается глюконео-генез, повышается постпрандиальная гликемия из-за более быстрого достижения пика всасывания углеводов, удлиняется время всасывания пищи из-за снижения двигательной активности желудочно-кишечного тракта, в то время как у здоровых женщин нарастающая во время беременности инсулинорезистентность компенсируется за счет повышения первой и второй фазы секреции инсулина в 2-3 раза [4]. Применение помповой инсулинотерапии у женщин с прегестационным СД при всех гормональных и метаболических изменениях во время беременности, в отличие от многократных ежедневных подкожных инъекций инсулина, обеспечивает идеальное распределение общей дозы инсулина в течение суток и отсутствие его подкожного депо, что уменьшает суточную потребность в инсулине.
Клинический случай № 2
Пациентка О., 28 лет, поступила в эндокринологическое отделение ГКБ № 52 с жалобами на общую слабость, состояние после кесарева сечения. Из анамнеза известно, что до настоящей беременности у эндокринолога не наблюдалась, СД в анамнезе отрицает. Данные роды четвертые (2009 г. – преждевременные роды на 20-й неделе; 2010 г. – роды в срок, мальчик 3200 г; 2011 г. – домашние роды в срок, мальчик 4000 г; 2016 г. – самопроизвольный выкидыш на 7-8 неделе). Впервые повышение гликемии до 12,3 ммоль/л выявлено на сроке 8 недель данной беременности, на консультацию к эндокринологу пациентка не явилась. При контроле во II триместре гликемия составила 8,1 ммоль/л. На сроке 15-16 недель впервые консультирована эндокринологом в ГКБ № 52. При осмотре: нормостенического телосложения, ИМТ до беременности – 20,9 кг/м2. В связи с неоднократным повышением уровня глюкозы венозной плазмы натощак более 7,0 ммоль/л диагностирован МСД. Рекомендовано начать инсулинотерапию в режиме 1 инъекции п/к аналога инсулина длительного действия Детемир по 8 ЕД в 22:00, проведение самоконтроля гликемии 6-7 раз в день на фоне соблюдения режима питания и физических нагрузок. Проведена беседа о негативном влиянии гипергликемии на плод, необходимости инсулинотерапии для коррекции углеводного обмена, соблюдения принципов питания и динамического наблюдения эндокринологом. Пациентка направлена на исследование HbA
В раннем послеродовом периоде у матери наблюдалось постепенное нарастание гликемии до 13,5 ммоль/л, уровень HbAlc составил 6,6%. Назначена базис-болюсная инсулинотерапия: Детемир 10 ЕД на ночь, Аспарт по 4 ЕД перед основными приемами пищи. На этом фоне отмечалась вариабельность гликемии в течение суток 6,2-10,3 ммоль/л. На пятые сутки переведена в отделение эндокринологии ГКБ № 52 с целью коррекции инсулинотерапии и компенсации углеводного обмена. Данный клинический пример демонстрирует важность с позиции здоровья матери и плода своевременной диагностики и лечения ГСД.
Заключение
НУО во время беременности является одной из причин макросомии, фетоплацентарной недостаточности, хронической внутриутробной гипоксии плода. Трудности диагностики НУО, связанные с отсутствием явных клинических признаков и невысокой гипергликемией при ГСД, обуславливают его позднюю выявляемость. Необходимо отметить, что, несмотря на современные диагностические возможности, встречаемость нарушений течения пре- и постгравидарного периодов, частота аномалий роста и развития плода остается высокой. Это связано с ростом частоты ожирения и СД во всем мире, отсутствием адекватной подготовки женщин с СД к беременности и приверженности к лечению во время беременности женщин ГСД и СД.
Планирование и правильное ведение беременности у женщин с прегестационным СД играют основную роль в предотвращении рисков как для матери, так и для плода и являются основой рождения здорового ребенка и здоровья матери.
Литература/References
- International Diabetes Federation Diabetes Atlas, 9th edition 2019.
- Эндокринология. Российские клинические рекомендации / Под ред. И. И. Дедова, Г. А. Мельниченко. ISBN: 5970450812, М.: ГЭОТАР-Медиа, 2019. C. 156-157. [Endocrinology. Russian clinical guidelines / Ed. By Dedov I. I., Melnichenko G. A. ISBN: 5970450812. М.: GEOTAR-Media, 2019. Р. 156-157.]
- Попова П. В., Дронова А. В. и др. Сравнение применения старых и новых Российских критериев диагностики гестационного сахарного диабета // Артериальная гипертензия. 2013. Т. 19, № 4. С. 367-373. [Popova P. V., Dronova A. V. et al. Sravnenie primeneniya starykh i novykh Rossiiskikh kriteriev diagnostiki gestatsionnogo sakharnogo diabeta [Old versus new Russian criteria for gestational diabetes] // Arterialnaya gipertenziya. 2013. V. 19, № 4. Р. 367-373.]
- Сахарный диабет и репродуктивная система женщины: руководство для врачей / Под. ред. Э. К. Айламазаяна. М.: ГЭОТАР-Медиа, 2017. С. 15-246. [Diabetes mellitus and reproductive system of the woman: a guide for doctors / Ed. by E. K. Aylamazayana. М.: GEOTAR-Media, 2017. Р. 15-246.]
- Капустин Р. В., Аржанова О. Н. и др. Роль ожирения и избытка массы тела как фактора развития гестационного сахарного диабета: систематический обзор // Журнал акушерства и женских болезней. 2015. Т. 64. № 5. C. 87-95. DOI: 10.17816/JOWD64587-95. [Kapustin R. V., Arzhanova O. N. et al. Rol ozhireniya I izbytka massy tela kak faktora razvitiya gestatsionnogo sakharnogo diabeta: sistematicheskii obzor [The role of obesity and overweight as a factor of gestational diabetes mellitus: a systematic review] // Zhurnal akusherstva i zhenskikh boleznei. 2015. V. 64. № 5. Р. 87-95. DOI:10.17816/JOWD64587-95.]
- Геворкян М. А. Ожирение и репродуктивное здоровье женщины // Ожирение и метаболизм. 2008. Т. 5. № 3. С. 13-16. [Gevorkyan M. A. Ozhirenie i reproduktivnoe zdorovie zhenschiny [Obesity and reproductive health of woman]. Ozhirenie i matabolizm. 2008. V. 5. № 3. P. 13-16.]
- Тиселько А. В. 7-й Международный симпозиум «Диабет, гипертония, метаболический синдром и беременность», 13-16 марта 2013. Флоренция, Италия // Сахарный диабет. 2013. № 1. С. 106-107. DOI: 10.14341/2072-0351-3605. [Tiselko A. V. 7th International Symposium «Diabetes, hypertension, metabolic syndrome and pregnancy", March 13-16, 2013. Florence, Italy // Sakharnyi diabet. 2013. № 1. P. 106-107. DOI: 10.14341/2072-0351-3605.]
- Kim С., et al. Gestational diabetes and incidence of type 2 diabetes: a systematic review // Diabetes Care. 2007. Vol. 25. P. 1862-1868.
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И. И. Дедова, М. В. Шестаковой, 9-й вып. 2019. С. 132-138. DOI: 10.14341/DM221S1. [Special Care Algorithms for Diabetes Patients / Ed. by Dedov I. I., Shestakova M. V., the 9th rel. 2019. Р. 132-138. DOI: 10.14341/DM221S1.]
- HAPO Study Cooperative Research Group, Metzger B., Lowe L. et al. The hyperglycemia and adverse pregnancy outcomes // N. Engl. J. Med. 2008. Vol. 358 (19). P. 1991-2002. DOI: 10/1056/NEJMoa0707943.
- Eriksson U. J., Borg L. A., et al. Pathogenesis of diabetes-induced congenital malformations // Ups J. Med. Sci. 2000. Vol. 105. P. 53-84.
- Akazawa S. Diabetic embryopathy: stadies using a rat embryo culture system and an animal model // Congenit Anom (Kyoto). 2005. Vol. 45. P. 73-79.
- Farrell T., Neale L., Cundy T. Congenital anomalies in the offspring of women with type 1, type 2 and gestational diabetes // Diabet. Med. 2002. Vol. 19. P. 322-326.
- Catalano P. M., Kirwan J. P. et al. Gestational diabetes and insulin resistance: role in short- and long-term implications for mother and fetus // J. Nutr. 2003. Vol. 133. P. 1245-1251.
- Westgate J. A. et al. Hyperinsulinemia in cord blood in mothers with type 2 diabetes and gestational diabetes mellitus in New Zeland // Diabetes Care. 2006. Vol. 29 (6). P. 1345-1350.
- Клинические рекомендации. Гестационный сахарный диабет. 2016. С. 8. [Clinical guidelines. Gestational diabetes mellitus. 2016. Р. 8.]
- Джобава Э. М., Арбатская Н. Ю. и др. Гестационный сахарный диабет и магний. Перспективы профилактики и комплексной терапии // Российский вестник акушера-гинеколога. 2014; 14 (6): 32-36. [Dzhobava E. M., Arbatskaia N. Yu. et al. Gestatsionnyi sakharnyi diabet i magnii. Perspektivy profilaktiki I kompleksnoi terapii [Gestational diabetes mellitus and magnesium: prospects for prevention and combination therapy] // Rossiskii vestnik akushera-ginekologa. 2014$ 14 (6): 32-36.]
- Шестакова М. В., Викулова О. К. и др. Эпидемиология сахарного диабета в Российской Федерации: что изменилось за последнее десятилетие? // Терапевтический архив. 2019; 10: 6. DOI: 10.26442/00403660.2019.10.000364. [Shestakova M. V., Vikulova O. K. et al. Epidemiologiya sakharnogo diabeta v Rossiiskoi Federatsii: chto izmenilos za poslednee desyatiletie? [Diabetes epidemiology in Russia: what has changed over the decade?] // Terapevticheskii arkhiv. 2019; 10: 6. DOI: 10.26442/00403660.2019.10.000364.]
- Демидова И. Ю. Актуальные проблемы компенсации сахарного диабета при беременности // Сахарный диабет. 2009. № 4. С. 32-38. [Demidova I. Yu. Aktualnye problemy kompensatsii pri beremennosti [Topical problems of diabetes treatment during pregnancy] // Sakharnyi diabet. 2009. № 4. Р. 32-38.]
- Langer O. The diabetes in pregnancy Dilemma. 2011. PMPH-USA, LTD. 445 р.
- Carlsen E., Renault K. еt al. The Association between Newborn Regional Body Composition and Blood Concentrations of C-Peptide and Insulin-like Growth Factor I // PLoS One. 2015. Vol. 10 (7). DOI: 10.1371/journal.pone.0121350.
- Беловоденко М. А. и др. Влияние гипергликемии на плод при гестационном и манифестном сахарном диабете типа 2 // Journal of Siberian Medical Sciences. 2018. № 2. С. 34-42. [Belovodenko M. A., et al. Vliyanie giperglikemii na plod pri gestatsionnom i manifestnom sakharnom diabete tipa 2 [Hyperglycemia effect on fetus in gestational and manifest type 2 diabetes mellitus] // Journal of Siberian Medical Sciences. 2018. № 2. P. 34-42.]
- Бурумкулова Ф. Ф., Петрухин В. А. Гестационный сахарный диабет: эндокринологические и акушерские аспекты // Врач. 2012. № 9. С. 2-5. [Burumkulova F. F., Petrukhin V. A. Gestatsionnyi sakharnyi diabet: endokrinologicheskie i akusherskie aspekty [Gestational diabetes mellitus: endocrinological and obstetric aspects] // Vrach. 2012. № 9. P. 2-5.]
Я. А. Соловьева
А. В. Печенкина
А. В. Горшкова
ГБУЗ ГКБ № 52 ДЗМ, Москва, Россия
1Контактная информация: markovatn18@yandex.ru
Сахарный диабет и беременность: клинические случаи из практики врача-эндокринолога/ Т. Н. Маркова, Я. А. Соловьева, А. В. Печенкина, А. В. Горшкова
Для цитирования: Маркова Т. Н., Соловьева Я. А., Печенкина А. В., Горшкова А. В. Сахарный диабет и беременность: клинические случаи из практики врача-эндокринолога // Лечащий Врач. 2020; 12 (23): 30-34. DOI: 10.26295/OS.2020.96.34.006
Теги: углеводный обмен, ожирение, гипергликемия, женщины, новорожденные
Купить номер с этой статьей в pdf