Хроническая сердечная недостаточность (ХСН) I–IV функционального класса (ФК) по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association, NYHA) по данным проведенных исследований в 22 субъектах РФ (ЭПОХА-ХСН и ЭПОХА-О-ХСН) составила 7% случаев (7,9 млн человек), а выраженная ХСН (II–IV ФК) отмечалась у 4,5% населения (5,1 млн человек) [1]. По данным Национальных рекомендаций Общества специалистов по сердечной недостаточности (ОССН), Российского кардиологического общества (РКО) и Российского национального медицинского общества терапевтов (РНМОТ) по диагностике и лечению ХСН четвертого пересмотра, декомпенсация ХСН является причиной госпитализации каждого второго пациента с заболеваниями сердца и сосудов. Основой для развития ХСН является нарушение структуры и/или функции сердца, в результате которого сердце не в состоянии удовлетворить потребности организма в кислороде при нормальном давлении наполнения сердца, и это возможно лишь ценой повышения давления наполнения сердца [2].
Тенденции фармакотерапии как острой, так и хронической сердечной недостаточности, помимо стандартной терапии, направлены на восстановление энергетического дисбаланса в условиях кислородного голодания сердечной мышцы, что может быть достигнуто применением цитопротекторов. Одним из хорошо известных клиницистам корректоров метаболизма является препарат Милдронат® (3–2,2,2-триметилгидразиний пропионат), который приводит к снижению энергетических затрат клетки посредством использования окисления глюкозы, уменьшая проникновение в клетку недоокисленных жирных кислот и предотвращая образование свободных радикалов, снижая таким образом оксидативный стресс. Особенно актуален данный механизм в условиях ишемизированного миокарда. Таким образом, использование препарата Милдронат® уменьшает проявления ХСН, улучшает сократительную функцию сердца, а следовательно, и толерантность к физическим нагрузкам [3].
Однако клинические исследования в отношении применения препарата Милдронат® у пациентов с сердечной недостаточностью не дают полного ответа на вопрос о влиянии препарата на прогноз и течение ХСН, а также возможность применения в остром периоде ХСН и влияние на долгосрочный прогноз у пациентов с ХСН.
Материалы и методы исследования
На базе ГКБ им. С. И. Спасокукоцкого г. Москвы за 2018 г. было обследовано 50 пациентов с декомпенсацией ХСН (II–III ФК по классификации NYHA) в возрасте от 61 года до 82 (в среднем 73,2 ± 5,6) лет. В первую группу были включены 30 пациентов, 16 мужчин и 14 женщин в возрасте 73,2 ± 5,6 года с декомпенсацией ХСН. Этим пациентам в стационаре был назначен Милдронат® в дозе 1000 мг 1 раз в сутки в/в в качестве дополнения к традиционной базисной терапии, а также после выписки из стационара по 500 мг в капсулах 2 раза в день в течение последующего периода наблюдения до трех месяцев. Во вторую группу было включено 20 пациентов, 8 мужчин и 12 женщин, средний возраст 75,3 ± 5,5 лет с декомпенсацией ХСН. Этим пациентам проводилась только традиционная базисная терапия (группа контроля). Длительность исследования составила 3 месяца.
Критериями исключения являлись: одышка некардиогенного генеза; детородный возраст у женщин, а также беременность или лактация; температура тела более 38,5 °C; сепсис или активная инфекция, требующая внутривенного введения антимикробных препаратов; клинические проявления острого коронарного синдрома в настоящее время или в течение 30 дней до включения; острая сердечная недостаточность вследствие значимой аритмии, острого миокардита или гипертрофической обструктивной, рестриктивной или констриктивной кардиомиопатии; наличие активной или рецидивирующей бактериальной, грибковой или вирусной инфекции на момент включения; наличие онкологических заболеваний; повышение уровня аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) более чем в 3 раза; индекс массы тела более 40 кг/м2.
Стандартная терапия ХСН назначалась врачом-исследователем и/или лечащим врачом в соответствии с принятым стандартом оказания медицинской помощи. Стандартная терапия включала в себя назначение ингибиторов АПФ, диуретической терапии (фуросемид, спиронолактон), сердечных гликозидов (дигоксин) по показаниям, антигипертензивные препараты по показаниям, антиагрегантную терапию.
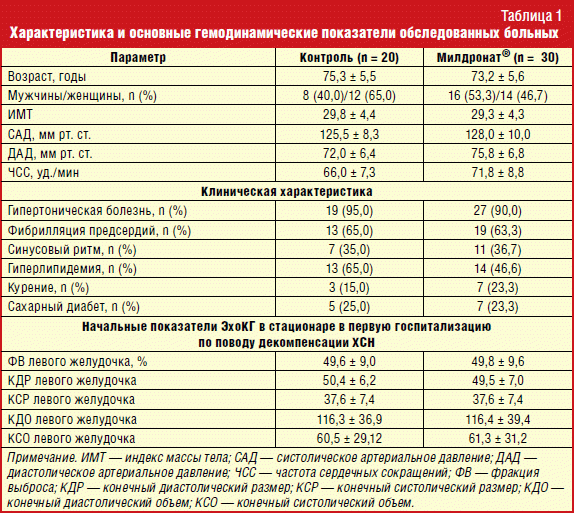
Характеристика и основные гемодинамические показатели обследованных больных представлены в табл. 1.
Результаты исследования
При лечении препаратом Милдронат® у пациентов с декомпенсацией ХСН, также как и в группе контроля, существенного влияния на частоту сердечных сокращений не наблюдалось, достоверной динамики артериального давления, как систолического, так и диастолического (p > 0,05), зарегистрировано не было. Ни в одном случае не обнаружено побочных эффектов препарата. Не было выявлено достоверных изменений в общем и биохимическом анализах крови, отсутствовали значимые изменения электрокардиограммы (ЭКГ).
За время исследования в группе стандартной терапии наблюдалось уменьшение КСР ЛЖ на 4,3% (p = 0,1), КДО ЛЖ на 5,3% (p = 0,5), КСО ЛЖ на 5% (p = 0,43), остальные показатели не имели клинически значимых изменений.
В группе препарата Милдронат® наблюдалось уменьшение размера левого предсердия на 2,5% (p = 0,04), КДР ЛЖ на 4,8% (p = 0,07), КСР ЛЖ на 7,3% (p = 0,08), КДО левого желудочка на 6,8%(p = 0,4), КСО ЛЖ на 16% (p = 0,3), уменьшение ММЛЖ на 9,4% (p = 0,1), увеличение фракции выброса на 7,4% (p = 0,1), однако данные изменения не достигли статистически значимого уровня, что, по нашему мнению, связано с недостаточным объемом выборки.
В группе препарата Милдронат® по сравнению с группой контроля наблюдалось выраженное увеличение фракции выброса на 6,8%, выраженное уменьшение КДР ЛЖ на 7,4%, КСР ЛЖ на 4,5%, КСО ЛЖ на 8% (табл. 2), положительный эффект применения препарата Милдронат® доказан в ходе относительно кратковременного наблюдения, продолжавшегося 3 месяца, однако при более длительном применении ожидается усиление положительного эффекта препарата.
В динамике NT-proBNP на 1-й и 7-й день госпитализации: в группе стандартной терапии — уменьшение на 32,8%, в группе препарата Милдронат® — уменьшение на 28,3%. Через 3 месяца после госпитализации: в группе стандартной терапии — увеличение NT-proBNP на 8,9%, в группе препарата Милдронат® — уменьшение NT-proBNP на 16,3% (p < 0,0004) по сравнению с NT-proBNP на 7-й день госпитализации (табл. 3, рис.), что показывает положительное влияние препарата Милдронат® в составе комплексной терапии у больных с декоменсацией ХСН, так как уровень NT-proBNP напрямую свидетельствует о таком показателе, как годичная выживаемость больных [4].
Обсуждение
Гипоксия — типовой патологический процесс, развивающийся вследствие абсолютной и/или относительной недостаточности биологического окисления, приводящий к нарушению энергетического обеспечения функций и пластических процессов в организме. Понимание того, что ишемическая болезнь сердца (ИБС) представляет собой несоответствие уровня потребления миокардом кислорода объему его доставки коронарным кровотоком, а также нарушение бета-окисления свободных жирных кислот в митохондриях кардиомиоцитов с накоплением в митохондриях недоокисленных продуктов — ацилкарнитина и ацилкоэнзима А (ацетил-КоА), открыло возможность для нового направления медикаментозного воздействия на ишемизированный миокард — миокардиальную цитопротекцию [5].
Идеология метаболической кардиопротекции сложилась достаточно давно. Использование корректоров метаболизма в схемах лечения пациентов с ХСН началось в 1990-х гг. [6]. Средства метаболического действия, целенаправленно влияющие на обменные процессы при гипоксии, — это препараты различных химических классов, их действие опосредуется различными механизмами: улучшением кислород-транспортной функции крови, поддержанием энергетического баланса клеток, коррекцией функции дыхательной цепи и метаболических нарушений клеток тканей и органов [7].
Милдронат® принадлежит к группе так называемых цитопротекторов — антигипоксантов, обеспечивающих защиту и энергоснабжение различных клеток организма в условиях ишемии и повышенной нагрузки. Милдронат®, будучи структурным аналогом γ-бутиробетаина (ГББ), является конкурентным ингибитором ГББ-гидроксилазы — последнего фермента в цепи биосинтеза карнитина в организме человека и животных.
В литературе приводится ряд исследований эффективности применения препарата Милдронат® при лечении ХСН. На сегодня опубликованы результаты более 250 клинических исследований, в которых оценивалась клиническая эффективность мельдония при целом ряде патологических состояний, причем возможности применения этой молекулы в разных областях клинической медицины продолжают активно изучаться. Наиболее существенный опыт его применения, пожалуй, накоплен при лечении пациентов с различными формами ишемической болезни сердца [8].
A. O. Недошивин и соавт. [9, 10] исследовали 60 мужчин с ИБС и ХСН II–III ФК с фракцией выброса менее 45%. В дополнение к стандартной базисной терапии 30 пациентов получали Милдронат® по 1000 мг 1 раз в сутки перорально в течение 4 недель. Контрольную группу составили 30 больных, получающих только базисную терапию. Эффект лечения оценивался по данным ЭхоКГ, при помощи теста шестиминутной ходьбы и с использованием вопросника SF-36 для оценки качества жизни.
Анализ результатов показал, что у пациентов, получавших Милдронат®, к концу курса лечения наблюдалось выраженное увеличение ФВ и уменьшение значений конечного диастолического и конечного систолического объемов ЛЖ. Степень прироста толерантности к физической нагрузке в группе больных, получавших Милдронат®, оказалась также выше, чем у больных, получавших только стандартную терапию.
Авторами был сделан вывод о том, что включение препарата Милдронат® в комплексную терапию ХСН позволяет обеспечить более выраженное позитивное влияние терапии на состояние гемодинамики, толерантность к физической нагрузке и качество жизни пациентов в целом.
Натрийуретические пептиды — класс родственных пептидов, включающий ANP (atrial natriuretic peptide — предсердный натрийуретический пептид), BNP, а также CNP (C-type natriuretic peptide — натрийуретический пептид типа C) и DNP (dendroaspis natriuretic peptide — D-натрийуретический пептид). Интересующий нас BNP синтезируется преимущественно желудочками сердца, а стимулирующим элементом повышенной секреции этого нейрогормона является объемная перегрузка камер сердца [11, 12]. Есть данные о том, что концентрация мозговых натрийуретических пептидов тесно коррелирует с размерами, функцией и массой ЛЖ, что имеет большое значение в диагностике ХСН и прогнозе этих больных [13, 14]. В исследовании С. А. Габрусенко и соавт. [15] изучались взаимосвязи клинических данных, гемодинамических показателей и концентрации натрийуретических пептидов у 110 пациентов с гипертрофической кардиомиопатией. Было выявлено, что содержание N-концевого предсердного натрийуретического пептида коррелировало со степенью митральной регургитации и более точно соотносилось с поперечным размером левого предсердия.
Повышенная концентрация натрийуретических пептидов является независимым фактором риска развития декомпенсации и вероятности летального исхода у пациентов с ХСН. R. Berger и соавт. в течение трех лет отслеживали на амбулаторном этапе 452 пациента с умеренной и тяжелой ХСН и фракцией выброса ЛЖ менее 35%. Концентрация мозгового натрийуретического пептида, повышенная еще в начале наблюдения, оказалась независимым фактором, предсказывающим внезапную смерть: только 1% пациентов с уровнем пептида меньше 130 пг/мл умерли внезапно, тогда как среди пациентов с уровнем мозгового натрийуретического пептида выше 130 пг/мл умерли 19% пациентов [16].
В рамках исследования, проведенного E. Lubien и соавт. [17], у 249 пациентов концентрации BNP были сопоставлены с эхокардиографическим параметром — трансмитральным диастолическим потоком. Пациенты были разделены на две группы: первая группа — больные с диастолической дисфункцией ЛЖ, а вторая группа — с референсными показателями диастолической функции ЛЖ. В первой группе концентрация BNP составила 286 ± 31 пг/мл, во второй — 33 ± 3 пг/мл. Примечательно, что наиболее высокие показатели пептида были отмечены в подгруппе больных с рестриктивным типом трансмитрального потока.
T. K. Lim и соавт. оценили возможность прогнозирования летальности и декомпенсации, ведущей к повторной госпитализации у 132 пациентов с подозрением на ХСН. Уровень N-концевого мозгового натрийуретического пептида 50 пмоль/л и выше и измененная ЭхоКГ оказались независимыми показателями, предсказывающими неблагоприятный исход [18].
Обобщая клинические исследования лечения препаратом Милдронат® ХСН, следует отметить, что Милдронат®: 1) улучшает сократимость миокарда по эхокардиографическим показателям; 2) увеличивает толерантность к физической нагрузке; 3) уменьшает количество желудочковых экстрасистол и не вызывает ишемизацию миокарда при нагрузке; 4) улучшает самочувствие и качество жизни больных; 5) улучшает функцию эндотелия сосудов; 6) может быть включен в схемы комбинированной терапии; 7) обладает благоприятным профилем безопасности; 8) оптимальная суточная доза препарата — 1000 мг в день, при длительности приема до 6 недель.
Заключение
Милдронат® в амбулаторной практике применяется как препарат с полимодальным действием и показан как при изолированной, так и при сочетанной патологиях сердечно-сосудистой системы ишемического генеза — ИБС, ХСН. В условиях стационара применение препарата Милдронат® в комплексной терапии помогает сокращению сроков пребывания больного и улучшает его прогноз.
Внутривенное применение в течение 7–10 дней препарата Милдронат® в дозе 1000 мг/сут с последующим пероральным приемом в дозе 1000 мг/сут в течение 3 месяцев в составе комбинированной терапии у больных с декомпенсацией ХСН оказывает положительное влияние: уменьшает проявления ХСН, что сопровождается снижением тяжести ФК ХСН и уменьшением содержания в крови больных уровня NT-proBNP, благоприятно влияя на прогноз пациентов, снижая вероятность повторной госпитализации по поводу декомпенсации ХСН. Низкий уровень NT-proBNP является прогностически благоприятным признаком и ассоциируется с более низкой вероятностью летального исхода и высоким уровнем качества жизни пациентов с ХСН; благоприятно влияет на структурно-функциональные параметры сердца (уменьшается число пациентов с неблагоприятными типами ремоделирования ЛЖ и улучшается диастолическая функция сердца).
Проведенное нами клиническое сравнительное исследование подтверждает эффективность, безопасность и благоприятное влияние препарата Милдронат® на прогноз заболевания при острой декомпенсации ХСН на госпитальном этапе и подтверждает необходимость пролонгации его приема на амбулаторном этапе лечения.
Литература
- Агеев Ф. Т., Беленков Ю. Н., Мареев В. Ю. Хроническая сердечная недостаточность. Избранные лекции по кардиологии. М.: ГЭОТАР-Медиа, 2006.
- Болезни сердца по Браунвальду: руководство по сердечно-сосудистой медицине / Под. ред. П. Либби и др.; пер. с англ., под общ. ред. Р. Г. Оганова. В 4 т. Том 2. М.: Логосфера, 2012. 596 с.
- Dzerve V., Matisone D., Kukulis I. et al. Mildronate improves peripheral circulation in patients with chronic heart failure: results of clinical trial (the first report) // Seminars in Cardiology. 2005. Vol. 11, № 2. Р. 56–64.
- Галявич А. С., Валиуллина Э. Р. N-терминальный про-мозговой натрийуретический пептид у больных гипертонической болезнью и влияние на него антигипертензивных средств // Российский кардиологический журнал. 2006. Т. 11, № 5. С. 76–81.
- Стаценко М. Е., Туркина С. В. Метаболическая кардиопротекция мельдонием при ишемической болезни сердца: итоги и перспективы // Лечащий Врач. 2012, № 7.
- Brottier L., Barat J. L., Combe C. et al. Therapeutic value of a cardioprotecti- ve agent in patients with severe ischemic cardiomyopathy // Eur Heart J. 1990; 11: 207–212.
- Морозова Т. Е. Метаболические лекарственные средства в кардиологической практике // Лечащий Врач. 2008. № 6.
- Дзерве В. Я., Калвиньш И. Я. Милдронат в кардиологии. Обзор исследований. 2013.
- Недошивин А. О., Кутузова А. Э., Перепеч Н. Б. Применение Mилдроната в комплексной терапии хронической сердечной недостаточности // Клиническая медицина. 1999; Т. 77. № 3. С. 41.
- Недошивин А. О. Автореферат дисс. … д. м. н. СПб, 2002. С. 32.
- Edvinsson M. L., Ahnstedt H., Edvinsson L., Andersson S. E. Char- acterization of relaxant responses to natriuretic peptides in the human microcirculation in vitro and in vivo // Microcirculation. 2016; 23 (6): 438–446.
- De Vito P. Atrial natriuretic peptide: an old hormone or a new cytokine? // Peptides. 2014; 58: 108–116.
- Groenning B. A., Nilsson J. C., Sondergaard L. et al. Detection of left ventricular en- largement and impaired systolic function with plasma N-terminal pro brain natriuretic peptide concentrations // Am Heart J. 2002; 143 (5): 923–929.
- Gustafsson F., Badskjær J., Hansen F. S. et al. Value of N-terminal proBNP in the di- agnosis of left ventricular systolic dysfunction in primary care patients referred for echocardiography // Heart Drug. 2003; 3: 141–146.
- Габрусенко С. А., Сафрыгина Ю. В., Овчинников А. Г., Масенко В. П.,. Наумов В. Г., Агеев Ф. Т., Беленков Ю. Н. Клинико-гемодинамический статус и сердечные натрийуретические пептиды в плазме крови больных гипертрофической кардиомиопатией // Consilium Medicum. Кардиологический вестник. 2006. Т. 1, № 2.
- Berger R., Huelsman M., Strecker K. et al. B-type natriuretic peptide predicts sudden death in patients with chronic heart failure // Circulation. 2002. № 105. P. 2392–2397.
- Lubien E., DeMaria A., Krishnaswamy K. Utility of B-natriuretic peptide in diagnosing diastolic dysfunction // Circulation. 2002. Vol. 105. P. 595–601.
- Lim T. K., Hayat S. A., Gaze D. et al. Independent value of echocardiography and N-terminal pro-natriuretic Peptide for the prediction of major outcomes in patients with suspected heart failure // Am J Cardiol. 2007. V. 100, № 5. P. 870–875.
С. В. Царегородцев
А. Л. Кебина
А. Л. Вёрткин, доктор медицинских наук, профессор
ГБОУ ВО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
1 Контактная информация: docsycheva@gmail.com
Эффективность применения мельдония в комплексном лечении пациентов с декомпенсацией хронической сердечной недостаточности/ А. С. Сычёва, С. В. Царегородцев, А. Л. Кебина, А. Л. Вёрткин
Для цитирования: Лечащий врач № 2/2019; Номера страниц в выпуске: 11-15
Теги: сердце, миокард, ишемия, цитопротекторы
Купить номер с этой статьей в pdf