Подагра — системное заболевание, при котором в различных тканях откладываются кристаллы моноурата натрия и у лиц с гиперурикемией развивается воспаление, обусловленное внешнесредовыми и/или генетическими факторами [1]. Распространенность подагрического артрита в популяции достаточно высока и составляет 5–28 на 1000 мужчин и 1–6 на 1000 женщин, а число новых случаев в год — 1–3 на 1000 мужчин и 0,2 на 1000 женщин [2].
За последние десятилетия заболеваемость подагрой увеличилась в несколько раз [3]. Несмотря на подробное описание подагры уже в прошлом тысячелетии, данное заболевание остается одним из поздно диагностируемых процессов. По данным клиники терапии и профболезней им. Е. М. Тареева Первого МГМУ им. И. М. Сеченова, из 128 больных типичной подагрой более чем у половины диагноз был установлен крайне поздно, уже при далеко зашедшем поражении органов [4].
Интерес к проблеме подагры обусловлен не только ростом ее заболеваемости, но и обнаруженными взаимосвязями подагры, гиперурикемии и кардиоваскулярного риска [5]. Гиперурикемия играет важную роль в развитии артериальной гипертензии (АГ), сахарного диабета и является независимым предиктором сердечно-сосудистых заболеваний [6].
Патогенетические механизмы повышения сердечно-сосудистой заболеваемости и смертности у лиц с гиперурикемией и подагрой многообразны. Хроническое воспаление — один из факторов, который запускает и поддерживает процесс формирования атеросклеротической бляшки у больных с гиперурикемией и подагрой [7]. Окислительный стресс является еще одним из важных факторов, способствующих эндотелиальной дисфункции и повреждению сосудистой стенки, лежащих в основе развития сердечной недостаточности (СН), АГ, ишемической болезни сердца (ИБС) у больных ревматическими заболеваниями [8].
По нашим данным, совпадающим с данными литературы [9], пациенты с подагрой относятся к группе больных с высоким риском фатальных сердечно-сосудистых осложнений, что обусловлено имеющейся эндотелиальной дисфункцией (повышением антитромбогенной активности сосудистой стенки, повреждением сосудистой стенки, увеличением жесткости артерий). Традиционные факторы сердечно-сосудистого риска чаще встречаются у больных подагрой, чем в общей популяции. В нашем исследовании у 91% больных по данным суточного мониторирования артериального давления (АД) выявлялась АГ, у большинства больных подагрой (73,7%) выявлен суточный профиль с недостаточной степенью ночного снижения АД (non-dipper) [10]. У таких пациентов значительно повышена жесткость артерий, уровень С-реактивного белка (СРБ) (р < 0,05) [11].
В последние годы исследователи находят взаимосвязь также между наличием аортального стеноза и подагры, однако является ли подагра фактором риска либо маркером поражения клапанов сердца, еще только предстоит изучить [12]. Но несомненно, что поражение сердечно-сосудистой системы при подагре, наряду с артритом, является одним из основных клинических проявлений подагры, определяющим тяжесть течения и прогноз заболевания [13]. Сердечно-сосудистая заболеваемость и смертность превышают смертность от поражения почек у больных подагрой [14].
В качестве иллюстрации приводим клинический случай пациента с подагрой с развитием фатального сердечно-сосудистого осложнения.
Пациент К., 62 лет, житель Саратовской области, работал в течение 38 лет водителем. Страдал подагрой в течение 13 лет. Заболевание началось типично, с возникновения острых приступов артрита суставов стоп, включая первые плюснефаланговые суставы, суставы предплюсны, повторяющихся 3–4 раза в год. Приступы купировались приемом нестероидных противовоспалительных препаратов (НПВП) в течение нескольких дней. Через 3 года от начала заболевания обратился к ревматологу, выставлен диагноз подагры, назначен аллопуринол в дозе 200 мг/сутки, но пациент изначально демонстрировал низкую приверженность лечению. Аллопуринол пр��нимал только лишь при рецидиве артрита, совмещал с приемом НПВП. Частота приступов артрита непрерывно увеличивалась, в течение последних 8 лет не было межприступных периодов. С 56-летнего возраста наблюдался максимально быстрый рост подкожных тофусов, что привело к деформации, обезображиванию конечностей, выраженному ограничению объема движений в суставах (кистей, стоп, коленных, голеностопных, лучезапястных, локтевых, плечевых). С 58 лет периодически отмечал повышение АД (максимально до 170 и 100 мм рт. ст.), однако постоянной антигипертензивной терапии не получал. Эпизодически принимал эналаприл 20 мг в сутки.
Был госпитализирован в ревматологическое отделение областной клинической больницы в апреле 2015 г. При осмотре: рост — 178 см, масса тела — 109 кг, ИМТ — 34,4 кг/м
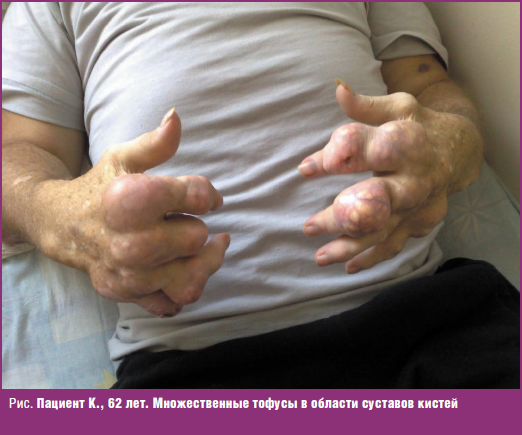
Обращали на себя внимание подкожные образования (тофусы) в области ушных раковин, тыльной поверхности пальцев стоп, локтевых, коленных суставов, кистей, некоторые — больших размеров (рис.); болезненность, припухлость суставов кистей и стоп, голеностопных, коленных суставов; ограничение движений в них. Интенсивность боли в суставах по визуальной аналоговой шкале — 80 мм. По данным лабораторных исследований: сывороточный уровень мочевой кислоты (МК) крови — 740 мкмоль/л (целевой уровень 360 мкмоль/л), креатинина — 98,4 мкмоль/л, СРБ — 10,4 мг/л, СОЭ — 45 мм/ч. После купирования артрита была возобновлена терапия аллопуринолом 200 мг/сутки. Через 1 неделю после начала терапии сывороточный уровень МК снизился до 504,3 мкмоль/л. Из антигипертензивных препаратов пациент принимал лозартан 100 мг/сутки, амлодипин 5 мг/сутки. На этом фоне АД было в пределах 140 и 90 мм рт. ст. Пациент был выписан на амбулаторный этап с рекомендациями продолжить терапию, титровать дозу аллопуринола до достижения целевых значений МК, чего пациент не выполнял. Терапию получал нерегулярно.
В феврале 2016 г. по экстренным показаниям был госпитализирован в отделение неотложной кардиологии с клиникой острого коронарного синдрома. Несмотря на проводимую терапию в полном объеме, больной скончался через 14 часов после поступления в стационар от острого Q-инфаркта миокарда с локализацией в задней стенке левого желудочка.
Данное клиническое наблюдение не уникально, а скорее типично. Пациенты мужского пола среднего и пожилого возраста, имеющие метаболический синдром, тофусную подагру, без адекватной гиперурикемической терапии чрезвычайно часто погибают от сердечно-сосудистых осложнений.
В 2016 г. были опубликованы новые Европейские рекомендации по ведению пациентов с подагрой [15]. Одной из причин пересмотра ранее существующих рекомендаций явилось появление новых лекарственных препаратов. Так, в последние десятилетия для лечения острых приступов, наряду с НПВП и колхицином, стали применяться ингибиторы ИЛ-1, в качестве уратснижающих препаратов — непуриновые ингибиторы ксантиноксидазы (КОИ), урикозурики, препараты уриказы.
В нашей стране ингибиторы ксантиноксидазы представлены двумя классами препаратов — пуриновыми (аллопуринол, оксипуринол) и непуриновыми (фебуксостат, топироксостат).
Согласно последним рекомендациям, аллопуринол остается препаратом первой линии уратснижающей терапии при сохраненной функции почек. Если целевой уровень МК не может быть достигнут с помощью адекватной дозы аллопуринола, то препарат должен быть заменен на фебуксостат. Фебуксостат показан при непереносимости аллопуринола и является препаратом выбора при хронической болезни почек [15].
Фебуксостат недавно зарегистрирован в Российской Федерации. Первый опыт его применения в нашей стране демонстрирует возможность его использования у больных с тяжелой инвалидизирующей подагрой [16]. До последнего времени отсутствие альтернативы аллопуринолу практически не оставляло шансов добиться желаемого результата лечения и предотвратить прогрессирование подагры, развитие осложнений, связанных с подагрой и гиперурикемией [17].
Важным аспектом изучения эффективности современных препаратов представляется влияние противоподагрических препаратов на сердечно-сосудистый риск. Предварительные сообщения о применении канакинумаба с целью профилактики сердечно-сосудистых заболеваний в рамках исследования CANTOS (Canakinumab ANti-inflammatory Thrombosis Outcomes Sudy), проводимого для проверки воспалительной теории атеросклероза, результаты других исследований предполагают благоприятное влияние препарата на исходы, связанные с атеросклерозом, что принципиально важно для пациентов с подагрой [18].
В результате крупных исследований были получены доказательства того, что эффективная уратснижающая терапия не только уменьшает риск развития новых приступов артрита и повышает качество жизни пациентов, но и снижает риск сердечно-сосудистых заболеваний, поражения почек и смертность [19].
В литературе имеются противоречивые данные в отношении протективного действия КОИ на сердечно-сосудистую систему [20]. Популяционное исследование в Великобритании показало, что прием аллопуринола при подагре отождествлялся с 19% снижением риска смерти [21]. Имеются данные о снижении выраженности эндотелиальной дисфункции на фоне приема аллопуринола у больных с высоким кардиоваскулярным риском [22].
В литературе обсуждается вопрос о возможном дозозависимом эффекте влияния аллопуринола на сердечно-сосудистый риск. Так, в работе А. Noman с соавт. (2010) аллопуринол в высоких дозах (600 мг/сутки) у пациентов со стенокардией показал себя в качестве эффективного антиишемического средства, а у пациентов с сердечной недостаточностью те же высокие дозы препарата двукратно снижали смертность [23]. Тогда как в более поздних работах имеется указание на нивелирование позитивного кардиоваскулярного эффекта аллопуринола в дозе, превышающей 300 мг в сутки [24], что может быть связано с повышением оксидативного стресса в условиях высокой концентрации метаболита аллопуринола — оксипуринола [25].
В 2018 г. в работе M. Bredemeier с соавт. представлен систематический обзор и метаанализ рандомизированных исследований [26], целью которого явился анализ случаев основных неблагоприятных сердечно-сосудистых событий, смертности (общей и сердечно-сосудистой) в рандомизированных контролируемых исследованиях с применением КОИ по сравнению с плацебо или отсутствием лечения. Анализ включал 81 статью (10 684 больных, 6434 пациенто-лет). Результаты показали, что назначение КОИ существенно не влияло на риск основных неблагоприятных сердечно-сосудистых событий (относительный риск (ОP) 0,71, 95% доверительный интервал (ДИ) 0,46–1,09) и смерти (ОР 0,89, 95% ДИ 0,59–1,33), но приводило к снижению риска общего числа (ОР 0,60, 95% ДИ 0,44–0,82), в том числе серьезных, сердечно-сосудистых событий (ОР 0,64, 95% ДИ 0,46–0,89) и АГ (ОР 0,54, 95% ДИ 0,37–0,80). Это касалось и больных с наличием сердечно-сосудистой патологии в анамнезе (ОР 0,42, 95% ДИ, 0,23–0,76).
У больных, получающих аллопуринол, был ниже риск развития инфаркта миокарда (ОР 0,38, 95% ДИ 0,17–0,83), АГ (ОР 0,32, 95% ДИ 0,18–0,58), общего числа (0,48, 0,31–0,75) и серьезных сердечно-сосудистых событий (ОР 0,56, 95% ДИ 0,36–0,86). Однако этот эффект нивелировался при повышении дозы аллопуринола выше 300 мг/сутки, что требует дальнейших исследований.
Кардиоваскулярные эффекты непуриновых ингибиторов ксантиноксидазы менее изучены. В результате селективного ингибирования двух форм ксантиноксидазы (окисленной и восстановленной) при приеме фебуксостата происходит снижение концентрации МК в сыворотке крови больного.
Описано влияние фебуксостата на инсулинорезистетнность (ИР), экспрессию высокочувствительного СРБ (вч-СРБ), что является важным как в терапии подагры, так и в снижении кардиоваскулярного риска [27]. В исследование J. Meng с соавт. было включено 42 пациента с подагрой и 20 испытуемых группы контроля, сопоставимых по полу и возрасту. Определяли уровень инсулина и глюкозы крови натощак, вч-СРБ. ИР оценивали с использованием индекса HOMA-IR. У пациентов с подагрой были более высокие показатели МК, инсулина, индекс НОМА-Ш и уровень вч-СРБ, чем у лиц группы контроля (р < 0,05). После 4, 12 и 24 недель лечения фебуксостатом концентрация МК и вч-СРБ значительно снизилась (р < 0,05). Уровень инсулина и индекс НОМА-IR несколько снизились после 4 недель терапии и значительно уменьшились через 12 и 24 недели лечения. Таким образом, фебуксостат позволяет эффективно контролировать уровень МК в сыворотке и повышает чувствительность к инсулину у пациентов с подагрой.
Непуриновые ингибиторы ксантиноксидазы обладают антиоксидантными свойствами за счет сокращения числа метаболитов пуринового метаболизма, улучшения функции эндотелия [28]. Существуют исследования, предполагающие преимущества фебуксостата перед аллопуринолом по устранению эндотелиальной дисфункции [28] и даже улучшение показателей у пациентов, получавших фебуксостат, по сравнению с аллопуринолом [29]. В то же время, согласно инструкции по медицинскому применению фебуксостата, применение препарата не рекомендуется у пациентов с ИБС или застойной СН, поскольку, согласно результатам долгосрочных широкомасштабных исследований, в группе пациентов, получающих фебуксостат, по сравнению с группой пациентов, получающих аллопуринол, отмечалось увеличение количества нарушений со стороны сердечно-сосудистой системы [30]. В группе фебуксостата отмечалось численно больше сердечно-сосудистых событий по композитной конечной точке «нефатальный инфаркт миокарда, нефатальный инсульт или сердечно-сосудистая смерть». Однако эти различия с группами аллопуринола не достигли статистической достоверности и не повторились в исследовании CONFIRMS [31].
В настоящее время продолжаются рандомизированные клинические исследования, способные оценить влияние фебуксостата на сердечно-сосудистый риск у больных с подагрой [32].
Таким образом, у больных подагрой повышен кардиоваскулярный риск. Адекватная уратснижающая терапия способна не только нормализовать уровень МК крови, но и улучшить жизненный прогноз пациентов с подагрой за счет снижения риска развития сердечно-сосудистых заболеваний. В представленном нами клиническом наблюдении отсутствие адекватной уратснижающей терапии явилось одним из факторов развития неблагоприятного исхода. Для уточнения механизмов и особенностей влияния различных ингибиторов ксантиноксидазы на сердечно-сосудистый риск требуются дальнейшие исследования.
Литература
- Ревматология. Национальное руководство / Под ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2008. 372 с.
- Барскова В. Г., Насонова В. А. Подагра: клиническое течение, диагностика, лечение. Качество жизни // Медицина. 2003. № 3. С. 49–53.
- Arromdee E., Michet C. J., Crowson C. S. Epidemiology of gout: is the incidence rising? // J. Rheumatol. 2012; 29: Р. 2403–2406.
- Мухин Н. А. Подагра: лики болезни // Современная ревматология. 2007. № 1. С. 5–9.
- Елисеев М. С., Денисов И. С., Маркелова Е. И. и др. Независимые факторы риска развития тяжелых сердечно-сосудистых осложнений у мужчин с подагрой: результаты 7-летнего проспективного наблюдения // Терапевтический архив. 2017. № 89 (5). С. 10–19.
- Feig D. I., Kang D. H., Johnson R. J. Uric acid and cardiovascular risk // N. Engl. J. Med. 2008; 359 (17): P. 1811–1821.
- Perez-Ruiz F., Becker M. A. Inflammation: a possible mechanism for a causative role of hyperuricemia/gout in cardiovascular disease // Curr. Med. Res. Opin. 2015; 31. Suppl 2: 9–14.
- Richette P., Perez-Ruiz F., Doherty M. et al. Improving cardiovascular and renal outcomes in gout: what should we target? // Nat. Rev. Rheumatol. 2014; 10. P. 654–661.
- Zhu Y., Pandya B., Choi H. Comorbidities of gout and hyperuricemia in the US general population: NHANES 2007–2008 // Am. J. Med. 2012: 125. P. 679–687.
- Ребров А. П., Магдеева Н. А. Применение амлодипина при артериальной гипертонии у больных подагрой // Саратовский научно-медицинский журнал. 2008. № 1 (19). С. 72–75.
- Ребров А. П., Магдеева Н. А. Особенности эндотелиальной дисфункции у больных подагрой и ее изменения на фоне проводимой терапии // Саратовский научно-медицинский журнал. 2008. № 3 (21). С. 59–62.
- Chang K., Yokose C., Tenner C. et al. Association between gout and aortic stenosis // Am. J. Med. 201 7; 130 (2): 230. e1–230.e8.
- Елисеев М. С., Денисов И. С., Маркелова Е. И. и др. Независимые факторы риска развития тяжелых сердечно-сосудистых осложнений у мужчин с подагрой: результаты 7-летнего проспективного исследования // Терапевтический архив. 2017. № 89 (5). С. 10–19.
- Krishnan E., Baker J. F., Furst D. E. et al. Gout and the risk of acute myocardial infarction // Arthritis Rheum. 2006 Aug; 54 (8): P. 2688–2696.
- Елисеев М. С. Обновленные рекомендации EULAR по лечению подагры. Комментарии к некоторым позициям // Научно-практическая ревматология. 2017. № 55 (6). С. 600–609.
- Елисеев М. С., Шаяхметова Р. У. Опыт применения фебуксостата у пациента с тяжелой инвалидизирующей подагрой // Современная ревматология. 2017. № 11 (3). С. 81–84.
- Елисеев М. С., Барскова В. Г., Денисов И. С. Динамика клинических проявлений подагры у мужчин (данные 7-летнего ретроспективного наблюдения) // Терапевтический архив. 2015. № 87 (5). С. 10–15.
- Елисеев М. С., Желябина О. В., Маркелова Е. И. и др. Оценка кардиоваскулярного риска при применении ингибитора интерлейкина 1 у больных тяжелой тофусной подагрой // Современная ревматология. 2016. № 10 (1). С. 7–14.
- Goicoechea M., de Vinuesa S. G., Verdalles U. et al. Effect of Allopurinol in Chronic Kidney Disease Progression and Cardiovascular Risk // Clin. J. Am. Soc. Nephrol. 2010; 5 (8): P. 1388–1393.
- Higgins P., Dawson J., Lees K. R. et al. Xanthine oxidase inhibition for the treatment of cardiovascular disease: a systematic review and meta-analysis // Cardiovasc. Ther. 2012; 30. P. 217–226.
- Dubreuil M., Zhu Y., Zhang Y. et al. Allopurinol initiation and allcause mortality in the general population // Ann. Rheum. Dis. 2015 Jul; 74 (7). P. 1368–1372.
- Xin W., Mi S., Lin Z. Allopurinol therapy improves vascular endothelial function in subjects at risk for cardiovascular diseases: a meta-analysis of randomized controlled trials // Cardiovasc. Ther. 2016; 34. P. 441–449.
- Noman A., Ang D. S., Ogston S. et al. Effect of high-dose allopurinol on exercise in patients with chronic stable angina: a randomised, placebo controlled crossover trial // Lancet. 2010; 375 (9732). P. 2161–2167.
- Givertz M. M., Anstrom K. J., Redfield M. M., Deswal A. Effects of Xanthine Oxidase inhibition in Hyperuricemic heart failure patients: the Xanthine Oxidase inhibition for Hyperuricemic heart failure patients (EXACT-HF) study // Circulation. 2015; 131. Р. 1763–1771.
- Stamp L. K., Turner R., Khalilova I. S., Zhang M. et al. Myeloperoxidase and oxidation of uric acid in gout: implications for the clinical consequences of hyperuricaemia // Rheumatology (Oxford). 2014; 53. Р. 1958–1965.
- Bredemeier M., Lopes L. M., Eisenreich M. A. et al. Xanthine oxidase inhibitors for prevention of cardiovascular events: a systematic review and meta-analysis of randomized controlled trials // BMC Cardiovasc. Disord. 2018, Feb 7; 18 (1): 24.
- Meng J., Li Y., Yuan X., Lu Y. Effects of febuxostat on insulin resistance and expression of high-sensitivity C-reactive protein in patients with primary gout // Rheumatol. Int. 2017 Feb; 37 (2). P. 299–303.
- Tsuruta Y., Kikuchi K., Tsuruta Y. et al. Febuxostat improves endothelial function in hemodialysis patients with hyperuricemia: a randomized controlled study // Hemodial. Int. 2015; 19. P. 514–520.
- Tausche A. K., Christoph M., Forkmann M. et al. As compared to allopurinol, urate-lowering therapy with febuxostat has superior effects on oxidative stress and pulse wave velocity in patients with severe chronic tophaceous gout // Rheumatol Int. 2014; 34. P. 101–119.
- Schumacher H. R. Jr., Becker M. A., Wortmann R. L. et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, doubleblind, parallel-group trial // Arthritis Rheum. 2008; 59 (11). P. 1540–1548.
- Becker M. A., Schumacher H. R., Espinoza L. R. et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial // Arthritis Res. 2010, 12 (2): R63.
- MacDonald T. M., Ford I., Nuki G. et al. Protocol of the Febuxostat versus Allopurinol streamlined trial (FAST): a large prospective, randomised, open, blinded endpoint study comparing the cardiovascular safety of allopurinol and febuxostat in the management of symptomatic hyperuricaemia // BMJ Open. 2014; 4: e005354.
И. А. Романова, кандидат медицинских наук
Н. М. Никитина1, доктор медицинских наук, профессор
ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
1 Контактная информация: nikina02@yandex.ru
Кардиоваскулярный риск у больных подагрой и возможные пути его снижения/ Н. А. Магдеева, И. А. Романова, Н. М. Никитина
Для цитирования: Лечащий врач № 9/2018; Номера страниц в выпуске: 82-85
Теги: подагрический артрит, сердечно-сосудистые осложнения, группа риска, гипертензия