В ходе неуклонной естественной убыли населения, длившейся более 20 лет, Россия потеряла более 5 млн человек [1]. Одна из ключевых причин — низкий уровень рождаемости, во многом обусловленный ухудшением репродуктивного потенциала молодых пар, вступающих в семейную жизнь. По данным Отдела народонаселения ООН к 2030 г. число жителей нашей страны составит всего 136,4 млн человек [2]. Демографический кризис, переживаемый Россией, отражается на социальных условиях россиян, экономическом и военном потенциале страны, а также на роли РФ на международной арене [3, 4].
Большое значение в снижении уровня рождаемости принадлежит учащению бесплодия семейных пар. За последние 5 лет количество бесплодных браков в России увеличилось на 43%, в некоторых регионах превысило критический уровень и составило от 8% до 19,6%. Считается, что при увеличении их количества до 15% от общего числа семейных пар неблагоприятную демографическую ситуацию уже можно рассматривать как серьезную проблему для здравоохранения, общества и государства [3, 4].
При этом имеют место нарушения в репродуктивной системе у одного или одновременно у обоих супругов: женский фактор доказан у 40% случаев, мужской — в 45%, сочетанный — в 15% [5, 6]. В сообщениях последних лет «вклад» мужского фактора в бесплодие пары (отдельно или в сочетании с женским фактором) неуклонно растет и уже достиг 60% [7]. Рассчитывая число бесплодных пар на количество жителей в России традиционным способом, уровень бесплодия в 15% уже дает нам более 2,5 млн бесплодных семейных пар репродуктивного возраста, или более 5 млн человек, что составляет порядка 3,5% от общего населения России [8].
ВОЗ выделяет 22 фактора риска, ассоциированных с бесплодием у мужчин, среди которых инфекционные заболевания органов полового тракта занимают одно из первых мест [5]. В середине прошлого века после открытия и введения в медицинскую практику пенициллина казалось, что инфекции, передающиеся половым путем (ИППП), будут скоро ликвидированы. Однако на первый план вышли другие, «новые» патогены, устойчивые к антибиотикам, в том числе вирусы, и заболеваемость ИППП не только не снизилась, но напротив — возросла [9].
Основное внимание в качестве потенциальных патогенов в течение последних 20 лет уделяется двум представителям семейства Herpesviridae — вирусам простого герпеса 1-го и 2-го типов (ВПГ-1 и ВПГ-2), широко распространенным в популяции и передающимся половым путем.
Согласно оценкам ВОЗ, в странах Восточной Европы и Центральной Азии в 2003 г. было зарегистрировано 29 млн случаев инфекции, вызванной ВПГ-2, у мужчин и 12,3 млн — у женщин [10]. На высокую эпидемическую распространенность среди населения земного шара указывает то, что уровень лиц, инфицированных ВПГ, приближается к 95%. О широкой распространенности и бесконтрольном характере герпесвирусной инфекции приводятся данные в отчетах экспертов ВОЗ: инфицировано ВПГ-1 — до 90% населения; наблюдаются клинические симптомы заболевания — только у 20%. Более 70% пациентов заражаются от больных с латентным (без клинических проявлений) течением герпетической инфекции. Среди мужчин, госпитализированных в венерологические клиники, герпесвирусная инфекция имеет место в 11–15% случаев. Среди больных, которые обращаются в венерологические заведения Скандинавских стран, генитальным герпесом страдают 8%. В США ежегодно диагностируют 724 тыс. свежих случаев генитального герпеса. По данным серологических исследований, признаки инфицирования ВПГ обнаружены почти у 30 млн жителей США. ВОЗ провозгласила герпесвирусные инфекции как фактор, определяющий инфекционную и соматическую заболеваемость XXI века [11].
ВПГ-1 и ВПГ-2 относятся к подсемейству альфа-герпес-вирусов (Alphaherpesvirinae) рода Simplexvirus, для представителей которого характерен короткий цикл репродукции с выраженным цитопатическим эффектом. Данная группа вирусов поражает кожу, ЛОР-органы, иногда приводит к развитию энцефалитов. Вирус, персистируя в организме человека, поддерживает латентную инфекцию, а при абортивных формах способствует канцерогенезу [11].
Среди всех известных вирусов наиболее распространенным является ВПГ-1 (оролабиальный герпес), который чаще всего вызывает поражения кожи лица и слизистых оболочек полости рта, красной каймы губ. Кроме того, он может вызывать офтальмогерпес, генитальный герпес, герпетический энцефалит и пневмониты. Оролабиальний герпес среди населения земного шара широко распространен. Серологические исследования показывают, что примерно 70–90% взрослых являются сероположительными относительно возбудителя ВПГ-1.
ВПГ-2 (генитальный герпес) близок к ВПГ-1 по морфологическим, антигенным, физико-химическим свойствам — они имеют высокую гомологию по нуклеотидным последовательностям генома (приблизительно 80%), а также по аминокислотным последовательностям кодируемых ими белков.
ВПГ-2 поражает кожу и слизистые нижней части тела (половые органы, ягодицы) и вызывает инфекционные поражения у новорожденных. В последние годы установлена этиологическая и патогенетическая роль этого вируса в возникновении рака шейки матки и онкотрансформации в половых органах мужчин (совместно с вирусом папилломы человека — HPV). ВПГ как ДНК-содержащий вирус может интегрировать генетический аппарат клеток хозяина и вызывать их злокачественную трансформацию [12, 13]. Поражение половой системы вызывается ВПГ-2 (около 80% случаев) и ВПГ-1 (20% случаев). Трансмиссия ВПГ-1 и ВПГ-2 происходит обычно при оральных и орогенитальных контактах. Для каждого из путей передачи вероятность заражения остается неизвестной, однако считают, что риск его существенно возрастает при наличии клинических проявлений инфекции.
Серологические исследования показывают, что 75–90% ВПГ-2-инфицированных лиц не знают о наличии у них генитального герпеса. Считается, что генитальный герпес является фактором риска как трансмиссии, так и инфицирования вирусом иммунодефицита человека (ВИЧ). Высокая частота одновременной инфицированности ВИЧ и ВПГ-2 предопределена, с одной стороны, одинаковым путем передачи этих возбудителей, а с другой — фактором воспаления и повреждения тканей при герпесвирусной инфекции, что приводит к повышению контагиозности к ВИЧ. Кроме того, ВИЧ-инфицированность усиливает бессимптомную экскрецию ВПГ-2 и клинические проявления герпетической инфекции, вследствие чего риск трансмиссии генитального герпеса также возрастает [9].
Вирус простого герпеса имеет диаметр 150–200 нм и относится к ДНК-содержащим вирусам группы Herpesviridae. Архитектоника ВПГ характеризуется наличием «сердцевины», содержащей вирусную ДНК, окруженную капсидом в форме икосаэдра. Последний состоит из 162 капсомеров, каждый из которых образован полипептидом, который является носителем антигенности группы и вида. Капсид снаружи окружен оболочкой, образованной из вирусных белков, и двухслойным липидным покровом. Гликопротеиды, которые имеются на поверхности липидного слоя, играют важную роль в связывании вируса с мембранными рецепторами и способствуют проникновению его вовнутрь клетки. Одиннадцать известных гликопротеидов в значительной мере предопределяют гуморальный иммунный ответ макроорганизма. При первичной инфекции липидная оболочка прикрепляется к наружной мембране эпителиальных клеток слизистой оболочки или эпидермиса, а капсид транспортируется через нуклеарные поры, где геном вируса высвобождается и встраивается в ядро клетки больного. Именно здесь начинается репликация вируса, при которой образуется 70 белков на протяжении раннего периода инфекции. Эти белки являются продуктами последовательной экспрессии трех групп вирусных генов:
- сверхранние — контролируют синтез белков, которые необходимы для трансактивации и регуляции других вирусных генов;
- ранние — контролируют синтез регуляторных белков и энзимов, необходимых для репликации вирусной ДНК (тимидинкиназы);
- поздние — отвечают за синтез структурных белков вируса.
Цикл репродукции вируса является сложным процессом продолжительностью около 10 часов. В зараженных клетках вирусные белки определяются уже через 2 часа и накапливаются в максимальном количестве приблизительно через 8 часов. Вирусная ДНК определяется на час позже, чем вирусные белки. Свободные зрелые вирионы появляются через 10 часов, достигая максимальной концентрации через 15 часов. После прикрепления к наружной стенке клеток хозяина ВПГ постепенно проникает в цитоплазму клетки. В цитоплазме происходит дезинтеграция вируса, высвобождение нуклеиновой кислоты от белковых оболочек. Одновременно с этим угнетается макромолекулярный синтез структур пораженной клетки, что приводит к разрушению ее ДНК. В это время начинают образовываться новые вирусные белки и нуклеиновые кислоты, которые позднее организуются в единые структуры — нуклеокапсиды, или виронуклеоны.
Следующим этапом репродукции возбудителя является синтез непосредственно ДНК вируса. ДНК вируса реплицируется полуконсервативно, а для инициации ее синтеза необходимо образование ранних белков. Внутриядерный цикл развития вируса завершается дифференцировкой, что выражается в покрытии нуклеокапсида липидной оболочкой, которая в дальнейшем выполняет также и защитную функцию вируса. В результате пораженная клетка становится гигантской многоядерной, теряя при этом свою жизнеспособность. Выход вируса из клетки происходит между 15 и 18 часами от начала репродукции. Это приводит к дистрофии верхних слоев эпидермиса (шиповатого и зернистого) в пораженном вирусом участке кожного покрова и слизистых, вследствие чего образуются пузырьки разных размеров. Типичным для поражения ВПГ также является наличие в клетках внутриядерных включений — эозинофильных телец или телец Липшютца.
Синтез вирусной ДНК происходит при участии энзимов (тимидинкиназы и ДНК-полимеразы вирусного происхождения), которые являются мишенями для антивирусной химиотерапии, в частности ациклогуанозина [14, 15].
Важным звеном патогенеза герпетической инфекции является инфицирование сенсорных ганглиев вегетативной нервной системы с пожизненной персистенцией ВПГ в организме. Уже на ранних этапах герпетической инфекции вирусные частицы внедряются вначале в нервные окончания кожи и слизистой оболочки, продвигаются центростремительно по аксоплазме, достигают периферических, затем сегментарных и регионарных чувствительных ганглиев центральной нервной системы, где ВПГ пожизненно сохраняется в латентном состоянии в нервных клетках. Распространение ВПГ в центробежном направлении во время рецидива определяет анатомическое постоянство очагов поражения при рецидивах герпеса. При герпесе гениталий это паравертебральные ганглии пояснично-крестцового отдела позвоночника симпатической нервной системы, служащие резервуаром вируса. Процесс распространения ВПГ по нервной системе приводит к нарушению передачи нервных импульсов, блокируя движение митохондрий в нейронах [16, 17]. Активность органелл определяется, в частности, концентрацией кальция во внутриклеточном матриксе, которая достигает максимума в момент получения сигнала от другого нейрона. Митохондриальный белок Miro позволяет митохондриям зафиксировать этот момент и переместиться на участок синапса, где наблюдается выброс кальция при попадании вируса герпеса внутрь нервной клетки. Там Miro инактивирует митохондрии, тем самым блокируя передачу нервных импульсов. Передвижение митохондрий осуществляется вдоль микротрубочек, пронизывающих матрикс клетки, при помощи моторных белков динеина и кинезина 1. Поскольку при повышенной концентрации кальция митохондрии лишены способности двигаться, кинезин 1 оказывается свободным. В результате вирус герпеса использует его для собственного перемещения внутри нервной клетки, что позволяет ему распространяться по нервным путям [16, 17]. Зараженные вирусом простого герпеса нейроны не погибают. Вирусный геном сохраняется в них в подавленном (латентном) состоянии, совместимом с нормальной жизнедеятельностью клеток. В латентном состоянии происходит транскрипция лишь ограниченного числа вирусных генов.
Под влиянием «пускового фактора» на фоне нарушений биохимического и иммунологического равновесия вирус активируется, перемещается из ганглия по аксону периферического нерва в эпителиальные клетки и репродуцируется в зоне иннервации инфицированным ганглием. Динамическая теория предполагает, что вирус находится в состоянии не абсолютной латенции, а воспроизводится каждые несколько дней небольшими сериями. Вышедшие из нейронов вирусы проникают в эпителиальные клетки и начинают в них размножаться, в результате чего образуются микрофокусы инфекции, которые либо блокируются, либо нет — в зависимости от состояния иммунитета, и носитель переживает инаппарантные, абортивные или клинические рецидивы. Этот процесс называется реактивацией [13, 18].
В отношении процессов перехода ВПГ в латентное состояние и его реактивации ведутся исследования, так как это важное звено патогенеза остается до конца не изученным и представляет интерес в отношении разработки новых методов борьбы с герпетической инфекцией.
Как правило, поражения, вызванные ВПГ-1, локализуются в области головы, заражение происходит обычно в детстве при тесном контакте с инфицированным человеком. Напротив, высыпания, вызванные ВПГ-2, обычно локализуются в нижней части тела, заражение происходит в более поздние сроки в результате полового контакта. Проявления и особенности течения инфекций, вызванных ВПГ-1 и ВПГ-2, сходны. ВПГ-2 почти всегда ассоциирован с поражением половых органов, а ВПГ-1 — как с орофарингеальными, так и генитальными высыпаниями.
Заражение ВПГ-1 обычно сопровождается высыпаниями в орофарингеальной области, вокруг рта, на губах и подбородке. Изредка встречается поражение глаз. Половая передача ВПГ чаще всего приводит к поражению слизистой оболочки и кожи полового члена и половых губ, а также кожи перигенитальной зоны. Попадание содержащего вирус отделяемого половых органов может привести к инфицированию других областей, например, глаз, ротоглотки и слизистой оболочки прямой кишки [19].
Первичная герпетическая инфекция, то есть первый контакт ВПГ- серонегативного человека с ВПГ-1 или ВПГ-2, как правило, протекает наиболее тяжело. В детском возрасте после инфицирования ВПГ обычно развиваются стоматит и фарингит. Проявления первичной инфекции разрешаются самопроизвольно, однако могут возникать рецидивы заболевания в результате реактивации вируса, находящегося в организме мужчин в латентном состоянии в шейных ганглиях. У мужчин, которые в детстве не инфицировались ВПГ-1, в более позднем возрасте могут возникнуть тяжелые высыпания на половых органах, обусловленные инфицированием ВПГ-2 половым путем. Как и при заражении ВПГ-1, проявления первичной инфекции ВПГ-2 разрешаются самопроизвольно, но возможно возникновение рецидивов в результате реактивации латентной инфекции, локализующейся в крестцовых ганглиях. Если мужчина, в организме которого имеются антитела к ВПГ-1, инфицируется ВПГ-2, поражение половых органов протекает менее тяжело, но также сопровождается рецидивированием. В большинстве случаев (80–90%) заболевание протекает в субклинической форме, но обострение может возникнуть в любой момент [20]. Инкубационный период при инфицировании как ВПГ-1, так и ВПГ-2, длится в среднем от 2 до 10 дней (может продолжаться до 4 недель). Поэтому первичная инфекция может указывать как на совсем недавнее, так и на отсроченное во времени инфицирование [21].
Рецидивирующая (вторичная) герпетическая инфекция связана с реактивацией вируса. Рецидивы заболевания могут возникать с различной частотой: от одного раза в год до нескольких раз в месяц. Локализации поражений при первичной и рецидивирующей инфекции обычно совпадают.
Рецидивы как экстрагенитального, так и генитального герпеса чередуются с периодами латенции, во время которых вирус сохраняется в ганглиях, но не размножается. При классическом течении заболевания каждый эпизод (рецидив) герпеса характеризуется появлением отечного красного пятна, на фоне которого возникают папулы и везикулы. Пузырьки содержат прозрачную жидкость, в которой находятся тысячи заразных вирусных частиц. Везикулы вскрываются, образуя мелкие эрозии, впоследствии покрывающиеся корками и самопроизвольно эпителизирующиеся, не оставляя после себя рубца. Рецидивы обычно продолжаются менее 10 дней, но в случае присоединения вторичной бактериальной инфекции или на фоне иммуносупрессии могут затягиваться. К сожалению, дифференциальная диагностика инфекции, вызванной ВПГ-1 и ВПГ-2, основанная на различной локализации высыпаний, не является абсолютной, поскольку герпес половых органов часто бывает обусловлен ВПГ-1, являясь результатом орогенитальных половых контактов, и наоборот [22].
Клиническая картина и репродуктивные нарушения у мужчин, вызванные ВПГ-1 и ВПГ-2, зависят от поражения вирусами уретры и внутренних половых органов (яичек с придатками, семявыносящих протоков, семенных пузырьков, предстательной железы) путем формирования воспалительных очагов, а также сенсорных ганглиев вегетативной нервной системы, ответственной за эрекцию и эякуляторную функцию. При этом основными причинами бесплодия у мужчин при инфекционной патологии являются:
1) количественные и качественные нарушения эякулята (тестикулярные и посттестикулярные нарушения);
2) невозможность осуществления полового акта (эректильная и/или эякуляторная дисфункция) [23, 24].
К количественным и качественным изменениям эякулята приводят тестикулярные и посттестикулярные нарушения.
Тестикулярные нарушения формируются за счет орхита и включают:
1) повреждение клеток герминативного эпителия и интерстиция:
а) вовлечение в воспалительный процесс герминативного эпителия приводит к нарушению сперматогенеза за счет нарушения аутокринных механизмов и рецепции к фолликулостимулирующему гормону (снижается количество и качество сперматозоидов);
б) вовлечение в воспалительный процесс интерстициальных клеток Лейдига нарушает рецепцию к лютеинизирующему гормону и снижает выработку тестостерона — формирование гипергонадотропного гипогонадизма (снижается количество и качество сперматозоидов);
2) повреждение сперматозоидов со снижением их качества (терато- и астенозооспермия):
а) факторами патогенности вирусов;
б) за счет возникновения аутоиммунных реакций при непосредственном участии вирусов [9, 25–27].
В качестве подтверждения влияния ВПГ на сперматогенез и качество сперматозоидов проведены цитологическое и молекулярно-цитогенетическое исследования клеток образцов спермы пациентов, у которых с помощью вирусологического и иммуноцитохимического методов выявлено инфицирование сперматозоидов вирусом простого герпеса. Сравнительный количественный анализ незрелых половых клеток эякулята пациентов с герпетическим инфицированием сперматозоидов и мужчин-доноров показал достоверное и значительное (в три раза) увеличение количества сперматоцитов I у инфицированных пациентов на предпахитенных стадиях профазы I мейоза: прелептотены, лептотены и зиготены. В то же время у пациентов с вирусинфицированными сперматозоидами выявлено статистически значимое уменьшение количества сперматоцитов I на стадиях пахитены и диплотены, сперматоцитов II и сперматид, а также двукратное увеличение количества неидентифицируемых незрелых половых клеток. Полученные результаты свидетельствуют о том, что у пациентов с герпетическим инфицированием сперматозоидов происходит частичный блок сперматогенеза на начальных этапах профазы I мейоза. Данные настоящей работы открывают возможность дальнейшего изучения клеточных механизмов нарушения сперматогенеза при вирусном инфицировании человека [25, 26].
Установлено, что у мужчин с первичным бесплодием в браке (даже без каких-либо клинических проявлений инфекции в урогенитальном тракте), по сравнению с практически здоровыми мужчинами, ВПГ достоверно чаще встречается как в цельном эякуляте, так и во фракции активно-подвижных сперматозоидов, причем чаще в зимние месяцы года. Показано, что обнаружение ВПГ в эякуляте прямо коррелирует со снижением количества активно-подвижных сперматозоидов и уменьшением доли морфологически нормальных форм половых клеток [9, 26, 28]. Также доказана связь инфицирования ВПГ эякулята со снижением суммарной подвижности и концентрации мужских гамет [29, 30].
При изучении влияния герпес-вирусов на состав популяции незрелых половых клеток (НПК) в эякуляте, а также на экспериментальных моделях было получено снижение количества сперматид у пациентов с вирусной герпетической инфекцией (ВГИ), что предполагает их гибель или замедление развития на этапе спермиогенеза при воздействии вируса — происходит гибель клеток-предшественников сперматозоидов — сперматогониев, сперматоцитов, сперматид. При этом наиболее чувствительными оказываются клетки, находящиеся в мейозе — сперматоциты и образующиеся в результате мейотического деления ранних стадий спермиогенеза — ранние сперматиды.
Нельзя также исключить влияния ВПГ на предшествующие стадии развития половых клеток — у пациентов с высокой вирусной нагрузкой по ВПГ показано снижение числа сперматоцитов I на стадии диплотены [9]. Значительное увеличение количества неидентифицируемых клеток в эякуляте бесплодных мужчин с ВГИ отражает дегенеративные процессы в популяции половых клеток. Полученные результаты согласуются с данными К. Н. Wu с соавт. [31], которые обнаружили в эякуляте, инфицированном ВПГ, и цитомегаловирус (ЦМВ), увеличение числа НПК с признаками дегенерации — пикнотичными ядрами, вакуолизацией хроматина, нарушениями целостности ядерной оболочки, наличием телец апоптоза.
Полученные данные позволяют заключить, что ВПГ является одним из факторов формирования мужского бесплодия и может негативно влиять на результаты вспомогательных репродуктивных технологий, что подтверждается: 1) нарушением ранних стадий эмбрионального развития при экстракорпоральном оплодотворении инфицированными ВПГ сперматозоидами; 2) связью невынашивания беременности с герпесвирусной инфекцией эякулята партнера; 3) корреляцией обнаружения ДНК ВПГ в сперматозоидах со снижением уровня формирования бластоцист и с низкими показателями имплантации эмбрионов [27, 32]. Установленное снижение эффективности лечения бесплодия методом экстракорпорального оплодотворения (ЭКО) может быть связано с механизмом передачи ВПГ эмбрионам в результате оплодотворения ооцитов инфицированными сперматозоидами.
Таким образом, в совокупности данные о высокой частоте выявления ВПГ в эякуляте мужчин с бесплодием, ухудшении показателей качества спермы, изменении состава популяции НПК у ВПГ-инфицированных лиц, а также о гаметотоксическом воздействии вируса в экспериментальных модельных системах указывают на то, что ВПГ играет определенную патогенетическую роль в формировании мужского бесплодия.
Этиологическая расшифровка диагноза открывает перспективы использования специфической противовирусной терапии в лечении данных пациентов.
Посттестикулярные нарушения формируются за счет воспалительного процесса в других органах репродуктивной системы вирусной этиологии: в придатках яичка, семявыносящих протоках, семенных пузырьках и предстательной железе [9, 33, 34]. При этом:
1) повреждаются семявыносящие протоки за счет рубцового процесса и формируется их непроходимость; при этом могут ухудшаться количественные показатели сперматозоидов;
2) повреждаются непосредственно сперматозоиды факторами патогенности микроорганизмов и за счет аутоиммунных реакций;
3) ухудшаются характеристики семенной плазмы за счет снижения качества экскретов семенных пузырьков и предстательной железы.
Во втором и третьем случаях присходит снижение качества сперматозоидов в виде астено- и/или тератозооспермии.
В формировании воспалительных очагов, кроме ВПГ-1 и ВПГ-2, нередко принимают участие другие патогены — представители экзогенной и эндогенной инфекции. Из экзогенных патогенов — это Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Mycoplasma genitalium. Но наиболее многочисленной является эндогенная бактериальная условно-патогенная микробиота. В данном случае дисбиоз, как начальный этап инфекционного процесса у мужчин, можно представить как уменьшение количества Micrococcus spp., Corynebacterium spp., коагулазоотрицательных стафилококков и увеличение других условно-патогенных бактерий [35].
Поэтому нередко возникновение и характер воспалительных очагов в мочеполовой системе у мужчин будет зависеть от разновидности экзопатогена, который (наряду с другими триггерными факторами) активирует вирусную инфекцию и запускает дисбиотический процесс (вариант экзоэндогенной микст-инфекции) [24].
Особенно важным для понимания патогенеза и установления лечебной тактики является рассмотрение противовирусной иммунной защиты при ВПГ-инфекции у мужчин, а также значимость системы интерферона (ИФН) в формировании иммунных реакций.
При рассмотрении механизмов противовирусного иммунитета (в том числе при ВПГ-инфекции) можно выделить несколько ключевых моментов [36]:
- Механизмы врожденного иммунитета с участием ИФН, NK-клеток (Natural Killer — естественный или натуральный киллер) и макрофагов способны сдерживать развитие инфекции и препятствовать ее распространению: а) интерфероны проявляют свою активность посредством разных механизмов; б) NK-клетки — это цитотоксические клетки для вирус-инфицированных клеток; в) макрофаги действуют на трех уровнях, чтобы деструктировать вирус и пораженные вирусом клетки; г) дендритные клетки (ДК) продуцируют ИФН-α с дальнейшим его участием в иммунном ответе.
- Вирусная инфекция влияет на развитие адаптивного иммунитета: а) антитела и комплемент могут ограничить распространение вируса и предупредить реинфекцию; б) Т-клетки опосредуют клеточный иммунитет разными путями: CD8+ цитотоксические Т-лимфоциты поражают инфицированные клетки; CD4+ Т-клетки (Th1 и Th2) выступают при иммунном ответе как клетки-эффекторы: под влиянием ИФН-γ NK-клеток и ИЛ-12 макрофагов Th1 способны продуцировать ИЛ-2, ИЛ-3, ИФН-γ, ФНО-α, ФНО-β; под влиянием ИЛ-4 базофилов и других иммунных клеток Th2 способны продуцировать ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-10, ИЛ-12, ИЛ-13.
Иммунный ответ Th1-типа направлен на внутриклеточные патогены; при этом активируется клеточный иммунитет, стимулируются макрофаги и запускается пролиферация цитотоксических Т-лимфоцитов (ЦТЛ).
Иммунный ответ Th2-типа направлен на внеклеточные патогены; при этом активируется гуморальный иммунитет, стимулируются В-лимфоциты, их пролиферация, переключение классов иммуноглобулинов и созревание в плазматические клетки.
- Вирусы (в том числе ВПГ) обладают рядом стратегий для противостояния иммунному ответу: наиболее эффективные механизмы — латенция вируса и антигенная вариабельность. Многие вирусы «уклоняются» от иммунного ответа путем продукции аналогов цитокинов и цитокиновых рецепторов. Многие ДНК-содержащие вирусы используют стратегию контроля за экспрессией молекул главного комплекса гистосовместимости (МНС — Major Histocompatibility Complex).
- Ответ на вирусные антигены может вызвать повреждение ткани в связи с образованием иммунных комплексов, развитием иммуносупрессии, иммунодефицита или аутоиммунных нарушений.
В упрощенной форме противовирусный иммунитет (в т. ч. при ВПГ) можно представить следующим образом (рис. 1) [36, 37].
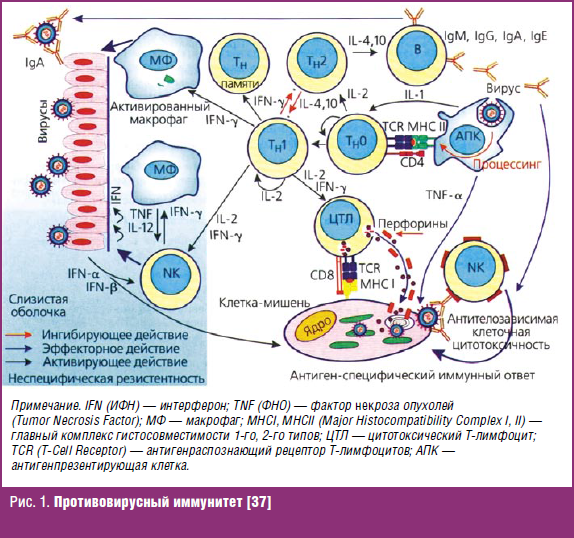
Основой противовирусного иммунитета является клеточный иммунитет. Антигенпрезентирующие клетки (АПК), поглотившие вирусы, активируют CD4+ Тh1-хелперы. Клетки-мишени, инфицированные вирусом, уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспецифическим белкам инфицированной клетки. Слизистые оболочки защищены от вирусов секреторными IgA- и IgM-антителами, которые, окружая вирионы, препятствуют их адсорбции на эпителиоцитах. Противовирусные антитела, как и факторы врожденного иммунитета — сывороточные противовирусные ингибиторы, способны нейтрализовать только внеклеточно расположенные вирусы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так называемый «выделительный иммунитет»).
Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме того, интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов МНС.
Особенно важными в противоинфекционной защите являются ранние стадии инфекции — это часто «соревнование на скорость» между вирусом и системой защиты макроорганизма [36, 38]. Первая линия защиты против вирусной инвазии — это целостность кожного покрова. Как только барьер преодолен, факторы врожденного иммунитета, такие как интерферон, NK-клетки и макрофаги, становятся активированными.
Семейство интерферонов представлено тремя типами — I, II и III.
- I тип включает: ИФН-α (лейкоцитарный), ИФН-β (фибробластный), ИФН-ω, ИФН-τ и ИФН-ε (трофобластный), ИФН-δ, ИФН-κ.
- II тип, или ИФН-γ, кодируется 1 геном на хромосоме 12 и продуцируется только после антигенной или митогенной стимуляции Т- и NK-клеток.
- III тип включает интерфероноподобные цитокины ИФН-λ1 (ИЛ-29), ИФН-λ2 (ИЛ-28А) и ИФН-λ3 (ИЛ-28В).
Главная роль в защите организма от инфекции принадлежит ИФН-α (включает 13 членов) и ИФН-β (представлен одним членом). ИФН-α (синтезируется эпителиальными клетками и клетками лейкоцитарного ряда) и ИФН-β (синтезируется фибробластами) активируются на ранних этапах инфекции и поэтому относятся к первой линии защиты организма. Среди известных в настоящее время вариантов ИФН-α (А1-А8, А10, А13, А14, А16, А17, А21 и А22) наиболее выраженная противовирусная активность продемонстрирована у ИФН-А2, преимущественно продуцируемого макрофагами. Стимуляция синтеза ИФН I типа происходит под действием вирусной ДНК, при этом различные штаммы ВПГ обладают индивидуальной интерфероногенной активностью. Некоторые цитокины, например ИЛ-1, ИЛ-2, ФНО и ростовые факторы оказывают дополнительный стимулирующий эффект на синтез ИФН I типа, а последние, в свою очередь, регулируют продукцию цитокинов. Так, при низком уровне ИФН I типа активируется транскрипция ИЛ-12 p35 и усиливается продукция ИФН-γ CD4+ и CD8+ T-клетками; при высокой концентрации, напротив, ингибируется синтез цепи ИЛ-12 p35 дендритными клетками и моноцитами, ИФН-γ — NK-клетками. Весьма важен баланс между ИФН-α/ИФН-β и провоспалительными цитокинами (ИЛ-1β, ИЛ-6, ФНО-α), так как выраженная локальная воспалительная реакция способствует диссеминации вирусной инфекции [18, 39].
Таким образом, основные функции интерферонов типа I (ИФН-α/β) следующие (полный перечень представлен на рис. 2):
1) мобилизация антимикробной защиты и подавление репликации вирусов как в инфицированной, так и в окружающих клетках с целью ограничения распространения инфекции;
2) балансировка иммуномодулирующего действия на клетки врожденного иммунитета. Они активируют цитотоксические NK-клетки и АПК. В последних происходит повышение антигенпрезентирующих свойств, а также стимуляция секреции некоторых провоспалительных цитокинов (ИЛ-6, ИЛ-12 и ИЛ-15) и хемокинов. Но в то же время ИФН типа I подавляют воспаление за счет секреции АПК противовоспалительных цитокинов ИЛ-10, трансформирующего фактора роста β (ТФР-β) и ИЛ-1RA;
3) активация клеток приобретенного иммунитета (Т- и В-лимфоциты) [38, 39].
По влиянию ИФН-α/β на ДК и В-лимфоциты известно, что они стимулируют превращение незрелых ДК в зрелые. Это приводит к усилению ими синтеза цитокинов, хемокинов, экспрессии молекул МНС, особенно I класса, костимуляторных молекул, экспрессии и секреции главных факторов выживания и активации В2-клеток — фактора, активирующего В-клетки, из семейства ФНО (В-cell Activating Factor belonging to the TNF Family — BAFF) и лиганд, индуцирующий пролиферацию (A PRoliferation-Inducing Ligand — APRIL). Эти лиганды, взаимодействуя с рецепторами В-клеток BAFFR и трансмембранного активатора, модулятора кальция и активатора лиганда циклофилина (Transmembrane Activator and Calcium-modulator and cytophilin ligand Interactor — TACI) соответственно, при участии цитокинов ИЛ-10, ТФР-β (ТФР-β — β Transforming Growth Factor) и ИЛ-15, синтезируемых активированными ДК, вызывают в наивных В-клетках переключение иммуноглобулиновых генов Сμ-Сγ и Сμ-Сα и их созревание в IgG- и IgA-плазмобласты. ИНФ-α/β являются необходимыми цитокинами для созревания и пролиферации В1-клеток — главных продуцентов естественных аутоантител в организме.
По влиянию ИФН-α/β на Т-клетки известно, что они стимулируют дифференцировку ИФН-γ-продуцирующих Th1-лимфоцитов хелперов в кооперации с такими цитокинами, как ИЛ-18 и ИЛ-21. Вместе с тем ИФН-α/β оказывают мощное антипролиферативное и проапоптозное действие, усиливая экспрессию проапоптотических молекул. Интерфероны I типа способны подавлять дифференцировку Тh2-лимфоцитов хелперов, а также провоспалительных клеток Th17 и в то же время стимулировать дифференцировку иммуносупрессорных Treg. Наличие одновременно про- и антивоспалительных свойств позволяет мобилизовать эффективный ответ против патогена, одновременно регулируя его силу с целью предотвращения избыточного повреждения собственных клеток и тканей.
Однако результаты исследований, проведенных у больных с тяжелой формой ВГИ, свидетельствовали о глубокой депрессии фагоцитарной системы (снижение показателей хемотаксиса макрофагальных клеток) в сочетании с нарушениями в Т-клеточном звене иммунитета, в системе интерферонов и интерлейкиновом статусе.
Эти изменения характеризовались в основном тенденцией к снижению субпопуляции Т-хелперов и повышению Т-супрессоров и активированных киллеров. В то же время отмечалось значительное снижение продукции ИФН-α и γ и регистрировалась отчетливая тенденция к активации спонтанной продукции интерлейкинов. Наблюдалась тенденция к снижению уровня NK-клеток и повышению их активности. Отмечались выраженные изменения в функционировании цитокиновой сети, проявляющиеся в подавлении продукции ИФН-α и γ в 4,5 и 11,7 раза соответственно и гиперпродукции исследуемых интерлейкинов.
Нарушения фагоцитарной активности клеток СМФ при рецидивирующем простом герпесе способствуют развитию иммунокомплексного процесса. Надо полагать, что по причине подавленности макрофагального звена иммунитета не происходит полноценной презентации информации о вирусе простого герпеса на Т-систему иммунитета, что характеризует иммунологический статус больных рецидивирующим герпесом как состояние иммунологической депрессии.
На фоне дисбаланса Т-клеточной иммунорегуляции наблюдается повышение провоспалительных интерлейкинов в сыворотке крови, что является отражением адаптивных реакций организма на вирусную персистенцию и характеризуется как острофазный ответ. Но несмотря на высокие концентрации не происходит адекватной активации эффекторных клеток и, следовательно, не реализуется полноценный клеточный цитолиз.
В связи с тем, что нарушения функционального состояния иммунной системы при рецидивирующей герпетической инфекции носят комплексный характер, затрагивая все звенья иммунного ответа, очевидно, что и методы коррекции должны быть направлены, с одной стороны, на подавление реакций иммунного воспаления, а с другой стороны, на восстановление реакций иммунологического реагирования [40].
Лечение мужчин с рецидивирующей ГВИ урогенитального тракта и бесплодием представляет довольно сложную задачу для практического врача и требует дифференцированного подхода в зависимости от клинической формы заболевания, а также состояния иммунной системы пациента. Важным этапом комплексного лечения таких больных является санация сопутствующих бактериальных инфекций. Использование комбинаций противовирусных препаратов, имеющих различную химическую структуру и принципиально различный механизм действия, может привести к усилению противовирусного эффекта. Сочетание противовирусных средств с препаратами другого механизма действия (интерфероном, индукторами интерферонов, иммуномодуляторами, антиоксидантами) снижает или предотвращает вероятность появления резистентных мутантов вирусов герпеса.
Базовая терапия должна включать противогерпетические препараты (внутривенно, перорально, местно) с обязательным увеличением дозы химиопрепарата (примерно в 2 раза), по сравнению с лицами с нормальной иммунной системой и продолжительности курса лечения и профилактики рецидивов у лиц с иммунодефицитными состояниями [41]. Для проведения базовой терапии можно использовать ацикловир (Зовиракс) в дозе 0,2 г 5 раз в сутки или 0,4 г 3 раза или 0,8 г 2 раза в сутки 5 дней; или валацикловир (Валтрекс) по 500 мг 2 раза в день 5–7 дней или 1,0 г 2 раза в сутки в течение 1 дня; или фамцикловир (Фамвир) по 250 мг 3 раза в сутки 7 дней; или рибавирин (Виразол, Рибамидил) по 200 мг 3–4 раза в сутки 7–10 дней; или ганцикловир (Цимевен) — при тяжелых формах, вызванных ацикловирустойчивыми штаммами, внутривенно 1–5 мг/кг каждые 12 часов 2–3 недели; или фоскарнет (Фоскавир) — при тяжелых формах, вызванных ацикловирустойчивыми штаммами, внутривенно 40–60 мг/кг каждые 8 часов с последующим переходом на поддерживающую дозу 90 мг/кг/сут в течение 2–3 недель [41, 42].
Противовирусные химиопрепараты необходимо применять в сочетании с интерферонами и индукторами интерферона (табл.) [39].
Из интерферонов (независимо от выбранного нуклеозида и его схемы) предпочтение необходимо, на наш взгляд, отдать препарату Виферон® — рекомбинантному ИФН-α-2b в сочетании с антиоксидантами (витамины С и Е). Рекомендуемая минимальная эффективная доза при рецидивирующей форме ВГИ — по одному ректальному суппозиторию, содержащему 500 000 МЕ, 2 раза в сутки с интервалом 12 часов в течение 10 дней [42]. Виферон® наиболее эффективен в период обострения ВГИ благодаря способности быстро купировать клинические проявления. Быстрота действия свечей определяется способом введения препарата. Прямая кишка имеет густую сеть кровеносных сосудов, через которую лекарственное вещество незамедлительно всасывается в кровь.
Включение в состав препарата аскорбиновой кислоты позволяет реализовать очень важные ее свойства. Аскорбиновая кислота (витамин С):
1) выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов;
2) обладает выраженными антиоксидантными свойствами;
3) участвует в процессах регенерации тканей, синтезе стероидных гормонов и др.;
4) усиливает детоксикационную и белковообразовательную функцию в печени за счет активации дыхательных ферментов;
5) участвует в регуляции иммунологических реакций (активирует синтез антител, С3-компонента комплемента, ИФН);
6) повышает фагоцитарную активность и сопротивляемость организма инфекциям.
Аскорбиновая кислота обладает противовоспалительным и, что особенно ценно, противоаллергическим действием, оказывает высокий профилактический и лечебный эффект в высоких и терапевтических дозах при вирусных инфекциях.
Витамин Е относится к группе жирорастворимых веществ. Его основная функция — нейтрализация свободных радикалов, вызывающих повреждение клеток и тканей человека. Свойства витамина Е, имеющие важное значение при терапии герпетической и других вирусных инфекций: 1) витамин является структурным элементом клеточных мембран; 2) обладает антиоксидантными свойствами; 3) регулирует синтез и распад фосфолипидов как при нормальной работе клеток, так и в условиях клеточной активации или при возникновении каких-либо патологических состояний, в том числе при инфекционно-воспалительных заболеваниях; 4) регулирует синтез простагландинов, участвует в работе иммунной системы; 5) косвенно способствует транспорту кислорода к тканям. Кроме того, при участии витамина Е происходит восстановление мембран клеток при воспалительных процессах, что предупреждает разрушение как эндогенного, так и экзогенного ИФН клеточными протеазами. Входящие в состав препарата Виферон® антиоксиданты — токоферола ацетат и аскорбиновая кислота — повышают противовирусную активность рекомбинантного человеческого ИФН-α-2b в 10–14 раз, что позволяет получить терапевтический эффект при минимальной дозе (у мужчин с рецидивами ВГИ — 1 000 000 МЕ в сутки 10 дней) и тем самым минимизировать побочные эффекты [42–45]. Однако в зависимости от выраженности клинических проявлений и длительности инфекционного процесса не исключается применение более высоких доз ИФН-α-2b (Виферон®) — по 2 000 000 МЕ и 3 000 000 МЕ в сутки ректально в течение 10 дней и более при отсутствии каких-либо побочных эффектов и доказанной высокой эффективности [40, 46].
Результаты иммунологического обследования больных на фоне применения препарата Виферон® показали, что после окончания курса терапии наблюдались положительные лабораторные сдвиги, характеризующиеся улучшением показателей функционального состояния макрофагов, нарастанием общего уровня Т-клеток с тенденцией к повышению уровней Т-хелперов и понижению Т-супрессоров и, следовательно, выравниванию их соотношений, а также регистрировалась тенденция к положительной динамике показателей цитокинового профиля. Все это свидетельствует о способности препарата Виферон® к стабилизации всех звеньев иммунной системы, в том числе к стимуляции выработки эндогенного интерферона [40, 45].
Целесообразно проводить также терапию в фазе ремиссии, после стихания основных клинических проявлений герпетической инфекции. Основная цель в этом периоде — достижение клинико-иммунологической ремиссии, подготовка больного к вакцинотерапии. Показано соблюдение режима труда и отдыха, диета должна быть разнообразной, богатой витаминами и микроэлементами. Учитывая нарушения различных звеньев иммунитета, которые сохраняются у пациентов с ВГИ и в фазе ремиссии, показано применение иммуномодуляторов (возможно тех же, что и в периоде рецидива) или адаптогенов растительного происхождения, например из семейства аралиевых, препаратов золотого корня, лимонника, аира, витамедина-М и др.
При выраженной иммуносупрессии показано назначение препаратов тимуса коротким курсом. Продолжить применение средств с иммуномодулирующим эффектом (интерферонов и его индукторов), коррекция ферментативных нарушений, восстановление нормальной микрофлоры кишечника (системная энзимотерапия, про- или пребиотики). Проводится симптоматическое, общеукрепляющее, физиотерапевтическое лечение, санация очагов инфекции, терапия хронических воспалительных заболеваний [9, 41].
Специфическую профилактику рецидивов ГВИ необходимо проводить с использованием герпетических инактивированных, рекомбинантных вакцин Герповакс и Витагерпавак через 2–3 месяца после окончания рецидива. Цель вакцинации — активация клеточного иммунитета, его коррекция и специфическая десенсибилизация организма. Этот этап начинают после достижения стойкой клинико-иммунологической ремиссии (если это оказывается возможным). Хороший эффект получен при использовании инактивированной вакцины в сочетании с индукторами интерферона или интерферонами (оптимально Виферон®) [9].
Критерием эффективности терапии ВГИ у мужчин является ликвидация воспалительных очагов в репродуктивной системе и восстановление фертильности (нормализация спермограммы).
Таким образом, вирусная герпетическая инфекция (ВПГ-1 и ВПГ-2) в последнее время занимает одну из ведущих позиций в формировании репродуктивных нарушений у мужчин и, как правило, сопровождается супрессией всех звеньев противовирусного иммунитета, в том числе системы интерферона.
В связи с этим для эффективного решения данной клинической проблемы требуется применение лечебного комплексного подхода, включающего базовую противовирусную терапию с обязательным применением препаратов интерферона и его индукторов. Среди интерферонов предпочтение необходимо отдать рекомбинантному альфа-2b в сочетании с антиоксидантами (витамины С и Е).
Литература
- Андреев Е. М., Вишневский А. Г. Демографические перспективы России до 2050 г. В кн.: Население России 2006: Четырнадцатый ежегодный демографический доклад / Отв. ред. А. Г. Вишневский. М.: Изд. дом ГУ ВШЭ, 2008. С. 265–288.
- Киселева Н. И. Вызовы и возможные решения демографического развития России / Новые ориентиры демографической политики Российской Федерации в условиях экономического кризиса: Материалы II Международной научно-практической конференции. М.: Изд-во «Экон-Информ», 2016. С. 25–30.
- Рищук С. В., Мирский В. Е. Ухудшение состояния здоровья молодого населения России — опасная тенденция, основные причины и пути выхода из кризиса // Национальная безопасность и стратегическое планирование. 2013; 4 (4): 100–112.
- Рищук С. В. Репродуктивная медицина сегодня — как угроза национальной безопасности России / Труды X Всероссийской научно-практической конференции с международным участием. 2015; 10 (1): 27–42.
- Тер-Аванесов Г. В. Современные аспекты диагностики и лечения мужского бесплодия. В кн.: Бесплодный брак. Современные подходы к диагностике и лечению / Под ред. Г. Т. Сухих, Т. А. Назаренко. 2-е изд., испр. и доп. М.: ГЭОТАР-Медиа, 2010. С. 324–411.
- Гинекология: Национальное руководство / Под ред. В. И. Кулакова, И. Б. Манухина, Г. М. Савельевой. М.: ГЭОТАР-Медиа, 2011. 1088 с.
- Колесникова Л. И., Колесников С. И., Курашова Н. А., Баирова Т. А. Причины и факторы риска мужской инфертильности // Вестник РАМН. 2015; 70 (5): 579–584.
- Лебедев С. В. Статистика бесплодия в России: заблуждения и факты (часть 1). 2012. [Электронный ресурс] (URL: Режим доступа: http://lebedev.livejournal.com/10738.html).
- Исаков В. А., Архипова Е. И., Исаков Д. В. Герпесвирусные инфекции человека: руководство для врачей / Под ред. В. А. Исакова. СПб: СпецЛит, 2013. 2-е изд., перераб. и доп. 670 с.
- Looker К. J., Garnett P. G., Schmid G. P. Лп estimate of the global prevalence and incidence of herpes simplex virus type 2 infection // Bull WHO. 2008; 86: 805–812.
- Дюдюн А. Д., Полион Н. Н., Нагорный А. Е. Герпесвирусная инфекция. Клинико-иммунологические особенности. Клиническая лекция // Дерматовенерология. Косметология. Сексопатология. 2015; 3–4; 119–142.
- Мурадова Е. О., Ткаченко К. В. Микробиология. М.: Эксмо, 2009. 336 с.
- Коколева А. С., Ахматов Э. А. Цитологические изменения при поражениях вирусом простого герпеса // Успехи современного естествознания. 2011; 8: 108–109.
- Modrow S., Falke D., Truyen U., Schätzl H. Molecular Virology. Springer, 2013. 1013 p.
- Руководство по вирусологии: Вирусы и вирусные инфекции человека и животных / Под ред. академика РАН Д. К. Львова. М.: ООО Издательство «Медицинское информационное агентство», 2013. 1200 с.
- Kramer Т., Enquist L. W. Alphaherpesvirus infection disrupts mitochondrial transport in neurons // Cell Host Microbe. 2012; 11 (5): 505–514.
- Kramer Т., Enquist L. W. Directional spread of alphaherpesviruses in the nervous system // Viruses. 2013; 5 (2): 678–707.
- Злотникова М. В., Новикова И. А. Механизмы естественного и адаптивного иммунитета при инфекциях, вызванных вирусами простого герпеса 1-го и 2-го типа // Проблемы здоровья и экологии. 2014; 1 (39): 7–14.
- Corey L., Spear P. G. Infections with herpes simplex viruses (1) // N. Engl. J. Med. 1986; 314 (11): 686–691.
- Langenberg A. G., Corey L., Ashley R. L., Leong W. P., Straus S. E. A prospective study of new infections with herpes simplex virus type 1 and type 2. Chiron. HSV Vaccine. Study. Group // N. Engl. J. Med. 1999; 341 (19): 1432–1438.
- Wald A., Zeh J., Selke S., Warren T., Ryncarz A. J., Ashley R., Krieger J. N., Corey L. Reactivation of genital herpes simplex virus type 2 infection in asymptomatic seropositive persons // N. Engl. J. Med. 2000; 342 (12): 844–850.
- Руководство по лабораторной диагностике инфекций урогенитального тракта / Под ред. Домейка М., Савичева А. М., Соколовский Е., Баллард Р., Унемо М. СПб: Изд-во Н-Л, 2012. 288 с.
- Рищук С. В. Половые инфекции как основная причина ухудшения репродуктивного здоровья семейных пар // TERRA MEDICA. 2013; 3: 5–11.
- Рищук С. В., Кахиани Е. И., Мирский В. Е., Душенкова Т. А. Половые инфекции и репродуктивный потенциал семьи. Бюллетень Оренбургского научного центра УрО РАН. 2016; 2: 59 c. [Электронный ресурс] (URL: http://elmag. uran.ru:9673/magazine/Numbers/2016–2/Articles/SVR-2016–2.pdf).
- Бочарова Е. Н., Курило Л. Ф., Шилейко Л. В., Брагина Е. Е., Юров Ю. Б., Климова Р. Р., Кущ А. А. Анализ популяции половых клеток в эякуляте мужчин, инфицированных вирусом простого герпеса // Онтогенез. 2008; 39 (1): 47–57.
- Науменко В. А. Выявление вируса простого герпеса и цитомегаловируса в мужских половых клетках при экспериментальной инфекции in vitro и в эякуляте мужчин с нарушениями фертильности: автореф. Дисс. … канд. мед. наук. М., 2009. 26 с.
- Кущ А. А., Науменко В. А., Климова Р. Р., Тюленев Ю. А., Малолина Е. А. Герпесвирусная инфекция мужских гамет и бесплодие: от экспериментальных моделей к разработке клинических рекомендаций // Вопр. вирусол. 2013; S1: 132–144.
- Климова Р. Р., Чичев Е. В., Науменко В. А., Гаджиева З. С., Цибизов А. С., Адиева А. А., Львов Д. К., Курило Л. Ф., Шилейко Л. В., Остроумова Т. В., Сорокина Т. М., Гаврилов Ю. А., Левчук Т. Н., Яковенко С. А., Васильева С. Г., Вознесенская Ю. В., Симоненко Е. Ю., Кущ А. А., Сухих Г. Т. Вирус простого герпеса и цитомегаловирус в эякуляте мужчин: вирус простого герпеса чаще встречается при идиопатическом бесплодии и коррелирует со снижением показателей спермы // Вопросы вирусологии. 2010; 55 (1): 27–31.
- Bezold G., Politch J. A., Kiviat N. B. et al. Prevalence of sexually transmissible pathogens in semen from asymptomatic male infertility patients with and without leukocytospermia // Fertil. Steril. 2007; 87: 1087–1097.
- Kotronias D., Kapranos N. Detection of herpes simplex virus DNA in human spermatozoa by in situ hybridization technique // In Vivo. 1998; 12: 391–394.
- Wu К. H., Zhou Q. K., Huang J. H. et al. Infection of cytomegalovirus and herpes simplex virus and morphology of the infected spermatogenic cells in infertile men // Zhonghua Nan Ke Xue. 2007; 13: 1075–1079.
- Цибизов А. С., Абдулмеджидова А. Г., Краснопольская К. В., Гаджиева З. С., Кущ А. А. Обнаружение вируса простого герпеса в сперматозоидах человека коррелирует со снижением частоты формирования бластоцисты и частоты имплантации эмбрионов при экстракорпоральном оплодотворении // Онтогенез. 2011; 42 (6): 447–452.
- Тиктинский О. Л., Калинина С. Н. Заболевания предстательной железы. СПб: Питер, 2006. 464 с.
- Простой герпес у взрослых: клинические рекомендации национального научного общества инфекционистов. М., 2014. 129 с.
- Ivanov I. B., Kuzmin M. D., Gritsenko V. A. Microflora of the seminal fluid of healthy men and men suffering from chronic prostatitis syndrome // Int J Androl. 2009. 32 (5): 462–467.
- Мейл Д., БростоффДж., РотД. Б., Ройтт А. Иммунология / Пер. с англ. М.: Логосфера, 2007. 568 с.
- Иммунология и аллергология (цветной атлас): учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова, А. В. Караулова. М.: Практическая медицина, 2006. 288 с.
- Хаитов Р. М., Ярилин А. А., Пинегин Б. В. Иммунология: атлас. М.: ГЭОТАР-Медиа, 2011. 624 с.
- Хаитов Р. М. Иммунология: учебник. 3-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 496 с.
- Халдин А. А., Полеско И. В., Малиновская В. В. Клинико- патогенетическое обоснование применения рекомбинантного интерферона альфа-2 b с антиоксидантами (витаминами Е и С), суппозитории ректальные в терапии рецидивирующего простого герпеса // Лечащий Врач. 2015; 11: 12–15.
- Исаков В. А., Исаков Д. В. Патогенез и лечение социально значимых вирусных урогенитальных инфекций (герпеса и папилломавирусной инфекции) // Клиническая фармакология и терапия. 2014; 23 (1): 68–74.
- Простой герпес. Цитомегаловирусная инфекция: методические рекомендации № 9 Правительства Москвы и Департамента здравоохранения Москвы. М., 2016. 16 с.
- Баграмова Г. Э., Гуреева М. А., Хлебникова А. Н., Молочков А. В. Иммуномодулирующая терапия папилломавирусной инфекции // Клиническая дерматология и венерология. 2011; 6: 47–50.
- Лусс Л. В., Малиновская В. В., Выжлова Е. Н. Интерфероны в комплексной терапии и профилактике гриппа и респираторных инфекций // Эффективная фармакотерапия. 2014; 5: 14–19.
- Ибишев Х. С. Современный взгляд на лечение и профилактику рецидивирующей инфекции нижних мочевых путей // Эффективная фармакотерапия. 2015; 26: 28–31.
- Гизингер О. А., Шеметова М. А., Зиганшин О. Р. Обоснованность применения интерферонотерапии при лечении герпесвирусной инфекции в дерматовенерологической практике // Лечащий Врач. 2016; 5: 1–5.
Е. И. Кахиани, доктор медицинских наук, профессор
В. Е. Мирский, доктор медицинских наук, профессор
М. С. Гогуа, кандидат медицинских наук
Д. С. Россолько, кандидат медицинских наук
Л. Ю. Нилова, кандидат медицинских наук
Т. А. Дудниченко, кандидат медицинских наук
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
1 Контактная информация: s.rishchuk@mail.ru
Перспективы использования интерферона в лечении бесплодия у мужчин/ С. В. Рищук, Е. И. Кахиани, В. Е. Мирский, М. С. Гогуа, Д. С. Россолько, Л. Ю. Нилова, Т. А. Дудниченко
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 75-85
Теги: фертильность, репродуктивное здоровье, инфекции
Купить номер с этой статьей в pdf