Многие заболевания, как острые, так и хронические, сопровождаются непреднамеренной потерей массы тела. Результатом этого может быть развитие недостаточного питания или истощения. Согласно определению, недавно предложенному Европейским обществом по клиническому питанию (European Society for Clinical Nutrition and Metabolism, ESPEN, 2015), недостаточным питанием называется состояние, при котором в результате недостаточного поступления в организм или усвоения в нем питательных веществ отмечаются изменения в компонентном составе организма, в частности снижение тощей массы тела, приводящие к нарушению физических и психических функций организма, ухудшающие клинический исход заболевания [1]. Ранее нами было предложено похожее определение недостаточности питания как «патологического состояния, обусловленного несоответствием поступления и расходов питательных веществ, приводящим к снижению массы тела и изменению компонентного состава организма» [2].
Компонентный состав организма в упрощенном виде состоит из двух частей — жировой массы и так называемой «тощей» или безжировой массы. При углубленном рассмотрении состав тощей массы неоднороден, в нее входят вода, мышечная масса, кости, кожа, внутренние органы [3].
Возможности детального анализа компонентного состава тела раньше были весьма ограничены. В настоящее время диагностические возможности существенно расширились. Для анализа многокомпонентного состава организма используются такие инструментальные и высокотехнологичные методы, как биоимпедансометрия, компьютерная и магнитно-резонансная томографии, рентгеновская абсорбциометрия, денситометрия и др. Они позволяют как качественно, так и количественно оценить точное содержание жира, мышечной массы, костей, воды в различных частях организма. Недавно был разработан метод периферической количественной компьютерной томографии [4, 5].
Благодаря новым техническим возможностям сегодня стало возможно оценить влияние изменений отдельных компонентов состава организма на течение и исход заболеваний. Было установлено, что снижение мышечной массы тела имеет большее прогностическое значение, чем изменения в количестве жировой ткани. Также было показано, что изменения в тощей и мышечной массе тела у больных часто опережают снижение общей массы тела.
В настоящее время определяющее значение в оценке тяжести, динамике течения и прогнозе заболевания имеет наличие и степень выраженности мышечного истощения (саркопении) у больных. Термин «саркопения» (от греческих слов sarx — мясо, плоть и penia — недостаток) был предложен профессором из США Ирвином Розенбергом (Irwin Rosenberg) в 1988 г. [6]. Предлагались и другие термины, обозначающие дефицит мышечной массы: миопения, кратопения, динапения и др. [7, 8].
Согласно Европейскому консенсусу по саркопении (2010), под этим термином понимают уменьшение мышечной массы тела и снижение функции мышц (силы и производительности), обусловленные возрастными нейрогуморальными сдвигами, нарушениями питания или мышечным катаболизмом [9, 10].
В сентябре 2016 г. диагноз «саркопения» был официально включен в дополненную 10-ю международную классификацию болезней (МКБ-10) под кодом М 62.84 [11].
Причины развития саркопении разнообразны. Она может возникнуть вследствие естественных инволютивных (старческих) изменений в организме, длительного голодания, нарушений питания, мальабсорбции и т. п. Саркопения часто наблюдается при хронических сердечно-сосудистых заболеваниях, сопровождающихся недостаточностью кровообращения, хронических болезнях легких с дыхательной недостаточностью, тяжелых поражениях печени и почек (циррозы, нефриты и т. п.), нейродегенеративных заболеваниях (болезнях Альцгеймера, Паркинсона, рассеянном склерозе и др.), различных видах рака, а также при кахексии любого происхождения. Кроме того, саркопения развивается при длительном постельном режиме, малоподвижности, в невесомости (у космонавтов), а также при дефиците стероидных половых гормонов, в частности тестостерона, а также гормона роста.
Саркопения часто встречается в клинической практике [12]. Так, при хронических сердечно-сосудистых и бронхолегочных заболеваниях распространенность саркопении в 2 раза выше, а при циррозах печени — в 18–50 раз выше, чем недостаточности питания (табл. 1).
По оценкам международных экспертов, саркопения станет к 2045 г. общемировой проблемой [13]. Это связано со старением населения нашей планеты, увеличением продолжительности жизни, а следовательно, числа лиц пожилого и старческого возраста. По оценкам международных экспертов, число пожилых людей в мире с 2000 по 2050 гг. возрастет с 600 млн до 2 млрд человек. Распространенность саркопении в мире при этом вырастет на 70% — с 19 млн (в 2016 г.) до 32 млн человек (в 2045 г.).
В патогенезе развития саркопении у больных, находящихся как в стационарах, так и на дому, имеет место так называемый «порочный круг», когда заболевание и постельный режим сопровождаются потерей аппетита и развитием нарушений питания, в частности саркопении, а она, в свою очередь, приводит к снижению двигательной активности, постельному режиму и потере аппетита (рис. 1).
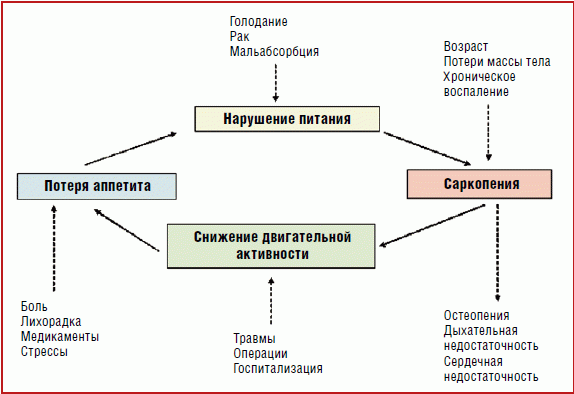
Рис. 1. Порочный круг саркопении
В последнее время установлено, что саркопения имеет определенное значение для прогноза течения и исхода заболевания, особенно у тяжелобольных. Показано, что за 10 суток нахождения больного в отделении реанимации он теряет около 17% массы мышц бедра. При этом величина снижения мышечной массы прямо коррелирует с тяжестью полиорганных нарушений. При потере от 5% до 10% массы мышц отмечается нарушение функции одного органа, от 10% до 20% — двух или трех органов, свыше 20% мышечной массы — четырех органов [14].
Таким образом, саркопения является независимым фактором риска развития осложнений, в том числе и жизнеугрожающих, таких как сепсис или полиорганная недостаточность. Установлено, что саркопения является независимым прогностическим фактором развития осложнений после радикальных операций при раке желудка и раке легких. В последнее время отмечается, что именно саркопения является основной причиной госпитализации, инвалидизации и смертности больных [15–17].
Если саркопения сопровождается критической потерей не только мышечной, но и жировой массы, она неизбежно переходит в форму кахексии (рис. 2) [18]. Под кахексией в настоящее время понимают тяжелое истощение, вызванное катаболизмом на фоне системной воспалительной реакции в организме [19]. Она наблюдается у многих пациентов с тяжелыми заболеваниями (сердечная, почечная, печеночная, раковая кахексии). Тяжелая кахексия характерна и для развернутой клинической картины СПИДа в 4-й и 5-й стадиях болезни [20].
При сочетании саркопении (потери мышц) с увеличением жировой массы развивается так называемое «саркопеническое ожирение». Такая форма саркопении наблюдается часто у лиц с резко выраженным ожирением, у пожилых и у больных, длительно находящихся на постельном режиме. Так, в проведенном во Франции исследовании EPIDOS показано, что у лиц до 70 лет саркопеническое ожирение наблюдалось в 10–12% случаев, в то время как у лиц старше 80 лет — уже у 15–27% [21].
В настоящее время для диагностики саркопении используются скрининговые и инструментальные методы. При этом оценивают как размеры (объем) мышечной ткани в организме, так и функцию мышц (мышечную силу и работоспособность). Для первичной скрининговой оценки наличия или отсутствия саркопении у больных сегодня используют достаточно простую шкалу оценки SARC-F [22]. В ней оцениваются такие показатели, как подъем груза, ходьба по комнате, вставание с кровати, подъем по лестнице, непроизвольные падения (табл. 2). Саркопения предполагается при наличии четырех и более баллов.
Для более точной диагностики наличия саркопении у пациентов используют такие инструментальные методы, как биоимпедансный анализ компонентного состава организма, компьютерную и магнитно-резонансную томографии, рентгеновскую абсорбциометрию, а в последнее время — и ультразвуковое исследование [18, 23].
Наиболее простым способом оценить состояние мышц является измерение окружности плеча и толщины кожно-жировых складок с последующим расчетом окружности мышц плеча. Затем по специальным формулам можно вычислить площадь мышц плеча и общую мышечную массу тела. При всей доступности антропометрического метода он является наименее точным и достаточно субъективным, так как зависит от навыка и мастерства исследователя. Кроме того, состояние мышц плеча не всегда отражает общую мышечную массу, в частности, объем мышц нижних конечностей.
В настоящее время для оценки компонентного состава организма достаточно широко используют метод биоимпедансометрии. Он основан на измерении сопротивления при прохождении слабого электрического тока через ткани организма. С помощью современных аппаратов для биоимпедансометрии можно достаточно точно определить содержание тощей и мышечной массы тела, активной клеточной массы и общее содержание белка в организме. Наличие саркопении устанавливается с помощью индекса тощей массы тела (табл. 3).
Вторым по частоте использования в клинической практике инструментальным методом является двухэнергетическая рентгеновская абсорбциометрия (DXA). Этот метод является относительно недорогим и отличается небольшой лучевой нагрузкой на пациента. С его помощью можно определить так называемый скелетно-мышечный индекс, основанный на суммарном измерении мышечной массы двух верхних и двух нижних конечностей.
Компьютерная и магнитно-резонансная томографии позволяют определить скелетно-мышечную массу на уровне третьего поясничного позвонка (L3) и оценить наличие или отсутствие саркопении, рассчитав так называемый поясничный скелетно-мышечный индекс (табл. 3). Кроме того, этими методами можно точно определить общую тощую массу тела [24].
Существенно снизить лучевую нагрузку на пациента позволяет метод периферической количественной компьютерной томографии (pQCT), при котором измеряется мышечный массив в одной конкретной конечности [25].
Ультразвуковым методом можно неинвазивно и без лучевой нагрузки для пациента точно измерить объем конкретной мышцы. Метод относительно недорог и может использоваться у лежачих больных [26].
Для оценки наличия или, наоборот, отсутствия саркопении необходимо оценить не только размеры, но и функцию мышц. Для этого используют динамометрию кистей рук, а в самое последнее время — и измерение силы мышц ног (квадрицепсов). Критерием снижения мышечной силы является выжимание ручным динамометром менее 30 кг для мужчин и менее 20 кг для женщин [23]. Важным показателем физической выносливости является скорость ходьбы. Для этого проводят 4-метровый тест. Критерием саркопении как у мужчин, так и у женщин является скорость ходьбы менее 0,8 м в секунду.
При наличии таких критериев, как снижение веса, саркопения, мышечная слабость (по динамометрии) и замедленная походка, устанавливается наличие синдрома «разбитости» (frailty syndrome) [27]. За рубежом для комплексной диагностики функционального состояния пациента и наличия или отсутствия саркопении проводят многоуровневый тест SARFRAIL [28].
До определенной стадии саркопения вполне обратима, за исключением возрастных инволютивных изменений. Для лечения саркопении используют усиленное белковое питание, стероидные и нестероидные анаболические средства, а также движение и физические упражнения.
Для профилактики и лечения саркопении необходимо увеличить синтез (анаболизм) и замедлить распад (катаболизм) белков в организме. С пищей в наш организм ежедневно поступает около 50–100 г белка, в то время как синтезируется и распадается у взрослого человека около 300 г белка в сутки. Поскольку белково-энергетическая недостаточность и нарушение синтеза белка всегда имеют место при саркопении, необходимо увеличить потребление белка до 1,2–1,5 г на кг массы тела в сутки. Для этого в последнее время используется дополнительное энтеральное питание, назначаемое перорально в виде жидких питательных смесей, выпиваемых медленно, со скоростью 100–200 мл в течение часа, так называемый пероральный сипинг [29].
В качестве дополнительного энтерального питания применяются сбалансированные питательные смеси, обогащенные как растительным, так и животным (молочным) белком. Жировой их компонент представлен комбинацией нескольких видов растительных масел (рапсового, подсолнечного, соевого, кокосового) и рыбьего жира, а углеводы — мальтодекстрином с высоким содержанием полисахаридов в виде крахмала. Также они содержат все необходимые витамины, макро- и микроэлементы (кальций, цинк, медь, железо, йод, фтор, хром, марганец, молибден, селен). Примером таких смесей может быть энтеральное питание Нутрикомп.
Для преодоления анаболической резистентности используются возможности таргетной фармакотерапии. Используются нестероидные и стероидные анаболические средства. Поскольку мужской половой гормон тестостерон влияет на пролиферацию и дифференцировку мышечных клеток, увеличивая синтез и уменьшая распад белка, таким образом увеличивая мышечную массу, силу и производительность, применяются синтетические аналоги тестостерона — стероидные анаболические средства, например, нандролон (Ретаболил). Эти препараты строго запрещены у спортсменов, так как относятся к допинговым средствам. Этой категории лиц, а также остальным пациентам могут быть беспрепятственно назначены нестероидные анаболические и энерготропные средства, в первую очередь левокарнитин (L-карнитин).
Карнитин в организме содержится в основном в мышечной ткани (95%). При его дефиците отмечается выраженная мышечная слабость, катаболизм белков мышц [30]. Показано, что прием L-карнитина приводит, в том числе, к увеличению содержания в крови анаболических гормонов, в частности, тестостерона и инсулиноподобного фактора роста [31]. При этом он не относится к запрещенным, допинговым средствам и может использоваться у спортсменов [32]. В нашей стране уже более 10 лет широко используется фармакологический препарат L-карнитина Элькар, назначаемый как перорально, так и парентерально. У больных с раковой саркопенией и кахексией карнитин снижает оксидативный стресс, подавляет выработку провоспалительных цитокинов, уменьшает атрофию мышц и мышечную слабость [33].
При переходе саркопении в стадию кахексии по показаниям назначают противовоспалительные (прогестины, глюкокортикоиды, каннабиноиды), антицитокиновые препараты (бимагрумаб, этанерцепт, талидомид и др.), а также гормон роста. В перспективе рассматривают возможность применения ингибиторов протеасом, антагонистов миостатина, аналога грелина — анаморелина [34, 35].
Большое значение при лечении саркопении имеет достаточная двигательная и физическая активность. Она способствует активизации анаболических процессов в организме, росту массы мышц и увеличению их силы и производительности. Показано, что физические упражнения увеличивают выработку инсулиноподобного фактора роста в организме в 4 раза [36, 37].
Результатом лечения саркопении должен быть не просто рост тощей (мышечной) массы тела, но и увеличение функции мышц, т. е. их силы и производительности, а также улучшение качества жизни больных.
Выводы
Саркопения достаточно часто встречается в клинической практике среди различных категорий терапевтических и хирургических пациентов.
Саркопения является независимым фактором риска развития осложнений, в том числе жизнеугрожающих, таких как сепсис и полиорганная недостаточность.
Диагноз «саркопения» с сентября 2016 г. официально включен в Международную классификацию болезней 10-го пересмотра (МКБ-10) под кодом М 62.84.
Для диагностики саркопении у пациентов используют скрининговые опросники, а также такие инструментальные методы, как биоимпедансный анализ компонентного состава организма, компьютерную и магнитно-резонансную томографии, двойную рентгеновскую абсорбциометрию, ультразвуковое исследование.
Для профилактики и лечения саркопении используют как усиленное по белку и энергии питание с включением сбалансированных энтеральных питательных смесей, так и стероидные или нестероидные анаболические средства, в том числе L-карнитин, а также физические упражнения.
Результатом лечения должно быть не просто увеличение массы мышц, но и повышение их функции, т. е. силы и производительности, а в итоге — улучшение качества жизни больных.
Предупреждение саркопении и перехода ее в кахексию является основной задачей лечения у различных категорий больных, поскольку кахексию проще предупредить, а в необратимой стадии кахексия практически неизлечима.
Литература
- Cederholm T., Bosaeus I., Barazzoni R. et al. Diagnostic criteria for malnutrition — an ESPEN Consensus Statement // Clin. Nutr. 2015. Vol. 34, № 3. P. 335–340.
- Хорошилов И. Е. Недостаточное питание у пациента: диагностика и лечение // Лечащий Врач. 2003. № 6. С. 62–64.
- Николаев Д. В., Смирнов А. В., Бобринская И. Г., Руднев С. Г. Биоимпедансный анализ состава тела человека. М.: Наука, 2009. 392 с.
- Frank A. W., Lorbergs A. L., Chilibeck P. D. et al. Muscle cross sectional area and grip torque contraction types are similarly related to pQCT derived bone strength indices in the radii of older healthy adults // J. Musculoskelet. Neuronal. Interact. 2010. Vol. 10, № 2. P. 136–141.
- Blew R. M., Lee V. R., Farr J. N. et al. Standardizing evaluation of pQCT image quality in the presence of subject movement: qualitative versus quantitative assessment // Calcif. Tissue Int. 2014. Vol. 94, № 2. P. 202–211.
- Rosenberg I. Summary comments // Am. J. Clin. Nutr. 1989. Vol. 50. P. 1231–1233.
- Fearon K., Evans W., Anker S. Myopenia — new universal term for muscle wasting // J. Cachexia Sarcopenia Muscle. 2011. Vol. 2. № 1. P. 1–3.
- Morley J. E. Sarcopenia epidemiology / Materials of 9 th International Conference on Cachexia, Sarcopenia and Muscle Wasting, Berlin, Germany, 10–11 December 2016. P. 13.
- Cruz-Jentoft A. J., Baeyens J. P., Bauer J. M. et al. Sarcopenia: European consensus on definition and diagnosis: report of the European working group on sarcopenia in older people // Age Ageing. 2010. Vol. 39, № 4. P. 412–423.
- Muscaritoli M., Anker S. D., Argiles J. et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by Special Interest Groups (SIG) «cachexia-anorexia in chronic wasting diseases» and «nutrition in geriatrics» // Clin. Nutr. 2010. Vol. 29, № 2. P. 154–159.
- Anker S. D., Morley J. E., von Haehling S. Welcome to the ICD-10 code for sarcopenia // J. Cachexia, Sarcopenia and Muscle. 2016. Vol. 7, № 5. P. 512–514.
- Von Haehling S., Morley J. E., Anker S. D. An overview of sarcopenia: facts and numbers on prevalence and clinical impact // J. Cachexia, Sarcopenia and Muscle. 2010. Vol. 1, № 2. P. 129–133.
- The future prevalence of sarcopenia in Europe. World Congress on osteoporosis, osteoarthritis and musculoskeletal diseases, 2016 // Osteoporosis Intern. 2016. Vol. 27, Suppl. 1.
- Puthucheary Z. A., Rawal J., McPhail M. et al. Acute skeletal muscle wasting in critical illness // JAMA. 2013. Vol. 310, № 15. P. 1591–1600.
- Morley J. E., Anker S. D., von Haehling S. Prevalence, incidence and clinical impact of sarcopenia: facts, numbers and epidemiology — Update 2014 // J. Cachexia, Sarcopenia and Muscle. 2014, № 5. Vol. 5. P. 253–259.
- Morley J. E. Sarcopenia epidemiology/ 9 th International conference on cachexia, sarcopenia and muscle wasting. Berlin, 10–11 December 2016. P. 13.
- Liccini A., Malmstrom T. K. Frailty and sarcopenia as predictor of adverse health outcomes in persons with diabetes mellitus // J. Am. Med. Dir. Assoc. 2016. Vol. 17. P. 846–851.
- Biolo G., Cederholm T., Muscaritoli M. Muscle contractile and metabolic dysfunction is a common feature of sarcopenia of aging and chronic diseases: from sarcopenic obesity to cachexia // Clin. Nutr. 2014. Vol. 33, № 5. P. 737–748.
- Хорошилов И. Е. Недостаточность питания и её распространенность в клинической практике. В кн.: Парентеральное и энтеральное питание: национальное руководство / Под ред. М. Ш. Хубутия, Т. С. Поповой, А. И. Салтанова. М.: ГЭОТАР-Медицина, 2014. С. 161–169.
- Белозеров Е. С., Горбунов В. И., Мурыванова Н. Н. ВИЧ-инфекция: медико-социальные аспекты. Ульяновск: УлГУ, 2014. С. 70–71.
- Dupuy C., Lauwers-Cances V., Guyonnet S. Searching for a relevant definition of sarcopenia: results from the cross-sectional EPIDOS study // J. Cachexia, Sarcopenia and Muscle. 2015. Vol. 6, № 2. P. 144–154.
- Malmstrom T. K., Morley J. E. SARC-F: a simple questionnaire to rapidly diagnose sarcopenia // J. Am. Med. Dir. Assoc. 2013. Vol. 14, № 8. P. 531-53-22.
- Sousa A., Guerra R. S., Fonseca I. Sarcopenia among hospitalized patients — a cross-sectional study // Clin. Nutr. 2015. Vol. 34, № 6. P. 1239–1244.
- Rollins K. E., Tewari N., Ackner A. The impact of sarcopenia and myosteatosis on outcomes of unresectable pancreatic cancer or distal cholangiocarcinoma // Clin. Nutr. 2016. Vol. 35, № 5. P. 1103–1109.
- Sergi G., Trevisan C., Veronese N. Imaging of sarcopenia // Eur. J. Radiol. 2016. Vol. 85, № 8. P. 1519–1524.
- Harris-Love M. O., Seamon B. A., Teixeira C., Ismail C. Ultrasound estimates of muscle quality in older adults: reliability and comparison of Photoshop and Image J for the grayscale analysis of muscle echogenicity // Peer J. 2016. Vol. 22, № 4. P. e1721.
- Morley J. E., Vellas B., van Kan G. A. Frailty consensus: a call to action // J. Am. Med. Dir. Assoc. 2013. Vol. 14, № 6. P. 392–397.
- Maggio M. Functional tests: gait speed, SPPB test / Materials of 9 th International Conference on Cachexia, Sarcopenia and Muscle Wasting, Berlin, Germany, 10–11 December 2016. P. 18.
- Хорошилов И. Е. Сипинговое энтеральное питание: клинико-фармакологический анализ и возможности использования в интенсивной терапии // Вестник анестезиологии и реаниматологии. 2015. Т. 12, № 5. С. 58–64.
- Хорошилов И. Е. Карнитин: роль в организме и возможности терапевтического применения при разных заболеваниях // Врач. 2017. № 3. С. 2–6.
- Kraemer W. J., Volek J. C., French D. N. et al. The effects of L-carnitine L-tartrate supplementation on hormonal responses resistence exercise and recovery // J. Strength Cond. Res. 2003. Vol. 17. P. 455–462.
- Парастаев С. А., Топольский А. В., Хван Д. Е. и др. О результатах применения L-карнитина (препарат Элькар) у спортсменов высокой квалификации // Спортивная медицина: наука и практика. 2012. № 2. С. 21–28.
- Silverio R., Laviano A., Fanelli F. R., Seelaender M. L-carnitine and cancer cachexia: clinical and experimental aspects // J. Cachexia, Sarcopenia and Muscle. 2011. Vol. 2, № 1. P. 37–44.
- White T. A., Le Brasseur N. K. Myostatin and sarcopenia: opportunities and challenges — a mini-review // Gerontology. 2014. Vol. 60. P. 289–293.
- Zhang H., Garcia J. M. Anamorelin hydrochloride for the treatment cancer-anorexia-cachexia in NSCLC // Expert. Opin. Pharmacother. 2015. Vol. 16. P. 1245–1253.
- Bowen T. S., Schuler G., Adams F. Skeletal muscle wasting in cachexia and sarcopenia: molecular pathophysiology and impact of exercise training // J. Cachexia, Sarcopenia and Muscle. 2015. Vol. 6, № 3. P. 197–207.
- Gomes M. J., Martinez P. F., Pagan L. U. Skeletal muscle aging: influence of oxidative stress and physical exercise // Oncotarget. 2017. Vol. 15. P. 1–13. DOI: 10.18632/oncotarget.14670.
И. Е. Хорошилов, доктор медицинских наук
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
Контактная информация: ighor1@yandex.ru
Купить номер с этой статьей в pdf