Поверхностные микозы кожи являются актуальной междисциплинарной проблемой во всех странах мира. По данным ВОЗ около 20% населения мира страдает микозами [1]. Согласно данным международных эпидемиологических проектов, посвященных изучению распространенности грибковой и негрибковой патологии стопы среди населения европейских государств, включая Россию и 6 стран Юго-Восточной Азии, грибковые инфекции занимают первое место (34,5%) среди всей выявленной патологии стопы. Микоз стоп выявлялся в 22,3% случаев при обращении к участковым (семейным) врачам-терапевтам и до 29% случаев — к дерматологу [2]. Заболеваемость микозом стоп неуклонно возрастает, объясняя общий рост заболеваемости дерматофитией, не всегда сдерживаемой с появлением новых антимикотиков. Излеченный микоз стоп при неизлеченном онихомикозе (стойкий резервуар), как правило, рецидивирует. Заболеваемость микозами стоп и онихомикозами выросла в 2,5 раза за последние 10 лет, с ежегодным приростом около 5% [3]. При этом особенно важно иметь эффективные лекарственные препараты, соответствующие современным клиническим особенностям микозов стоп [4].
В Российской Федерации в 2015 г. было зарегистрировано 180 008 новых больных с микозом стоп и кистей, в том числе 67,1% — с онихомикозом [5]. Уровень заболеваемости населения микозом стоп и кистей в различных федеральных округах (ФО) России значительно варьирует: от 184,8 случая на 100 тыс. населения в Дальневосточном ФО до 64,1 в Северо-Кавказском при среднероссийском показателе 123,1 случая на 100 тыс. населения.
Рост потребности в отечественных антифунгальных препаратах, пригодных для медицинского применения, опережает реальные результаты их скрининга и целенаправленной химической трансформации [6].
На российском фармрынке имеется более 200 препаратов, в регистре лекарственных средств (РЛС) России представлено порядка 40 зарегистрированных топических препаратов — наружных противогрибковых средств (на основе аллиламинов — 46,2%, азолов — 38,5%), из которых 30,8% отечественного производства. В РСЛ России представлено 50 противогрибковых препаратов системного действия (на основе азолов — 70,0%, аллиламинов — 30,0%), доля отечественных препаратов из них — 42,0% [7, 8].
Основной целью стратегии развития медицинской науки в Российской Федерации на период до 2025 г. является развитие передовых технологий и внедрение на их основе инновационных продуктов. Актуальность разработки отечественных лекарственных средств подтверждается принятой Правительством РФ Стратегией и Федеральной целевой программой развития фармацевтической промышленности в России «Фарма 2020» (ФЦП «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года»). В научной платформе «фармакология» приоритетным направлением является создание библиотек соединений, перспективных для разработки фармакологически активных препаратов, поиск фармакологически активных веществ в рядах химических соединений [9]. Несмотря на достаточно обширный класс разнообразных химических соединений как природного происхождения, так и полученных путем химического синтеза, обладающих специфической активностью в отношении патогенных грибов, существующие антимикотические препараты полностью не решают проблемы этиологической терапии микозов.
Трудности лечения определяются локализацией и характером патологического процесса, а также хроническим течением заболевания и частыми рецидивами. Наличие у пациентов нарушений в иммунной системе, периферической иннервации и кровоснабжении на фоне сопутствующих заболеваний, длительного приема антибактериальных и цитостатических препаратов, влияния вредных факторов внешней среды ослабляет устойчивость организма к патогенным грибам [3].
В настоящее время в клинической практике имеется определенный выбор препаратов системного и локального действия, обладающих антимикотической активностью, но вызываемые ими побочные или токсические эффекты нередко ограничивают их применение в медицинской практике. Производные имидазола и триазола (кетоконазол, итраконазол, бифоназол, оксиконазол, флуконазол, клотримазол) при системном применении в разной степени обладают гепато- и нефротоксичностью, неблагоприятным действием на органы эндокринной системы, при местном применении способствуют возникновению аллергических реакций. Производные группы аллиламинов (тербинафин, толнафтат, нафтифин) при системном применении оказывают побочное действие на желудочно-кишечный тракт. При длительном местном применении могут вызывать аллергические реакции [10]. Отмечается резистентность дерматофитов, в частности T. rubrum, к тербинафину (15,1%), итраконазолу (20,0%), флуконазолу (48,2%) [11].
В связи с этим поиск, разработка и внедрение в практическое здравоохранение высокоактивных и малотоксичных лекарственных средств, способных специфически воздействовать на патогенные грибы, не оказывая при этом нежелательного действия на организм, является актуальным.
Целью настоящей работы был мишень-направленный поиск фармакологически активных вновь синтезированных химических соединений, перспективных для создания фармакологических препаратов, обладающих фунгистатическим действием, с последующим изучением их биологических свойств, в том числе спектра антимикотической активности.
Материалы и методы исследования
Оценка антифунгальной активности проводилась in vitro с использованием тест-культур дерматофитов, с изученными биохимическими и серологическими свойствами, из Российской коллекции патогенных грибов: T. rubrum РКПГ F 1408, T. mentagrophytes var. gypseum РКПГ F 1425, T. tonsurans РКПГ F 1458, T. violaceum РКПГ F 1393/658, T. mentagrophytes var. interdigitale РКПГ F 1229, T. schoenleinii РКПГ F 235/25, E. floccosum РКПГ F 1174, M. canis РКПГ F 1403, Candida albicans РКПГ Y 401/NCTC 885/653.
Фунгистатическую активность химических соединений определяли методом двукратных серийных разведений. Тестируемые химические соединения и контроли растворяли в диметилсульфоксиде (ДМСО), исходное разведение 1000 мкг/мл готовили на дистиллированной стерильной воде; рабочие концентрации (от 100 мкг/мл до 0,19 мкг/мл) готовили с применением жидкой питательной среды Сабуро.
Из культуры грибов готовили инокулюм по стандарту мутности 108 КОЕ/мл. В каждую пробирку с разведенным препаратом вносили взвесь культуры гриба. Инкубировали при 27 °С 14 дней. В каждом тесте использовали положительный и отрицательный контроль. Минимальную ингибирующую концентрацию (MИК) определяли визуально как наименьшую концентрацию, которая ингибирует рост культуры гриба. В опыте с C. albicans MИК определяли визуально как наименьшую концентрацию, которая ингибирует рост, что подтверждалось отсутствием помутнения и осадка [12, 13]. В качестве контрольных субстанций использовали тербинафин, итраконазол, флуконазол (Sigma-Aldrich, США).
Результаты исследования
В Уральском НИИ дерматовенерологии и иммунопатологии МЗ СО проведено экспериментальное доклиническое изучение противогрибковой активности 210 новых гетероциклических соединений азинового ряда, синтезированных в Институте органического синтеза им. И. Я. Постовского Уральского отделения Российской академии наук.
Проведенные исследования показали, что 105 соединений (50,0%) обладали разной степенью фунгистатической активности (рис. 1).
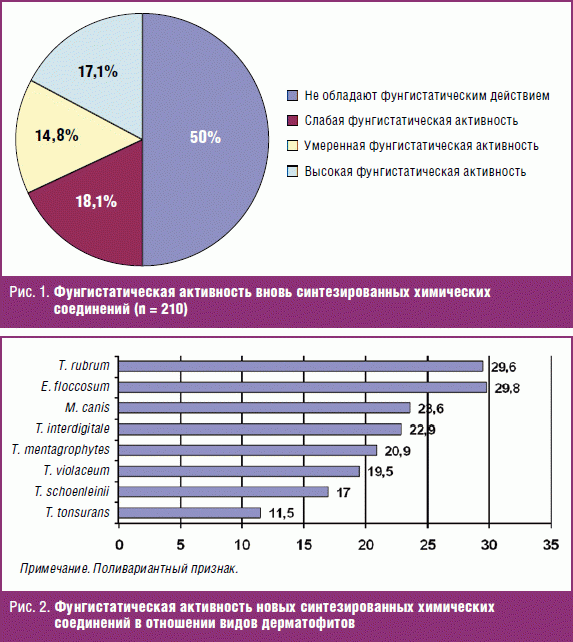
Высокая фунгистатическая активность (МИК 0,19–6,25 мкг/мл) in vitro отмечалась у 36 (17,1%) химических соединений и их изомеров. Умеренная фунгистатическая активность (МИК 12,5–25 мкг/мл) регистрировалась у 31 (14,8%) вещества. 38 (18,1%) вновь синтезированных химических соединений обладали слабой фунгистатической активностью (МИК 50–100 мкг/мл).
Высокую фунгистатическую активность в отношении протестированных штаммов дерматофитов показали 9 химических соединений (8,6%). У 8 (7,6%) вновь синтезированных химических соединений высокая противогрибковая активность отмечена в отношении T. rubrum, у 5 (4,8%) — в отношении T. schoenleinii, у 4 (3,8%) — в отношении E. floccosum, по одному — в отношении M. canis (0,9%); T. rubrum и T. interdigitale (0,9%); T. rubrum и E. floccosum (0,9%); T. rubrum, T. violaceum, E. floccosum (0,9%); T. rubrum, T. violaceum, T. schoenleinii, E. floccosum, M. canis (0,9%); T. rubrum, T. tonsurans, T. violaceum, T. interdigitale, E. floccosum, M. canis (0,9%); T. interdigitale и E. floccosum (0,9%); T. violaceum и M. canis (0,9%); T. interdigitale, T. schoenleinii, E. floccosum; T. tonsurans, T. violaceum, T. schoenleinii, E. floccosum (0,9%).
Отмечена умеренная фунгистатическая активность (МИК 12,5–25 мкг/мл) у 10 (9,5%) вновь синтезированных химических веществ в отношении T. rubrum; у 7 (6,7%) — в отношении E. floccosum; у 3 (2,9%) — в отношении
Треть новых химических соединений проявили антифунгальную активность различной степени выраженности в отношении основных возбудителей микоза ногтей, кистей и стоп — T. rubrum, E. floccosum, T. interdigitale, в отношении зооантропофильных дерматофитов, вызывающих заболевания у животных и человека (M. canis, T. mentagrophytes var. gypseum), — 23,6–20,9% соответственно. Противогрибковая активность вновь синтезированных химических соединений в отношении различных видов дерматофитов представлена на рис. 2. Фунгистатическая активность химических соединений различной степени выраженности представлена на рис. 3.
Синтезирован ряд новых 3-замещенных имидазотетразинов, содержащих азолильные, аминопиридильные и алкоксильные заместители, и установлено, что они обладают широким спектром действия, ингибируя рост у 6–8 культур грибов рода Trichophyton, Epidermophyton, Microsporum с минимальной ингибирующей концентрацией в диапазоне 0,75–25 мкг/мл. Наибольшая активность имидазотетразинов наблюдалась в отношении T. rubrum, T. violaceum, E. floccosum (МИК 1,5–6,25 мкг/мл) [14]. Проведен поиск антифунгальных соединений у синтезированных производных 2,3-дицианопиразина и отмечена корреляция антифунгальной (МИК — 12,5–25 мкг/мл) и антимикобактериальной активности [15].
В результате изучения биологических свойств и спектра антифунгальной активности фармакологически активных новых гетероциклических производных в ряду диазинов и тетразинов установлены перспективы разработки фармакологических препаратов для 36 (17,1%) химических соединений, создана библиотека перспективных химических субстанций, обладающих высокой фунгистатической активностью к широкому спектру клинически значимых видов дерматофитов.
Литература
- Coogan M. M., Fidel P. L., Komesu M. C., Maeda L. P. Candida and Mycotic Infections // Adv. Dent. Res. 2006. Vol. 19. P. 130–138.
- Сергеев А. Ю., Бучинский О. И., Мокина Е. В., Жарикова Н. Е. Проект «Ахиллес»: эпидемиология и этиология микозов стопы и онихомикозов в конце XX века // Росс. журн. кожных и венерических болезней. 2002. № 5. С. 47–50.
- Сергеев В. Ю., Сергеев А. Ю. Дерматофитии: новое в диагностике, терапии и профилактике наиболее распространенных микозов человека // Consilium Medicum. 2008. № 1. С. 30–35.
- Наружная терапия микозов стоп. Пособие для врачей / Под ред. Сергеева Ю. В. М.: Национальная академия микологии. 2005. 20 с.
- Ресурсы и деятельность медицинских организаций дерматовенерологического профиля. Заболеваемость инфекциями, передаваемыми половым путем, заразными кожными болезнями и болезнями кожи (Статистические материалы). М., 2016. 206 с.
- Катлинский А. В., Сазыкин Ю. О., Бибикова М. В., Орехов С. Н. Основные направления поиска и создания новых антифунгальных препаратов. В кн.: Успехи медицинской микологии / Под общей научной ред. акад. РАЕН Ю. В. Сергеева). Т. 3. М.: Национальная академия микологии, 2004. 334 с. С. 59–62.
- Регистр лекарственных средств России РЛС Энциклопедия лекарств. 22-й вып. / Гл. ред. Г. Л. Вышковский. М.: ВЕДАНТА, 2013. 1428 с.
- http://www.rlsnet.ru/news_101744.htm.
- Стратегия развития медицинской науки в Российской Федерации на период до 2025 года.
- Шилова И. Б. Изучение производного тиазолидин-2,4-диона (микозидина) в качестве потенциального противогрибкового средства. Автореф. … к.м.н. Старая Купавна, 2007.
- Медведева Т. В. Сравнительная характеристика системных антимикотиков в терапии микозов кистей и стоп с онихомикозом. Автореф. … к.м.н. СПб, 2004.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей ред. чл.-корр. РАМН, профессора Р. У. Хабриева. 2-изд., перераб. и доп. М.: ОАО «Издательство «Медицина», 2005. 832 с.
- Кубанова А. А., Степанова Ж. В., Гуськова Т. А., Пушкина Т. В., Крылова Л. Ю., Шилова И. Б., Тренин А. С. Методические указания по изучению противогрибковой активности лекарственных средств. В кн.: Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А. Н. Миронова. М.: Гриф и К, 2012. 944 с. С. 578–586.
- Ишметова Р. И., Игнатенко Н. К., Белянинова И. А., Толщина С. Г., Коротина А. В., Слепухин П. А., Евстигнеева Н. П., Зильберберг Н. В., Аминева П. Г., Кунгуров Н. В., Русинов Г. Л., Чупахин О. Н. Синтез и противогрибковая активность 3-замещенных имидазо [1,2-b] [1,2,4,5]тетразинов // Известия Академии наук. Серия химическая. 2015, № 9, с. 2100–2105.
- Verbitskiy E. V., Slepukhin P. A., Kravchenko M. A., Skornyakov S. N., Evstigneeva N. P., Kungurov N. V., Zil’berberg N. V., Rusinov G. L., Chupakhin O. N., Charushin V. N. Synthesis, antimycobacterial and antifungal evaluation of some new 1-ethyl-5- (hetero)aryl-6-styryl-1,6-dihydropyrazine-2,3-dicarbonitriles // Bioorganic & Medicinal Chemistry Letters. 2015, Vol. 25, Is. 3, p. 524–528.
Н. А. Герасимова*, кандидат биологических наук
Е. В. Вербицкий**, кандидат химических наук
С. Г. Толщина**, кандидат химических наук
Н. В. Зильберберг*, доктор медицинских наук
Н. В. Кунгуров*, доктор медицинских наук, профессор
Р. И. Ишметова**, кандидат химических наук
Г. Л. Русинов**, кандидат химических наук
О. Н. Чупахин**, доктор химических наук, профессор, академик РАН
В. Н. Чарушин**, доктор химических наук, профессор, академик РАН
* ГБУ СО УрНИИДВИ МЗ СО, Екатеринбург
** ФГБУН ИОС им. И. Я. Постовского Уральского отделения РАН, Екатеринбург
1 Контактная информация: evstigneeva-np@yandex.ru
Купить номер с этой статьей в pdf