На современном этапе в России по данным диспансеризации алиментарное ожирение (Е60.0 по МКБ-10) является самой частой патологией среди женского населения. С другой стороны, патология молочных желез занимает лидирующую позицию среди патологии репродуктивной системы. Доброкачественные заболевания молочных желез выявляются у 25% женщин в возрасте до 30 лет, у 60% женщин старше 40 лет и у 80% пациенток с гинекологической патологией. Наиболее часто наблюдается диффузная форма доброкачественной дисгормональной дисплазии молочных желез (N60.0 по МКБ-10). На современном этапе следует рассматривать доброкачественную дисплазию молочных желез как фоновое заболевание для развития рака молочных желез. Известно, что ожирение является ведущим фактором риска развития рака молочных желез. Поэтому ранняя диагностика патологии молочных желез на стадии диффузного гиперпластического процесса и проведение патогенетического лечения, эффективная коррекция избыточного веса, а также наблюдение за этими пациентками реализуют профилактику рака молочной железы. Пока же мы имеем страшную реальность — рак молочных желез в настоящий момент занимает первое место в онкологической заболеваемости и смертности женщин России [1–3].
С 2009 г. выявление и лечение доброкачественной патологии молочных желез входит в обязанности специалиста акушера-гинеколога. Однако практическая реализация должного встречает определенные затруднения, несмотря на принятые в ряде регионов России распоряжения Департаментов здравоохранения о тактике ведения пациенток с патологией молочных желез на основании Приказа МЗ РФ № 572-н. В обязанности специалиста акушера-гинеколога входит назначение рекомендаций и медикаментозной терапии пациенткам с алиментарным ожирением. Здесь также наблюдается неактивность гинекологов относительно должной борьбы с лишним весом, а массовое направление ими пациенток к эндокринологам, которое можно назвать «спихотерапией».
Основой для выявления патологии молочных желез является применение методов лучевой диагностики (ультразвуковое исследование, маммография, магнитно-резонансная томография). Сегодня именно гинеколог стал для женщины первым специалистом для выбора дифференцированной тактики: ежегодное наблюдение, лечение диффузных форм мастопатии у гинеколога или направление к онкологу при выявлении узловых форм заболевания и рака молочных желез [4, 5]. Для этих целей наиболее удобным и доступным диагностическим методом является ультразвуковое исследование. Однако на современном этапе мы имеем трудности, касающиеся интерпретации сонографических характеристик клинических форм диффузной мастопатии различными авторами, что затрудняет работу практикующего специалиста и не позволяет решить глобальную задачу, а именно выполнить раннюю профилактику развития рака молочных желез [6–8]. Доказательная медицина (evidence based medicine) становится технологией и философией современной медицины [9]. А практическая медицина, как никакая другая деятельность, нуждается в разработке методов и критериев, обеспечивающих объективные доказательства принимаемых решений при обследовании пациентов.
Целью настоящего исследования было при помощи разработанной современной математической модели ультразвуковой диагностики дисгормональной патологии молочных желез оценить состояние молочных желез у пациенток с диффузной доброкачественной дисплазией молочных желез на фоне терапии алиментарного ожирения препаратом Редуксин.
Материал и методы исследования
В рамках целевой межведомственной научно-практической программы «Здоровье женщины» по профилактике рака молочных желез, совместного проекта СибГМУ, НИИ фармакологии РАН (руководитель — профессор Л. С. Сотникова), обследовано 266 женщин репродуктивного возраста. Средний возраст пациенток в исследовании был 31,2 ± 0,2 года. Основную группу составили 240 пациенток, имевших в соответствии с клинико-рентгенологической классификацией Н. И. Рожковой (1993 г.) диагноз: диффузная дисгормональная дисплазия молочных желез (ДДДМЖ). Наличие дисгормональной патологии молочных желез верифицировалось с помощью ультразвукового исследования с использованием линейного датчика 14 МГц с применением цветового и энергетического допплеровского картирования в первую фазу менструального цикла (5–10 день), пациенткам старше 35 лет с дополнительным выполнением рентгенологической маммографии. Полученные эхографические показатели позволили разделить пациенток с ДДДМЖ на четыре клинических группы: I группа (n = 72) — с преобладанием железистого компонента; II группа (n = 66) — с преобладанием кистозного компонента; III группа (n = 53) — с преобладанием фиброзного компонента; IV группа (n = 49) — смешанной формы. Контрольную группу составили 50 практически здоровых женщин, сопоставимых с основной группой по возрасту, без соматической и гинекологической патологии.
Из статистических методов обработки результатов обследования проводился анализ вариационных рядов методами описательной статистики с вычислением медианы (Ме) и верхнего и нижнего квартилей. Качественные признаки оценивались путем вычисления абсолютных и относительных частот. Анализ различий по количественным признакам выполнялся методами множественного сравнения независимых групп (ANOVA Краскела–Уоллиса) и методами сравнения двух независимых групп (U-тест Манна–Уитни). Для изучения связей между признаками применялся корреляционный анализ Кенделла. Разницу значений принимали статистически значимой при p < 0,05. Статистический анализ данных осуществлялся при помощи пакета программ Statistica 6,0 (StatSoft, USA).
Используемые статистические методы позволяют понять общую тенденцию развития болезни. Однако для оценки индивидуальных особенностей пациентки необходимо разработать принципы врачебной технологии, когда на фоне общих закономерностей была бы возможность делать доказательные выводы о состоянии здоровья каждой обследуемой женщины. С этой целью в работе был реализован алгоритм неоднородной последовательной процедуры распознавания в модификации А. А. Генкина [10].
Результаты и обсуждение
Вопрос о наличии или отсутствии ДДДМЖ у пациентки, правильная интерпретация полученных клинико-анамнестических, лабораторных и эхоскопических данных, а также определение формы мастопатии у данной конкретной пациентки остается острым и в настоящее время. Эта проблема ежедневно возникает у многих специалистов (гинекологов, онкологов, врачей ультразвуковой диагностики). В связи с этим назрела необходимость создания и использования в практической медицине алгоритмов с целью получения диагностических коэффициентов, согласно современным требованиям доказательной медицины.
Для решения задач диагностики с помощью неоднородной последовательной процедуры распознавания были сформированы две группы обследованных женщин: обучающая (n = 130) и тестовая (n = 90). Для обучающей группы в ходе исследования были получены диагностические коэффициенты для каждого из возможных состояний — «болен», «здоров». Из всех эхографических признаков была построена последовательность, в которой признаки располагались в порядке убывания информативности.
Для каждой формы диффузной дисгормональной дисплазии молочных желез по диагностическим коэффициентам (ДК) с учетом информативности признаков были получены решающие правила. Качество распознавания с использованием диагностических таблиц проверялось на тестовой группе женщин. Полученные с помощью неоднородной последовательной процедуры распознавания диагнозы для женщин тестовой группы сопоставлялись с клиническими данными, затем определялось количество правильно и неправильно принятых решений. Анализ полученных результатов показал, что ошибка риска составляет от 0,3–0,7 при 95% доверительном интервале, а построенные диагностические таблицы позволяют получить дополнительную информацию для повышения качества диагностики и прогнозирования заболевания.
Эхоскопически при ДДДМЖ с преобладанием железистого компонента у пациенток отмечалось увеличение толщины слоя паренхимы желез до 20,9 [8,08; 14,5] мм, средняя или пониженная эхогенность железистого слоя, со слабой выраженностью или отсутствием явлений жировой инволюции; уменьшение толщины премаммарной клетчатки (средние значения [1,91; 11,4] мм) и ретромаммарного слоя (средние значения [2,64; 8,95] мм). Дуктэктазия встретилась лишь у 8% пациенток I группы. При проведении допплерографии нами выявлено увеличение количества сосудов и увеличение скоростей кровотока. Средние значения скоростей кровотока составили Vmax — 0,16 [0,15–0,17] м/с, Vmin — 0,06 [0,05–0,07] м/с, RI-0,6 [0,5–0,7], PI 1,13 [1,11–1,15]. На основании формулы определения вероятности наличия у пациентки ДДДМЖ с преобладанием железистого компонента с использованием неоднородной последовательной процедуры распознавания в модификации А. А. Генкина нами были получены диапазоны значений и диагностические коэффициенты признаков, характерных именно для железистой формы ДДДМЖ. Полученные решающие правила в виде диагностических таблиц для диагностики ДДДМЖ с преобладанием железистого компонента обеспечивают качество распознавания 94%.
При ДДМЖ с преобладанием кистозного компонента основным признаком, который был выявлен у всех пациенток данной группы, стало наличие кист, средние размеры которых составили 5 [4–7] мм. В большей части случаев кисты обнаружены в обеих железах (89%), у 11% женщин в одной из желез. Увеличение толщины железистого слоя было у 77% пациенток и составило 16 [14–18] мм, что достоверно ниже, чем при железистом варианте ДДДМЖ (r = 0,73; р < 0,05). Во II группе также отмечено наличие более выраженного перидуктального фиброза, а у 30% пациенток выявлено расширение млечных протоков. Анализ измеренных допплерографически показателей кровотока при ДДДМЖ с преобладанием кистозного компонента не выявил достоверных отличий от пациенток I группы. Нами были получены диапазоны значений и диагностические коэффициенты признаков, характерных для ДДМЖ с преобладанием кистозного компонента, при этом качество распознавания составило 87%.
Характерным признаком наличия у пациенток ДДДМЖ с преобладанием фиброзного компонента стало выявление увеличения толщины слоя фиброгландуляной ткани у всех пациенток до 15 [13–17] мм. Отмечено резкое повышение эхогенности железистой ткани, наличие перидуктального фиброза и фиброзирование связок Купера, а также увеличение количества жировых включений, увеличение толщины пре- и ретромаммарной клечатки, толщина которой в большинстве случаев соответствовала нормальным значениям для пациенток данной возрастной группы. Дуктэктазия выявлена нами у 67%, достоверно чаще, чем в двух других группах (r = 0,76; р < 0,05). Оценка показателей кровотока при ДДДМЖ с преобладанием фиброзного компонента не выявила достоверных отличий от других вариантов ДДДМЖ. Сравнительный анализ показал, что в III группе пациенток увеличение толщины железистой ткани значимо ниже, чем в I группе больных (r = 0,81; р < 0,05), и не отличается от толщины фиброгландулярного слоя пациенток II группы (r = 0,47; р > 0,05). Рассмотренный для диагностики алгоритм с использованием неоднородной последовательной процедуры распознавания конкретно для этой формы обеспечивает качество распознавания 84%.
Признаками наличия у пациенток смешанной формы ДДДМЖ наряду с увеличением толщины слоя фиброгландуляной ткани до 15 [13–17] мм, резким повышением эхогенности железистого слоя, наличием перидуктального фиброза и фиброзированием связок Купера, увеличением толщины пре- и ретромаммарной клечатки стало выявление разнокалиберных кист. В 71,4% случаев кисты обнаружены в обеих железах. Дуктэктазия выявлена нами у 50% пациенток, достоверно чаще, чем в двух других группах (r = 0,76; р < 0,05). Анализ показателей кровотока при данной форме не выявил достоверных отличий от других вариантов ДДДМЖ. При определении вероятности возникновения смешанной формы ДДДМЖ с использованием неоднородной последовательной процедуры распознавания нами также были получены диапазоны значений и диагностические коэффициенты признаков, характерных для смешанной формы ДДДМЖ. Отношение риска для данных значений составило 0,6 при 95% доверительном интервале.
Практическая значимость разработанной нами математической модели заключается в простой и объективной диагностике формы диффузной дисгормональной дисплазии молочных желез в любом возрасте с применением метода ультразвуковой диагностики и в объективной оценке эффективности проводимых лечебных мероприятий с позиции доказательной медицины (Патент № 2452389 «Способ дифференциальной диагностики форм фиброзно-кистозной болезни у женщин с сохраненной репродуктивной функцией» зарегистрирован 10.06.2012).
С применением разработанной нами математической модели в рамках целевой межведомственной научно-практической программы «Здоровье женщины» по профилактике рака молочных желез (СибГМУ, НИИ фармакологии РАМН) проведена оценка состояния молочных желез у пациенток с диффузной доброкачественной дисплазией молочных желез на фоне терапии алиментарного ожирения препаратом Редуксин. Клиническое исследование (фаза IV) являлось сравнительным, проспективным (параллельные группы), рандомизированным (метод «случай-контроль») и моноцентровым.
В исследование вошли 100 пациенток репродуктивного возраста от 26 до 42 лет (средний возраст 31,2 ± 1,5 года) с наличием ДДДМЖ на фоне алиментарного ожирения с индексом массы тела (ИМТ) 30 кг/м3 и более, которые были распределены в основную группу (n = 56) и группу сравнения (n = 44). Средний ИМТ в обеих группах составил 33 ± 0,5 кг/м куб. У пациенток основной группы медикаментозное лечение алиментарного ожирения проводилось препаратом Редуксин (МНН: сибутрамин и целлюлоза микрокристаллическая) в дозе 10 мг в сутки курсом 6 месяцев. Базовым препаратом для лечения патологии молочных желез являлся препарат Мастодинон (капли для приема внутрь) в суточной дозе 60 капель курсом 3 месяца и дальнейшим сроком наблюдения до 6 месяцев. Группа сравнения была сформирована из 38 пациенток, не получавших лечение ожирения, но принимающих препарат Мастодинон по известной схеме. Пациентки, принимавшие для терапии ожирения препарат Редуксин, были рандомизированы из участников российской наблюдательной программы «Прима-Вера», одобренной независимым междисциплинарным Комитетом по этической экспертизе клинических исследований (12.10.2012). В течение исследования рандомизированные пациентки основной группы и группы сравнения наносили врачу три плановых визита — до начала исследования (визит 0), в начале лечения (визит 1) и через 6 месяцев после начала лечения (визит 2). Контрольную группу составили 40 практически здоровых женщин, сопоставимых с основной группой по возрасту, без соматической и гинекологической патологии. У всех женщин было получено добровольное информированное согласие на участие в исследовании.
Полученные при объективном осмотре данные были автоматически обработаны с помощью разработанного и предлагаемого нами диагностического алгоритма. В табл. 1 представлена часть перечня признаков (ключевые эхографические показатели), значения каждого из них, диапазон, в который попадает признак, диагностический коэффициент, соответствующий данному диапазону.
При математической обработке полученных результатов сумма всех диагностических коэффициентов была равна 3,836121, что больше, чем пороговое значение, равное 0,97, то есть основная когорта обследуемых пациенток (n = 72) имела ДДДМЖ с преобладанием железистого компонента.
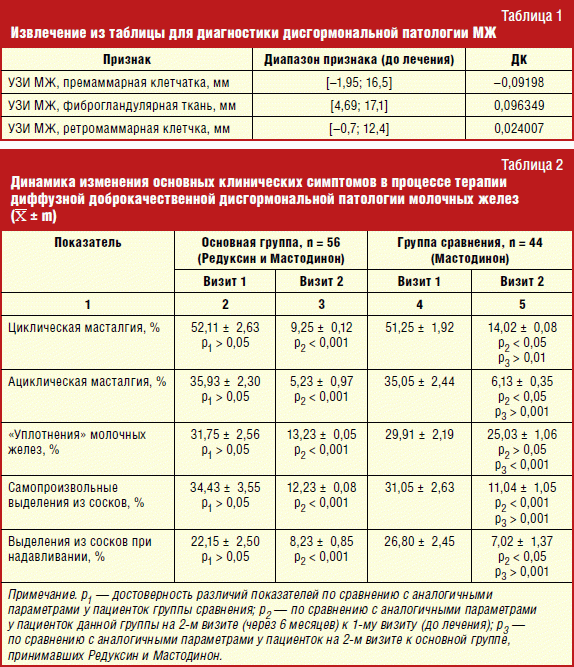
При систематизации многообразных клинических проявлений доброкачественной дисплазии молочных желез у обследованных пациенток выявлено, что основной жалобой являлась умеренно выраженная масталгия, носящая циклический характер. Исследуя эффективность совместной терапии патологии молочных желез и алиментарного ожирения, нами была также оценена динамика клинических проявлений заболевания в группах обследуемых (табл. 2).
Через 6 месяцев при контрольном обследовании собранные клинико-анамнестические, лабораторные данные и результаты ультразвукового сканирования молочных желез пациенток были в виде абсолютных значений признаков внесены в предлагаемый алгоритм с последующим пересчетом диагностических коэффициентов. После математической обработки полученных результатов выявилось, что основными значимыми объективными критериями оценки эффективности проводимой терапии явились ряд эхографических показателей (измерение толщины премаммарной клетчатки, толщины фиброгландулярного слоя и толщины ретромаммарной клетчатки).
При ультразвуковом исследовании молочных желез после 6 месяцев наблюдения полученные показатели в виде абсолютных значений признаков были внесены в предлагаемый алгоритм с последующим пересчетом диагностических коэффициентов, при этом сумма всех диагностических коэффициентов составила: –3,02376, что меньше, чем пороговое значение: –1,255272505.
При анализе полученных значений диапазона признака и диагностического критерия делаем вывод, что эхографические показатели состояния молочных желез через 6 месяцев после терапии препаратом Мастодинон вошли в диапазон нормальных значений. Оцениваемые показатели УЗИ молочных желез у пациенток, принимавших медикаментозную терапию алиментарного ожирения препаратом Редуксин совместно с базовым лечением ДДДМЖ препаратом Мастодинон, наиболее соответствовали показателям здоровых женщин контрольной группы (табл. 3).
Обсуждение результатов и выводы
На современном этапе использование принципов доказательной медицины при проведении комплексной и сравнительной оценки данных ультразвуковой картины у пациенток с диффузной дисгормональной дисплазией молочных желез позволяет сформулировать ведущий диагностический алгоритм и выработать диагностические коэффициенты для каждой конкретной формы заболевания. Полученные решающие правила в виде диагностических таблиц обеспечивают качество распознавания 87–94%, что позволяет для практического здравоохранения существенно ускорить и облегчить работу специалиста в качественной диагностике дисгормональной патологии молочных желез. На примере применения разработанной нами математической модели возможно максимально объективно проводить диагностику и оценку эффективности терапии дисгормональной патологии молочных желез (Патент № 2452389 «Способ дифференциальной диагностики форм фиброзно-кистозной болезни у женщин с сохраненной репродуктивной функцией» зарегистрирован 10.06.2012) [11].
Лекарственный препарат Мастодинон имеет доказанную высокую эффективность при терапии диффузной доброкачественной дисгормональной дисплазии молочных желез (N60.0 по МКБ-10). При этом значимыми критериями оценки эффективности являются не только клинические симптомы, но и определенные нами объективные эхографические показатели (толщина премаммарной клетчатки, толщина фиброгландулярного слоя и толщина ретромаммарной клетчатки).
Наши многолетние исследования подтвердили наличие у препарата Мастодинон дополнительных механизмов действия при дисгормональной патологии молочных желез, а именно: нормализацию функционального состояния вегетативной нервной системы; устранение надпочечниковой дисфункции за счет снижения в сыворотке крови уровней АКТГ и кортизола; нормализацию метаболизма эстрогенов за счет повышения продукции 2-гидроксиэстрона и улучшения соотношения 2-ОНЕ1/16αОНЕ1; повышение лимфоцитами продукции ИЛ-10, обладающего антипролиферативным действием за счет активации апоптоза, а также снижение продукции ФНО-α, стимулирующего пролиферативные процессы. Наличие комплекса патогенетически обоснованных механизмов действия у препарата Мастодинон позволяют использовать его не только как базовый препарат для лечения доброкачественной патологии молочных желез, но и с целью «прикрытия» молочной железы от нежелательных эффектов при назначении гормональных препаратов: комбинированных оральных контрац��птивов, менопаузальной гормональной терапии, препаратов для стимуляции овуляции или суперовуляции в рамках вспомогательных репродуктивных технологий, а также в эстетической и пластической хирургии молочных желез [12, 13].
Ожирение у женщин связано с повышенным (в сравнении со средним по популяции) риском развития доброкачественных и злокачественных заболеваний молочных желез за счет внегонадного синтеза эстрогенов в жировой ткани, местного усиления ароматазной активности и активации локального стероидогенеза, а также увеличения содержания рецепторов к эстрадиолу, повышения чувствительности клеток к действию эстрадиола, ускорения роста эпителиальных клеток и формирования функциональной гиперпролактинемии [14].
Наше исследование достоверно показало, что совместная комплексная терапия алиментарного ожирения (Е60.0 по МКБ-10) лекарственным препаратом Редуксин и дисгормональной патологии молочных желез препаратом Мастодинон является эффективной по оценке основных признаков клинической картины и данных эхографических характеристик заболевания, хорошо переносимой пациентками и безопасной. Средний ИМТ у пациенток после 6 месяцев применения Редуксина составил 26 ± 0,5 кг/м3.
Препарат Редуксин является единственным комплексным препаратом для медикаментозного лечения алиментарного ожирения с повышенным профилем безопасности, содержащим сибутрамин и микрокристаллическую целлюлозу. Сибутрамин является пролекарством и проявляет свое действие за счет метаболитов, ингибирующих обратный захват моноаминов серотонина, норадреналина и дофамина. Целлюлоза микрокристаллическая является энтеросорбентом, обладает сорбционными свойствами и неспецифическим дезинтоксикационным действием. На современном этапе препарат Редуксин является препаратом выбора не только для терапии ожирения, но и для полноценного формирования правильного пищевого поведения, что кратно увеличивает эффективность лечения и снижает рецидивы возврата избыточной массы тела.
Таким образом, сегодня мы имеем удобную для широкого применения в практическом здравоохранении математическую модель для ультразвуковой диагностики и объективной оценки эффективности терапии доброкачественной дисплазии молочных желез, что позволяет осуществляемую гинекологами раннюю профилактику рака молочных желез вывести на качественно новый уровень. Одной из схем терапии дисгормональной патологии молочных желез является предлагаемая нами совместная терапия ДДДМЖ и алиментарного ожирения.
Литература
- Радзинский В. Е. Молочные железы и гинекологические болезни. М., 2010. 302 с.
- Филиппов О. С. Доброкачественные заболевания молочных желез: руководство по диагностике и лечению. М.: Медпресс-информ, 2007. 54 с.
- Gynecol. Endocrinol. 2006. Dec. 15. Suppl. 6. P. 37–43.
- Цой Л. К. Лекарственная терапия диффузной мастопатии и ПМС // Эффективная фармакотерапия. Онкология, гематология и радиология. 2010. № 3. С. 2–7.
- Olawaiye A., Withiam-Leitch M., Danakas G. et al. Mastalgia: a review of management // J. Reprod. Med. 2005. № 12 (50). P. 933–939.
- Рожкова Н. И. Рентгенодиагностика заболеваний молочной железы / Под ред. А. С. Павлова. М.: Медицина, 1993. 227 с.
- Коновалова В. Н. Дискуссионные вопросы тактики ведения женщин с дисгормональными заболеваниями молочных желез // Эффективная фармакотерапия. Акушерство и гинекология. 2009. № 6. С. 6–12.
- Love S. M., Gelman R. S., Silen W. Fibrocystic disease of the breast: a nondisease // N. Engl. J. Med. 1982. № 307. P. 1010–1014.
- Власов В. В. Введение в доказательную медицину. М.: Медиа Сфера, 2001. 392 с.
- Гублер Е. В. Информатика в патологии, клинической медицине и педиатрии. СПб: Медицина, 2002. 176 с.
- Tonkikh O. S., Sotnikova L. S., Gerget O. M., ElAkad E. V., Okkel J. V. The implementation of guidelines for evidence diagnosis of benign mammary dysplasia/Sciense and Education: materials of the II international research and practice conference — Germany. 2012. Р. 474–480.
- Сотникова Л. С. и соавт. Состояние гормональной регуляции при фиброзно-кистозной мастопатии // Мать и дитя. 2011, № 1, с. 342–346.
- Сотникова Л. С., Сотников А. А., Удут Е. В., Тонких О. С. Возможности применения препарата мастодинон после эндопротезирования молочных желез // Вопросы реконструктивной и пластической хирургии. 2013. Т. 16, № 4, с. 38–44.
- Андреева Е. Н., Хамошина М. Б., Руднева О. Д. Пролактин и молочные железы: норма и патология // Гинекология. 2011. Т. 14, № 1, с. 34–38.
Л. С. Сотникова*, 1, доктор медицинских наук, профессор
О. С. Тонких**, кандидат медицинских наук
Е. В. Голубятникова***
* ФГБОУ ВО СибГМУ МЗ РФ, Томск
** ООО ЛДЦ «Международный институт биологических систем – Томск», Томск
*** ОГБУЗ ОЦ, Томск
1 Контактная информация: sotnikova-larisa@mail.ru
Купить номер с этой статьей в pdf