Лечение атопического дерматита (АтД) предс��авляет значительный вызов профессиональной компетенции врачей многих специальностей — дерматологов, аллергологов-иммунологов, терапевтов, педиатров и др. АтД — хроническое заболевание, начинающееся в раннем детском возрасте, нередко продолжающееся в течение всей жизни и характеризующееся стадийностью развития воспалительного процесса кожи. Это одно из наиболее распространенных заболеваний, встречающееся во всех странах, у лиц обоего пола и в разных возрастных группах. На основании представления о вариантах протекания кожного процесса при АтД сформулирован основной принцип его лечения — ступенчатость терапии: каждая ступень соответствует тяжести протекания заболевания и является дополнением к следующей [1]. Соблюдение этого принципа и патогенетически обоснованный характер лечения позволяют предотвратить обострения кожного процесса у больных с АтД, а также переход кожного процесса в более тяжелую стадию течения. Однако остается неясным, почему у некоторых пациентов с первоначальной легкой и средней степенью тяжести АтД, невзирая на адекватное лечение, высокий уровень комплаентности к нему и тщательно соблюдаемые рекомендации по профилактике, кожный процесс, тем не менее, прогрессирует.
В докладе «Организация оказания специализированной помощи по профилю «Дерматовенерология» в РФ в 2015 г.» на XVI съезде дерматовенерологов и косметологов в июне 2016 г. главный внештатный специалист по дерматовенерологии и косметологии Минздрава России академик РАН А. А. Кубанова привела следующие цифры: заболеваемость АтД среди взрослого населения РФ составляет 152,7 на 100 тысяч населения, при этом на постоянном диспансерном наблюдении находятся менее трети пациентов с АтД (32%). С профилактическими целями к врачам обращаются 41% больных, что с точки зрения современных тенденций в медицине абсолютно недостаточно. Министр здравоохранения РФ В. И. Скворцова в выступлении на медицинской смене молодежного форума «Территория смыслов» в августе 2016 г. подчеркнула, что медицина XXI века обязана быть, во-первых, персонализированной и предиктивной, т. е. учитывать особенности строения генома каждого человека, обуславливающие уникальный белковый спектр каждого организма; во-вторых, профилактической, т. е. предполагающей в первую очередь сопровождение здоровых людей, а не лечение больных. В-третьих, предполагается первоочередное развитие фармакогенетического направления, обеспечивающего индивидуализированный выбор препаратов и их доз для каждого больного внутри стандартных подходов, основанный на определении индивидуальной генетической предрасположенности.
Очевидно, что значение каждого из факторов мультифакториального патогенеза АтД может быть разным для каждого больного. Следовательно, патогенетически обоснованные системы лечения и профилактики, в соответствии с современными тенденциями в медицине, обязаны быть персонализированными и учитывать степень важности того или иного патогенетического фактора для каждого конкретного больного АтД. Таким образом, основой оптимального персонализированного лечебного подхода и индивидуальной системы профилактики обострений АтД, учитывающих основные патогенетические факторы заболевания, являются молекулярно-генетические исследования.
Среди определенных к настоящему времени групп «генов-кандидатов», определяющих развитие АтД, наибольший интерес представляют изменения нуклеотидной последовательности в генах белков цитокиновой сети, в частности в генах интерлейкинов-4, 10, 13 (ИЛ-4, ИЛ-10, ИЛ-13), приводящих к формированию предрасположенности к аллергическим заболеваниям, в том числе к АтД, путем взаимодействия со своими рецепторами на В-клетках и активации синтеза иммуноглобулина Е (IgE). ИЛ-4 является ключевым цитокином, необходимым для дифференцировки Т-хелперов второго типа (Th2) и продукции IgE. ИЛ-4 подавляет продукцию интерферона гамма и иммунный ответ по Th1-типу, способствует синтезу IgЕ. Кроме того, он стимулирует экспрессию сосудистых молекул адгезии, которые обеспечивают миграцию эозинофилов и моноцитов в очаг воспаления, т. е. клеточную инфильтрацию, характерную для развития поздней фазы атопической реакции. При наличии островоспалительных изменений в участках кожного поражения определялось повышение продукции ИЛ-4 [2]. ИЛ-13 функционально и структурно сходен с ИЛ-4 и опосредует ряд физиологических изменений (повышение уровня IgE, увеличение числа эозинофилов, тучных клеток и др.), которые происходят в тканях при аллергическом воспалении. ИЛ-13 принимает участие в дифференцировке Th0-лимфоцитов в Th2 в период развития эффективной фазы аллергического воспаления. ИЛ-13 тормозит продукцию провоспалительных медиаторов макрофагами и моноцитами, таких как простогландины, реактивные формы кислорода, оксид азота. Таким образом, определение сывороточных уровней ИЛ-4 и функционально и структурно сходного с ним ИЛ-13 у больных с различными иммунологическими вариантами АтД может способствовать пониманию их роли в патогенезе заболевания у каждого конкретного больного, в частности, при IgE-зависимом варианте течения АтД. Основной функцией иммунорегуляторного ИЛ-10 является защита ткани от повреждения при воспалении. ИЛ-10 подавляет секрецию цитокинов Т-хелперами 1-го типа, контролируя таким образом баланс Тh1/Тh2 и осуществляя регуляцию воспалительного ответа по принципу отрицательной обратной связи. ИЛ-10 индуцирует терминальную дифференцировку В-клеток в плазмоциты, обусловливая аллергическую реактивность организма [3]. У больных АтД с повышенным уровнем ИЛ-10 в коже отмечается ослабление противоинфекционной защиты вследствие снижения содержания антимикробных пептидов [4] и, следовательно, повышается риск развития инфекционных осложнений на коже больных АтД.
Продукция цитокинов кодируется генами, в которых часто определяются однонуклеотидные замены (single nucleotide polymorphism, SNP). Эти генетические вариации вносят важный вклад в индивидуальные особенности иммунного ответа и течение иммунозависимых заболеваний. Некоторые из известных SNP генов цитокинов располагаются в регуляторных участках генов и могут напрямую влиять на их транскрипционную активность и, как следствие, концентрацию данного цитокина в плазме крови [5, 6]. Показано, что полиморфизм в различных участках генов рецепторов для цитокинов оказывает влияние на продукцию соответствующего белка, что может обуславливать изменение действия цитокинов [7]. В ряде исследований, проведенных в различных популяциях, выявлено сцепление аллергических заболеваний с хромосомной областью 5q31–33 [8], в которой локализован кластер Th2, в том числе гены ИЛ-4 и ИЛ-13, участвующие в развитии IgE-опосредованного воспаления [9]. Выявлена ассоциация замен в промоторной области гена ИЛ-10 с развитием АтД у детей в Корее, что, возможно, обуславливает повышенную продукцию ИЛ-10 [10]. Однако сведения об исследованиях полиморфизмов генов ИЛ-4, ИЛ-10 и ИЛ-13 у пациентов с АтД в России недостаточны.
Таким образом, известно, что изменения нуклеотидной последовательности генов, кодирующих цитокины-регуляторы развития аллергического воспалительного процесса, приводят к нарушениям иммунных реакций и формированию предрасположенности к аллергическим заболеваниям, в частности АтД. Молекулярно-генетические исследования АтД последних лет значительно расширили знания о генетических факторах, обусловливающих наследственную предрасположенность к данному заболеванию, и позволили рассматривать АтД как патологию, обусловленную реализацией фенотипа, т. е. проявлением генотипа, опосредованного рядом внешнесредовых факторов. Значение цитокинов и, в частности, ИЛ-4, ИЛ-10, ИЛ-13 в развитии иммунного воспаления при АтД показано достаточно доказательно.
Очевидно, что способность оказывать влияние на факторы иммунопатогенеза АтД определяет эффективность метода лечения. Тенденция к ремиссии кожного процесса у больных АтД в летнее время и обострения заболевания в осенне-зимний период долгое время предопределяли климатотерапию как наиболее радикальный способ профилактики обострений кожного процесса, а также способствовали развитию фототерапии, начавшемуся с середины XX века. К настоящему времени стало известно, что фототерапия лучами УФ-спектра, применяемая для лечения больных со среднетяжелыми и тяжелыми формами течения АтД, способна оказывать нормализующее влияние на их иммунный статус. К настоящему времени установлено, что действие УФ-облучения на организм человека может быть разным — в зависимости от параметров примененного физического фактора. Проникающая способность того или иного вида излучения через кожу человека зависит от длины волны, что важно при назначении лечения кожных болезней, когда патологический процесс локализуется в различных слоях кожи. Так, например, средневолновые лучи (УФ-В) проникают через роговой слой и достигают шиповатого слоя эпидермиса, длинноволновые лучи (УФ-А) — сосочкового и сетчатого слоев дермы, а инфракрасные (ИК) лучи, проходя через эпидермис и дерму, достигают подкожной жировой клетчатки.
В настоящее время в дерматологии применяются следующие виды фототерапии:
1) фотохимиотерапия (ПУВА) — сочетанное применение длинноволнового УФ-облучения (УФ-А) с фотосенсибилизаторами;
2) селективная фототерапия (СФТ) — комбинация средневолнового излучения при длине волн 295–330 нм с длинноволновым УФ-облучением (УФА);
3) узковолновая УФ-В-фототерапия с максимумом эмиссии на длине волны 311 нм;
4) фототерапия с применением длинноволнового УФ-облучения узкого спектра (УФА-1) при длине волны 370 нм.
Научные достижения в фотоиммунологии и молекулярной биологии позволили объяснить механизм действия различных видов фототерапии при АтД. Наиболее эффективным методом признана фотохимиотерапия (ПУВА), однако именно у этого метода лечения отмечено наибольшее количество побочных явлений: пероральное применение фотосенсибилизаторов фурокумаринового ряда может сопровождаться тошнотой, эпигастральным дискомфортом, а при патологии пищеварительного тракта, которая часто сопровождает АтД, прием внутрь данных препаратов вообще противопоказан. Кроме того, применение УФ-А-облучения чревато риском развития катаракты, а также рака кожи.
Ряд исследований сообщают о воздействии длинноволнового и средневолнового облучения на программированную гибель клетки. Отмечено также, что длинноволновой спектр уменьшает воспаление кожи путем возможной модуляции лимфоцитов — «естественных киллеров» (NK), а также индуцирует выработку цитокинов, нейропептидов и простагландинов. Имеются данные о супрессивном действии средневолнового спектра на продукцию антигенов S. aureus, что значительно повышает эффективность терапии осложненного АтД после воздействия длинноволнового излучения [11].
Применение УФ-В-облучения (290–320 нм) является старейшим методом фототерапии. Благодаря использованию флуоресцентных и ртутных ламп, схемы с применением УФ-В-лучей оставались методами выбора на протяжении длительного времени. Показано, что УФ-В оказывает иммуносупрессивное действие, ингибируя презентацию антигена и индуцируя высвобождение иммуносупрессивных цитокинов. Данный вид фототерапии избирательно ингибирует Th1-иммунный ответ и даже способен изменять иммунные реакции в сторону Th2-типа. При длительно протекающем АтД наблюдается сдвиг в сторону Th1-реакций, и вызванная УФ-В-фототерапией иммуносупрессия оказывает положительное влияние; при этом длительно существующие на коже очаги поражения лучше отвечают на воздействие УФ-В, чем недавно появившиеся [12].
Большей эффективностью по сравнению с широкополосной УФ-В-терапией обладает комбинированная терапия УФ-А- и УФ-В-излучением. СФТ позволяет достичь клинического эффекта при лечении АтД без использования фотосенсибилизаторов. Более высокую терапевтическую эффективность имеет фототерапия УФ-В-лучами спектра 311 нм (узкополосная), которая по клиническим результатам сопоставима с ПУВА-терапией. В большей степени этот вид фототерапии исследован у больных псориазом; в частности, установлено, что положительный клинический эффект коррелирует с достоверным снижением изначально повышенных уровней провоспалительных и регуляторных цитокинов ИЛ-1, ФНО-альфа, ИЛ-2 и интерферона гамма и с повышением изначально сниженного уровня противовоспалительного цитокина ИЛ-4 [13]. Отмечено нормализующее действие узкополосной (311 нм) фототерапии на патологически трансформированные клеточные структуры эпидермиса и дермы, что подтверждает противовоспалительный эффект узкополосного спектра ультрафиолета на кожные покровы пациентов с АтД [14]. В исследовании Т. А. Горячевой (2009) на основании мониторинга морфологических изменений пораженной кожи у больных АтД установлено выраженное нормализующее влияние узкополосной (311 нм) средневолновой ультрафиолетовой терапии на патологически измененную структуру дермы и эпидермиса, включая количество тучных клеток, что также подтверждает противовоспалительное действие данного вида лечения на кожу больных АтД. При этом данный вид фототерапии более безопасен: среди наблюдаемых в ближайшие и отдаленные сроки (от полутора до четырех лет) 44 больных с тяжелым и среднетяжелым течением АтД ни у одного из них ни клинически, ни гистологически не было обнаружено какого-либо малигнизирующего или же деструктивного действия узкополосной средневолновой фототерапии [15].
По данным А. Г. Богадельниковой и соавт., в результате лечения СФТ спектра 311 нм достоверно снижался изначально повышенный уровень ИЛ-4, оставаясь, однако, выше нормы. Снижение уровня сывороточного цитокина ИЛ-4 коррелировало с улучшением кожного статуса [16]. Однако иммуномодулирующая активность этого вида фототерапии может отличаться в зависимости от возраста больных и, возможно, клинической картины и тяжести течения АтД. А. Н. Платонова (2010) в своей работе выявила влияние комплексной терапии с включением узкополосной средневолновой УФ-терапии с длиной волны 311 нм на динамику уровня противовоспалительных цитокинов у детей, страдающих АтД. В результате лечения было установлено снижение уровня ИЛ-13 в 1,5 раза по сравнению с исходными значениями, однако уровень ИЛ-4 как до, так и после лечения определялся в пределах нормы [17].
При изучении уровня в крови цитокинов у больных АтД в исследовании C. А. Монахова и соавт. (2012) было выявлено достоверное увеличение уровня ИЛ-4, что закономерно коррелировало с повышенным содержанием IgE, повышением иммунорегуляторного индекса (соотношение CD4/CD8) за счет увеличения содержания CD4-хелперов и снижения содержания СD8-цитотоксических Т-лимфоцитов, сдерживающих иммунный ответ на фоне снижения общего числа Т-лимфоцитов. Исследованные в динамике под влиянием СФТ 311 нм показатели клеточного и гуморального иммунитета и цитокинового статуса больных АтД свидетельствовали о том, что действие метода не ограничивается статистически значимым снижением изначально повышенного содержания ИЛ-4. Отмечено модулирующее влияние как на клеточное звено иммунитета (иммунорегуляторный индекс CD4/CD8 приближался к норме из-за снижения содержания Т-хелперов и повышения цитотоксических Т-лимфоцитов), так и на гуморальное (повышение содержания IgA, снижение IgM и IgE в сыворотке крови и их нормализация) [18].
Терапия, в которой применяются средние (30–40 Дж/см2) и низкие (5–20 Дж/см2) дозы ультрафиолетового излучения УФА-1-диапазона при длине волны 350–400 нм, признана действенным методом лечения пациентов с АтД тяжелого и среднетяжелого течения. В основе механизма действия УФА-1 лежат иммуномодулирующие, противовоспалительные и антифиброзные эффекты, которые опосредуются через индукцию апоптоза клеток кожи, модуляцию экспрессии клеточных рецепторов, регуляцию продукции цитокинов и других медиаторов межклеточного взаимодействия [19]. При обследовании 30 пациентов с АтД тяжелого и среднетяжелого течения благоприятный терапевтический результат отмечался более чем у 95% больных (28 человек): улучшение у 45,2%, клиническое выздоровление у 50%. Степень тяжести кожного процесса по SCORAD снижалась примерно в 4,3 раза, а продолжительность ремиссии по сравнению с исходными данными увеличивалась в 5,2 раза Таким образом, был сделан вывод, что назначение УФА-1-терапии больным с тяжелым и среднетяжелым течением АтД, получающим общепринятую терапию, повышает эффективность лечения. Установлено, что УФА-1-терапия приводит к существенному снижению содержания CD4+ лимфоцитов и интерферона-гамма в очагах поражения кожи, что свидетельствует о ее иммуносупрессивном действии [20].
G. von Kobyletzki и соавт. при лечении больных АтД средними дозами УФА-1-излучения наряду с улучшением клинической картины заболевания отметили значительное снижение в крови растворимых рецепторов ИЛ-2 и ИЛ-4, а также эозинофильного катионного белка, что является косвенным доказательством уменьшения активности эозинофилов и Т-хелперов [21]. N. Smit et al. и R. Musson et al. в своих исследованиях выявили, что облучение УФА-1-светом приводит к эффектам, наблюдаемым при воздействии ингибиторами кальциневрина, и способно снижать активность кальциневрина в различных клеточных культурах (клетках Т-лимфомы, фибробластах и кератиноцитах кожи, мононуклеарных клетках крови) [22, 23]. Кроме того, в клетках Т-лимфомы и мононуклеарных клетках крови авторами обнаружено уменьшение под действием данного вида облучения содержания ИЛ-4 и ИЛ-10, продукция которых контролируется путем Ca
Таким образом, установлено, что различные виды фототерапии влияют на иммунные показатели у больных АтД, в частности, на сывороточные уровни цитокинов, регулирующих развитие воспаления, и, следовательно, являются патогенетически обоснованными. Однако анализ большинства исследований показывает, что изолированное определение цитокинов как биомаркеров АтД имеет невысокую чувствительность и специфичность, зачастую полученные результаты носят противоречивый характер, следствием чего является необходимость расширения поиска прогностических факторов развития АтД и их комбинаций. Это определяет направление научного поиска в сторону комплексного изучения генетических механизмов АтД. Комплексный анализ сывороточных уровней регулирующих возникновение и развитие воспалительного процесса интерлейкинов и генетического полиморфизма в их генах даст возможность повысить эффективность диагностики и лечения АтД, выявлять факторы риска и строить систему своевременного прогнозирования развития АтД и вариантов его протекания персонализированно для каждого больного. Полученные знания также могут быть полезными при составлении плана лечения больных АтД с индивидуальным подбором фототерапии.
В патогенезе АтД также важное значение имеют изменения генов, кодирующих ферменты-детоксиканты (глутатион-S-трансферазы), которые участвуют в метаболизме ряда эндогенных веществ, реализуют воспалительные и аллергические реакции и, следовательно, играют исключительно важную роль в развитии генетически детерминированных (но в большой степени зависящих также от факторов внешней среды) заболеваний, к числу которых относится также и АтД. Установлено, что генетический полиморфизм глутатион-S-трансфераз влияет на формирование и течение «атопической триады»: АтД, бронхиальной астмы и аллергического ринита. На основании оценки полиморфизма генов глутатион-S-трансфераз определены генетические маркеры благоприятного и неблагоприятного прогноза АтД. Показано, что наличие определенных генотипов (или комбинаций мутантных генотипов) ферментов детоксикации ассоциированы с риском развития тяжелого течения АтД, диффузного поражения кожи и предрасполагают к частым обострениям и раннему появлению на коже пролиферативных изменений [25, 26]. Таким образом, очевидно, что определение полиморфизма генов глутатион-S-трансфераз может рекомендоваться для раннего определения прогноза клинического течения АтД, т. е. дает возможность на начальных этапах оценить риск развития тяжелых форм заболевания и разработать индивидуальную программу профилактики, исключив ряд неблагоприятных факторов: например, курение, в том числе пассивное, а также приняв меры по устранению пищевой аллергии.
Заключение
На сегодняшний день известно, что в патогенезе АтД важнейшая роль принадлежит наследственно обусловленным иммунным нарушениям и сочетанному действию факторов риска, которые при определенных условиях инициируют патологический процесс и влияют в дальнейшем на его течение. При этом роли известных патогенетических факторов у разных больных АтД неравнозначны, и стандартизованный подход к лечению зачастую приводит к его неэффективности.
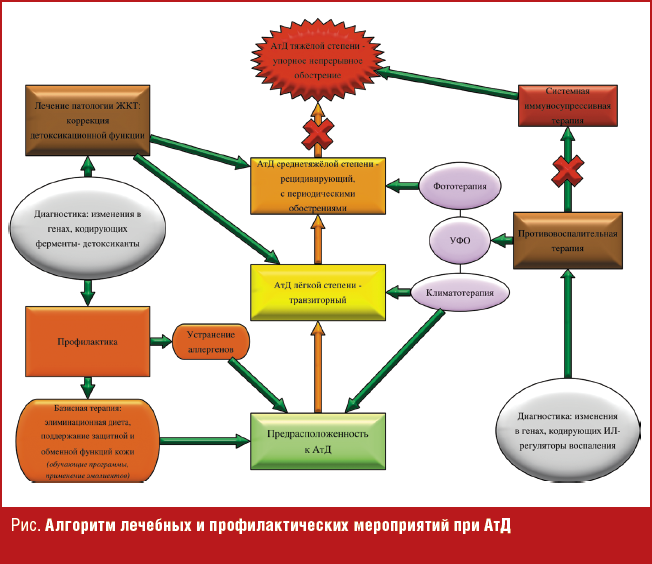
Молекулярно-генетические исследования АтД последних лет значительно расширили знания о генетических факторах, обусловливающих наследственную предрасположенность к данному заболеванию. Определены гены, полиморфные варианты которых ассоциированы с АтД, однако результаты исследований характеризуются значительной межпопуляционной вариабельностью, что и определяет дальнейшее направление научного поиска в сторону выявления комбинации прогностических факторов развития АтД. Это позволит выстроить план индивидуализированной системы лечения и профилактики обострений АтД, предотвратить переход заболевания в тяжелую степень протекания и избежать, таким образом, негативных побочных эффектов от необходимости назначения «therapia magna» — системной иммуносупрессивной терапии (рис.).
Литература
- Прошутинская Д. В., Чикин В. В., Знаменская Л. Ф. и др. Федеральные клинические рекомендации по ведению больных атопическим дерматитом. 2015. [Электронный ресус]. Режим доступа: http://www.cnikvi.ru/docs/clinic_recs/bolezni-kozhi-i-pridatkovkozhi/atopicheskiy_dermatit.
- Чебуркин А. А., Смолкин Ю. С. Профилактика атопического дерматита // Аллергология и иммунология в педиатрии. 2004. № 1. С. 59.
- Белова О. В., Арион В. Я., Сергиенко В. И. Роль цитокинов в иммунологической функции кожи // Иммунопатология, аллергология, инфектология. 2008. № 1. С. 41–55.
- Ong P. Y., Ohtake T., Brandt C. et al. Endogenous antimicrobial peptides and skin infections in atopic dermatitis // N. Engl. J. Med. 2002. Vol. 34. P. 1151–1160.
- Симбирцев А. С., Громова А. Ю., Рыдловская А. В. Роль полиморфизма генов цитокинов в регуляции воспаления и иммунитета // Медицинский академический журнал. 2006. Т. 6. № 1. С. 144–150.
- Ризванова Ф. Ф., Пикуза О. И., Файзуллина Р. А. и соавт. Генетическая диагностика: полиморфизм генов цитокинов // Практическая медицина. 2010. № 6 (45). С. 41–43.
- Бодиенкова Г. М., Титова Ж. В. Роль полиморфизма и экспрессии отдельных генов цитокинов в формировании патологии (обзор) // Advances in Current Natural sciences. 2015. № 1. P. 616–61.
- Barnes K. C. An update on the genetics of atopic dermatitis: scratching the surface in 2009 // J. Allergy Clin. Immunol. 2010. Vol. 125 (1). P. 16–29.
- Kiyohara C., Tanaka K., Miyake Y. Genetic susceptibility to atopic dermatitis // Allergol. Int. 2008. Vol. 57 (1). P. 39–56.
- Sohn M. H., Song J. S., Kim K. W. et al. Association of interleukin-10 gene promoter polymorphism in children with atopic dermatitis // J. Pediatr. 2007. Vol. 150 (1). P. 106–108.
- Yoshimura-Mishima M., Akamatsu H., Namura S., Horio T. // J. Dermatol. Ski. 1999. Vol. 19, № 1. P. 31–36.
- George S. A., Bilsland D. J., Johnson B. E., Ferguson J. Narrow-band (TL-01) UVB airconditioned phototherapy for chronic severe adult atopic dermatitis // Br J Dermatol. 1993. 128 (1): 49–56.
- Талыбова А. М. Ближайшие и отдаленные результаты фототерапии средневолновым ультрафиолетовым излучением 311 нм с учетом изучения иммунного статуса и морфофункционального состояния кожи больных псориазом. Автореф. дис. … к.м.н. М., 2011. С. 24.
- Алипов Н. В. Фототерапия при атопическом дерматите: современные возможности применения (обзор) // Дерматовенерология. 2014. С. 518–521.
- Горячева Т. А., Самсонов В. А., Надгериева О. В., Волнухин В. А. Клинические результаты узкополосной (311 нм) фототерапии больных атопическим дерматитом // Российский журнал кожных и венерических болезней. 2009. № 3. С. 22–25.
- Богадельникова А., Олисова О. Влияние селективной фототерапии узкого спектра 311 нм на некоторые показатели иммунного статуса у больных атопическим дерматитом // Врач. 2007. № 2. С. 63–64.
- Платонова А. Н. Узкополосное средневолновое УФ-излучение в комплексном лечении детей, больных атопическим дерматитом. Автореф. дис. … к.м.н. М., 2010. С. 24.
- Монахов С. А., Корчажкина Н. Б., Олисова О. Ю. Узковолновая фототерапия 311 нм в лечении больных атопическим дерматитом // Российский журнал кожных и венерических болезней. 2012. С. 25–27.
- Волнухин В. А., Самсонов В. А. УФА-1 терапия локализованной склеродермии и других заболеваний, сопровождающихся склерозом кожи // Вестник дерматологии и венерологии. 2013. № 5. С. 52–54.
- Авиденко И. Н., Кубанов А. А. Эффективность дальней длинноволновой ультрафиолетовой терапии у больных атопическим дерматитом. Вестник дерматологии и венерологии. 2009. № 3. С. 61–63.
- Von Kobyletzki G. et al. Circulating activation markers of severe atopic dermatitis following ultraviolet A1 cold light phototherapy: eosinophil cationic protein, soluble interleukin-2 receptor and soluble interleukin-4 receptor // Br J Dermatol. 1999; 140 (5): 966–968.
- Smit N., Musson R., Romijn F. et al. Effects of ultraviolet A-1 radiation on calcineurin activity and cytokine production in (skin) cell cultures // Photochem Photobiol. 2010; 86 (2): 360–366.
- Musson R. E., Mullenders L. H., Smit N. P. Effects of arsenite and UVA — 1 radiation on calcineurin signaling // Mutat Res. 2012; 735 (1–2): 32–38.
- Grewe M., Gyufko K., Krutmann J. Interleukin-10 production by cultured human keratinocytes: regulation by ultraviolet B and ultraviolet A1 radiation // J Invest Dermatol. 1995; 104 (1): 3–6.
- Беляева Л. М., Панулина Н. И., Микульчик Н. В. и соавт. Дифференциально-диагностические признаки изолированных и сочетанных форм атопических болезней у детей // Репродуктивное здоровье в Беларуси. 2010. № 5. С. 25–34.
- Ляпунова А. А. Полиморфизм генов глутатион-S-трансфераз М1 и Т1 у детей с атопическим дерматитом. Автореф. дис. … к.м.н. Новосибирск, 2004. 20 с.
И. В. Кошелева*, 1, доктор медицинских наук, профессор
Л. И. Шадыжева*
А. Р. Хасанова*
Н. А. Кливитская**, кандидат медицинских наук
* ФГБОУ ДПО РМАПО МЗ РФ, Москва
** ФГАОУ ВО РУДН, Москва
1 Контактная информация: koshelevaiv@rmapo.ru
Купить номер с этой статьей в pdf