Прогрессирование тубуло-интерстициальных болезней почек (ТИБП) у детей с формированием хронической болезни почек (ХБП), терминальной хронической почечной недостаточности (тХПН), требующей проведения заместительной терапии, а в последующем трансплантации почек, является одной из актуальных проблем нефрологии [1–3].
Тубуло-интерстициальное поражение почек (ТИПП) — это воспалительное (бактериальное и абактериальное) и невоспалительное повреждение интерстициальной ткани почек с расположенными в ней сосудами (артериальными и венозными), лимфатическими протоками, нервными окончаниями, а также чашечно-лоханочной системы врожденного, наследственного или приобретенного генеза с исходом в нарастание необратимых морфологических изменений (интерстициальный фиброз) параллельно со снижением функциональных возможностей почек, формированием ХБП [4].
К факторам инициации и прогрессирования ТИПП относят и ренальную инфекцию [5]. Факторами риска развития ТИПП при ренальной инфекции являются: высокие степени (III–V степени) пузырно-мочеточникового рефлюкса (ПМР), двусторонний ПМР, интраренальный рефлюкс, сочетание с обструкцией, частые рецидивы ренальной инфекции, поздняя ее диагностика, невыполнение назначений врача, генетические факторы (DD-фенотип гена ангиотензинпревращающего фермента) [6, 7]. Доказательствами роли ренальной инфекции в прогрессировании ТИБП являются: у 85–100% детей с рефлюкс-нефропатией (РН) имеет место ренальная инфекция; ТИПП наблюдается у 25% детей с рецидивирующим течением ренальной инфекции; частота ТИПП коррелирует со степенью ПМР, ТИПП более типичен для ПМР на фоне ренальной инфекции, чем для «стерильного» рефлюкса; ТИПП может быть смоделировано созданием ПМР и его инфицированием [8–11]. Установлена зависимость прогрессирования ТИПП от ПМР: чем меньше степень ПМР, тем большее значение имеет ренальная инфекция в прогрессировании ТИБП [12, 13]. Р. А. Жетищев, проведя прижизненные морфологические исследования ткани почек больных с РН, установил, что у 15% обследованных детей с ренальной инфекцией на фоне ПМР развивается ТИПП [14].
Повреждение почечной паренхимы наиболее часто отмечается при инфицировании интраренального рефлюкса [15, 16]. Ренальная инфекция является одним из основных факторов, приводящих к инфильтрации почечного интерстиция воспалительными клетками с последующей выработкой ими медиаторов воспаления и фиброгенеза [17].
Установлено, что при ПМР высокой степени происходит нарушение внутрипочечной гемодинамики путем снижения артериального кровотока вследствие повышения внутрилоханочного и внутриканальцевого давления [18]. Таким образом, у больных с нарушениями уродинамики возникает не только микробно-воспалительное поражение почек, но и нарушение внутриорганной гемодинамики, приводящее к формированию стойкой ишемии почки с активацией ренин-ангиотензин-альдостероновой системы (РААС), что способствует развитию артериальной гипертензии ренального генеза. Установлено, что ангиотензин II, продукт активации РААС, является медиатором оксидативного стресса, стимулирует высвобождение просклеротических цитокинов и факторов роста, стимулирует активацию фибробластов [19]. Доказано, что ангиотензин II участвует в процессе фиброгенеза, вызывая фенотипические изменения фибробластов, превращая их в миофибробласты (α-гладкомышечные актинозитивные клетки) [20, 21]. В экспериментальной модели при длительном введении ангиотензина II крысам у них развивалась атрофия и дилатация канальцев, инфильтрация ткани моноцитами и фиброз интерстиция с отложением в нем коллагена IV типа [22, 23]. Культуры фибробластов почечного интерстиция также имеют рецепторы к ангиотензину II, поэтому после его введения происходит ускорение клеточной пролиферации, экспрессия и синтез белков внеклеточного матрикса, таких как фибронектин, а также ТФР-β [24]. При этом присутствие миофибробластов в тубуло-интерстициальной ткани почки тесно коррелирует с распространенностью интерстициального фиброза и состоянием почечных функций [25].
Таким образом, замыкается патологический механизм прогрессирования ТИБП, состоящий из оксидативного стресса, воспаления и эндотелиальной дисфункции [26]. Установлено, что у детей с часто рецидивирующим течением ренальной инфекции увеличивается продукция медиаторов воспаления с развитием ТИПП [27]. Этот факт способствует развитию более выраженных как морфологических, так и функциональных тубулоинтерстициальных изменений почек [28, —30]. Каждое последующее обострение ренальной инфекции расширяет зону ТИПП, способствуя процессам фиброгенеза [31].
Изучение вопросов участия ренальной инфекции в прогрессировании ХБП, ее профилактики является перспективным направлением нефрологии детского возраста [32, 33].
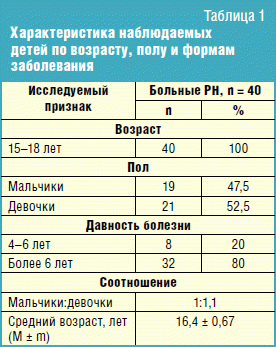

Цель исследования — оценить эффективность профилактики прогрессирования ХБП у подростков с ренальной инфекцией.
Проведено сопоставление комплекса клинических и параклинических данных 40 детей в возрасте от 15 до 18 лет с РН (n = 40) с ренальной инфекцией на разных стадиях ТИПП (табл. 1).
Критерии включения больных в исследование:
- добровольное информированное согласие родителей ребенка на участие в клиническом исследовании;
- возраст пациентов от 15 года до 18 лет включительно;
- наличие верифицированного диагноза РН по международным критериям.
Критерии исключения больных из исследования:
- отказ родителей от участия в клиническом исследовании;
- двусторонняя РН.
В результате проведенного обследования были выделены следующие группы клинического наблюдения согласно классификации J. M. Smellie [34]:
1) дети с рефлюкс-нефропатией А (n = 10);
2) дети с рефлюкс-нефропатией В (n = 10);
3) дети с рефлюкс-нефропатией С (n = 10);
4) дети с рефлюкс-нефропатией D (n = 10).
Клинико-параклиническое обследование детей проводилось в ГАУЗ ГКБ № 6 г. Оренбурга.
Нефросцинтиграфия, позволившая верифицировать степени РН, проводилась на базе отделений радиоизотопной диагностики ГБУЗ ОрОКБ.
Всем детям проведены специальные микробиологические исследования мочи, включающие определение степени бактериурии секторным посевом на кровяной агар и среду Эндо. Видовую идентификацию выделенной урофлоры осуществляли общепринятыми методами. У изолированных штаммов микроорганизмов определяли чувствительность к антимикробным препаратам.
Всем детям проведена оценка функционального состояния почек по пробам Реберга с поправкой по формуле Шварца, Зимницкого, суточной экскреции с мочой титруемых кислот, аммиака.
Профилактика прогрессирования ХБП у подростков с ренальной инфекцией включала в себя последовательное использование уросептиков, фитопрепарата Фитолизин в дозе 1 чайная ложка 3 раза в день 4 недели параллельно с назначением ингибитора ангиотензинпревращающего фермента (иАПФ) эналаприла в дозе 1 мг/кг/24 ч в 2 приема. Пациенты наблюдались проспективно 1 год.
Статистическая обработка материала произведена путем вычисления средней арифметической (М), ошибки средней (m) с помощью биометрических методов анализа, коэффициента Стьюдента (t) с последующим нахождением уровня достоверности различий (р) по таблицам. Достоверным считали различие при р < 0,05. Оценка эффективности профилактики прогрессирования ХБП проведена с помощью принципов доказательной медицины с оценкой снижения абсолютного риска (САР), снижения относительного риска (СОР); числа больных, нуждающихся в лечении (ЧБНЛ); частоты исходов в контрольной группе (ЧИК), частоты исходов в группе лечения (ЧИЛ).
Результаты исследования
Проведена оценка эффективности медикаментозной профилактики ХБП у подростков с ренальной инфекцией на разных стадиях ТИПП. Критериями эффективности профилактики ХБП были приняты: частота обострений ренальной инфекции и их длительность, функциональное состояние почек по скорости клубочковой фильтрации (СКФ). Определение показателей, заявленных как критерии эффективности, проводилось нами в динамике одного года.
Проведя анализ частоты обострений ренальной инфекции после терапии уросептиками и Фитолизином в динамике одного года, установлено снижение частоты обострений ренальной инфекции у пациентов начальных стадий ТИПП: РН А 1,71 ± 0,55, РН В 2,33 ± 0,24 раз в год (p < 0,05) (табл. 2). Нами не установлено достоверных различий показателей частоты обострений ренальной инфекции у пациентов с РН С 3,27 ± 0,29 и РН D 3,35 ± 0,44 (p > 0,05).
Проведя анализ длительности обострений ренальной инфекции после получения профилактической терапии уросептиками и Фитолизином в течение одного года, установлено снижение длительности обострений ренальной инфекции у пациентов начальных стадий РН: РН А до 9,27 ± 1,96, РН В до 9,33 ± 1,27 дня (p < 0,05) (табл. 2). Нами не установлено достоверных различий показателей длительности обострений ренальной инфекции у пациентов с РН С 12,49 ± 2,92 и РН D 12,62 ± 2,67 дня (p > 0,05).
Эффективность профилактики прогрессирования ХБП подтверждена методами доказательной медицины с определением снижения относительного риска (СОР), снижения абсолютного риска (САР), числа больных, нуждающихся в лечении (ЧБНЛ) (табл. 3).
Проведено определение СКФ у пациентов с РН на разных стадиях ТИПП после терапии иАПФ в динамике одного года.
Установлено увеличение СКФ у пациентов с РН А до 103,2 ± 1,22 мл/мин/1,73 м2, с РН В до 100,1 ± 0,36 мл/мин/1,73 м2 (р < 0,05) на фоне терапии иАПФ в течение одного года. Таким образом, у детей с РН В, соответствовавшей I стадии ХБП, произошло ее купирование на фоне нефропротективной терапии иАПФ в течение одного года.
Нами не установлено достоверного увеличения (р > 0,05) СКФ у детей с РН С (89,8 ± 0,62 мл/мин/1,73 м2), РН D (63,1 ± 1,25 мл/мин/1,73 м2) на фоне терапии иАПФ в течение одного года (рис.).
Эффективность профилактики прогрессирования ХБП иАПФ подтверждена методами доказательной медицины с определением СОР, САР; ЧБНЛ, частоты исходов в контрольной группе (ЧИК), частоты исходов в группе лечения (ЧИЛ) (табл. 4).
Обсуждение
Основными критериями оценки эффективности профилактики прогрессирования ХБП у подростков с ренальной инфекцией являются снижение частоты и длительности ее рецидивов на 27%, увеличение на 4% СКФ, подтверждающих обратимость I стадии ХБП у пациентов с ТИПП.
Отсутствие эффекта от профилактики прогрессирования ХБП на II стадии (С 2) доказывает необратимое прогрессирующее снижение функциональных возможностей почек у подростков с ренальной инфекцией, что подтверждает необходимость профилактики ХБП.
Проведенная оценка эффективности профилактики ХБП у детей обосновывает использование данных групп лекарственных препаратов для профилактики прогрессирования нефросклероза у пациентов с ренальной инфекцией.
Литература
- Игнатова М. С. Проблемы прогрессирования болезней почек у детей и современные возможности ренопротекции // Нефрология и диализ. 2005. Т. 4, № 7. С. 428–434.
- Center for Disease Control and Prevention: CDC Growth Charts: U.S. http://www.cdc.gov/nchs/about/maior/nhanes/growthcharts/background.htm (2008).
- Definition and classification of chronic kidney disease: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO) // Kidney International. 2005. Vol. 67. P. 2089–2100.
- Вялкова А. А. Актуальные проблемы тубулоинтерстициального поражения почек у детей // Педиатрия. 2008. Т. 87, № 3. С. 122–127.
- Вялкова А. А., Гриценко В. А. Современные представления об этиологии, патогенезе и ранней диагностике микробно-воспалительных заболеваний органов мочевой системы у детей / Материалы III Конгресса педиатров-нефрологов России. СПб, 2003. С. 21–31.
- Маковецкая Г. А., Гасилина Е. С., Борисова О. В. Функциональный портрет почки при тубулоинтерстициальных поражениях у детей // Нефрология. 2003. № 2. С. 55–61.
- Lorz C., Justo P., Subira D. et al. Paracetamol-induced renal tubular injury: a role for ER stress // J Am Soc Nephrol. 2004. V. 15 (2). P. 380–389.
- Лопаткин Н. А. (ред.) Урология: нац. руководство. М.: ГЭОТАР-Медиа, 2009.
- Пекарева H. A., Пантелеева Е. Ю., Лоскутова С. А., Чупрова A. B. Особенности течения и диагностики пузырно-мочеточникового рефлюкса у детей // Педиатрия. 2008. № 3. С. 31–36.
- Edwin A. S. Pyelonephritis, renal scarring, and reflux nephropathy: a pediatric urologist’s perspective // Pediatr Radiol. 2008. Vol. 38. P. 76–82.
- Jose M. P. S., Jose S. S. D., Eleonora M. L. et al. Independent risk factors for renal damage in a series of primary vesicoureteral reflux: A multivariate analysis. // Nephrology. 2009. Vol. 14 (2). P. 198–204.
- Soylu A., Demir B. K., Ttrkmen M. et al. Predictors of renal scar in children with urinary infection and vesicoureteral reflux // Pediatr Nephrol. 2008. Vol. 23 (12). P. 2227–2232.
- Chertin B., Natsheh A., Fridmans A. et al. Renal scarring and urinary tract infection after endoscopic correction of vesicoureteral reflux // J. Urol. 2009. Vol. 182 (4). P. 1706–1707.
- Жетищев Р. А., Мамбетова А. М. Диспластические фенотипы у больных с врожденными аномалиями органов мочевой системы / Материалы I Международного Конгресса по перинатальной медицине, посв. 85-летию академика РАМН В. А. Таболина. Москва, 16–18 июня. 2011. С. 81.
- Бухарин О. В., Вялкова А. А., Гриценко В. А. Клинико-микробиологическое обоснование ранней диагностики пиелонефрита у детей // Российский педиатрический журнал. 2003. № 2. С. 42–47.
- Hagerty J., Maizels M., Kirsch A. et al. Treatment of occult reflux lowers the incidence rate of pediatric febrile urinary tract infection // J. Urol. 2008. Vol. 72 (1). P. 72–78.
- Вялкова А. А., Гриценко В. А. Современные представления об этиологии, патогенезе и ранней диагностике микробно-воспалительных заболеваний органов мочевой системы у детей / Материалы III Конгресса педиатров-нефрологов России. СПб, 2003. С. 21–31.
- Haberlik A. Detection of low-grade vesicoureteral reflux in children by color Doppler imaging mode // Pediatr. Surg. Int. 1997. V. 12 (1). P. 38–43.
- Карабаева, А. Ж., Каюков И. Г., Есаян A. M., Смирнов А. В. Ренин-ангиотензин-альдостероновая система при хронической болезни почек // Нефрология. 2006. Т. 10, № 4. С. 43–48.
- Mezzano S. A., Ruiz-Ortega M., Egido J. Angiotensin II and renal fibrosis // Hypertension. 2001. Vol. 38. № 3. P. 635–638.
- Sun Y., Zhang J., Zhang J. Q., Ramires F. J. A. Local angiotensin II and transforming growth factor-β in renal fibrosis of rats // Hypertension. 2000. V. 35. P. 1078–1082.
- Ninichuk V., Kulkarni O., Clauss S. Tubular atrophy, interstitial fibrosis and inflammation in type 2 diabetic db/db mice. An accelerated model of advanced diabetic nephropathy // European journal of medical research. 2007. Vol. 12 (8). P. 351–355.
- Powell D. W., Bertram C. C., Cummins T. D. Renal tubulointerstitial fibrosis in OVE26 diabetic mice // Nephron Exp Nephrol. 2009; 111: e1 l-el9.
- Zeisberg M., Strutz F., Muller G. A. Role of fibroblast activation in inducing interstitial fibrosis // Nephrol. 2000. 13 [Suppl 3]. P. 111–120.
- Gabbiani G. Thie myofibroblast in wound healing and fibrocontractive diseases // J. Pathol. 2003; 200. P. 500–503.
- Гусев Е. Ю., Черешнев В. А., Юрченко Л. Н. Системное воспаление с позиции теории типового патологического процесса // Цитокины и воспаление. 2007. № 4. С. 9–21.
- Паунова С. С., Кучеренко А. Г., Смирнов И. Е., Ольхова Е. Б., Цукерман Л. И., Хворостов И. Н. Факторы роста при рефлюкс-нефропатии у детей // Вопросы современной педиатрии. 2004. Т. 3, № 2. С. 85.
- Hansson S., Dhamey M., Sigstrom O. et al. Dimercapto-succinic acid scintigraphy instead of voiding cystourethrography for infants with urinary tract infection // J Urol. 2004. Vol. 172. P. 1071.
- Moghazi S., Jones E., Schroepple J. et al. Correlation of renal histopathology with sonographic findings // Kidney Int. 2005. Vol. 67. P. l 515-15-20.
- Паунова С. С. Рефлюкс-нефропатии. В кн.: Детская нефрология. Руководство для врачей. 3-е издание / Под ред. М. С. Игнатовой. М.: МИА. 2011. С. 502–511.
- Brezniceanu M. L., Liu F., Wei C. C. Attenuation of interstitial fibrosis and tubular apoptosis in db/db transgenic mice overexpressing catalase in renal proximal tubular cells // Diabetes. 2008; 57. P. 451–459.
- Eriksen B. O., Ingebretsen O. C. The progression of chronic kidney disease: a 10-year population-based study of the effects of gender and age // Kidney Int. 2006. Vol. 69. P. 375–382.
- Guan Y. Nuclear receptors link gender dismorphism of renal disease progression // Kidney Inter. 2006. Vol. 70. P. 1889–1890.
- Smellie J. M., Ransley P. G. Development of new renal scars: a collaborative study // BJM. 1985. V. 290. P. 1457–1460.
И. В. Зорин1, доктор медицинских наук, профессор
А. А. Вялкова, доктор медицинских наук, профессор
ФГБОУ ВПО ОрГМУ МЗ РФ, Оренбург
1 Контактная информация: zorin2000@yandex.ru
Купить номер с этой статьей в pdf