Достаточный уровень биосинтеза коллагена является одним из важнейших показателей нормофизиологического метаболизма соединительной ткани. Фундаментальные и клинические исследования показали, что уровни кальция во внеклеточной среде стимулируют синтез/секрецию коллагена клетками внеклеточного матрикса соединительной ткани.
В эксперименте недостаточное потребление кальция негативно сказывается на состоянии биосинтеза коллагена в костной ткани [1]. Известно, в частности, что так называемые «блокаторы кальциевых каналов» ингибируют синтез коллагена I типа и его секрецию фибробластами, а аскорбат-анион противодействует эффектам блокаторов кальция [2] (рис. 1). Исследования с использованием изотопных меток показали, что блокаторы кальциевых каналов снижают преимущественно биосинтез коллагена, а не биосинтез неколлагеновых белков соединительной ткани [3].
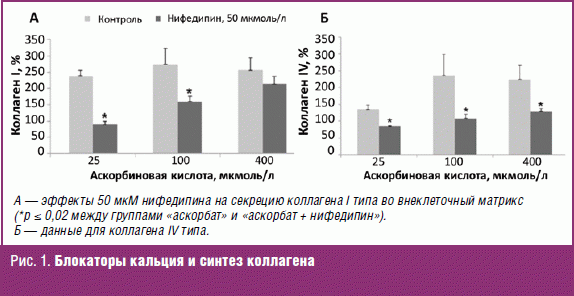
Показано также, что использование препаратов кальция стимулирует синтез коллагена, ускоряя заживление ран и переломов. Например, альгинат кальция улучшает заживление ран в эксперименте, повышая синтез коллагена I типа и соотношение количеств фибриллярного коллагена I типа и ретикулярного коллагена III типа. Скорость закрытия раны при использовании альгината увеличивалась по сравнению с контрольной группой [4].
В проведенном нами экспериментальном исследовании были изучены эффекты синергидной комбинации кальция с цинком, медью, марганцем, бором, магнием и витамином D (препарат Кальцемин Адванс) на модели резаной раны. Введение препарата в виде водной суспензии в течение 21 сут приводило к снижению среднего времени до полного заживления раны на 6 сут по сравнению с контролем (вода, p < 0,05). При этом средняя площадь раны достоверно отличалась между группами уже начиная с 9-го дня эксперимента (значения р в интервале 0,00013–0,047) [5].
Повышенная скорость заживления раны при приеме синергидной комбинации кальция сопровождалась повышением содержания волокон коллагена I типа в области раны (рис. 2А). В контрольной группе процент окрашивания коллагена составил 62 ± 11%, а при приеме Кальцемин Адванс — 82 ± 8% (т. е. на 20% выше по сравнению с контролем, р = 0,00056) [5]. Гистоморфологический анализ подтвердил ускорение процесса созревания рубцовой ткани и указал на снижение воспалительной реакции в созревающей соединительной ткани и улучшение эпителизации раны. В контрольной группе кожный дефект замещен рыхло-волокнистой соединительной тканью. В опытной группе (Кальцемин Адванс) практически во всех наблюдениях в зоне кожной раны сформировалась зрелая соединительная (рубцовая) ткань из мономорфных ориентированных коллагеновых волокон и лишь в одном наблюдении кожный дефект был замещен рыхло-волокнистой соединительной тканью (рис. 2Б, В) [5].
Описываемый эффект воздействия кальция на уровни коллагена был также подтвержден в клинических исследованиях. Например, дотации препаратов кальция (1200 мг/сут, 2 мес) женщинам в постменопаузе с низким потреблением кальция снижали коллагеновые маркеры деградации — гидроксипролин, пиридинолин, дезоксипиридинолин [6].
Таким образом, экспериментальные и клинические исследования показывают, что препараты кальция стимулируют синтез/секрецию коллагена. В настоящей работе представлены результаты системно-биологического анализа белков протеома человека, проведенного с целью установления наиболее вероятных молекулярных механизмов осуществления данного эффекта воздействия кальция на метаболизм коллагена.
Материалы и методы исследования
В настоящей работе использован метод анализа функциональных взаимосвязей [7] — одна из информационных технологий современной биоинформатики. Соединяя данные различных уровней (данные о моногенных заболеваниях, биохимические данные о кофакторах белков, данные о клеточных ролях белков, симптоматику и критерии диагностики заболеваний и т. д.), данный метод позволяет систематически рассмотреть все возможные области применения препаратов кальция. В целом при использовании метода анализа функциональных взаимосвязей для каждого белка протеома человека составляется последовательная цепь описаний:
- аминокислотная последовательность белка;
- список биохимически необходимых эссенциальных кофакторов белка (в т. ч. с указанием потребности ионов кальция для активности рассматриваемого белка);
- список моногенных заболеваний, связанных с полной или частичной потерей активности этого белка;
- список клеточных функций белка (по БД Gene Ontology, GO и др.);
- список отдельных симптомов заболеваний, список диагнозов по МКБ-10 и другая информация из баз данных.
Далее в полученном списке описаний белков выделяются Са-зависимые белки и проводятся последующие анализы их функций на основании статистических критериев. Для статистической обработки результатов исследования использовались методы математической статистики, включающие расчет числовых характеристик случайных величин, проверки статистических гипотез с использованием параметрических и непараметрических критериев, корреляционного и дисперсионного анализа. Сравнение прогнозируемых и наблюдаемых частот встречаемости исследуемых признаков проводилось с помощью критерия χ-квадрат, T-критерия Вилкоксона–Манна–Уитни и теста Стьюдента. Для статистической обработки материала использовались прикладная программа Statistica 6.0 и электронные таблицы Microsoft Excel.
Результаты исследования
В ходе исследования была проанализирована информация по 23 500 белкам протеома человека, для которых установлены биологические роли. Из 23 500 белков функции 2145 белков в той или иной мере зависят от уровней кальция (например, изменяются уровни экспрессии белка), а 625 из 2145 белков непосредственно связывают ион кальция как кофактор [8]. В целом ионы кальция необходимы для функционирования многочисленных мембранных белков (как правило, белков-рецепторов) и внутриядерных белков (белки транскрипции и метаболизма ДНК). Также ионы кальция принимают значительное участие в процессах межклеточной адгезии и формирования структуры соединительной ткани, регуляции клеточного апоптоза и воспаления, синаптической трансмиссии и роста аксонов (рис. 3).
Результаты проведенного системно-биологического анализа кальций-зависимых белков [8] указали на диагнозы по МКБ-10, специфически ассоциированные с генетическими дефектами в кальций-зависимых белках. Результаты показали, что наиболее кальций-специфичными группами патологий являются нарушения гемостаза и состава крови, пороки развития различных органов, нарушения функции щитовидной и паращитовидной железы и патологии соединительной ткани. Для целей настоящего исследования интересно отметить, что многие из этих диагнозов были ассоциированы с нарушениями структуры соединительной ткани, в т. ч. коллагеновых сетей соединительной ткани (табл. 1).
В целом перечисленные в табл. 1 диагнозы, ассоциированные с нарушениями структуры соединительной ткани и коллагена, зависят от нарушений активности более 58 Са-зависимых белков. Для уточнения молекулярных механизмов воздействия кальция на метаболизм коллагена рассмотрим молекулярные механизмы биосинтеза коллагена и затем оценим соответствия между результатами системно-биологического анализа Са-зависимых белков и этими механизмами.
Молекулярные механизмы биосинтеза коллагена
Коллагеновые фибриллы являются механической основой соединительной ткани всех органов и в частности кости. Коллаген I типа образует наиважнейший компонент коллагеновой сети — протяженные фибриллы. В костях фибриллы коллагена минерализуются гидроксиапатитом кальция и связывают ион кальция аминокислотными остатками № 1277…1285 [9]. В костной ткани фибриллы коллагена взаимодействуют с ионами кальция на поверхности кристаллов гидроксиапатита [10] (рис. 4).
Однако взаимодействия между кальцием и коллагеном вовсе не ограничены непосредственными взаимодействиями между гидроксиапатитом и коллагеновыми фибриллами в костной ткани. Например, взаимодействия между клетками, синтезирующими коллаген, и самими коллагеновыми молекулами зависят от активности магний-зависимого и инозитол-зависимого фермента фосфатидилинозитол-3-киназы (PI3K), который участвует в регуляции уровней внутриклеточного Ca2+ [11]. Рассмотрим и другие потенциальные возможности участия препаратов кальция в процессе биосинтеза коллагена, основные стадии которого представлены на рис. 5.
Осуществляемый фибробластами или другими типами клеток соединительной ткани биосинтез коллагена включает в себя следующие стадии [12]:
- синтез мРНК (транскрипция генов, кодирующих коллагены, 34 гена) — участвуют десятки магний- и кальций-зависимых белков;
- синтез аминокислотной цепи препроколлагена на рибосоме из мРНК (трансляция) поддерживается магний- и кальций-зависимыми белками, магний-зависимыми тРНК и рибосомной РНК;
- транспорт цепи препроколлагена в эндоплазматический ретикулум посредством «адреса» (сигнального пептида) на N-концевом участке аминокислотной цепи;
- удаление сигнального пептида в последовательности препроколлагена посредством фермента пептидазы сигнальных пептидов SPP (нет кофакторов);
- гидроксилирование аминокислотных остатков пролина и лизина в препроколлагене с участием ферментов пролил-3-гидроксилазы, пролил-4-гидроксилазы и лизил-гидроксилаз 1, 2, 3. Все перечисленные ферменты требуют Fe2+ и аскорбат анион в качестве кофакторов, O2 в качестве субстрата. Гиповитаминоз С и особенно авитаминоз С (цинга) ассоциированы с резким падением активности именно этих ферментов;
- гликозилирование моносахаридами аминокислотных остатков лизина в препроколлагене посредством проколлаген галактозилтрансфераз, гидроксилизил галактозил трансферазы (УДФ-галактозы-5-гидроксилизин-коллаген галактозилтрансферазы) и галактозил гидроксилизил глюкозилтрансферазы (УДФ-глюкоза-5-гидроксилизин-коллаген глюкозилтрансферазы). Данные ферменты содержат ионы марганца (и, возможно, ионы Са2+) в качестве кофакторов;
- сборка тройной спирали проколлагена из 3 аминокислотных цепей препроколлагена;
- внесение необходимых конформационных изменений в проколлаген посредством изомеризации остатков цистеина и пролина ферментами протеиндисульфид изомеразы и пролил-цис-транс-изомеразы. Данные ферменты не содержат кофакторов;
- упаковка проколлагена в транспортный везикул, перенос во внеклеточный матрикс;
- вне клетки проколлаген протеиназы модифицируют молекулу проколлагена с образованием тропоколлагена. Дефекты генов проколлаген протеиназы ассоциированы с известным синдромом Элерса–Данло. Проколлаген-N-протеиназа и проколлаген-С-протеиназа нуждаются в ионах Zn2+ в качестве кофактора;
- формирование коллагеновых фибрилл из тропоколлагена посредством лизилоксидазы, образующей ковалентные связки между отдельными сегментами тропоколлагена. Кофакторами лизилоксидазы являются ионы Cu+ и тирозил-хинон.
Таким образом, процесс биосинтеза коллагена нуждается в определенных кофакторах: ионах Са
Системно-биологический анализ Са-зависимых белков, которые могут воздействовать на биосинтез коллагена
Для установления Са-зависимых белков протеома, которые могут воздействовать на синтез коллагена, был проведен поиск с использованием перечисленных в табл. 2 биологических ролей. В результате был получен список из 15 белков (табл. 3).
Для оценки вклада каждого из анализируемых 15 белков во взаимосвязь между уровнями кальция и коллагена была разработана балльная шкала оценки релевантности биологических функций белков, содержащая следующие пункты:
- белок влияет, прямо или косвенно, на биосинтез коллагена — 1 балл;
- белок влияет на биодеградацию коллагена — 1 балл;
- имеются экспериментальные данные о том, что на активность белка влияют уровни кальция, — 1 балл;
- белок содержит хотя бы один Са-связывающий сайт — 1 балл;
- эффект кальция на данный белок состоит в повышении активности коллаген-синтезирующих ферментов или в снижении активности коллаген-деградирующих ферментов — 1 балл;
- биологические роли белка осуществляются посредством изменения внутриклеточных концентраций ионов Са2+ — 1 балл;
- имеются экспериментальные данные, подтверждающие воздействие ионов кальция на биосинтез коллагена при участии данного белка, — 1 балл.
В табл. 3 приведены результаты оценки релевантности различных Са-зависимых белков по отношению к воздействию ионов Са2+ на биосинтез коллагена. Очевидно, что наиболее интересными «таргетными белками» являются Са-чувствительный рецептор (CASR) и костный морфогенетический белок 4 (BMP4). Далее представлен более подробный анализ перечисленных в табл. 3 белков.
Са-чувствительный рецептор CASR
В паращитовидной железе CASR «измеряет» концентрации ионов Са2+ в плазме крови и активирует внутриклеточные сигнальные пути, регулирующие секрецию ПТГ или фильтрацию катионов в почках. В остеоцитах CASR детектирует уровни внеклеточного кальция и активирует остеогенез. Высокие внеклеточные уровни ионов Ca2+ (порядка 10 мМ) стимулируют экспрессию остеогенных маркеров, включая щелочную фосфатазу, костный сиалопротеин, коллаген, остеокальцин IA1, и увеличивают минерализацию кости. Кроме того, блокада рецептора CASR ингибирует клеточный ответ остеоцитов на изменения внеклеточной концентрации Ca2+ [17].
Однако рецептор CASR играет и другие важные роли, далеко простирающиеся за рамки регулирования уровней внеклеточного Са
Также CASR является физиологическим регулятором роста, дифференцировки и выживания остеобластов и остеокластов [19]. Экспрессия рецептора CASR в хрящевой и костной ткани непосредственно регулирует скелетный гомеостаз и метаболизм соединительной ткани. Рецептор CASR вносит важный вклад в рост хрящевой пластинки, в т. ч. в процессы роста и дифференцировки остеобластов и остеокластов [20] (рис. 7).
На рис. 7 можно видеть, что остеобластогенез протекает посредством дифференциации мезенхимальных клеток-предшественников остеобластов, которые делятся и дифференцируются в преостеобласты, которые, в свою очередь, созревают в остеобласты. Зрелые остеобласты секретируют неминерализованный костный матрикс (остеоид), который минерализуется с образованием кости, в которой зрелые остеобласты становятся остеоцитами. Во время стимуляции остеобластов экспрессия активной R-формы рецептора CASR увеличивается в остеобластах, а экспрессия неактивной O-формы рецептора снижается, что повышает соотношение R:O и способствует остеокластогенезу. У молодых животных стимулируемый ионами кальция Са
В эксперименте было показано, что активируемый ионами Ca2+ рецептор стимулирует деление фибробластов и секрецию матриксных металлопротеиназ ММР-3, ММР-9 [21]. Повышение уровней внеклеточного кальция in vitro дозозависимо стимулирует деление фибробластов (рис. 8, контроль — 105 клеток, кальций — 2,2 × 105 клеток, p < 0,05) и их активность (хемотаксис, рис. 9). Внеклеточный кальций, действуя через рецептор CASR, усиливает минерализацию кости остеобластами (рис. 10) [17].
Как известно, фибробласты являются клетками, производящими все компоненты соединительной ткани: коллагеновые волокна, эластиновые волокна и протеингликаны гелеобразной среды. Стимулирование CASR деления фибробластов неизбежно связано с повышением общего уровня активности фибробластов, в т. ч. более активным биосинтезом коллагена. Таким образом, активация рецептора CASR ионами Ca2+ является наиболее убедительным механизмом коллаген-продуцирующего действия кальциевых препаратов.
Костный морфогенетический белок 4
Костный морфогенетический белок 4 индуцирует образование хряща и кости, участвует в развитии зубов, формировании конечностей и заживлении переломов. Интересно, что механическая нагрузка на кость способствует синтезу внеклеточного матрикса остеобластами на фоне увеличения уровней белков BMP-2/4 [22].
Повышение уровня внеклеточного кальция стимулирует увеличение числа остеобластов и ингибирует образование остеокластов, в частности, посредством воздействия на уровни экспрессии костных морфогенетических белков. Например, добавление 0,1–0,4 мМ CaCl2 к клеткам в культуре достоверно увеличивало уровни мРНК BMP-2 и BMP-4, количество синтезируемого коллагена I типа, оцененного по уровням карбокси-концевого пептида проколлагена I [23]. Повышенные уровни Ca2+ увеличивают экспрессию генов белков морфогенеза костей (в частности, BMP-2) [24].
Взаимосвязи между активностью рецептора CASR и экспрессией морфогенетических белков остаются недостаточно изученными. С одной стороны, считается, что регулируемая секреция BMP-2 происходит в ответ на активацию рецептора CASR [25].
С другой стороны, использование кальцимиметика NPS-R568, специфического агониста для рецептора CASR, не увеличивало экспрессию BMP-2. Кроме того, известно, что CASR реагирует не только на уровни Са2+, но и на ионы Mg2+, Sr2+, Gd3+. Однако только ионы Са
О других Са-зависимых белках и их воздействии на метаболизм коллагена
К другим Са-зависимым белкам, так или иначе влияющим на метаболизм коллагена, относятся матриксные металлопротеиназы (ММП) и некоторые ростовые факторы (табл. 3). Матриксные металлопротеиназы осуществляют протеолиз тройных спиралей коллагенов различных типов и играют роль в процессе заживления ран, ремоделировании соединительной ткани, деградации хряща, развитии и минерализации кости и заживлении переломов костей [26]. В структурах ММП содержатся Са-связывающие сайты, так что достаточные уровни кальция необходимы для деградации коллагена посредством ММП. Таким образом, ММП не могут непосредственно усиливать процессы биосинтеза коллагена.
Более вероятно, что уровни внеклеточного кальция могут способствовать повышению биологической активности ростовых факторов, активность которых связана с увеличением биосинтеза коллагена. Общеизвестно, что эффекты ростовых факторов TGFB1, PDGFRB и CTGF (табл. 3) осуществляются за счет «всплеска» внутриклеточных концентраций ионов Са2+ в момент активации рецептора. Повышение внеклеточных концентраций Са
Преобразующий фактор роста бета-1 (TGF-бета1) контролирует деление и дифференцировку многих типов клеток, в т. ч. фибробластов и остеобластов. TGF-бета1 стимулирует приток ионов Са2+ в цитоплазму клетки [27] и непосредственно стимулирует синтез коллагена в остеобластах (р = 0,001), что имеет важное значение для образования костной ткани. На остеобластах в культуре одновременное добавление к среде Ca(OH)2 и TGF-бета1 значительно увеличило синтез белка вообще и синтез коллагена в частности (р = 0,048) [28].
Рецептор тромбоцитарных факторов роста PDGF-B и PDGF-D (PDGFRB) играет существенную роль в регуляции клеточного деления, выживаемости, дифференцировки и миграции клеток. Мутации в структуре молекулы рецептора ухудшают заживление ран и уменьшают отложение коллагена в соединительной ткани [29]. Рецептор PDGFRB активирует фосфолипазу Сγ1 (PLCG1), что инициирует процессы внутриклеточной передачи сигнала с участием сигнальных молекул диацилглицерола, инозитол-1,4,5-трифосфата, мобилизации внутриклеточного Ca
Фактор роста соединительной ткани (CTGF) способствует делению и дифференцировке хондроцитов, обеспечивает клеточную адгезию фибробластов, осуществляет положительное регулирование процесса биосинтеза коллагена [31] посредством сигнальных путей Rac1/MLK3/JNK/AP-1 [32]. В частности, CTGF связывается с рецептором-2 факторов роста фибробластов (FGFR2) и стимулирует Са-зависимую внутриклеточную передачу сигнала [33].
Заключение
Улучшение биосинтеза коллагена — необходимое условие для восстановления структуры кости при срастании переломов, регенерации кости при постменопаузальном, лекарственном остеопорозе, а также при других нарушениях целостности кости. Нормализация биосинтеза коллагена способствует лучшему удержанию кальция в костной ткани и, следовательно, повышению минеральной плотности кости. Миллионам женщин старше сорока лет грозит перелом из-за хрупкости костей вследствие вымывания кальция. Каждые 5 минут в России происходит перелом кости. В особой группе риска 34 миллиона женщин России старше 40 лет, и 24 миллиона не знают об этом. Основная причина хрупкости костей — вымывание кальция и утрата коллагена. В отличие от других препаратов, Кальцемин Адванс содержит кальций и минералы, формирующие коллагеновую сетку, что удерживает кальций в костях. Она препятствует вымыванию кальция и сохраняет прочность костной ткани.
Системно-биологический анализ кальций-зависимых белков протеома человека показал, что ионы кальция стимулируют биосинтез коллагена посредством действия ионов кальция на Са-чувствительный рецептор CASR и костный морфогенетический белок BMP4.
Костный метаболизм вообще и биосинтез коллагена в частности нуждаются в поддержке определенными «остеотропными» микронутриентами. В частности, процесс биосинтеза коллагена нуждается в ионах Са2+, Mg2+, Fe2+, Mn2+, Zn2+, Cu+ как кофакторах соответствующих ферментов. Поэтому препараты кальция, способствующие повышению обеспеченности организма магнием, цинком, медью, марганцем (например, препарат Кальцемин Адванс), повышают потенциал коллагенообразования в соединительной ткани.
Литература
- Shoshan S., Pisanti S. The metabolic effect of low calcium intake on collagen of bones and dental structures in the rat // Arch Oral Biol. 1971; 16 (7): 791–800.
- Ivanov V., Ivanova S., Kalinovsky T., Niedzwiecki A., Rath M. Inhibition of collagen synthesis by select calcium and sodium channel blockers can be mitigated by ascorbic acid and ascorbyl palmitate // Am J Cardiovasc Dis. 2016; 6 (2): 26–35 eCollection 2.
- Dietrich J. W., Duffield R. Effects of the calcium antagonist verapamil on in vitro synthesis of skeletal collagen and noncollagen protein // Endocrinology. 1979; 105 (5): 1168–1172.
- Wang T., Gu Q., Zhao J., Mei J., Shao M., Pan Y., Zhang J., Wu H., Zhang Z., Liu F. Calcium alginate enhances wound healing by up-regulating the ratio of collagen types I/III in diabetic rats // Int J Clin Exp Pathol. 2015; 8 (6): 6636–6645 eCollection.
- Демидов В. И., Жидоморов Н. Ю., Торшин И. Ю., Волков А. Ю., Громова О. А. Эффективность заживления кожи при использовании синергидной композиции кальция на модели резаной раны // Акушерство и гинекология, 2015. № 4. С. 56–61.
- Kamel S., Fardellone P., Meddah B., Lorget-Gondelmann F., Sebert J. L., Brazier M. Response of several markers of bone collagen degradation to calcium supplementation in postmenopausal women with low calcium intake // Clin Chem. 1998; 44 (7): 1437–1442.
- Torshin I. Yu. Sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books, NY, USA, 2009. In: Bioinformatics in the Post-Genomic Era series, ISBN 1–60692–217–0.
- Громова О. А., Торшин И. Ю., Гришина Т. Р., Лисица А. В. Перспективы использования препаратов на основе органических солей кальция. Молекулярные механизмы кальция // Лечащий Врач. 2013. № 4. С. 42–44.
- Cui F. Z., Wang Y., Caia Q., Zhang W. Conformation change of collagen during the initial stage of biomineralization of calcium phosphate // J. Mater. Chem. 2008, 18, 3835–3840. DOI: 10.1039/B805467 C. pubs.rsc.org/en/content/articlelanding/2008/jm/b805467c#! divAbstract.
- Landis W. J., Jacquet R. Association of calcium and phosphate ions with collagen in the mineralization of vertebrate tissues // Calcif Tissue Int. 2013; 93 (4): 329–337.
- Ahlen K., Berg A., Stiger F., Tengholm A., Siegbahn A., Gylfe E., Reed R. K., Rubin K. Cell interactions with collagen matrices in vivo and in vitro depend on phosphatidylinositol 3-kinase and free cytoplasmic calcium // Cell Adhes Commun. 1998; 5 (6): 461–473.
- Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. Molecular Biology of the Cell, 4 th edition. NY, Garland Science, 2002, ISBN-10 0–8153–3218–1, 0–8153–4072–9.
- Zhang C., Zhang T., Zou J., Miller C. L., Gorkhali R., Yang J. Y., Schilmiller A., Wang S., Huang K., Brown E. M., Moremen K. W., Hu J., Yang J. J. Structural basis for regulation of human calcium-sensing receptor by magnesium ions and an unexpected tryptophan derivative co-agonist // Sci Adv. 2016; 2 (5): e1600241.
- Ray K. Calcium-Sensing Receptor: Trafficking, Endocytosis, Recycling, and Importance of Interacting Proteins // Prog Mol Biol Transl Sci. 2015; 132: 127–150.
- Zhang C., Miller C. L., Brown E. M., Yang J. J. The calcium sensing receptor: from calcium sensing to signaling // Sci China Life Sci. 2015; 58 (1): 14–27.
- Huang C., Miller R. T. The calcium-sensing receptor and its interacting proteins // J Cell Mol Med. 2007; 11 (5): 923–934.
- Gonzalez-Vazquez A., Planell J. A., Engel E. Extracellular calcium and CaSR drive osteoinduction in mesenchymal stromal cells // Acta Biomater. 2014; 10 (6): 2824–2833.
- Toka H. R. New functional aspects of the extracellular calcium-sensing receptor // Curr Opin Nephrol Hypertens. 2014; 23 (4): 352–360.
- Caudarella R., Vescini F., Buffa A., Rizzoli E., Ceccoli L., Francucci C. M. Role of calcium-sensing receptor in bone biology // J Endocrinol Invest. 2011; 34 (7 Suppl): 13–17.
- Goltzman D., Hendy G. N. The calcium-sensing receptor in bone — mechanistic and therapeutic insights // Nat Rev Endocrinol. 2015; 11 (5): 298–307.
- Zhang X., Zhang T., Wu J., Yu X., Zheng D., Yang F., Li T., Wang L., Zhao Y., Dong S., Zhong X., Fu S., Xu C. Q., Lu F., Zhang W. H. Calcium sensing receptor promotes cardiac fibroblast proliferation and extracellular matrix secretion // Cell Physiol Biochem. 2014; 33 (3): 557–568.
- Guo Y., Zhang C. Q., Zeng Q. C., Li R. X., Liu L., Hao Q. X., Shi C. H., Zhang X. Z., Yan Y. X. Mechanical strain promotes osteoblast ECM formation and improves its osteoinductive potential // Biomed Eng Online. 2012; 11: 80.
- Nakade O., Takahashi K., Takuma T., Aoki T., Kaku T. Effect of extracellular calcium on the gene expression of bone morphogenetic protein-2 and –4 of normal human bone cells // J Bone Miner Metab. 2001; 19 (1): 13–19.
- Tada H., Nemoto E., Kanaya S., Hamaji N., Sato H., Shimauchi H. Elevated extracellular calcium increases expression of bone morphogenetic protein-2 gene via a calcium channel and ERK pathway in human dental pulp cells // Biochem Biophys Res Commun. 2010; 394 (4): 1093–1097.
- Peiris D., Pacheco I., Spencer C., MacLeod R. J. The extracellular calcium-sensing receptor reciprocally regulates the secretion of BMP-2 and the BMP antagonist Noggin in colonic myofibroblasts // Am J Physiol Gastrointest Liver Physiol. 2007; 292 (3): G753–766. Epub 2006.
- Lausch E., Keppler R., Hilbert K., Cormier-Daire V., Nikkel S., Nishimura G., Unger S., Spranger J., Superti-Furga A., Zabel B. Mutations in MMP9 and MMP13 determine the mode of inheritance and the clinical spectrum of metaphyseal anadysplasia // Am J Hum Genet. 2009; 85 (2): 168–178.
- Alevizopoulos A., Dusserre Y., Ruegg U., Mermod N. Regulation of the transforming growth factor beta-responsive transcription factor CTF-1 by calcineurin and calcium/calmodulin-dependent protein kinase IV // J Biol Chem. 1997; 272 (38): 23597–23605.
- Jaunberzins A., Gutmann J. L., Witherspoon D. E., Harper R. P. Effects of calcium hydroxide and transforming [correction of tumor] growth factor-beta on collagen synthesis in subcultures I and V of osteoblasts // J Endod. 2000; 26 (9): 494–499.
- Vanlandewijck M., Lebouvier T., Andaloussi Mae M., Nahar K., Hornemann S., Kenkel D., Cunha S. I., Lennartsson J., Boss A., Heldin C. H., Keller A., Betsholtz C. Functional Characterization of Germline Mutations in PDGFB and PDGFRB in Primary Familial Brain Calcification // PLoS One. 2015; 10 (11): e0143407.
- Mukherjee S., Duan F., Kolb M. R., Janssen L. J. Platelet derived growth factor-evoked Ca2+ wave and matrix gene expression through phospholipase C in human pulmonary fibroblast // Int J Biochem Cell Biol. 2013; 45 (7): 1516–1524.
- Oliver N., Sternlicht M., Gerritsen K., Goldschmeding R. Could aging human skin use a connective tissue growth factor boost to increase collagen content? // J Invest Dermatol. 2010; 130 (2): 338–341.
- Lin C. H., Yu M. C., Tung W. H., Chen T. T., Yu C. C., Weng C. M., Tsai Y. J., Bai K. J., Hong C. Y., Chien M. H., Chen B. C. Connective tissue growth factor induces collagen I expression in human lung fibroblasts through the Rac1/MLK3/JNK/AP-1 pathway // Biochim Biophys Acta. 2013; 1833 (12): 2823–2833.
- Aoyama E., Kubota S., Takigawa M. CCN2/CTGF binds to fibroblast growth factor receptor 2 and modulates its signaling // FEBS Lett. 2012; 586 (24): 4270–4275.
О. А. Громова*, 1, доктор медицинских наук, профессор
И. Ю. Торшин**, кандидат химических наук
И. К. Томилова*, доктор медицинских наук
А. В. Гилельс***
* ГБОУ ВПО ИвГМА МЗ РФ, Иваново
** РСЦ Института микроэлементов ЮНЕСКО при РНИМУ им. Н. И. Пирогова, Москва
*** Клиника RHANA, Москва
1 Контактная информация: unesco.gromova@gmail.com
Купить номер с этой статьей в pdf