Прогрессирование хронических заболеваний почек (ХЗП) �� формированием хронической болезни почек (ХБП), требующей на последних стадиях проведения заместительной терапии и трансплантации почек, является одной из актуальных проблем нефрологии [1, 2]. Для унификации подходов к оценке стадии ХЗП Национальным почечным фондом США/Инициативой качества лечения заболеваний почек (National Kidney Foundation (NKF)/Kidney Disease Outcomes Quality Initiative (KDOQI) в 2002 г. предложена концепция ХБП [3–5]. ХБП — это стадийный процесс, инициирующийся при воздействии разнообразных экзогенных и эндогенных факторов, в дальнейшем участвующих в прогрессировании ренального поражения с формированием нефросклероза [6–9]. Основная цель объединения нефрологических заболеваний термином ХБП — необходимость объективной оценки функционального состояния почек у больных, которая проводится на основании определения скорости клубочковой фильтрации (СКФ), что позволяет оценить темпы прогрессирования патологии и своевременно начинать ренопротективные мероприятия [10–16].
Тубулоинтерстициальные болезни почек (ТИБП), ассоциированные с врожденными или наследственными нефропатиями, уропатиями с нарушением уродинамики, осложненные ренальной инфекцией, рефлюкс-нефропатией (РН), в структуре причин ХБП встречаются от 22% (North American Pediatric Renal Transplant Cooperative Study, 2010) до 57,6% (European Renal Association-European Dialysis Transplant Association, 2012) [17, 18]. Вот почему изучение структурных и функциональных изменений почек у детей на разных стадиях тубулоинтерстицинального поражения почек (ТИПП), соответствующих стадиям ХБП, является актуальным [19–21].
Целью данного исследования было оценить структурные и функциональные изменения почек у детей с РН на разных стадиях тубулоинтерстициального поражения почек.
Пациенты и методы исследования
Проведено определение и сопоставление комплекса клинических и параклинических данных 188 детей в возрасте от 1 года до 17 лет, больных рефлюкс-нефропатией (n = 118), пациентов с пузырно-мочеточниковым рефлюксом (ПМР) без признаков ТИПП (n = 40) и детей контрольной группы (n = 30) (табл.).
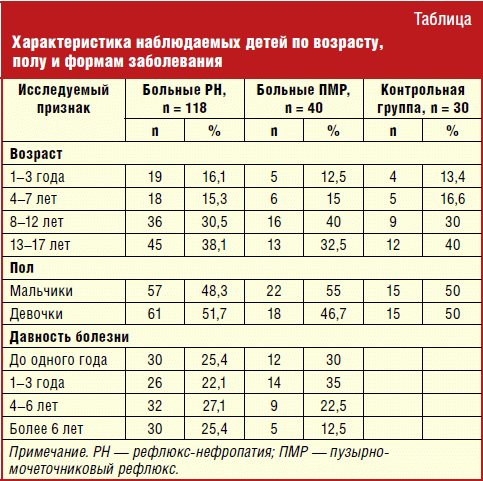
Критерии включения больных в исследование:
- добровольное информированное согласие родителей ребенка на участие в клиническом исследовании;
- возраст пациентов от 1 года до 18 лет включительно;
- наличие верифицированных диагнозов по международным критериям: РН (J. M. Smellie, 1985), ПМР (Международный комитет по изучению пузырно-мочеточникового рефлюкса, 1981);
- отсутствие клинико-лабораторных признаков обострения заболевания в течение последних 3 месяцев.
Критерии исключения больных из исследования:
- отказ родителей от участия в клиническом исследовании;
- двусторонняя РН;
- двусторонний ПМР.
В результате проведенного обследования, на основании критериев рефлюкс-нефропатии, разработанных J. M. Smellie, критериев верификации ПМР [22], были выделены следующие группы клинического наблюдения:
1) дети с рефлюкс-нефропатией А (n = 30);
2) дети с рефлюкс-нефропатией В (n = 30);
3) дети с рефлюкс-нефропатией С (n = 30);
4) дети с рефлюкс-нефропатией D (n = 28);
5) дети с пузырно-мочеточниковым рефлюксом без признаков тубулоинтерстициального поражения почек (n = 40).
Контрольную группу составили дети (n = 30) без органической патологии почек.
Клинико-параклиническое обследование детей проводилось в региональном детском нефрологическом центре на базе ГАУЗ ГКБ № 6 г. Оренбурга.
Нефросцинтиграфия, позволившая верифицировать степени рефлюкс-нефропатии, проводилась на базе отделений радиоизотопной диагностики ГБУЗ Оренбургская ОКБ, ГБУЗ Самарская ОБ им. М. И. Калинина.
Всем детям проведена оценка функционального состояния почек по пробам Реберга с поправкой по формуле Шварца, Зимницкого, суточной экскреции с мочой титруемых кислот, аммиака [23, 24].
Верификация ХБП проводилась на основании критериев NKF/КDOQI (National Kidney Foundation/Kidney Disease Outcomes Quality Initiative) [3–5].
При проведении экскреторной урографии оценивались размеры и контуры почек, состояние полостной системы, ее соотношение с почечной паренхимой, функциональная способность почек. Для оценки размеров, роста почек и степени истончения почечной паренхимы использовался рентгенологический метод с определением номограммы, определяющей стандартные девиации в отношении формы почек и толщины паренхимы. Также проводилась рентгенопланиметрическая оценка площади почек в соотношении к индивидуальному нормативу, определение депурационной способности почек путем расчета клиренса контрастного вещества по соотношению к стандартной поверхности тела, изучение функциональной емкости паренхимы путем расчета показателя относительной фильтрационной способности [25].
Ультразвуковая диагностика в серошкальном — В-режиме проводилась на аппарате фирмы «Гетвей». Обследование проводилось в положении пациента лежа на спине, левом и правом боку и на животе. При этом выполнялись продольные, поперечные и корональные срезы. На первом срезе измерялись длина и толщина почки, на втором — ширина; корональный срез позволяет видеть почку во фронтальной плоскости так, как она видна на урограммах. Определение размеров почек проводилось с учетом роста ребенка [26–28].
При первичном ультразвуковом осмотре в В-режиме оценивались линейные размеры, толщина, эхогенность и равномерность паренхиматозного слоя, состояние чашечно-лоханочной системы, подвижность и структура почек, а также форма, размер, состояние стенок и сократительная функция мочевого пузыря [29].
Статистическая обработка материала произведена путем вычисления средней арифметической (М), среднеквадратического отклонения (s), ошибки средней (m) с помощью биометрических методов анализа, коэффициента Стьюдента (t) с последующим нахождением уровня достоверности различий (р) по таблицам. Достоверным считали различие при р < 0,05. Для выявления статистически значимых различий в сравниваемых группах использованы параметрический метод и непараметрический ранговый метод.
Результаты исследования
В ходе проведения УЗИ почек у детей с РН на разных стадиях ТИПП нами выявлены неравномерное уменьшение толщины паренхимы почек, преимущественно в области полюсов почки и в средней ее части (79,6%, n = 94), уменьшение как длины, так и площади почки (74,6%, n = 88), повышение эхогенности паренхимы и нарушение кортико-медуллярной дифференцировки (77,1%, n = 91).
Сопоставление результатов ультразвукового исследования почек у детей с РН сравниваемых подгрупп показало, что для ранней стадии РН (А и В степени) наиболее характерной эхокартиной было уменьшение толщины паренхимы пораженной почки (70%, n = 42); для РН C и D степени — уменьшение длины и площади почки более чем на 10% от нормы (100%, n = 58), нарушение дифференцировки коркового и мозгового слоев (100%, n = 58), уменьшение толщины паренхимы пораженной почки (100%, n = 58).
Наиболее характерными эхографическими показателями у больных с РН А и В степени (в порядке убывания) были изменения почечной паренхимы в виде уменьшения толщины паренхимы в области полюсов и в средней части (70%, n = 42); изменение соотношения, дифференцировки, плотности коркового и мозгового слоев (65%, n = 39); уменьшение длины и площади почки на 10% и более (55%, n = 33); неровность, бугристость контуров, наличие участков уплотнения по наружному контуру (51,6%, n = 31).
У больных с РН С и D степени по сравнению с РН А и В степени достоверно чаще было выявлено уменьшение длины и площади почки, нарушение соотношения коркового и мозгового слоев, уменьшение толщины паренхимы в области полюсов, неровность, бугристость контуров (p < 0,001).
Выявлены достоверные различия показателей эхографии между больными с РН и ПМР по всем признакам — уменьшение длины и площади почки на 10% и более; уменьшение толщины паренхимы; неровность, бугристость контуров; изменение соотношения коркового и мозгового слоев; показатель увеличения контралатеральной почки (p < 0,001).
По результатам экскреторной урографии признаки ТИПП выявлены у 96,6% (n = 114) больных с РН. У 13,3% детей с РН А (n = 4) не найдены рентгенологические признаки по данным урографии, тогда как для больных с РН В, С и D степени характерны рентгенологические признаки в виде изменения размеров и контуров почки, уменьшение площади почки на 20% и более от возрастной нормы, увеличение ренокортикального индекса в 1,5–2 раза по сравнению с визуально сохранной почкой, деформация собирательной системы, «грибовидная» деформация чашечек (симптом «вянущего цветка»).
При анализе показателей функционального состояния почек по данным внутривенной урографии установлено, что у 87,3% больных с РН (n = 103) нарушено выведение контрастного вещества. Нарушения функции почек по результатам экскреторной урографии достоверно чаще выявлены при РН C и D степени по сравнению с РН А и В степени (100% — n = 58 против 25% — n = 15 соответственно, р < 0,05).
Совпадение диагностических данных рентгенологического и ультразвукового методов имело место у 96,6% пациентов (n = 114).
В результате исследования функционального состояния почек у детей с ПМР и РН на разных стадиях ТИПП установлены достоверные различия частоты нарушений почечных функций в зависимости от стадии РН. Анализ результатов исследования функционального состояния почек у детей с РН показал в 100% (n = 118) нарушения тубулярных функций по сравнению с детьми с ПМР без признаков ТИПП (n = 40) (р < 0,05).
Признаками снижения функции почек по канальцевому типу были гипераминоацидурия у 68,6% детей с РН (n = 81); снижение ацидогенеза по показателю титруемой кислотности мочи (57,6% (n = 68); экскреции аммиака (34,7% (n = 41); уровня канальцевой реабсорбции (30,5% (n = 36); изменение концентрационной функции по показателю снижения относительной плотности мочи (71,1% (n = 84), никтурия у 39,8% больных с РН (n = 47), (p < 0,05). У больных с РН в проксимальных канальцах наблюдалось снижение реабсорбции фосфатов (37,3%, n = 44), аминокислот (62,7%, n = 74). При анализе функционального состояния почек у больных с РН выявлено поэтапное снижение функции почек на разных стадиях прогрессирования ТИПП: нарастание гипераминоацидурии (68,6%, n = 81); снижение ацидогенеза по показателю титруемой кислотности мочи (57,6%, n = 68); экскреции аммиака (34,7%, n = 41); снижение уровня канальцевой реабсорбции (30,5%, n = 36); изменение концентрационной функции в виде снижения относительной плотности мочи (71,1%, n = 84).
При анализе показателя СКФ у детей с ПМР и РН установлено ее снижение на начальной стадии ТИПП, то есть у пациентов с РН А по сравнению с группой детей с ПМР без признаков нефросклероза (р < 0,05). Доказано, что по мере прогрессирования ТИПП отмечается стадийное снижение скорости клубочковой фильтрации у пациентов с РН (рис. 1).
Таким образом, ХБП была верифицирована у 88 детей, что составило 74,6% от общего количества пациентов с ТИПП. При этом ХБП I стадии была диагностирована у 30 детей с ТИПП (25,4% от общего количества детей с ТИПП), II стадия ХБП у 58 больных (49,2% больных с ТИПП).
Результаты оценки функционального состояния почек подтверждены данными динамической нефросцинтиграфии (ДНСГ). Установлены различия (p < 0,001) показателей максимальной активности у пациентов с ПМР без признаков нефросклероза и по мере прогрессирования ТИПП у больных с РН. Доказано, что по мере как формирования, так и прогрессирования ТИПП отмечается снижение максимальной активности. При этом наиболее существенные статистические различия установлены между группами пациентов с ПМР без признаков нефросклероза (189,3 ± 6,07 соб/с) и пациентами с начальной стадией склерозирования почки (РН А — 81,5 ± 0,53 соб/с).
Сходная тенденция установлена нами при анализе показателей средней скорости прохождения радиофармпрепарата (РФП) через сосудистое русло почек. Наиболее существенные статистические различия (p < 0,001) установлены между группами пациентов с ПМР без признаков нефросклероза (29,11 ± 0,93 соб/с) и пациентами с начальной стадией склерозирования почки (РН А — 11,5 ± 0,47 соб/с). Таким образом, при формировании очагов склероза в почках на ранней стадии РН происходит резкое снижение показателя средней скорости прохождения РФП через сосудистое русло почек. По мере прогрессирования ТИПП у пациентов с РН происходит дальнейшее снижение показателя средней скорости прохождения РФП через сосудистое русло почек.
Нами доказаны снижение тубулярных функций почек при формировании ТИПП у пациентов с ПМР, а также по мере его прогрессирования у детей с РН на разных стадиях заболевания. По мере склерозирования почки установлено прогрессирующее снижение тубулярной функции, отражаемое снижением показателя вклада в общее накопление в начале формирования ТИПП у пациентов с ПМР (рис. 2).
У всех больных с РН по данным ДНСГ выявлены значительные изменения тубулоинтерстициальной зоны в виде достоверного снижения максимума накапливаемого РФП, средней скорости его накопления, максимальной активности. Степень снижения времени максимального накопления, максимума накапливаемого препарата, вклада в суммарную скорость и общее накопление, средней скорости выведения РФП наиболее были выражены при РН С и D степени.
При анализе реносцинтиграмм у больных РН отмечалось изменение секреторного сегмента, связанное с нарушением функции проксимального нефрона, проявившееся увеличением времени наступления максимума; значимым нарушением показателей экскреторного сегмента — временем полувыведения и выведения 2/3 максимума РФП. У 44% больных с РН гистограммы были «изостенурическими», что соответствовало нефункционирующей почке и отражало грубые нарушения функции канальцев почек. У 70% (n = 21) больных с РН А и В степени и у детей с ПМР отмечалось удлинение и уплощение секреторного сегмента, медленный спад кривой, отражающий нарушение экскреции из-за уменьшения компенсаторных резервов канальцевых функций.
Анализ структурных изменений почек по данным нефросцинтиграфии выявил изменения показателей в виде уменьшения размеров почки в сочетании со снижением количества функционирующей паренхимы и неровностью контуров почки, наличием очаговых или диффузных проявлений нефросклероза у 100% больных с РН. Так, у 96,6% больных с РН (n = 114) выявлено уменьшение размеров почки, в т. ч. при РН А и В степени у 6,6% пациентов (n = 4), при РН С и D степени — у 100% больных (n = 58). Для 96,6% (n = 114) больных с РН было характерно снижение количества функционирующей паренхимы, неровность контуров почки. Для больных с РН было характерно в 100% случаев (n = 118) выявление очагов нефросклероза, снижение количества функционирующей паренхимы с сохранением участков неизмененной паренхимы, отмечались неровность контуров почки, уменьшение почки в размерах. На нефросцинтиграммах у 7,5% (n = 3) больных с ПМР обнаруживались очаги низкой плотности радиофармпрепарата, что указывало на обеднение кровотока и снижение функционирования данных участков паренхимы, что предложено рассматривать C. С. Пауновой как пресклеротическую стадию формирования РН [30].
Обсуждение результатов
Полученные нами данные свидетельствуют о различии структурно-функциональных изменений почек у больных с ПМР и РН [30].
Функциональное состояние почек у детей с ТИПП при РН зависит от степени структурных изменений интерстициальной ткани. По мере инициации и прогрессирования ТИПП происходит стадийное снижение скорости клубочковой фильтрации и канальцевых функций почек с исходом в ХБП.
Параметры нефросцинтиграфии (максимальной активности, средней скорости прохождения РФП через сосудистое русло почек, вклада суммарных скоростей) могут быть использованы как для ранней диагностики ТИПП у пациентов с ПМР, так и для диагностики прогрессирования ТИПП у пациентов с РН.
Литература
- Iturbe B. R., Johnson R. J., Herrera-Acosta J. Tubulointerstitial damage and progression of renal failure // Kidney International. 2005. Vol. 68. Supplement 99. P. 82–86.
- Muller G. A., Zeisberg M., Strutz F. The importance of tubulointerstitial damage in progressive renal disease // Nephrol. Dial. Transplant. 2000. Vol. 15. Suppl 6. P. 76–77.
- Definition and classification of chronic kidney disease: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney International. 2005. Vol. 67. P. 2089–2100.
- National Kidney Foundation Kidney Disease Outcomes Quality Initiatives. K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease Evaluation Classification Stratification // Am J Kidney Dis. 2002. Vol. 39. P. 1–266.
- National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative clinical practice guidelines for chronic kidney disease in children and adolescents: evaluation, classification, and stratification // Pediatrics. 2003. Vol. 111. P. 1416–1421.
- Vassalotti J. A., Stevens L. A., Levey A. S. Testing for chronic kidney disease: a position statement from the National Kidney Foundation // Am J Kidney Dis. 2007; 50 (2): 169–180.
- Игнатова М. С. О хронических болезнях почек и тубулоинтерстициальных нефропатиях // Педиатрия. Журнал им. Г. Н. Сперанского. 2008. Т. 87, № 3. С. 128.
- Маковецкая Г. А. Современный взгляд на хронические заболевания почек. Дискуссионные вопросы // Вопросы современной педиатрии. 2006. № 5 (1). С. 748.
- Смирнов А. В., Добронравов В. А., Каюков И. Г. и др. Хроническая болезнь почек: дальнейшее развитие концепции и классификации // Нефрология. 2007. № 4. С. 7–18.
- Вялкова A. A. Современные представления о тубулоинтерстициальных нефропатиях и концепция хронической болезни почек в практической нефрологии // Педиатрия. 2008. № 3. С. 129–131.
- Маковецкая Г. А. К вопросу о хронических болезнях почек у детей // Педиатрия. Журнал им. Г. Н. Сперанского. 2008. Т. 87, № 3. С. 134–137.
- Сергеева Т. В., Картамышева Н. Н., Комарова О. В. и др. Клинико-функциональные параллели при хронической болезни почек у детей // Оригинальные исследования. Педиатрия. 2010. С. 56.
- Утц И. А., Костина M. JI. Концепция хронической болезни почек и тубулоинтерстициальные нефропатии в педиатрической нефрологии // Педиатрия. 2008. Т. 87, № 1. С. 146–149.
- Bradly A., Chadha W., Chadha V. Chronic kidney disease in children: the global perspective // Pediatr Nephrol. 2007. Vol. 23. P. 9–17.
- Coresh J., Byrd-Holt D., Astor B. C. et al. Chronic kidney disease awareness, prevalence, and trends among U. S. adults, 1999 to 2000 // J. Am. Soc. Nephrol. 2005. Vol. 16, № 1. P. 180–188.
- Parmar M. S. Chronic renal disease // BMJ. 2002. Vol. 325. P. 85–90.
- North American Pediatric Renal Transplant Cooperative Study (NAPRTCS) // Annual report. 2008. The EMMES Corporation, Rockville, MD.
- ESPN/ERA-EDTA Registry annual report 2008–2010. http://www.espn-reg.org.
- Игнатова М. С. Проблемы прогрессирования болезней почек у детей и современные возможности ренопротекции: научное издание // Нефрология и диализ. 2005. Т. 4, № 7. С. 428–434.
- Litwin M. Risk factors for renal failure in children with non-glomerular Nephropathies // Pediatric Nephrology. 2004. Vol. 19. P. 178–186.
- Warady В. А., Chadha V. Chronic kidney disease in children: the global perspective // Pediatr Nephrol. 2007. 22 December. Р. 1999–2009.
- Smellie J. M., Ransley P. G. Development of new renal scars: a collaborative study // BJM.1985; (290): 1457–1460.
- Abraham A. G., Schwartz G. J., Furth S., Warady В. A., Munoz A. Longitudinal Formulas to Estimate GFR in Children with CKD // Clin. J. Am. Soc. Nephrol. 2009.
- Delanghe J. R. How to estimate GFR in children // Nephrol. Dial. Transplant. 2009. V. 24. P. 714–716.
- Рентгенодиагностика в медицине. Рук-во для врачей в 2 т. / Под ред. Босина В. Ф. и Филиппкина М. А. М.: Медицина, 1998. T. 2. С. 13–46.
- Бакстер Г. М., Сидху П. С. Ультразвуковые исследования мочевыделительной системы. М.: МЕДпресс-информ. 2008. С. 280.
- Пыков М. И. Клиническое руководство по ультразвуковой диагностике в педиатрии / Под ред. М. И. Пыкова, К. В. Ватолина. М.: Видар, 1998. С. 410–429.
- Bruin R. Pediatric Ultrasound. Edinburgh: Churchill Livigstone, 2005. P. 373.
- Ольхова Е. Б. Эхографические аспекты нефросклероза детей // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. 2000. № 2. С. 136–142.
- Паунова С. С. Патогенетические основы формирования рефлюкс-нефропатии у детей. Автореф. дис. … докт. мед. наук. М., 2004. 25 с.
И. В. Зорин1, доктор медицинских наук
А. А. Вялкова, доктор медицинских наук, профессор
ГБОУ ВПО ОрГМУ МЗ РФ, Оренбург
1 Контактная информация: zorin2000@yandex.ru
Купить номер с этой статьей в pdf