Выбор тактики лечения больных с ревматоидным артритом (РА) на сегодняшний день связан с концепцией «Лечение до достижения цели», что обуславливает как можно более раннюю и достаточно агрессивную терапию [1].
Известно, что для лечения РА используется широкий спектр препаратов, обладающих противовоспалительной и иммуносупрессивной активностью [2, 3]. Однако, несмотря на рациональное применение синтетических лекарственных средств (базовых противовоспалительных препаратов, БПВП), позволившее существенно улучшить прогноз и отсрочить развитие инвалидности, более чем у половины пациентов с РА не удается надежно контролировать прогрессирование заболевания.
При отсутствии эффекта от традиционной терапии с применением БПВП и сохранении высокой активности иммуновоспалительного процесса больным РА назначаются генно-инженерные биологические препараты (ГИБП) [4]. Перечень ГИБП постоянно расширяется, однако наиболее изученными и чаще всего используемыми в клинической практике остаются ингибиторы фактора некроза опухоли-α (ФНО-α) — основного цитокина, определяющего развитие иммуновоспалительного процесса и костных деструкций при РА, а также анти-В-клеточные моноклональные антитела против антигена CD20, находящегося на поверхности зрелых В-лимфоцитов (ритуксимаб). К препаратам, блокирующим стимуляцию Th1-лимфоцитов путем связывания молекул CD80/86, находящихся на поверхности антигенпрезентирующих клеток, которые взаимодействуют с рецепторами CD28 Т-лимфоцитов, относится абатацепт. Также применяется гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 — тоцилизумаб [4, 9, 11].
Несмотря на высокую клиническую эффективность ГИБП у пациентов с тяжелым РА, опыт длительного применения этих препаратов в реальной клинической практике свидетельствует, что 30% пациентов рефрактерны к этой терапии [9].
Следует подчеркнуть, что и синтетические БПВП, и ГИБП в равной степени способны токсически воздействовать на различные системы организма, включая сердечно-сосудистую, гепатобилиарную, вызывая развитие тяжелых состояний, что является существенным ограничением для применения данного вида терапии [1, 4].
Больная С., 59 лет, с апреля 2010 г. наблюдается в ревматологическом отделении клиники СЗГМУ им. И. И. Мечникова. На основании критериев ACR (1987 г.) верифицирован РА высокой степени активности (DAS28 = 5,8). Показатели функции печени на тот момент находились в пределах нормальных значений. Проведена пульс-терапия высокими дозами глюкокортикоидов и цитостатиков с улучшением, базисная терапия лефлуномидом 20 мг в сутки совместно с глюкокортикоидами (метилпреднизолон 12 мг в сутки). От приема метотрексата решено воздержаться в связи с имеющимся участком фиброателекталаза S5 правого легкого и участков локального пневмофиброза обоих легких.
В августе 2010 г. активность РА высокая (DAS28 = 6,4), впервые отмечается повышение уровня печеночных ферментов до 7–8 норм, прием лефлуномида отменен.
С ноября 2010 г. начата ГИБП — препаратом выбора стал тоцилизумаб (моноклональное антитело к рецептору интерлейкина-6). После первых трех инфузий лабораторная активность заболевания остается высокой. Параллельно проводилась пульс-терапия, плазмаферез без эффекта, а также начата базисная терапия азатиоприном 100 мг в сутки. В декабре 2010 г. уровень аланинаминотрансферазы (АЛТ) составлял 12 норм, аспартатаминотрансфераза (АСТ) 17 норм, в связи с чем азатиоприн отменен.
В связи со стойкой высокой активностью РА, отсутствием эффекта от неоднократной комбинированной пульс-терапии, инфузий тоцилизумаба, непереносимости базисной терапии лефлуномидом, метотрексатом, в марте 2011 г. начата анти-В-клеточная терапия ритуксимабом. Первые 2 инфузии препарата по 500 мг выполнены без осложнений. После лечения значительного улучшения больная не отмечала, сохранялись боли в суставах, синовиты, длительная утренняя скованность, субфебрильная лихорадка.
В июле 2011 г. активность РА сохраняется высокая (DAS28 = 6,19) и принято решение о переводе больной на биологическую терапию модуляторами Т-клеточной костимуляции — препарат абатацепт. Первое введение без осложнений, показатели функции печени находились на высоком уровне. Пациентке регулярно проводилось обследование на вирусные гепатиты, неоднократно проводилось ультразвуковое исследование (УЗИ) брюшной полости, компьютерная томография (КТ) брюшной полости, но размеры и структура печени находились в пределах нормы.
На фоне терапии абатацептом впервые отмечалось улучшение самочувствия и регресс суставного синдрома. В декабре 2011 г. после пятой инфузии абатацепта уровень печеночных ферментов стабильно высокий и дальнейшее лечение данным препаратом прекращено.
В июле 2012 г. начата базисная терапия циклофосфаном внутримышечно в дозе 200 мг 2 раза в неделю, но попытка однократного введения препарата вызвала тошноту, слабость, головокружение, сердцебиение, кардиалгии, боли в животе. От дальнейшего введения циклофосфана также было решено отказаться. Лабораторное обследование в это время демонстрировало стабильно высокий уровень печеночных ферментов (до 8 норм) при отсутствии повышения уровня билирубина. Для уточнения состояния печени больной проведена эластометрия печени, сцинтиграфия скелета, печени, селезенки, компьютерная томография брюшной полости, расширенное вирусологическое обследование, но патологии не выявлено. На фоне массивного курса гепатопротекторной терапии добиться значимого снижения уровня биохимических показателей не удавалось. В ноябре 2012 г. проведена биопсия печени, по результатам которой обнаружен лобулярный гепатит минимальной степени активности, данных за вирусное поражение не получено. К лечению в это время добавлена урсодезоксихолевая кислота (УДХК) в дозировке 1000 мг в сутки. Все изменения биохимических показателей были расценены как проявления лекарственного токсического гепатита. На фоне приема УДХК в феврале 2013 г. наблюдалась практически полная нормализации уровня ферментов. Обсуждался вопрос о назначении биологической терапии блокаторами ФНО-α (инфликсимаб), но больная отказалась от этого лечения.
До июня 2015 г. пациентка наблюдалась амбулаторно с коррекцией дозы метилпреднизолона (максимально до 16 мг в сутки). От приема базисной терапии, а также терапии биологическими препаратами и проведения пульс-терапии решено воздержаться.
Последнее стационарное обследование в декабре 2015 г. Сохраняется умеренная активность РА (DAS28 — 5,1) и нормальный уровень ферментативной активности печени. Значимых изменений и ухудшений со стороны внутренних органов не выявлено. До настоящего времени для лечения РА больная получает метилпреднизолон 8 мг в сутки, НПВП (рис.).
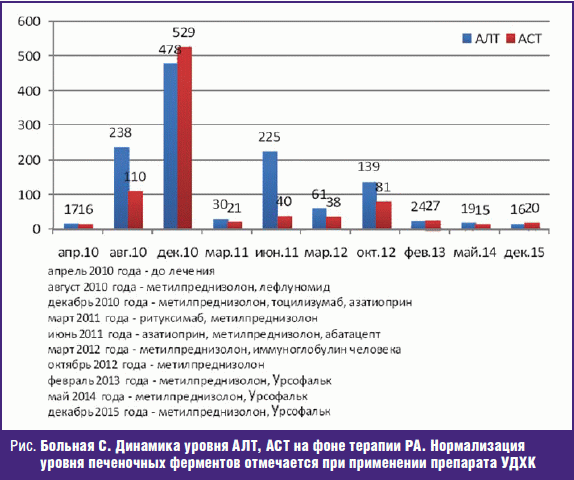
Данный клинический случай демонстрирует яркий пример неэффективности и развития побочного действия препаратов терапии РА при соблюдении концепции «Лечение до достижения цели».
Преодоление неэффективности остается одной из актуальных проблем клинической ревматологии, в связи с чем разрабатываются лекарственные средства нового поколения для лечения данной патологии [6].
Одним из таких препаратов является тофацитиниб, отличающийся по механизму подавления провоспалительных цитокинов от других ГИБП [5]. Это единственный препарат для перорального приема, блокирующий сигнальные пути цитокинов через систему «янус-киназ» (ЯК, JAK). Сигнализирование с помощью ЯК — основной сигнальный путь для многих важных цитокинов и факторов роста, задействованных в РА, в том числе ФНО-α/β и нескольких интерлейкинов.
На сегодняшний день активность РА у больной сохраняется на высоком уровне, что требует поиска решения проблемы дальнейшей тактики ее ведения. В мае 2016 г. после расширенного комплексного обследования планируется начать терапию с применением ингибиторов янус-киназ (тофацитиниб (Яквинус)) согласно рекомендациям Европейской противоревматической лиги (European League Against Rheumatism, EULAR) 2013 г. [10] совместно с поддерживающей дозой препарата УДХК [7, 8].
Литература
- Smolen J. S. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update // Ann Rheum Dis. 2013; 0: 1–18.
- Мазуров В. И. Современные методы диагностики и лечения ревматических заболеваний // Мед. иммунология. 2001. Т. 3, № 2. С. 187–193.
- Мазуров В. И., Лила А. М., Зоткин Е. Г. Клиническая ревматология. М.: ООО «Изд-во ФОЛИАНТ», 2005. С. 515.
- Насонов Е. Л. Генно-инженерные биологические препараты в лечении ревматоидного артрита / Под ред. академика РАМН Е. Л. Насонова. М.: ООО «ИМА-ПРЕСС», 2013. С. 549.
- Насонов Е. Л, Денисов Л. Н., Станислав М. Л. Новые аспекты фармакотерапии ревматоидного артрита: ингибиторы малых молекул // Научно-практическая ревматология. 2012. № 2. С. 66–75.
- Keystone E. C., Braun J. et al. Update consensus statement on biological agents for the treatment of rheumatic disease, 2011 // Ann Rheum Dis. 2012; 71 Suppl 2: i2–45.
- Федосьина Е. А., Маевская М. В. Применение урсодезоксихолевой кислоты при неалкогольном и алкогольном стеатогепатите // РЖГГК. 2010. Т. 20. № 3. С. 29–36.
- Roma M. G., Toledo F. D., Boaglio A. C., Basiglio C. L., Crocenzi F. A., Sánchez Pozzi E. J. Ursodesoxycholic acid in cholestasis: Linking action mechanisms to therapeutic applications // Clin. Sci. (Lond.). 2011. Vol. 121. Р. 523–544.
- Чичасова Н. В. Возможные причины неэффективности генно-инженерных биологических препаратов при ревматоидном артрите и пути ее предотвращения // Современная ревматология. 2012. № 2. С. 31–41.
- Nam J. L., Winthrop K. L., Vollenhoven R. F. Current evidence for the management of rheumatoid arthritis with biological disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendation for the management of RA // Ann Rheum Dis. 2010; 69: 976–986.
- Saag K. S., Teng G. G., Patkar N. M. et al. American College of Rheumatology 2008 Recommendations for the Use of Nonbiologic and Biologic Disease-Modifying Antirheumatic Drugs in Rheumatoid Arthritis // Arthritis Care & Research. 2008; 59: 762–784.
Е. А. Трофимов, кандидат медицинских наук
А. С. Трофимова1
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
1 Контактная информация: bukatsel_anna@mail.ru
Купить номер с этой статьей в pdf