Тубулоинтерстициальное поражение почек (ТИПП) у детей занимает ведущее место среди хронических заболеваний почек, приводящих к снижению качества жизни и социальной активности пациентов, ранней инвалидизации с формированием хронической болезни почек (ХБП), терминальной почечной недостаточности (тХПН) уже в детском возрасте [1].
Тубулоинтерстициальное поражение почек — это воспалительное (бактериальное и абактериальное) и невоспалительное повреждение интерстициальной ткани почек с расположенными в ней сосудами (артериальными и венозными), лимфатическими протоками, нервными окончаниями, а также чашечно-лоханочной системы врожденного, наследственного или приобретенного генеза с исходом в нарастание необратимых морфологических изменений (интерстициальный фиброз) параллельно со снижением функциональных возможностей почек, формированием ХБП [2].
В настоящее время в литературе широко обсуждается патогенетическое значение нарушений интраренальной гемодинамики в инициации почечного повреждения и прогрессировании ТИПП у детей [3].
Ряд авторов считают, что приоритет в диагностике нефросклероза принадлежит ультразвуковым методам визуализации [4, 5].
Допплерография сосудов почек позволяет оценить внутриорганную гемодинамику. Данный метод в силу своей высокой разрешающей способности и визуализации мельчайших сосудов вплоть до системы микроциркуляторного русла получил название «ультразвуковой ангиографии» [6].
При исследовании почечных сосудов в режиме центрального допплеровского картирования (ЦДК) окрашивается все сосудистое дерево почки: сегментарные, междолевые, дуговые артерии. Исследование позволяет визуализировать эти виды сосудов с оценкой их архитектоники, провести морфометрию, диагностировать локальные и диффузные нарушения внутрипочечной гемодинамики. ЦДК позволяет оценить три параметра кровотока одновременно: направление, скорость и характер (однородность и турбулентность). При этом исключается возможность «наслаивания» близлежащих сосудов, имеющих различные типы кровотока, друг на друга [7].
Обеднение внутрипочечного кровотока свидетельствует о значительной ишемии коркового слоя, отражая такие сосудистые изменения, как нефросклероз, гиалиноз мелких артерий с сужением их просвета [8]. При ТИПП именно процессы фиброзирования тубулоинтерстициальной ткани почек приводят к деформации сосудистого рисунка за счет экстравазального воздействия: уменьшение числа мелких ветвей сегментарных артерий вплоть до картины «обгорелого дерева», уменьшение диаметра почечной артерии, сегментарных артерий, выраженная деформация, извитость сегментарных артерий и хорошая визуализация ренальной ангиоархитектоники вплоть до мелких ветвей викарно увеличенной контралатеральной почки. С. С. Пауновой установлено, что изменения параметров внутрипочечной гемодинамики нередко предшествуют лучевым, радионуклеидным и ультразвуковым данным диагностики ТИПП при ПМР [9].
В режиме допплерографии наиболее важными характеристиками внутрипочечной гемодинамики являются линейные показатели скорости кровотока (систолическая и диастолическая скорости кровотока), позволяющие косвенно судить о состоянии и величине периферического сосудистого сопротивления.
Установлено, что повышение показателей индексов Ri и Рi характерно для вазоспастических реакций при воспалительных и склеротических процессах в периваскулярных тканях почки. Механизм, лежащий в основе повышения Ri при поражении сосудов почек, до конца не ясен. Установлена связь между повышенным внутрипочечным сосудистым сопротивлением и снижением функции почек. Снижение величины указанных выше показателей наблюдается в случаях развития артериовенозного шунтирования при истощении миогенного механизма регуляции внутрипочечной гемодинамики. Подключение данного механизма сопровождается снижением гидростатического давления в клубочках и в сосудах, ишемией клубочка и усугублением его склерозирования [10]. K. Galesic установил, что увеличение почечного сосудистого сопротивления по индексу Ri у пациентов с эссенциальной гипертензией отражает развитие нефросклероза, вызванного гипертензией [11]. Ю. Б. Перевезенцева показала, что при уровне Ri 0,71 можно предположить с высокой вероятностью наличие ТИПП [12]. Е. Б. Ольховой установлено, что уменьшение Vmax на почечной артерии менее 0,4 м/с является признаком снижения функции почки [13].
Таким образом, эхографические методы диагностики позволяют оценить не только анатомические, но и функциональные характеристики почек, в том числе и у больных без явных клинических проявлений ХБП, что позволяет использовать данный метод как для ранней диагностики, так и для диагностики прогрессирования ТИПП.
Материалы и методы исследования
Целью данного исследования было установить изменения параметров внутрипочечной гемодинамики у детей с пузырно-мочеточниковым рефлюксом (ПМР) и рефлюкс-нефропатией (РН) на разных стадиях ТИПП.
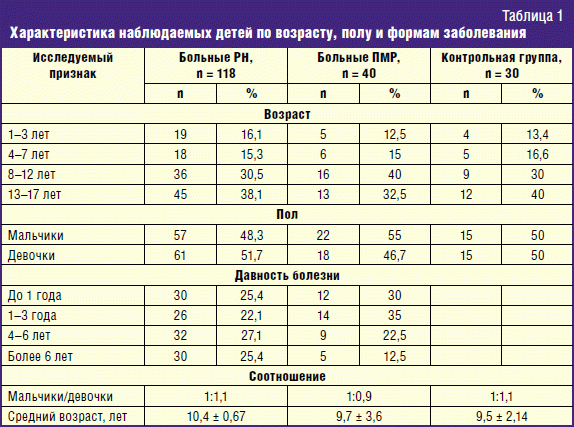
Проведено обследование 188 детей, в том числе 118 детей с РН на разных стадиях ТИПП; 40 пациентов с ПМР без признаков ТИПП, 30 детей контрольной группы (табл. 1).
Критерии включения пациентов в клиническое обследование:
- добровольное информированное согласие родителей ребенка на участие в клиническом обследовании;
- возраст пациентов от 1 года до 17 лет включительно;
- наличие верифицированных диагнозов по международным критериям: ПМР (комитет по интернациональному изучению ПМР, 1981), РН (J. M. Smellie, 1985).
Критерии исключения больных из исследования:
- отказ родителей от участия в клиническом обследовании;
- двусторонняя РН;
- двусторонний ПМР;
- ХБП III–V (С3-С5).
В результате проведенного обследования выделены следующие группы клинического наблюдения:
1) дети с ПМР без признаков ТИПП (n = 40);
2) дети с РН А (n = 30);
3) дети с РН В (n = 30);
4) дети с РН С (n = 30);
5) дети с РН D (n = 28).
Контрольную группу составили условно здоровые дети (n = 30).
При постановке диагноза РН использована классификация, предложенная J. M. Smellie, основанная на степени нефросклероза, верифицированного по результатам нефросцинтиграфии (НСГ):
- А — наличие не более двух очагов нефросклероза;
- В — выявление более двух очагов нефросклероза с сохранением участков неизмененной паренхимы;
- С — генерализованные изменения почечной паренхимы, уменьшение почки в размерах;
- D — конечная стадия сморщивания почки, с сохранением менее 10% функционирующей паренхимы [14].
Диагноз ПМР верифицировался на основании критериев, разработанных Комитетом по интернациональному изучению пузырно-мочеточникового рефлюкса в 1981 г. по степени заброса рентгеноконтрастного вещества и дилатации чашечно-лоханочной системы почек.
Клинико-параклиническое обследование детей проводилось в ГАУЗ ГКБ № 6 города Оренбурга.
Нефросцинтиграфия, позволившая верифицировать стадии РН, проводилась на базе отделений радиоизотопной диагностики ГБУЗ Оренбургская ОКБ.
Динамическая и статическая НСГ с фармпрепаратом, меченным 99mTc-пентатех, проводилась на сцинтиляционной γ-камере «МВ-9200» с оценкой обработки данных по программе «Сцинтипро», регистрирующей ангиографические, ренографические и сцинтиграфические показатели почек. По сцинтиграммам определяли форму, размер, положение почек, состояние их паренхимы, очаги патологического распределения радиофармпрепарата (РФП); по уровню накопления и характеру распределения активности в почечной паренхиме оценивали состояние гемодинамики почек и отдельных участков ее сосудистого русла:
- ВМН — время максимального накопления в секундах, характеризующее своевременность поступления препарата в сосудистое русло почек;
- максимальная активность (МА) — показатель, определяющий амплитуду ангиографической кривой и характеризующий достаточность поступления РФП в сосудистое русло почек, исчисляется собственным счетом компьютера (соб/с);
- ССП — средняя скорость прохождения РФП через сосудистое русло почек (соб/с);
- отношение средних скоростей обеих почек (вклад в суммарную скорость, ВСС) в %;
- отношение максимумов обеих почек (вклад в общее накопление, ВОН) в %.
Пациентам проводились ультразвуковое исследование почек с определением внутрипочечной гемодинамики в режиме допплерографии почечных сосудов, который состоит в возможности визуализации всех движущихся жидкостей организма в режиме реального времени и проведении анализа их движения. В основе — сочетание изображения органа, включая сосуды в В-режиме с одновременным исследованием кровотока в сосуде, основанном на использовании эффекта Допплера. Данная методика позволяет визуализировать деформации сосудов (изгибы, извитости, петли), которые могут иметь приобретенный характер в случае экстравазального воздействия, например, в результате рубцевания почечной паренхимы при вторичном сморщивании почки. В таком случае сосудистые деформации имеют множественный характер. В деформированных сосудах кровоток приобретает турбулентный характер и, в зависимости от формы и выраженности деформации, в таких артериях происходят различные изменения кровотока.
При дуплексном допплеровском сканировании проводилась последовательная локация почечной артерии в области почечного синуса, на уровне междолевой, сегментарной и дуговой артерий. Обследование начиналось с переднего доступа для визуализации проксимального отдела брюшной аорты в продольном сечении и отходящих от аорты чревного ствола и верхней брыжеечной артерии, которая является хорошим ориентиром при поиске почечных артерий. После получения изображений правой и левой почечных артерий в их устьях в режиме ЦДК определяли основные характеристики сосудов, кровотока. Из заднелатерального доступа получали изображение почки в ее воротах, в режиме ЦДК исследовали ход сосудистого пучка, направление кровотока и его параметры. После получения информации о кровотоке в основном стволе почечной артерии проводили оценку кровотока по внутрипочечным артериям, используя задний и боковой доступы. В режиме ЦДК определяли расположение сегментарных (область центрального эхо-комплекса почки), междолевых (проходят в мозговом веществе вдоль пирамид) и дуговых (огибают основания пирамид на границе коркового и мозгового вещества) артерий, направление кровотока; запись проводили при задержке дыхания пациента, чтобы предотвратить возникновение шумовых сигналов, связанных с движением органа.
Количественный анализ кровотока осуществляли с помощью компьютерной программы для сосудистых исследований по следующим параметрам:
- Vs — пиковая систолическая скорость кровотока (максимальный частотный сдвиг в систолу) — максимальная величина скорости в фазе систолы, мм/сек;
- Vd — конечная диастолическая скорость кровотока (минимальный частотный сдвиг в диастолу) — минимальная величина скорости в фазе диастолы, см/сек, которые зависят в основном от ударного объема крови, т. е. от сердечного выброса, в меньшей степени на них оказывает влияние свойства сосудистой стенки и реологические характеристики крови, мм/сек;
- индекс Stuart (систолодиастолическое соотношение, отражающее периферическое сопротивление);
- Ri — индекс резистентности;
- Pi — пульсационный индекс.
Ri и Pi позволяют косвенно судить о величине периферического сопротивления. Тестирование проводилось в режиме реального времени (real-time imaging), при этом оценивалось функциональное состояние нефрона путем искусственно созданных условий усиленной перфузии почек, а также оценки характера нарушений уродинамики верхних мочевых путей. Показатели сосудистых индексов рассчитывались автоматически по программе УЗ-аппарата при ручной обводке допплеровской кривой кровотока.
Всем детям проведена оценка функционального состояния почек по пробам Реберга с поправкой по формуле Шварца, Зимницкого, суточной экскреции с мочой титруемых кислот, аммиака. Верификация ХБП проводилась на основании критериев NKF/КDOQI (National Kidney Foundation/Kidney Disease Outcomes Quality Initiative) [1].
Статистическая обработка материала произведена путем вычисления средней арифметической (М), ошибки средней (m) с помощью биометрических методов анализа, коэффициента Стьюдента (t) с последующим нахождением уровня достоверности различий (р) по таблицам. Достоверным считали различие при р < 0,05.
Результаты
Нами проведено изучение параметров внутрипочечной гемодинамики по данным ультразвукового исследования почек в режиме центрального допплеровского картирования у пациентов с ПМР и на разных стадиях РН.
Нарушения показателей УЗИ в режиме ЦДК достоверно чаще встречались у больных с РН по сравнению с ПМР: асимметрия гемодинамических показателей, диффузное обеднение васкуляризации почек, турбулентность кровотока, локация редких, истонченных и деформированных сосудов (табл. 2).
Так, нарушения достоверно чаще встречались у больных с РН А по сравнению с ПМР по показателям: асимметрии гемодинамики (36,6% и 22,5% соответственно, p < 0,001), диффузного обеднения интраренального сосудистого рисунка за счет уменьшения или отсутствия мелких ветвей сегментарных артерий (36,6% и 22,5%, p < 0,001), турбулентности кровотока (36,6% и 7,5%, p < 0,001), локации редких, истонченных и деформированных сосудов (13,3% и 2,5%, p < 0,001).
Установлено, что у пациентов с выраженным нефросклерозом (РН С и D степени) по сравнению с РН А и В степени внутрипочечная гемодинамика характеризовалась достоверно более частыми нарушениями показателей ЦДК: турбулентности кровотока, асимметрии гемодинамических показателей, локации редких, истонченных и деформированных сосудов, диффузного обеднения васкуляризации.
У большинства больных с РН (78,8%, n = 71) по ЦДК кровоток был резко обеднен, не прослеживался до капсулы почки, что свидетельствует о значительной ишемии коркового слоя, отражая тяжелые сосудистые изменения в виде склероза, гиалиноза мелких артерий с сужением их просвета.
Таким образом, установлено, что по мере прогрессирования ТИПП происходит значительное нарушение параметров внутрипочечной гемодинамики по данным ЦДК, свидетельствующих о тяжелых ишемических сосудистых изменениях в почках.
При сравнении показателей импульсной допплерографии больных с ПМР без признаков нефросклероза, детей с РН на разных стадиях ТИПП установлены существенные различия скоростных показателей у пациентов всех сравниваемых групп.
Установлены существенные различия (p < 0,001) показателей систолической скорости кровотока (Vs) у пациентов с ПМР и начальной стадии ТИПП (РН А). По мере прогрессирования ТИПП отмечается снижение показателей Vs у пациентов с РН. Чем более выраженные склеротические изменения в почках, тем меньше показатели Vs, что говорит о развитии ишемических изменений в почках с развитием нарушения ренальной гемодинамики.
Нами установлены значимые изменения показателей внутрипочечной гемодинамики по данным определения Vd у пациентов с ПМР без признаков нефросклероза и пациентов с РН на разных стадиях ТИПП. Установлено, что по мере формирования ТИПП происходит нарушение внутрипочечной гемодинамики, характеризующееся значительным снижением показателей Vd у пациентов в начальной стадии нефросклероза (РН А) по сравнению с пациентами с ПМР без признаков ТИПП (5,95 ± 0,12 и 10,33 ± 0,33 соответственно). По мере прогрессирования ТИПП отмечается дальнейшее снижение показателей Vd у пациентов с РН (рис. 1).
При оценке показателей Ri нами не установлено статистически значимых различий (p > 0,001) данного показателя у пациентов с ПМР без признаков нефросклероза и пациентов в начальной стадии его формирования (РН А) (0,63 ± 0,01 и 0,63 ± 0,03 соответственно).
Данный факт расценен нами как формирование и развитие у пациентов с начальными склеротическими изменениями (РН А) артериовенозного шунтирования на юкстамедуллярном уровне для снижения периферического сосудистого сопротивления, а следовательно, внутрипочечной гипертензии при нефросклерозе, приводящих к его повышению, что согласуется с данными С. С. Пауновой [15], Е. Б. Ольховой [4]. Таким образом, артериовенозный шунт является компенсаторной мерой при повышенном периферическом сосудистом сопротивлении в почках в условиях склерозирования органа.
По мере прогрессирования ТИПП нами отмечается снижение показателя Ri у больных с РН (табл. 2). Тем не менее, нами не установлены статистически значимые различия (p > 0,001) показателей индекса резистентности (Ri) между пациентами с РН В и РН С (0,54 ± 0,04 и 0,5 ± 0,01 соответственно).
Отсутствие значимых статистических различий показателя Ri у пациентов с ПМР и РН А, РН В и РН С доказывает его низкую информативность и невозможность использования данного показателя как для ранней диагностики ТИПП у пациентов с ПМР, так и для диагностики прогрессирования ТИПП у пациентов с РН.
Нами установлены изменения (p < 0,001) показателей Pi у пациентов с ПМР без признаков нефросклероза и пациентов с начальной стадией РН. По мере формирования ТИПП происходит снижение Pi, который составляет у пациентов с ПМР 1,08 ± 0,05, а у пациентов с РН А 0,76 ± 0,03 (p < 0,001).
По мере прогрессирования ТИПП установлено дальнейшее снижение Pi у пациентов с РН. Тем не менее, нами не получено статистически значимых различий показателей Pi (p > 0,001) у пациентов на начальных стадиях прогрессирования ТИПП. Так, показатель Pi у пациентов с РН А составил 0,76 ± 0,03, а у больных с РН В 0,71 ± 0,02 (p > 0,001).
Таким образом, отсутствие статистически значимых различий (p > 0,001) Pi у пациентов на ранних стадиях формирования РН не позволяет его использовать в качестве критерия диагностики прогрессирования ТИПП. Тем не менее, учитывая существенные статистические различия (p < 0,001) показателя Pi у пациентов с ПМР без признаков нефросклероза и пациентов с начальной стадией РН, возможно использовать данный показатель для ранней диагностики ТИПП у пациентов с ПМР.
Нами установлены статистически значимые различия S/D как у пациентов с ПМР без признаков нефросклероза, так и у пациентов на разных стадиях РН. По мере прогрессирования ТИПП отмечается увеличение S/D, что позволяет использовать данный показатель как для ранней диагностики склеротических изменений у пациентов с ПМР, так и для диагностики прогрессирования ТИПП у больных РН.
Таким образом, нами установлены существенные изменения параметров внутрипочечной гемодинамики по данным допплерографии сосудов почек по таким показателям, как Vs, Vd, S/D. По мере формирования нефросклероза у пациентов с ПМР отмечается снижение внутрипочечного кровотока, доказываемое снижением Vs, Vd, увеличение S/D.
По мере прогрессирования ТИПП у пациентов с РН нами установлены дальнейшие нарушения ренальной гемодинамики, характеризующиеся снижением внутрипочечного кровотока, подтверждаемого снижением показателей Vs, Vd, увеличением S/D (рис. 2).
Нами не установлено статистически значимых различий (p > 0,001) показателей Ri у пациентов с ПМР без признаков нефросклероза и пациентов в начальной стадии его формирования (РН А), а также между пациентами с РН В и РН С, то есть по мере прогрессирования ТИПП. Отсутствие статистических различий показателя Ri у пациентов указанных выше групп сравнения доказывает его низкую информативность как для ранней диагностики склеротических изменений у пациентов с ПМР, так и для диагностики прогрессирования нефросклероза у пациентов с РН.
Нами не установлено статистически значимых различий показателей Pi (p > 0,001) у пациентов на начальных стадиях нефросклероза у пациентов с РН А и РН В, что не позволяет использовать его в качестве критерия диагностики прогрессирования ТИПП. Тем не менее, учитывая существенные статистические различия (p < 0,001) показателя Pi у пациентов с ПМР без признаков нефросклероза и пациентов с начальной стадией РН, возможно использовать данный показатель для ранней диагностики ТИПП у пациентов с ПМР.
Постадийное снижение параметров внутрипочечной гемодинамики подтверждено сравнительными данными нефросцинтиграфии, проведенной у детей с РН на разных стадиях ТИПП.
Установлено, что по мере инициации интерстициального повреждения и прогрессирования ТИПП происходит постадийное снижение показателей максимальной активности (МА), средней скорости прохождения РФП через сосудистое русло почек (ССП), вклада суммарных скоростей (ВСС) (p < 0,05).
Нами установлены различия (p < 0,001) показателей МА у пациентов с ПМР без признаков нефросклероза и по мере прогрессирования ТИПП у больных с РН (табл. 3). Установлено, что по мере как формирования, так и прогрессирования ТИПП отмечается снижение МА. При этом наиболее существенные статистические различия установлены между группами пациентов с ПМР без признаков нефросклероза (189,3 ± 6,07 соб/с) и пациентами с начальной стадией склерозирования почки (РН А — 81,5 ± 0,53 соб/с).
Сходная тенденция установлена нами при анализе показателей средней скорости прохождения РФП через сосудистое русло почек (ССП). Наиболее существенные статистические различия (p < 0,001) установлены между группами пациентов с ПМР без признаков нефросклероза (29,11 ± 0,93 соб/с) и пациентами с начальной стадией склерозирования почки (РН А — 11,5 ± 0,47 соб/с) (рис. 3). Таким образом, при формировании очагов склероза в почках на ранней стадии РН происходит резкое снижение показателя ССП, что говорит о значимом нарушении ренальной гемодинамики на данной стадии. По мере прогрессирования ТИПП у пациентов с РН происходит дальнейшее снижение показателя ССП, то есть дальнейшее прогрессирование нарушений внутрипочечной гемодинамики.
Нами установлены изменения вклада суммарных скоростей (ВСС) у пациентов с ПМР без признаков нефросклероза и детей с РН на разных стадиях прогрессирования нефросклероза. По мере формирования, а затем прогрессирования ТИПП установлено снижение показателя ВСС, что доказывает тяжелые сосудистые интраренальные гемодинамические изменения в почках при склерозировании органа.
Нами установлены нарушения параметров внутрипочечной гемодинамики и тубулярной функции почек по данным НСГ (табл. 4). По мере формирования ТИПП у пациентов с ПМР, а затем прогрессирования ТИПП у больных РН происходит постадийное снижение параметров внутрипочечной гемодинамики по показателям МА, ССП, ВСС.
Обсуждение
В результате проведенного исследования нами установлено стадийное снижение параметров внутрипочечной гемодинамики по данным допплерографии сосудов почек и НСГ. По мере инициации интерстициального повреждения и прогрессирования ТИПП у пациентов с РН отмечается стадийное снижение Vs, Vd, отражающее глубокие ишемические изменения в почках, в то время как увеличивается S/D.
Определение Pi является информативным только для ранней диагностики ТИПП у пациентов с ПМР, но не для диагностики прогрессирования ТИПП у пациентов с РН.
Определение Ri не является информативным как для ранней диагностики ТИПП у пациентов с ПМР, так и для диагностики прогрессирования ТИПП у пациентов с РН.
Таким образом, определение индексов в допплерографии сосудов почек является менее информативным как для диагностики ТИПП у пациентов с ПМР, так и для диагностики его прогрессирования у больных с РН по сравнению со скоростными характеристиками (Vd, Vs).
Параметры НСГ (МА, ССП, ВСС) могут быть использованы как для ранней диагностики ТИПП у пациентов с ПМР, так и для диагностики прогрессирования ТИПП у пациентов с РН.
Литература
- National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative clinical practice guidelines for chronic kidney disease in children and adolescents: evaluation, classification, and stratification // Pediatrics. 2003. Vol. 111. P. 1416–1421.
- Вялкова А. А. Актуальные проблемы тубулоинтерстициального поражения почек у детей // Педиатрия. 2008. Т. 87, № 3. С. 122–127.
- Паунова С. С. Патогенетические основы нефросклероза // Нефрология и диализ. 2005. № 2. С. 130–135.
- Ольхова Е. Б., Крылова Е. М., Ефремова И. И. Возможности ультразвуковой оценки состояния почек при рефлюкс-нефропатии у детей // Эхография. 2001. Т. 2, № 1. С. 61–67.
- Пыков М. И. Клиническое руководство по ультразвуковой диагностике в педиатрии/Под ред. М. И. Пыкова, К. В. Ватолина. М.: Видар, 1998. С. 410–429.
- Ольхова Е. Б., Копылова Е. М., Пачес О. А., Никитина С. Ю. Ультразвуковое исследование почек при пузырно-мочеточниковом рефлюксе у детей // Эхография. 2001. Т. 2, № 2. С. 201–211.
- Пыков М. И., Коровина Н. А., Скоков Ю. М. Допплерографический контроль почечного кровотока при нефропатиях у детей // Ультразвуковая диагностика. 1999. № 2. С. 63–69.
- Ольхова Е. Б. Эхографические аспекты нефросклероза детей // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. 2000. № 2. С. 136–142.
- Паунова С. С. Патогенетические основы формирования рефлюкс-нефропатии у детей. Автореф. дис. докт. мед. наук. М., 2004. 25 с.
- Iturbe B. R., Johnson R. J., Herrera-Acosta J. Tubulointerstitial damage and progression of renal failure // Kidney International. 2005. Vol. 68. Supp. 99. P. 82–86.
- Galesic K., Brkljacic В., Sabljar-Matovinovic M. et al. Renal vascular resistance in essential hypertension: duplex-Doppler ultrasonographic evaluation // Angiology. 2000. Vol. 51 № 8. P. 667–675.
- Перевезенцева Ю. Б., Смирнова Н. Н., Румянцева И. В., Беляев А. П. Особенности ренальной гемодинамики в условиях функциональной нагрузки // Нефрология. 2003. Т. 7. № 1. С. 51–57.
- Ольхова Е. Б., Крылова Е. М., Ефремова И. И. Ультразвуковая оценка хронического пиелонефрита у детей с пузырно-мочеточниковым рефлюксом // Нефрология и диализ. 2001. № 2. С. 299.
- Smellie J. M. Childhood reflux and urinary infection: a follow-up of 10–41 years in 226 adults // J. Pediatr. Nephrol. 1998. Vol. 12. P. 727–736.
- Паунова С. С. Рефлюкс-нефропатии. В кн.: Детская нефрология. Руководство для врачей/Под ред. М. С. Игнатовой. 3-е изд. М.: МИА. 2011. С. 502–511.
И. В. Зорин1, доктор медицинских наук
А. А. Вялкова, доктор медицинских наук, профессор
Л. В. Ванюшина, доктор медицинских наук, профессор
ГБОУ ВПО ОрГМУ МЗ РФ, Оренбург
1 Контактная информация: zorin2000@yandex.ru
Купить номер с этой статьей в pdf