Диабетическая стопа (ДС) — одно из наиболее частых и серьезных осложнений сахарного диабета (СД), поражающее до 15% пациентов [1], хотя по некоторым данным риск развития ДС у пациентов с СД может достигать 25% и выше [2, 3].
Из всех поздних осложнений СД поражения ног, видимо, наиболее предотвратимы [4]. Комплексные стратегии могут снизить необходимость ампутаций при СД на 49–85%. Всемирная организация здравоохранения (World Health Organization, WHO) и Международная диабетическая федерация (International Diabetes Federation, IDF) определили ближайшую цель — снижение ампутаций до 50% [5].
Имея сложный патогенез, диабетическая патология стопы отражает практически весь комплекс диабетических поражений и, как показал ряд исследований, является независимым предиктором смертности. Так, одно из завершившихся исследований — TRIAD (Translating Research Into Action for Diabetes) было посвящено изучению влияния патологии стопы на смертность в течение 10 лет (2000–2009 гг.) вне зависимости от других демографических, биологических или социоэкономических факторов. В проспективном исследовании наблюдались 6692 пациента, исходно имевших остеоартропатию Шарко (1%), язвенные поражения стоп (3%), анамнез ампутации конечностей (2%). За 10-летний период смертность составила 29%, при этом большинство смертельных случаев было связано с сердечно-сосудистой патологией. Ампутации были связаны с повышением 5-летней и 10-летней (39% и 67%) смертности. При этом большие ампутации повышали смертность почти на 85% (OR 1,89, 95% ДИ 1,18–3,01), малые — на 50% (OR 1,48; 95% ДИ 0,92–2,40) [6]. Недавно были опубликованы результаты метаанализа 8 исследований, выполненных в период 2006–2011 гг. и включивших 17 830 пациентов (81 116 человеко-лет наблюдения): 4 исследования были проведены в США, 2 — в Европе, 1 — в Австралии, 1 — в Юго-Восточной Азии. Средний возраст включенных пациентов варьировал от 58 до 73 лет, длительность СД — от 6 до 16 лет. Распространенность заболеваний сердца, инсультов, артериальной гипертензии и гиперхолестеринемии была выше среди пациентов с язвенными поражениями стоп. Результаты анализа показали, что язвенные поражения стоп примерно в 2 раза увеличива��т риск смертности от всех причин, превышая соответствующий риск при наличии СД без поражения стоп. Смертность среди пациентов с наличием язвенных поражений составила 99,9 на 1 000 человеко-лет, тогда как в популяции пациентов с СД без поражения стоп — 41,6 на 1 000 человеко-лет. Основной причиной смертности в обеих группах также были сердечно-сосудистые заболевания, причем не было различий между этими группами в кардиоваскулярных причинах смерти (43,6% и 44,2% соответственно для групп с поражением стоп и без таковых). Таким образом, повышенная смертность от всех причин при синдроме ДС лишь отчасти связана с сердечно-сосудистой патологией. Авторы делают закономерный вывод о том, что данное наблюдение предполагает необходимость более агрессивной модификации факторов риска сердечно-сосудистых заболеваний, а также профилактику образования язвенных поражений стоп с целью влияния на повышенный уровень смертности среди пациентов с язвенными дефектами стоп [7].
Факторами риска развития синдрома ДС являются нейропатия, патология периферических артерий, снижение резистентности к инфекциям, предсуществующий провоспалительный статус, курение и др. [4, 8–11]. Важнейшая роль принадлежит также деформациям стоп, повреждениям и неправильно подобранной обуви [12]. Наиболее частая триада причин развития ДС — нейропатия, деформация и травма [3]. Однозначно к группе риска относятся следующие категории пациентов [3, 13]:
- пациенты с дистальной полинейропатией на стадии клинических проявлений;
- лица с заболеваниями периферических артерий любого генеза;
- больные с деформациями стоп любого генеза;
- слепые и слабовидящие;
- больные с диабетической нефропатией и хронической почечной недостаточностью;
- одинокие и пожилые пациенты;
- злоупотребляющие алкоголем;
- курильщики.
Соответственно, в каждом клиническом случае важно оценить анамнез язвенных поражений стоп, ампутаций, развития стопы Шарко, хирургических операций на сосудах, ангиопластики, курения, признаков нейропатии (боль, парестезии, нарушения чувствительности и пр.), симптомов сосудистых поражений (боли при ходьбе и в покое, незаживающие язвы), других осложнений диабета (микроангиопатии) [3].
Ключевые позиции профилактики развития ДС среди пациентов группы риска [5]:
- регулярный осмотр и обследование стоп;
- выявление группы риска («стопа риска»);
- обучение пациентов, их семей, медицинских работников;
- удобная обувь;
- лечение неязвенной патологии.
Регулярный осмотр и выявление группы риска
Любые профилактические мероприятия начинаются со скрининга (рис. 1).
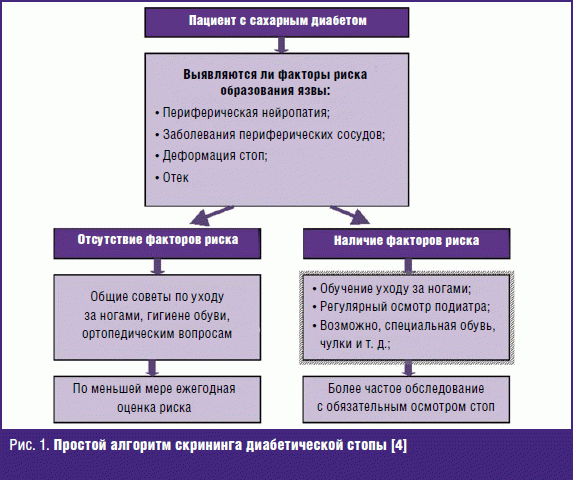
Обычный клинический осмотр даже без дополнительных сложных инструментальных методов исследования в немалой части случаев позволяет сориентироваться относительно наличия или отсутствия факторов риска, даже у пациентов, не предъявляющих каких-либо жалоб (табл. 1).
В частоте осмотров можно ориентироваться на классификацию категорий риска развития язвенных поражений стоп (табл. 2) [3].
Обучение пациентов, членов их семей и медицинских работников, участвующих в курации, удобная обувь
Обучение пациентов является важнейшей составляющей профилактической программы [14]. Как справедливо отмечают, «драматизм ситуации заключается в том, что у большинства больных, которые обращаются в кабинет диабетической стопы с трофической язвой, это осложнение можно было бы предотвратить» [15]. Простые правила должны соблюдаться пациентами под контролем членов их семей и медицинских работников.
Общие рекомендации для пациентов с СД:
- Пациент с сахарным диабетом.
- Ежедневный осмотр ног, включая зоны между пальцами.
- Пациенты, которые не в состоянии выполнить осмотр, должны привлекать других людей с соответствующими навыками (при значительном снижении зрения пациенты не должны сами пытаться осматривать ноги).
- Регулярный туалет ног с тщательным вытиранием кожи, особенно в зонах между пальцами.
- Температура воды для туалета ног всегда должна быть ниже 37 °C.
- Нельзя использовать нагреватели и грелки для согревания ног.
- Избегать ходить босиком в помещении и на открытом воздухе, носить обувь без носков.
- Нельзя использовать химические вещества и пластыри для удаления мозолей.
- Ежедневный осмотр и пальпация внутренней стороны обуви.
- Не носить тесную обувь или обувь с грубыми краями и неровными швами.
- Возможно использование увлажняющих масел и кремов, кроме зон между пальцами.
- Ежедневная смена носков.
- Носить носки, чулки со швами наизнанку или предпочтительно без швов.
- Никогда не носить тесные носки или гольфы.
- Стричь ногти, не скругляя свободные углы ногтевой пластины.
- Мозоли должны обрабатываться медицинским работником.
- Необходимо регулярно проводить осмотр ног медицинским работником.
- Необходимо своевременно сообщать медицинскому работнику о появлении мозоли, повреждения или боли в области стопы.
Ношение неправильно подобранной обуви — одна из основных причин развития язвенных дефектов стоп при СД (рис. 3). Две трети пациентов носят неправильно подобранную обувь [16].
В то же время известно, что правильно подобранная обувь может наполовину снижать повторное образование язв [17]. Основные требования к подбору обуви: отсутствие жесткого подноска, что делает верх обуви мягким и податливым; ригидная подошва, что значительно снижает давление в области передней подошвенной поверхности стопы; отсутствие швов внутреннего пространства обуви, что исключает вероятность образования потертостей [18].
Лечение неязвенной патологии и коррекция факторов риска
При наличии сопутствующих заболеваний кожи (мозоли, дерматозы), ногтей (микозы) необходимо провести соответствующее лечение у специалистов, при наличии деформации суставов стопы, по показаниям — хирургическую коррекцию.
Безусловным условием проведения любых профилактических и лечебных вмешательств среди пациентов группы риска является достижение индивидуально подобранной цели гликемического контроля и устранение или коррекция факторов риска развития ДС. Развитие ДС — сложный процесс взаимодействия множества патогенетических факторов, ни один из которых не является абсолютно достаточным для развития язвенного поражения стоп. Поэтому рациональная профилактическая технология должна быть комплексной, по возможности, воздействующей на все звенья патогенеза. В частности, при наличии признаков диабетической нейропатии, поражении периферических сосудов речь идет о специфической патогенетический терапии, успешное осуществление которой, к сожалению, не всегда достижимо.
Диабетическая нейропатия присутствует у 22–24% пациентов с диабетом [19, 20]. Риск развития язвенного поражения стоп у пациентов с СД и нейропатией в 7 раз выше, чем у пациентов с СД без нейропатии [19]. Можно говорить, что язвенное поражение стоп — конечная стадия развития нейропатии, существенно повышающая уровень затрат здравоохранения и значительно снижающая качество жизни пациентов [21, 22]. Логично полагать, что одной из основ профилактики развития синдрома ДС является профилактика возникновения и специфическое патогенетическое лечение диабетической нейропатии. Повышение уровня глюкозы крови является наиболее очевидным фактором развития нейропатии, а управление гипергликемией — задача в большинстве случаев решаемая. Однако относительно значимости гликемического контроля в предупреждении возникновения и прогрессирования периферической нейропатии данные противоречивы. Исследования DCCT и EDIC продемонстрировали, что снижение гликемии предупреждает развитие нейропатии, как и микрососудистых осложнений СД [23, 24]. Однако ряд исследований, в частности, Rochester Diabetic Neuropathy Study, VACSDM, Steno-2 Study, не подтвердили эти результаты как для автономной, так и для периферической нейропатии [25–27]. Не умаляя значимости контроля гликемии, следует говорить о поиске возможностей адекватного контроля и других патогенетических механизмов развития и прогрессирования нейропатии. Разрабатывается целый ряд новых перспективных направлений патогенетической терапии нейропатии, однако их результаты в большинстве не дошли до клинической практики. Так, неэффективными оказались ацетил-L-карнитин, фактор роста нервов, нейротропный фактор мозга; изъяты вследствие нежелательных лекарственных реакций аминогуанидин, несколько препаратов группы ингибиторов альдозоредуктазы, гамма-линоленовая кислота; противоречивы данные эффективности миоинозитола, эпалрестата, изосорбида динитрата; обнадеживают предварительные положительные результаты эффективности иАПФ [28].
Единственным средством на сегодняшний день, применяемым в клинической практике, является α-липоевая кислота. Исследование SYDNEY показало, что применение α-липоевой кислоты быстро и значимо улучшает нейропатические симптомы и функцию нерва у пациентов с дистальной нейропатией [29]. Результаты метаанализа небольших клинических исследований также показали удовлетворительную эффективность препарата [30]. Недостатком многих исследований, показавших некую эффективность α-липоевой кислоты, была оценка эффекта, ориентированная на суррогатные параметры (степень нарушения функции нерва), а не на клинически значимые исходы (предупреждение прогрессирования нейропатии до стадии формирования трофических язв или необходимости ампутации) [15]. По результатам целого ряда исследований, в том числе проспективных, плацебо-контролируемых, длительных, эффекты данного средства оказались неубедительными или противоречивыми [31–33]. Неоднозначность результатов исследований, посвященных изучению эффективности α-липоевой кислоты, ограничивает применение ее за рубежом, в то время как в России данное средство применяется достаточно широко, вероятно с расчетом на некоторое клиническое улучшение без влияния на снижение риска развития синдрома ДС [15]. Нужны дальнейшие тщательно спланированные исследования, которые смогут определить клиническую значимость применения α-липоевой кислоты с целью воздействия на патогенез диабетической нейропатии.
Патология периферических артерий — один из компонентов патогенеза ДС в трети случаев [3]. Распространенность диабетической макроангиопатии нижних конечностей при ультразвуковом скрининге, по различным данным, составляет 15–20% [15]. Составляющими профилактических программ развития синдрома ДС, ориентированных на макрососудистый атеросклеротический компонент патогенеза, безусловно, являются контроль гликемии, снижение массы тела при ее избытке, отказ от курения, нормализация артериального давления [15]. К сожалению, в реальной клинической практике отмечается явный уклон в сторону медикаментозной терапии. Вместе с тем одним из эффективнейших методов улучшения клинических симптомов и профилактики прогрессирования недостаточности периферического кровообращения (за счет развития коллатерального кровотока) является тренировочная ходьба для пациентов с хронической артериальной недостаточностью 2-й степени (противопоказана при 3–4 стадиях).
Наиболее целесообразный режим тренировочной ходьбы для пациентов с хронической артериальной недостаточностью 2-й степени [15]:
- Трехразовые тренировки в течение недели, которые вначале длятся по 30 мин, но затем удлиняются до 1 ч.
- Во время таких тренировок проводится упражнение на беговой дорожке с такими скоростью и углом наклона дорожки, что перемежающая хромота возникает в пределах 3,5 мин.
- Больной должен прекратить ходьбу при умеренной боли (менее положительный эффект достигается, когда пациент останавливается сразу при появлении малейшей боли).
- Затем больной отдыхает до уменьшения боли, после чего возобновляет ходьбу до возникновения умеренного мышечного дискомфорта.
- Такой цикл нагрузки и отдыха длится как минимум 35 мин в начале тренировок и возрастает до 50 мин, когда пациент адаптируется к тренировкам.
- Во время последующих тренировок увеличивается скорость или угол наклона дорожки.
- Дополнительная цель упражнения: достижение больным нормальной скорости ходьбы 4,5–5,0 км/ч, тогда как начальная скорость ходьбы пациента с хроническим облитерирующим заболеванием артерий нижних конечностей — 2,4–3,2 км/ч.
Диабетическая дислипидемия (нетипично малые, менее плотные липопротеиды низкой плотности (ЛПНП), гиперпродукция липопротеидов очень низкой плотности (ЛПОНП) и триглицеридов (ТГ), сниженная продукция липопротеидов высокой плотности (ЛПВП), увеличение периода полураспада липопротеинов) — наиболее изученный фактор риска развития и прогрессирования атеросклероза у пациентов с СД [4]. Снижение уровня атерогенных фракций — ключевая позиция первичных и вторичных профилактических воздействий. Препаратами первого выбора являются ингибиторы гидроксиметилглутарил-коэнзим-А-редуктазы (статины). Все пациенты с СД и периферическим атеросклерозом должны получать статины в эффективных дозировках, обеспечивающих достижение целевого уровня ЛПНП < 1,8 ммоль/л [34].
Несмотря на отсутствие специальных исследований, ориентированных на эффективность ацетилсалициловой кислоты в плане снижения риска прогрессирования ишемии нижних конечностей и предупреждения развития синдрома ДС, при наличии хронической артериальной недостаточности рекомендован ежедневный прием профилактических доз ацетилсалициловой кислоты (81–325 мг/сут) или, при наличии противопоказаний, клопидогреля [15, 34, 35].
К сожалению, в отношении методов медикаментозного воздействия для профилактики прогрессирования ишемии конечностей и развития ДС в отечественной практике существует множество мифов относительно неэффективности препаратов с доказанной эффективностью и безопасностью (статины) и эффективности средств, не имеющих достаточного уровня доказательности или просто не исследованных в указанном аспекте (вазоактивные препараты: Пентоксифиллин, простагландины и их аналоги, гепарины, Актовегин и пр.). Существуют убедительные доказательства эффективности (уровень А) только двух вазоактивных препаратов (цилостазола и нафтидрофурила), призванных улучшать кровоток и микроциркуляцию в ишемизированной конечности, в отношении клинических симптомов хронической артериальной недостаточности 2-й степени. В частности, новый для России препарат нафтидрофурил применяется в Европе с 1968 года. Один из наиболее полных метаанализов клинической эффективности препарата, основанный на данных нескольких крупнейших баз медицинских, биомедицинских и фармацевтических данных (Medline, International Pharmaceutical Abstracts, Embase), данных Кокрановского сотрудничества (Cochrane trial registers) и периодического издания Science Citation Index, включавший результаты 7 исследований (1266 пациентов с перемежающей хромотой, в том числе 13% пациентов с СД), показал клиническую эффективность нафтидрофурила в сравнении с плацебо в отношении увеличения дистанции ходьбы у пациентов с перемежающей хромотой [36]. В новой редакции руководства по диагностике и лечению заболеваний периферических артерий нижних конечностей Национального института здоровья и качества медицинской помощи (National Institute for Health and Clinical Excellence, NICE) только нафтидрофурил (не цилостазол) рекомендуется пациентам с перемежающей хромотой, которые не достигли значимого улучшения при дозированной ходьбе и отказываются от хирургического лечения, с оценкой эффекта в течение 3–6 месяцев терапии (увеличение длительности ходьбы, дистанции безболевой ходьбы) [37].
На основании данных анализа экономической эффективности в рекомендациях сделан вывод, что из всех изученных препаратов (Пентоксифиллин, цилостозол, нафтидрофурил и инозитол никотинат) клиническая эффективность терапии нафтидрофурилом оказалась лучшей, а затраты на лечение — наименьшими в расчете на каждый дополнительный год жизни пациента [37].
В настоящее время в России зарегистрирован только один препарат нафтидрофурила — Дузофарм. Дузофарм (нафтидрофурил) проявляет свои эффекты за счет селективной блокады серотониновых рецепторов класса 5НТ2, расположенных преимущественно в стенках артериол, тромбоцитах и эритроцитах, головном мозге. Защита клеток от агрессивного воздействия серотонина приводит к улучшению микроциркуляции и реологических свойств крови, за счет снижения агрегации тромбоцитов и эритроцитов. Уже после 7 дней применения нафтидрофурила повышается парциальное напряжение кислорода в тканях на 40%, улучшается метаболизм и кровообращение в ишемизированных областях [41]. Совокупность этих эффектов приводит к снижению болей и увеличивает максимальную и безболевую дистанцию при ходьбе [40], а также способствует уменьшению размера язвенной поверхности.
Дополнительный анксиолитический эффект препарата Дузофарм связан с влиянием на рецепторы серотонина класса 5НТ2 в головном мозге и может также рассматриваться как положительный у пациентов, страдающих СД. При применении нафтидрофурила (Дузофарм) не возникает синдром обкрадывания. Обусловлено это тем, что нафтидрофурил блокирует вазоконстрикцию, вызванную серотонином, не вызывая собственно вазодилятацию и, соответственно, синдром обкрадывания. Этот факт выгодно отличает нафтидрофурил от сосудорасширяющих препаратов.
К сожалению, применяемые сегодня вазоактивные препараты не влияют на прогрессирование атеросклероза [15, 35].
Диабетическая стопа — междисциплинарная проблема, требующая соответствующего консолидированного подхода, работы по единому принципу сплоченной врачебной бригады. Примером структуры многопрофильной врачебной бригады может быть бригада, включающая постоянных и приглашаемых специалистов (рис. 4).
В июне 2014 г. на очередной научной сессии Американской диабетической ассоциации (American Diabetes Association, ADA) были доложены результаты нового исследования в области управления поражениями ног при сахарном диабете. Был представлен ретроспективный анализ историй наблюдения 451 пациента с СД (средний возраст 55,9 года, 72,5% — мужчины, средний уровень гликированного гемоглобина (HbA1c) 9%), перенесшего ампутации нижних конечностей за период 2000–2011 гг. В этой группе пациентов 70% больных имели ишемическую болезнь сердца, 14% — терминальную стадию заболевания почек, 35% — анамнез злоупотребления психоактивными веществами, 62% были курильщиками, только 31% пациентов не имели указанных особенностей клинического статуса и анамнеза. Программа профилактики развития диабетической стопы, начавшая реализовываться с 2006 г., была основана на работе комплексной врачебной бригады, подразумевала регулярные запланированные осмотры ног, обучение пациентов, исследования сосудов ног, подбор обуви и уход за раной, при необходимости — хирургическое лечение, выполняемое по показаниям. Существовал единый протокол антимикробной терапии и эндоваскулярных техник для реваскуляризации. Во врачебную бригаду кроме подиаторов были включены инфекционист, фармаколог, интервенционный кардиолог. До внедрения программы, в течение 2000–2005 гг., более трети пациентов перенесли ампутацию конечностей (36,3%; 28,2–46,7%). Результатом реализации программы было снижение доли пациентов, перенесших ампутации (2006–2011 гг.), до 11% (3,7–18,9%) (р < 0,001). При этом между группами пациентов не было значимых различий по характеристикам заболевания, HbA
Литература
- Boulton A. J. et al. The global burden of diabetic foot disease // Lancet. 2005. V. 366. P. 1719–1724.
- Clayton W., Elasy T. A review of the pathophysiology, classification and treatment of foot ulcers in diabetic patients // Clinical Diabetes. 2009. V. 7. P. 52–58.
- Comprehensive Foot Examination and Risk Assessment. A report of the Task Force of the Foot Care Interest Group of the American Diabetes Association, with endorsement by the American Association of Clinical Endocrinologists // Diab. Care. 2008. V. 31. № 8. Р. 1679–1685.
- Кроненберг Г. М., Мелмед Ш., Полонски К. С., Ларсен П. Р. Сахарный диабет и нарушения углеводного обмена / Пер. с англ. под ред. И. И. Дедова, Г. А. Мельниченко. М.: ООО «Рид Элсивер», 2010. 448 с. (Серия «Эндокринология по Вильямсу»). Пер. изд. Williams Textbook of Endocrinilogy, 11 edition.
- Practical guidelines on the management and prevention of the diabetic foot 2011 // Diabetes Metab Res Rev. 2012. V. 28 (Suppl 1). P. 225–231.
- American Diabetes Association 2014 Scientific Sessions. 2014. Abstract 221-OR.
- Brownrigg J. R. W. et al. The association of ulceration of the foot with cardiovascular and all-cause mortality in patients with diabetes: a meta-analysis // Diabetologia. 2012. V. 55. P. 2906–2912.
- Dinh T. L., Veves A. A. A review of the mechanisms implicated in the pathogenesis of the diabetic foot // Int. J. Low Extrem. Wounds. 2005. V. 4. P. 154–159.
- American Diabetes Association. Consensus Development Conference on Diabetic Foot Wound Care // Diabetes Care. 1999. V. 22. P. 1354–1360.
- Dinh Th. et al. Mechanisms Involved in the Development and Healing of Diabetic Foot Ulceration // Diabetes. 2012. V. 61 (11). P. 2937–2947.
- Campbell I. W. Diabetic foot disease — new thoughts on prevention and treatment // British Journal of Diabetes and Vascular Disease. 2011. V. 11 (2). P. 53–54.
- Lavery L. A., Peters E. J., Armstrong D. G. What are the most effective interventions in preventing diabetic foot ulcers? // Int. Wound J. 2008. V. 5. P. 425–433.
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И. И. Дедова, М. В. Шестаковой. 6-й выпуск. М., 2013.
- Bruce D. G. et al. Diabetes education and knowledge in patients with type 2 diabetes from the community: the Fremantle diabetes Study // J. Diab. Complications. 2003. V. 17 (2). P. 82–89.
- Удовиченко О. В., Грекова Н. М. Диабетическая стопа. М.: Практическая медицина, 2010. 272 с.
- Harrison S. et al. Do patients with diabetes wear the correct sized shoes for their feet? // Int. J. Clin. Pract. 2007. V. 61. P. 1900–1904.
- Uccioli L. et al. Manufactured shoes in the prevention of diabetic foot ulcers // Diabetes Care. 1995. V. 18. P. 1376–1378.
- Галстян Г. Р., Токмакова А. Ю. Современные принципы ведения больных с синдромом диабетической стопы // Сахарный диабет. 2005. № 3. С. 26–32.
- Abbott et al. The North West Diabetes Care Foot study: incidence of, risk factors for, new diabetic foot ulceration in a community-based cohort // Diab. Med. 2002. V. 19. P. 377–384.
- Tesfaye S. et al. EURODIAB Prospective Complications study Group Vascular risk factors and diabetic neuropathy // N. Engl. J. Med. 2005. V. 352. P. 341–350.
- Frykberg R. G. et al. Diabetic foot disorders. A clinical practice guideline (2006 revision) // J. Foot Ankle Surg. 2006. V. 45 (5 Suppl). S1–66.
- Monastiriotis C., Papanas N., Veletza S., Maltezos E. APOE gene polymorphisms and diabetic peripheral neuropathy // Arch. Med. Sci. 2012. V. 8 (4). P. 583–588. doi: 10.5114/aoms.2012.30279.
- The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. // N. Engl. J. Med. 1993. V. 329 (14). P. 977–986.
- Martin C. L. et al. Neuropathy among the diabetes control and complications trial cohort 8 years after trial completion // Diabetes Care. 2006. V. 29 (2). P. 340–344.
- Dyck P. J. et al. Risk factors for severity of diabetic polyneuropathy: intensive longitudinal assessment of the Rochester Diabetic Neuropathy Study cohort // Diabetes Care. 1999. V. 22. P. 1479–1486.
- Azad N. et al. The effects of intensive glycemic control on neuropathy in the VA Cooperative Study on Type II Diabetes Mellitus (VA CSDM) // J. Diabetes Compl. 1999. V. 13. P. 307–313.
- Gaede P. et al. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes // N. Engl. J. Med. 2003. V. 348. P. 383–393.
- Tesfaye S. Recent advances in the management of diabetic distal symmetrical polyneuropathy // J. Diabetes Invest. doi: 10.1111/j.2040–1124.2010.00083.x.
- Ametov A. S. et al. SYDNEY Trial Study Group. The sensory symptoms of diabetic polyneuropathy are improved with alpha-lipoic acid: the SYDNEYtrial // Diabetes Care. 2003. V. 26. P. 770–776.
- Ziegler D. et al. Treatment of symptomatic diabetic polyneuropathy with alpha-lipoic acid: a meta-analysis // Diabetic Med. 2004. V. 21. P. 114–121.
- Ziegler D., Reljanovic M., Mehnert H., Gries F. A Alfa-Lipoic acid in the treatment of diabetic polyneuropathy in Germany: current evidence from clinical trials // Exp. Clin. Endocrinol. Diabetes. 1999. V. 107. P. 421–430.
- Boulton A. J. M. Management of diabetic peripheral neuropathy // Clin. Diab. 2005. V. 23. P. 9–15.
- Efficacy and Safety of Antioxidant Treatment With α-Lipoic Acid Over 4 Years in Diabetic Polyneuropathy The NATHAN 1 trial // Diabetes Care. 2011. V. 34, № 9. Р. 2054–2060.
- ESC/EAS Guidelines for the management of dyslipidaemias The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS), 2011 // E. Heart J. doi:10.1093/eurheartj/ehr169.
- Aslam F. et al. Peripheral Arterial Disease: Current Perspectives and New Trends in Management // South Med. J. 2009. V. 102 (11). P. 1141–1149.
- Layden J. et al. Diagnosis and management of lower limb peripheral arterial disease: summary of NICE guidance//B.M.J. 2012. V. 345. doi: http://dx.doi.org/10.1136/bmj.e4947.
- Lower limb peripheral arterial disease: diagnosis and managment. (Clinical guideline 147.) National Institute for Health and Clinical Excellence. 2012. http://guidance.nice.org.uk/CG147.
- http://www.medscape.com/viewarticle/827137#1.
- Parakramawansha R., Fisher M., McKay G. Naftidrofuryl // Practical diabetes. 2014. V. 31. № 3. Р. 129–130.
- Lehert P., Comte S., Gamand S, Brown T. M. Naftidrofuryl in intermittent claudication: a retrospective analysis // Journal of Cardiovascular Pharmacology. 1994. 23 (Suppl. 3), S48-S52.
- Sternitzky R., Kessler H., Mrowietz C., Pindur G., Jung F. Effect of naftidrofuryl on intramuscular partial oxygen pressure (pO2) prior to, during and after physical load on the treadmill in apparently healthy subjects // Clin Hemorheol Microcirc. 2002; 27 (3–4): 185–191.
И. В. Друк1, кандидат медицинских наук
Г. И. Нечаева, доктор медицинских наук, профессор
Е. А. Ряполова
ГБОУ ВПО ОмГМА МЗ РФ, Омск
1 Контактная информация: drukinna@yandex.ru
Купить номер с этой статьей в pdf