Часть 2. Начало статьи читайте в № 4, 2014 год
Поиск генетических маркеров при бронхиальной астме и ожирении
Анализ генетических основ различных заболеваний является наиболее стремительно развивающимся направлением современной науки.
Существенные успехи в расшифровке генетических маркеров стали возможными благодаря осуществлению проекта «Геном человека», в ходе выполнения которого была расшифрована нуклеотидная последовательность всех хромосом человека, его геном, то есть совокупность наследственного материала, заключенного в гаплоидном наборе хромосом клеток данного вида организмов. Генетическая характеристика вида в целом, эта энциклопедия жизни, записанная четырьмя буквами, оказалась гораздо сложнее, чем ожидали ученые. При реализации проекта «Геном человека», наиболее известного из многих международных геномных проектов, нацеленных на секвенирование ДНК конкретного организма, предполагалось получить важную информацию для понимания механизмов развития болезней. Однако работа над интерпретацией данных генома находится все еще в своей начальной стадии [34]. Поскольку астма рассматривается как иммуноопосредованное заболевание, приведем в качестве примера некоторые данные о генетическом контроле работы иммунной системы. Общее число генов, ответственных за иммунитет, составляет почти 6% от всего генома. Большая часть этих генов располагается на 6-й хромосоме. Иммунитет человека управляется 2190 генами. 2190 генов состоят из 166 миллионов нуклеотидных пар. Из 2190 генов 633 являются неактивными, то есть кодируемые ими белки никогда не синтезируются в клетках иммунной системы. Из оставшихся 1557 генов на данный момент изучены функции примерно половины, причем известно, что дефекты 130 генов могут провоцировать развитие нарушений иммунитета.
Что касается БА, то на сегодняшний день детально изучено несколько десятков генов, определяющих течение болезни и фенотипы БА, среди которых можно назвать «главные» гены, гены-«модификаторы» и гены-«кандидаты». Учитывая сложность патогенеза астмы, предполагают, что число генов-кандидатов заболевания достаточно велико [35–37] и среди них можно выделить несколько групп таких генов:
- Гены факторов антигенного распознавания и гуморального иммунного ответа. К ним относят прежде всего гены цитокинов (интерлейкины, интерфероны, факторы некроза опухолей и т. д.), а также гены рецепторов Т- и В-клеток и гены главного комплекса гистосовмес��имости.
- Гены факторов воспаления, среди которых, видимо, большую важность для астмы имеют гены собственно медиаторов воспаления белковой природы (например, некоторые протеазы) и ферментов их метаболизма, а также гены хемокинов и молекул межклеточной адгезии.
- Гены рецепторов цитокинов и агентов воспаления, чьи белковые продукты осуществляют фиксацию внешних молекул-лигандов на клетках-мишенях.
- Гены внутриклеточных сигнальных молекул. Это гены большой и гетерогенной группы белков, объединяемых в несколько семейств, которые осуществляют и контролируют трансдукцию сигнала лиганда на «чувствительные» генные локусы. К этой группе, видимо, можно отнести и факторы транскрипции, которые активируются при участии данных посредников.
- Другие гены, функционально имеющие отношение к БА, которые невозможно однозначно отнести ни к одной из указанных групп. В их числе можно рассматривать, например, исследуемые отечественными учеными гены биотрансформации ксенобиотиков, в частности, NAT2, CYP1A, GSTT1, GSTM1.
Идентификация кандидатных и других генов, полногеномный поиск генов с анализом сцепления БА с большим набором высокоинформативных генетических маркеров позволили выявить сцепление БА с локусами 5q31.1-33, 6p12-21.2, 11q12-13, 12q14-24.1, 13q12-22, 14q11-12, 16p12.1-11.2 и Xq28/Yq12. Именно здесь расположены наиболее важные гены заболевания, контролирующие ключевые звенья его патогенеза. Хромосома 5q23-34 содержит гены для β
Центральным компонентом изучения БА, важным для развития персонализированной медицины, являются фармакогенетические исследования, которые продемонстрировали, что высокая степень гетерогенности ответа пациентов с астмой на фармакотерапию бронходилататорами, ингаляционными ГКС, антилейкотриеновыми (АЛТ) препаратами обусловлена генетической изменчивостью.
Кроме того, геномный скрининг установил еще около 10–15 хромосомных участков, сцепленных с БА. Это данные свидетельствуют о том, что в развитие астматического синдрома включено множество различных генов, каждый из которых способен вносить небольшой вклад в общую генетическую базу заболевания. Показано также, что количество, а также соотносительная важность генов и эффектов окружающей среды или генов-модификаторов в развитии БА варьирует в зависимости от этнического фона. Эти различия могут лежать в основе межпопуляционной вариабельности заболеваемости астмой. Наконец, получила подтверждение идея о различных молекулярных основах БА и атопии: как правило, локусы, сцепленные с БА
Полногеномный поиск генов подверженности к БА проведен также у мышей, имеющих фенотипически сходные с астмой признаки: воспаление дыхательных путей, инфильтрацию эозинофилов и неспецифическую бронхиальную гиперреактивность [38].
В результате было установлено сцепление «астмы» с пятью генными локусами, причем четыре из них соответствуют гомологичным хромосомным областям, где локализованы гены-кандидаты заболевания у человека: 5q31, 6p21, 12q22-24, 17q12-22.
Перечень генов, связанных с ожирением, насчитывает около 300 вариантов [39–41]. Результаты, опубликованные в биологическом научном журнале Nature Genetics, представляют итоги исследования GIANT (Генетическое исследование антропометрических показателей). Специалистами проанализировано 2,8 миллиона вариантов генов, в результате пересмотрены роли ранее известных «генов ожирения» и обнаружены четыре гена, вариации которых связаны с ростом, а также семь ранее неизвестных генов, отвечающих за повышенную массу тела [42, 43].
Безусловный интерес вызывают гены, кодирующие инсулино-подобный фактор роста 1 (insulin-like growth factor 1 — IGF 1), выявленные гены ADAM 33 на хромосоме 20р13, DENND1 B на хромосоме 1q31 [44, 45].
Ассоциации ИМТ и астмы на генетическом уровне изучались многими исследователями, но ни одна из этих ковариаций не была значительной (после коррекции для многократного тестирования), никакой преобладающей ассоциации не обнаружено. Это объясняет гетерогенность патологических процессов и требует изучения других звеньев патогенеза, которые влияют на характер течения астмы, определяют или модифицируют подходы к диагностике и лечению и связаны с функционированием жировой ткани.
Характеристика воспаления и ответ на фармакотерапию
Жировая ткань обладает эндо-, ауто- и паракринной функциями, здесь вырабатываются различные адипокины с про- и противовоспалительным эффектом: лептин, интерлейкин-6, свободные жирные кислоты; протеин, стимулирующий ацетилирование; ингибитор активатора плазминогена-1 (ИАП-1); трансформирующий ростовой фактор В; ангиотензиноген и др. Жировая ткань содержит важные регуляторы липопротеинового метаболизма: ЛПЛ (липопротеиновую липазу), ГЧЛ (гормоночувствительную липазу), протеин, переносящий эфиры холестерина.
Баланс между противовоспалительными (адипонектин) и провоспалительными (лептин, резистин) адипокинами играет важную роль в ассоциативной связи ожирения и астмы [46].
Лептин, пептидный гормон, регулирующий энергетический обмен (его нередко называют «гормоном голода») в физиологических условиях регулирует потребление энергии и ее расходование. Первоначально описанный как «гормон антитучности», лептин в настоящее время рассматривается как регулятор основного обмена, кроветворения, термогенеза, репродукции, ангиогенеза. Несмотря на то, что лептин действует в качестве гормона, способствующего снижению массы тела, у людей и животных, страдающих ожирением, его концентрация в крови резко повышена, а инъекции экзогенного лептина не дают никакого клинического эффекта. Вероятно, в этом случае наблюдается нарушение каких-либо других компонентов сигнального пути данного гормона, а организм безуспешно пытается компенсировать это, повышая уровень секреции собственного лептина. Как цитокин, лептин обеспечивает тимический гомеостаз и может влиять на секрецию цитокинов острой фазы, таких как ИЛ-1 и ФНО-α. Лептин связан со статусом питания и провоспалительным Th1-иммунным ответом. Снижение концентрации лептина в плазме во время лишения пищи приводит к нарушению иммунной функции. Подобно другим провоспалительным цитокинам лептин, способствуя дифференциации Th1-клеток, может модулировать начало и прогрессирование аутоиммунных реакций [47].
Современные концепции предполагают, что в ходе развития ожирения гипертрофия жировой ткани приводит к местной тканевой гипоксии, фокальному некрозу адипоцитов и, как следствие этого процесса, к усилению рекрутирования макрофагов через активацию толл-подобных рецепторов (TLR). В результате активации макрофагов повышается секреция ФНО-α, ИЛ-1, ИЛ-6, активируются молекулы адгезии, фагоцитоз, оксидативный стресс. Лептин влияет на воспаление путем усиления синтеза и высвобождения лейкотриенов из альвеолярных макрофагов и лимфоцитов [48, 49]. Такую гипотезу подтверждают результаты исследований, где было продемонстрировано, что лептин in vitro и in vivo регулирует систему интерлейкинов [50]. Примечательно, что в детстве уровень лептина выше у мальчиков, чем у девочек, что может объяснять превалирование астмы у мальчиков, а уровень лептина среди взрослых выше у женщин, чем у мужчин, как и уровень заболеваемости БА.
Специфическая роль лептина в развитии астмы между тем еще далека от разрешения. Роль и место активации других клеток, изменения процессов сигнальных путей, поляризации Т-клеток и активации Th2-ответа, роль трансформирующего фактора роста TGF-β, эотаксина продолжают изучаться [18, 46].
Другие цитокины жировой ткани также участвуют в патогенезе различных воспалительных реакций при ожирении и астме. CXCL5 — цитокин, который производится жировыми клетками в ответ на ФНО, вырабатываемый резидентными макрофагами, и может вызвать несколько связанных с ожирением осложнений, таких как астма, атеросклероз, заболевания кишечника, колиты, сахарный диабет и ретинопатии [51, 52].
Результаты исследований последних лет свидетельствуют о важной роли хронического воспаления жировой ткани, которое рассматривается как следствие и причина ожирения и связанных с ним многочисленных заболеваний. Это воспаление характеризуется клеточной инфильтрацией, фиброзом, изменениями микроциркуляции, сдвигом секреции адипокинов и нарушениями метаболизма жировой ткани, повышением в крови уровня таких неспецифических маркеров воспаления, как С-реактивный белок, фибриноген, выдыхаемый оксид азота (FeNO), лейкоциты, коррелирующих с выраженностью процесса [53].
При воспалении жировой ткани, как и при других воспалительных процессах, развивается фиброз. Адипоциты и преадипоциты под влиянием активированных макрофагов продуцируют компоненты экстрацеллюлярного матрикса, локализующиеся в виде аморфной зоны вокруг адипоцитов и свидетельствующие о повреждении жировой ткани. Примечательно, что снижение веса в результате хирургического лечения больных с ожирением приводило к уменьшению системных параметров воспаления и инфильтрации жировой ткани макрофагами, но не снижало степень фиброза. Подобная ирреверсибельность (необратимость) фиброза в определенной степени объясняет безуспешность терапии ожирения у части больных, несмотря на адекватность проводимого лечения [54, 55].
Как в развитии астмы, так и ожирения принимают участие тучные клетки, которые являются одновременно источником и мишенью для адипоцитокинов. Под действием сигнализационных молекул при метаболическом синдроме наблюдается изменение секреции ИЛ-9, ИЛ-33, стрессорных молекул, включая кортикотропин-высвобождающий гормон (CRH) и нейротензин (NT). В свою очередь, CRH и NT оказывают синергетический эффект на секрецию тучными клетками сосудистого эндотелиального фактора роста (VEGF). ИЛ-33 усиливает высвобождение VEGF, индуцированное субстанцией Р (SP), и высвобождение ФНО, индуцированное нейротензином. Как ИЛ-9, так и ИЛ-33 способствуют инфильтрации легких тучными клетками и увеличивают аллергическое воспаление, малочувствительное к ГКС и бронходилататорам. Эти молекулы, экспрессированные на тучных клетках человека, оказывают аутокринный эффект [56].
Патогенетическое значение воспаления жировой ткани для развития бронхиальной астмы имеют медиаторы воспаления, продуцируемые жировой тканью, которые, с одной стороны, могут модулировать иммунные реакции в легких; с другой стороны, хроническое устойчивое, хотя и невысокое по интенсивности, воспаление в жировой ткани влияет
на готовность дыхательных путей к развитию обструкции. Ожирение приводит к снижению эластичности легких, падению легочных объемов и уменьшению калибра дистальных дыхательных путей, а также гиперреактивности бронхов, изменению легочного кровотока, вентиляционно-перфузионному несоответствию, формированию хронической обструкции дыхательных путей из-за нарушения тонуса и сокращения гладких мышц. Это становится важным механизмом усугубляющего воздействия ожирения на течение астмы и тяжесть ее проявлений [57–59].
Идентификация фенотипов БА с помощью кластерного анализа, проведенная в нескольких исследованиях за последнее время, позволяет выделить фенотип тяжелой БА, которая характеризуется поздним началом, большей распространенностью среди женщин, страдающих ожирением и имеющих неэозинофильное воспаление дыхательных путей [60–63].
Механизм неэозинофильного воспаления до конца не ясен, но считают, что нейтрофильный тип воспаления дыхательных путей при БА ассоциирован с повышением уровней ИЛ-8, нейтрофильной эластазы и высокомолекулярной формы матриксной металлопротеиназы-9. Последнее свидетельствует о снижении активности тканевых ингибиторов матриксных металлопротеиназ [64].
В то же время развитие ожирения связано с огромным количеством различных изменений в структуре жировой ткани, включающих не только адипогенез, ангиогенез, но и протеолиз внеклеточного матрикса [65].
Активация этих энзимов может модифицировать структуру дыхательных путей и обусловливать прогрессивное снижение функции легких. В любом случае нейтрофильное воспаление при БА связано со значительным ослаблением ответа на терапию противоастматическими препаратами, что характерно для фенотипа астмы с ожирением.
Эти данные определенно свидетельствуют о наличии постоянных трудностей, возникающих при лечении таких больных. Очевидно, что в данном случае речь идет о существенно меньшей степени контроля астмы препаратами базисной терапии, в том числе и из группы ингаляционных глюкокортикостероидов (ИГКС). Это может быть связано как с недостаточностью применяемой дозы, так и с возможным развитием толерантности к данной группе препаратов на молекулярно-клеточном уровне. Кроме того, сама терапия высокими дозами ГКС (прежде всего системная) может приводить к девиации воспаления в сторону преобладания нейтрофильного типа, т. к. ГКС способны тормозить апоптоз нейтрофилов, что было показано в исследовании in vitro [66, 67]. В настоящее время не определен маркер нейтрофильного воспаления при БА, который мог бы служить критерием эффективности терапии.
Более высокая частота обострений течения астмы у больных с ожирением также неизбежно приводит к увеличению применения бронхолитических препаратов из групп бета-агонистов, холинолитиков или их комбинации в качестве средств неотложной помощи. Регулярное использование данных препаратов с частотой более двух раз в сутки также свидетельствует о недостаточном контроле астмы и, кроме того, сопряжено с развитием ряда неблагоприятных побочных эффектов. Для пациентов старших возрастных групп, к которым преимущественно и относятся больные астмой с ожирением, побочные эффекты бронхолитиков на сердечно-сосудистую систему могут оказаться достаточно серьезным препятствием к их повседневному применению или даже стать источником дополнительных сопутствующих заболеваний. Кроме того, сам факт зависимости пациента от препаратов неотложной помощи существенно снижает качество его жизни даже вне зависимости от возможных побочных эффектов такой терапии [68].
Авторы [68] провели post-hoc (лат. — «после этого», ретроспективный) анализ, обобщив данные по четырем двойным слепым плацебо-контролируемым исследованиям, в котором прошли рандомизацию 3073 взрослых пациента со среднетяжелой астмой, получавшие монтелукаст (n = 1439), беклометазон (n = 894) или плацебо (n = 740). Первичной конечной точкой было определение числа дней контролируемой астмы; другими конечными точками были показатели ОФВ1, потребность в бета-агонистах и частота ночных пробуждений. Анализы проводились с использованием классификации ИМТ как нормальное значение (< 25,0–52% пациентов), избыточный вес (25–29,9–32%) и ожирение (≥ 30,0–16%) категории, а также ИМТ как непрерывной переменной.
Лечебные группы были сбалансированы для ИМТ, демографических характеристик и параметров контроля астмы. Реакция на плацебо для всех конечных точек была в целом ниже с увеличением ИМТ. Аналогичным образом она снизилась в ответ на ингаляционные ГКС, но оставалась стабильной в ответ на антагонисты лейкотриенов (рис.).
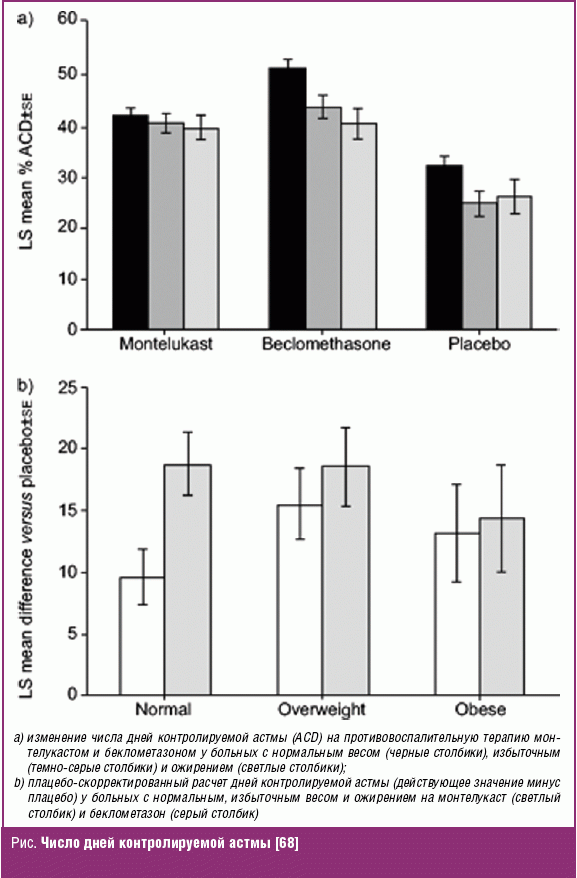
Данные приведенного исследования показывают, что ИМТ может влиять на естественное течение астмы и ее контроль (как это отражено в ответе на плацебо) и терапию ингаляционными ГКС- и АЛТ-препаратами (ответ на терапию ингаляционными ГКС снижается с повышением ИМТ, тогда как ответ на монтелукаст не меняется с повышением ИМТ).
Для объяснения стабильности ответа на АЛТ-препараты можно принять во внимание дополнительный факт о том, что ожирение у больных БА ассоциировано с повышенным уровнем лейкотриен ЛТЕ4/креатинин в моче, по сравнению с больными БА без ожирения и здоровыми лицами. При этом уровень лептина имел положительную, а адипонектина — отрицательную связь с ЛТЕ4/креатинин в моче [69].
Резистентность пациентов с ожирением к базисной терапии при астме подтверждена на разных группах больных с избыточным ИМТ. У тучных пациентов с астмой отмечается более низкий уровень ответа на ингаляционные ГКС как основу длительной терапии для контроля заболевания. Существенно, что такая же закономерность наблюдалась и для комбинированных препаратов, содержавших в своем составе помимо ИГКС также и бета-агонисты [70]. Критерием недостаточной эффективности терапии могут выступать, помимо более высокой применяемой дозы, частота экстренного использования бета-агонистов для купирования симптомов, наличие приступов в ночное время, частота и тяжесть обострений, а также маркеры воспаления.
У пациентов с избыточным весом и персистирующей астмой на фоне 4-недельной терапии ИГКС отмечалось уменьшение оксида азота в выдыхаемом воздухе при незначительном замедлении разрешения симптомов астмы и при этом прирост ОФВ1 и снижение гиперреактивности в пробе с метахолином такие же, как и у пациентов с нормальным весом [71].
Резистентность к базисной терапии астмы у больных с ожирением требуют разработки новых направлений в оптимизации лечения таких пациентов [72].
Во-первых, это повышение дозы используемых препаратов ИГКС с учетом дозозависимого эффекта их действия. Альтернативой этому может быть более широкое применение АЛТ-препаратов, усовершенствование самих молекул ИГКС, размеров ингаляционных частиц и способов доставки непосредственно в мелкие дыхательные пути — ту зону, где наиболее значимо проявляются последствия воспаления.
Определенные надежды связываются также с возможным участием тучных пациентов с астмой в специализированных программах по снижению веса.
Влияние программ коррекции веса на течение бронхиальной астмы у больных с ожирением
Среди опубликованных в последние годы работ представлены данные с разным уровнем доказательности о том, что снижение веса у больных с избыточным ИМТ оказывает благоприятное действие на общий статус здоровья и улучшает контроль астмы; функцию легких (особенно колебания пиковой скорости выдоха (ПСВ)); уменьшает тяжесть симптомов астмы и улучшает состояние здоровья (уровень доказательности B) [73, 74].
Позитивные результаты наблюдались при использовании хирургических методов лечения ожирения. Бариатрическая хирургия сопровождалась сокращением использования противоастматических препаратов [75].
Значительная часть исследований, посвященных последствиям потери веса при астме после хирургических или диетических мероприятий, носит преимущественно наблюдательный характер. В то время как хорошо спланированных доказательных исследований для подтверждения положения о том, что потеря веса может рассматриваться как особый терапевтический подход, направленный на улучшение течения астмы при ведении пациентов с фенотипом астмы, ассоциированной с ожирением, в настоящее время не хватает.
Поэтому особую ценность представляет позиционная статья (руководство) Европейской академии аллергологии и клинической иммунологии (European Academy of Allergology and Clinical Immunology, EAACI) «Вмешательства по снижению веса при бронхиальной астме», основанная на доказательной клинической практике [76].
Авторами подготовлен систематический обзор трех больших биомедицинских баз данных. Исследования были тщательно изучены и критически оценены в соответствии с системой доказательств по шкале GRADE.
В последние 10 лет международная группа экспертов активно развивает и внедряет новую систему оценки доказательности и силы клинической информации GRADE (Grading of Recommendations Assessment, Development and Evaluation; http://www.gradeworkinggroup.org). Система GRADE была разработана для написания систематических обзоров и вынесения рекомендаций, касающихся альтернативных подходов к лечению (в том числе отсутствия лечения и современных стандартов лечения). Данная система оценки применима для решения широкого спектра клинических вопросов, включая диагностику, скрининг, профилактику и терапевтическое лечение, а также вопросов общественного здравоохранения. В настоящее время эта система принята ведущими международными и национальными медицинскими организациями как наиболее оптимальный принцип градации клинической информации для использования ее оценок в клинических рекомендациях [77, 78]. Уровни достоверности доказательств по системе GRADE включают 4 категории: высокий, средний, низкий и очень низкий уровни. По умолчанию, доказательства, основанные на результатах рандомизированных клинических исследований (РКИ), относятся к высокому уровню достоверности, а доказательства, основанные на результатах обсервационных исследований, к низкому уровню достоверности доказательств.
Основные критерии, которые авторы принимали во внимание при отборе клинической информации:
- четкое и однозначное определение клинических исходов;
- использование стандартного метода лечения в контрольной группе;
- однозначный и точный алгоритм критериев и методов отбора клинических групп;
- однозначное определение когорт исследования;
- эпидемиологические цифровые характеристики полученных в исследовании клинических эффектов.
Авторы использовали клиническую информацию с высоким уровнем качества в результатах метаанализа клинических исследований, который был выполнен по специальному алгоритму. Такой подход и обобщающие исследования позволили получить наиболее корректные результаты.
В систематический обзор было включено тридцать исследований, соответствующих критериям отбора, при этом в трех исследованиях в качестве вмешательств для снижения веса использована диета, в одном исследовании — дополнительно к диете использовались лекарственные препараты для лечения ожирения, и в четырех — представлены результаты бариатрической хирургии. Остальные 22 исследования носили наблюдательный характер. В систематическом обзоре исследований, включающих лиц любого возраста и пола с диагнозом астмы независимо от степени тяжести, предшествующего или текущего лечения, сравнивали или оценивали эффект от изменения веса (естественного или индуцированного соответствующим вмешательством) в качестве первичной конечной точки рассматривали количество обострений БА, требующих госпитализации или применения оральных стероидов. В качестве вторичных оценочных критериев (с возможными вариантами I–IV) рассматривали исходы, отражающие изменение контроля персистирующей астмы, например, (I) изменения в симптомах, качестве жизни и использовании быстродействующих скоропомощных β
Показано, что ожирение повышает риск развития астмы (отношение шансов) у взрослых в 1,82 раза (с 95% ДИ 1,47–2,25), и у детей в 1,98 (95% ДИ 0,71–5,52).
Среди включенных в систематический обзор исследований только одно соответствовало критерию высокого уровня достоверности доказательств, но с ограниченным числом участников [73]. В этом клиническом рандомизированном контролируемом исследовании в течение года наблюдения после реализации программ снижения веса отмечалось значительное улучшение среднего балла по шкале симптомов, использованию препаратов неотложной помощи и числу обострений астмы в группе вмешательства. В других исследованиях (где использовались как терапевтические, так и хирургические подходы к снижению веса) были получены улучшения изучаемых исходов, но уровень достоверности доказательств расценивался как низкий из-за ограничений в дизайне и отсутствии надлежащего контроля.
Преимущества потери веса для улучшения функции внешнего дыхания были зарегистрированы в ряде исследований. Однако эти преимущества были не столь впечатляющими, хотя и статистически достоверными: улучшение ОФВ
О влиянии потери веса при астме на маркеры воспаления сообщалось в трех включенных в обзор наблюдательных исследованиях. В самом крупном из них не было обнаружено изменений в уровнях выдыхаемого оксида азота.
Несмотря на противоречивость данных наблюдательных исследований, определенные ограничения и слабое методическое качество публикаций, свидетельствующих о благотворном влиянии похудения на астму, нельзя не принять во внимание данные из РКИ оценки воздействия 14-недельного диетического вмешательства для потери веса, которое показало улучшение контроля астмы и функции легких, уменьшение симптомов и улучшение состояния здоровья даже спустя год после вмешательства [74]. Это дает основание рассматривать рекомендацию управления весом и борьбы с ожирением как неотъемлемую часть лечения ассоциированной с ожирением астмы.
Таким образом, ассоциация между ожирением и астмой не является обычным статистическим совпадением, систематическим сочетанием двух распространенных заболеваний. Взаимосвязь между астмой и ожирением строго соответствует критериям коморбидности, включающим наличие причинно-следственных связей; общих факторов риска, обусловленных взаимодействием генетики и окружающей среды; дозозависимых взаимоотношений, биологической вероятности, соответствующей по времени последовательности наступления событий. Необходимо развивать и поддерживать РКИ высокого качества для создания рекомендаций по снижению факторов риска (баланс между питанием и расходом энергии, управление весом, физическая активность, отказ от курения) при астме в сочетании
Литература
- Lavie P. Who was the first to use the term Pickwickian in connection with sleepy patients? History of sleep apnoea syndrome // Sleep Med Rev. 2008; 12 (1): 5–17.
- Osler W. Principles and Practice of Medicine. 6 th ed. London: Sidney Appleton; 1905.
- Burwell C. S., Robin E. D., Whaley R. D., Bicklemann A. G. Extreme obesity associated with alveolar hypoventilation; a Pickwickian syndrome (англ.) // Am. J. Med. 1956. Т. 21. № 5. С. 811–818.
- WHO. Prevention and management of the global epidemic of obesity. Report of the WHO consultation on obesity. Geneva; 1997.
- ВОЗ. Информационный бюллетень № 311, март 2013 г. Ожирение и избыточный вес. http://www.who.int/mediacentre/factsheets/fs311/ru/.
- Stevens G. A., Finucane M. M,. Paciorek C. J. et al. Nutrition Impact Model Study Group (Child Growth). Trends in mild, moderate, and severe stunting and underweight, and progress towards MDG 1 in 141 developing countries: a systematic analysis of population representative data // Lancet. 2012, Sep 1; 380 (9844): 824–834.
- Finucane M. M., Stevens G. A., Cowan M. J. et al. Global Burden of Metabolic Risk Factors of Chronic Diseases Collaborating Group (Body Mass Index). National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9×1 million participants // Lancet. 2011, Feb 12; 377 (9765): 557–567.
- FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS Rome, 2013. Доклад ООН, 2013.
- Российский мониторинг экономического положения и здоровья населения (РМЭЗ, 1994–2010).
- Петеркова В. А., Ремизов О. В. Ожирение в детском возрасте // Ожирение и метаболизм. 2004. № 1. С. 17–23.
- Дедов И. И. и соавт. Ожирение у подростков в России // Ожирение и метаболизм. 2006, № 4.
- Global Burden of Asthma, 2004.
- Bousquet J. et al. The public health implications of asthma // Bulletin of the World Health Organization. 2005; 83: Jul. 548–554.
- Чучалин А. Г. Пульмонология. М.: Белая книга. 2003.
- Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика» (4-е издание, испр. и доп.). 2012. 182 с.
- Brüske I., Flexeder C., Heinrich J. Body mass index and the incidence of asthma in children // Curr Opin Allergy Clin Immunol. 2014, Feb 4.
- Beuther D. A., Sutherland E. R. Overweight, obesity, and incident asthma: a meta-analysis of prospective epidemiologic studies // Am J Respir Crit Care Med. 2007, Apr 1; 175 (7): 661–666.
- Weiss S. T. Obesity: insight into the origins of asthma // Nat Immunol. 2005; 6 (6): 537–539. Review.
- Taylor B., Mannino D., Brown C., Crocker D., Twum-Baah N., Holguin F. Body mass index and asthma severity in the National Asthma Survey // Thorax. 2008; 63 (1): 14–20.
- Gibeon D., Batuwita K., Osmond M. et al. Obesity–Associated Severe Asthma Represents a Distinct Clinical Phenotype: Analysis of the British Thoracic Society Difficult Asthma Registry Patient Cohort According to BMI // Chest. 2013, v. 143, № 2.
- E. R. Sutherland, Goleva E., King T. S. et al. Cluster Analysis of Obesity and Asthma Phenotypes // PLoS ONE (www.plosone.org). 2012, vol. 7, Is. 5, e36631.
- Saint-Pierre P., Bourdin A., Chanez P., Daures J. P., Godard P. Are overweight asthmatics more difficult to control? // Allergy. 2006, 61, 79–84.
- Boulet L. P. Asthma and obesity // Clin Exp Allergy. 2013; 43 (1): 8–21; Juel C. T., Ulrik C. S. Obesity and asthma: impact on severity, asthma control, and response to therapy // Respir Care. 2013; 58 (5): 867–873.
- Marcon A., Corsico A., Cazzoletti L., Bugiani M., Accordini S., Almar E. et al. Body mass index, weight gain, and other determinants of lung function decline in adult asthma // J Allergy Clin Immunol. 2009; 123: 1069–1074.
- American Lung Association Asthma Clinical Research Centers. Clinical trial of low-dose theophylline and montelukast in patients with poorly controlled asthma. // Am J Respir Crit Care Med. 2007; 175: 235–242.
- Dixon A. E., Shade D. M., Cohen R. I. et al. Effect of obesity on clinical presentation and response to treatment in asthma // J Asthma. 2006; 43 (7): 553–558.
- Бойков В. А., Кобякова О. С., Деев И. А. и соавт. Состояние функции внешнего дыхания у пациентов с ожирением // Бюллетень сибирской медицины. 2013, т. 12, № 1, с. 86–92.
- Lessard A., Alméras N., Turcotte H., Tremblay A., Després J. P., Boulet L. P. Adiposity and pulmonary function: relationship with body fat distribution and systemic inflammation // Clin Invest. Med. 2011. Apr. 1. № 34 (2). Р. 64–70.
- Tantisira K. G., Weiss S. T. COMPLEX INTERACTIONS IN COMPLEX TRAITS: OBESITY AND ASTHMA // Thorax. 2001; 56 (Suppl II): ii64– ii74.
- Brashier В., Salvi S. Obesity and Asthma: Physiological Perspective Hindawi Publishing // Corporation Journal of Allergy. 2013, 1–11.
- Авдеев С. Н. и соавт. Согласованные рекомендации по обоснованию выбора терапии бронхиальной астмы и хронической обструктивной болезни легких с учетом фенотипа заболевания и роли малых дыхательных путей // Атмосфера. 2013, № 2.
- Sutherland R. Linking obesity and asthma. Annals of the New York Academy of Sciences 2014; AOP: 10.1111/nyas.12357.
- Hallstrand T. S. et al. Genetic pleiotropy between asthma and obesity in a community-based sample of twin // Journal of Allergy and Clinical Immunolog. 2005, vol. 116, 6, p. 1235–1241.
- Report on the Human Genome Initiative for the Office of Health and Environmental Research.
- Hall I. P. Genetics and pulmonary medicine 8: asthmа // Thorax. 1999; 54 (1): 65–69. Review.
- Фрейдин М. Б., Огородова Л. М., Цой А. Н., Бердникова Н. Г. Генетика бронхиальной астмы. В кн.: Генетика бронхолегочных заболеваний: Монография / Под ред. Пузырева В. П., Огородовой Л. М. (Серия монографий Российского респираторного общества; Гл. ред. серии Чучалин А. Г.). М.: Издательский холдинг «Атмосфера», 2010. 160 с.
- Курбачева О. М. Павлова К. С. Фенотипы и эндотипы бронхиальной астмы: от патогенеза и клинической картины к выбору терапии // РАЖ. 2013, № 1, с. 15–24.
- Zhang Y., Lefort J., Kearsey V., Lapa e Silva J. R., Cookson W. O., Vargaftig B. B. A genome-wide screen for asthma-associated quantitative trait loci in a mouse model of allergic asthma // Hum Mol Genet. 1999; 8 (4): 601–605.
- Rankinen T., Zuberi A., Chagnon Y. C, Weisnagel S. J., Argyropoulos G., Walts B. et al. The human obesity gene map: the 2005 update // Obesity (Silver Spring). 2006; 14: 529–644.
- Lu Y., Loos R. J. Obesity genomics: assessing the transferability of susceptibility loci across diverse populations // Genome Med. 2013, Jun 28; 5 (6): 55.
- Melén E., Granell R., Kogevinas M. et al. Genome-wide association study of body mass index in 23 000 individuals with and without asthma // Clin Exp Allergy. 2013; 43 (4): 463–474.
- Wen W., Cho Y. S., Zheng W. et al. Meta-analysis identifies common variants associated with body mass index in east Asians // Nat Genet. 2012, Feb 19; 44 (3): 307-31-13.
- Turchin M. C., Chiang C. W., Palmer C. D., Sankararaman S., Reich D. Genetic Investigation of Anthropometric Traits (GIANT) Consortium, Hirschhorn J. N. Evidence of widespread selection on standing variation in Europe at height-associated SNPs // Nat Genet. 2012; 44 (9): 1015–1019.
- Holgate S. T., Yang Y., Haitchi H. M., Powell R. M., Holloway J. W., Yoshisue H., Pang Y. Y., Cakebread J., Davies D. E. The genetics of asthma: ADAM33 as an example of a susceptibility gene // Proc Am Thorac Soc. 2006; 3 (5): 440–443. Review.
- Sleiman P. M., Flory J., Imielinski M. et al. Variants of DENND1 B associated with asthma in children // N Engl J Med. 2010, Jan 7; 362 (1): 36–44.
- Sood А., Shore S. A. Adiponectin, Leptin, and Resistin in Asthma // Basic Mechanisms through Population Studies Journal of Allergy. 2013, Article ID 785835, 15 p. http://dx.doi.оrg/10.1155/2013/78583.
- Procaccini C. L., Jirillo E., Matarese G. Leptin as an immunomodulator // Mol Aspects Med. 2012; 33 (1): 35–45.
- Mancuso P. et al. Leptin augments alveolar macrophage leukotriene synthesis by increasing phospholipase activity and enhancing group IVC iPLA2 (cPLA2 gamma) protein expression // Am. J. Physiol. Lung Cell Mol. Physiol. 2004. Vol. 287. P. 497–502.
- Matarese G., Moschos S., Mantzoros C. S. Leptin in immunology [Text] // J. Immunol. 2005. Vol. 174. P. 3137–3142.
- La Cava A., Matarese G. The weight of leptin in immunity // Nature Reviews Immunology, 2004, 4 (5), 371–437.
- Song Y. et al. Asthma, Chronic Obstructive Pulmonary Disease, and Type 2 Diabetes in the Women’s Health Study // Diabetes Res Clin Pract. 2010; 90 (3): 365–437.
- Chavey C., Fajas L. CXCL5 drives obesity to diabetes, and further AGING. 2009, № 7, vol. 1.
- Periyalil H. A., Gibson P. G., Wood L. G. Immunometabolism in Obese Asthmatics: Are We There Yet? // Nutrients. 2013, 5, 3506–3530.
- Шварц В. Жировая ткань как орган иммунной системы // Цитокины и воспаление. 2009. Т. 8, № 4. С. 3–10.
- Шварц В. Воспаление жировой ткани (часть 7). Немедикаментозное лечение // Проблемы эндокринологии. 2012, 2, с. 62–70.
- Sismanopoulos N. et. al. Do mast cells link obesity and asthma? // Allergy. 2013; 68 (1): 8–15.
- Цибулькина В. Н., Цибулькин Н. А. Бронхиальная астма и ожирение: совпадение или закономерность? // Практическая медицина. 2011, ноябрь.
- Beuther D. A., Weiss S. T., Sutherland E. R. Obesity and asthma // Am J Respir Crit Care Med. 2006; 174: 112–119.
- Fredberg J. J. Airway obstruction in asthma: does the response to a deep inspiration matter? // Respir Res. 2001; 2: 273–275.
- Wenzel S. Asthma: defining of the persistent adult phenotypes // Lancet. 2006; 368: 804–813.
- Haldar P., Pavord I., Shaw D. et al. Cluster analysis and clinical asthma phenotypes // Am J Respir Crit Care Med. 2008; 178: 218–224.
- Moore W. C., Meyers D. A., Wenzel S. E. et al. Identification of asthma phenotypes using cluster analysis in the Severe Asthma Research Program // AmJ Respir Crit Care Med. 2010; 181: 315–323.
- Sutherland E. R. et al. Cluster Analysis of Obesity and Asthma Phenotypes // PLoS ONE www.plosone.org. 2012, vol. 7, Issue 5, e36631.
- Simpson J. L., Scott R. J., Boyle M. J. et al. Differential Proteolytic Enzyme Activity in Eosinophilic and Neutrophilic Asthma // Am J Respir Crit Care Med. 2005; 172: 559–565.
- Lijnen H. R., Maquoi E., Hansen L. B., Van Hoef B., Frederix L., Collen D. Matrix metalloproteinase inhibition impairs adipose tissue development in mice // Arterioscler. Thromb. Vasc. Biol. 2002, 22, 374–379.
- Cox G. Glucocorticoid treatment inhibits apoptosis in human neutrophils. Separation of survival and activationoutcomes // J Immunol. 1995; 154; 4719–4725.
- Nguyen L. T., Lin S., Oates T., Chung K. F. Increase in airway neutrophilia after oral but not inhaled corticosteroid therapy in mild asthma // Respir Med. 2005; 99: 200–207.
- Peters-Golden M. et al, Influence of body mass index on the response to asthma controller agents // Eur Respir J. 2006; 27 (3): 495–503.
- Giouleka P., Papatheodorou G., Lyberopoulos P. // Eur J Clin Invest. 2010; 41 (1): 30–38.
- Camargo C. A. et al. Body mass index and response to asthma therapy: fluticasone propionate/salmeterol versus montelukast // J Asthma. 2010; 47 (1): 76–82.
- Anderson W. J., Lipworth B. J. Does body mass index influence responsiveness to inhaled corticosteroids in persistent asthma? // Ann Allergy Asthma Immunol. 2012; 108 (4): 237–242.
- Kattan M. et al. Asthma Control, Adiposity and Adipokines among Inner-City Adolescents // J Allergy Clin Immunol. 2010; 125 (3): 584–592.
- Hakala K., Stenius-Aarniala B., Sovijarvi A. Effects of weight loss on peak flow variability, airways obstruction, and lung volumes in obese patients with asthma // Chest. 2000; 118: 1315–1321.
- Stenius-Aarniala B., Poussa T., Kvarnstrom J., Gronlund E. L., Ylikahri M., Mustajoki P. Immediate and long term effects of weight reduction in obese people with asthma: randomised controlled study // BMJ. 2000; 320: 827–832.
- Reddy R. C. et al. The effects of bariatric surgery on asthma severity // Obes Surg. 2011; 21 (2): 200–206.
- Moreira A., Bonini M., Garcia-Larsen V., Bonini S., Del Giacco S. R., Agache I., Fonseca J., Papadopoulos N. G., Carlsen K.-H., Delgado L., Haahtela T. Weight loss interventions in asthma: EAACI Evidence-Based Clinical Practice Guideline (Part I) // Allergy. 2013; 68: 425–443.
- The GRADE working group. Grading quality of evidence and strength of recommendations // BMJ. 2004; 328: 1490–1494.
- Guyatt G. H. et al. GRADE guidelines: 12. Preparing summary of findings tables — binary outcomes // J Clin Epidemiol. 2012. May 18.
Н. Г. Астафьева1, доктор медицинских наук, профессор
И. В. Гамова, кандидат медицинских наук
Е. Н. Удовиченко, кандидат медицинских наук
И. А. Перфилова, кандидат медицинских наук
ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
1 Контактная информация: astang@mail.ru
Купить номер с этой статьей в pdf