Питание является важным модифицируемым фактором, определяющим развитие и поддержание костной массы. Диета, сбалансированная по калорийности, белку (1 г/кг/сут), жирам и углеводам (не более 60% от общей калорийности пищи) способствует нормальному метаболизму кальция (Ca) в костной ткани. В настоящее время кальций в сочетании с витамином D является основой нутрициальной коррекции для профилактики и лечения остеопороза, остеопении и рахита [1]. Тем не менее, сочетанный прием кальция и витамина D не всегда успешно профилактирует остеопороз, так как не компенсирует всех нутрициальных потребностей костной ткани.
Важность таких факторов питания, как кальций, фосфор (P) и витамин D, для целостности костей неоспорима. Рецептор витамина D, подобно эстрогеновым рецепторам, является фактором транскрипции, который, в частности, регулирует экспрессию белков, вовлеченных в гомеостаз кальция и фосфора. Экспериментальные данные показывают, что физиологические эффекты витамина D включают торможение секреции провоспалительных цитокинов, молекул адгезии и пролиферацию сосудистых гладкомышечных клеток — процессов, которые имеют важное значение для кальцификации артерий [2].
В то же время проводимые в течение последнего десятилетия исследования показали, что для поддержания структуры костной ткани также необходимы витамины A, C, E, K и микроэлементы медь (Cu), марганец (Mn), цинк, стронций, магний (Mg), железо и бор. Дефицит этих микронутриентов замедляет набор костной массы в детстве и в подростковом возрасте и способствует ускоренной потере костной массы в пожилом возрасте [3, 4]. В настоящей работе рассмотрены результаты экспериментальных и клинических исследований, указывающие на важность компенсации дефицитов этих микроэлементов в профилактике и терапии остеопороза, остеопении и рахита. Особое внимание уделяется бору — микроэлементу, оказывающему значительное влияние на структуру костной ткани и, тем не менее, пренебрегаемому в подавляющем большинстве витаминно-минеральных комплексов.
Магний и поддержка соединительной и костной ткани
Одной из принципиально важных нутрициальных потребностей кости является обеспеченность костей магнием — элементом, регулирующим минерализацию, равномерный рост, гибкость и прочность костной ткани и увеличивающим репаративный потенциал костей. И наоборот, дефицит магния в организме препятствует успешной терапии и профилактике нарушений структуры кости (остеопороз и др.). Среди различных тканей организма основным депо магния являются именно костная ткань. Помимо того, что кость является депо магния, магний также оказывает существенное влияние на минерализацию и структуру костной ткани — низкие уровни магния связаны с низкой костной массой и остеопорозом [5].
Магний является одним из принципиально важных нутриентных факторов, воздействующих на соединительную ткань. Недостаточная обеспеченность магнием является одной из важнейших причин нарушений структуры (дисплазии) соединительной ткани. Систематический анализ взаимосвязей между обеспеченностью клеток магнием и молекулярной структурой соединительной ткани указал на такие молекулярные механизмы воздействия дефицита магния, как ослабление синтеза белков вследствие дестабилизации тРНК, снижение активности гиалуронансинтетаз, повышение активности металлопротеиназ, повышенные активности гиалуронидаз и лизиноксидазы [6]. Следует напомнить, что костная ткань состоит только на 70% из кальциевых соединений, а на 22% — из коллагена, 8% составляет водная фракция.
Важность роли магния в поддержании структуры кости связана и с тем, что при хроническом дефиците магния нарушается важнейший аспект минерального обмена костной ткани — отношение Mg:Ca. При снижении соотношения Mg:Ca в сторону дефицита магния обменные процессы в кости замедлены, быстрее депонируются токсичные металлы (прежде всего, кадмий и свинец). Вследствие накопления токсичных элементов в суставе из-за нарушения пропорции Mg:Ca функция суставов постепенно ухудшается: уменьшается объем движений, происходит деформация суставов конечностей и позвоночника. Эпидемиологические исследования частоты остеопороза в различных странах показали, что более высокое значение отношения Mg:Ca в питании соответствует более низкой встречаемости остеопороза [7].
В эксперименте диета с очень низким содержанием магния (7% от нормального уровня потребления) приводила к значительной гипомагниемии, гипокальциемии, характерным для остеопороза изменениям костной ткани у цыплят. Дефицит магния приводит к разрежению костной ткани, вплоть до образования полостей; компенсация дефицита магния — к восстановлению структуры костной ткани [8].
Более высокое диетарное потребление магния соответствует повышенной минеральной плотности кости (МПК) у мужчин и женщин. В исследовании когорты из 2038 человек оценка диетарного потребления магния по опроснику коррелировала с МПК после поправок на возраст, калорийность диеты, потребление кальция и витамина D, индекс массы тела, курение, алкоголь, физическую активность, использование тиазидных диуретиков и эстроген-содержащих препаратов (р = 0,05, мужчины; p = 0,005, женщины) [9].
Материнское питание во время беременности значительно влияет на минеральную плотность костной ткани у детей. Наблюдения за 173 парами мать–ребенок в течение 8 лет после родов показали, что МПК шейки бедра у детей повышалась с повышением диетарной обеспеченности беременной магнием. МПК поясничного отдела позвоночника зависела от обеспеченности беременной магнием, калием, фосфором и калием. Дети, матери которых были адекватно обеспечены указанными минеральными веществами во время беременности, характеризовались значимо бо?льшими значениями МПК (шейка бедра +5,5%, поясничного отдела позвоночника +12%, всего тела +7%) [10].
Железо
Помимо того, что железо необходимо для поддержания достаточной обеспеченности тканей кислородом, этот микроэлемент также участвует в метаболизме коллагена — основного структурного белка всех видов соединительной ткани, в т. ч. костной. Хронический дефицит железа в эксперименте приводит к задержке созревания коллагена в бедренной кости и также к нарушениям фосфорно-кальциевого метаболизма [11]. В эксперименте железодефицитная анемия (ЖДА) приводит к нарушению минерализации и увеличению резорбции кости [12].
По данным крупных клинико-эпидемиологических исследований, ЖДА способствует значительному повышению риска остеопороза и переломов. Например, в лонгитудинальном исследовании 5286 человек (2511 мужчин и 2775 женщин, 55–74 лет) наблюдались в течение 8 лет. Низкие уровни гемоглобина были связаны с когнитивными нарушениями и более низкой костной массой. За время наблюдения у 235 мужчин и 641 женщины был установлен хотя бы один перелом (исключая переломы позвоночника). Уменьшение содержания гемоглобина в крови на одно стандартное отклонение соответствовало повышению риска переломов на 30% у мужчин (р < 0,001) и на 8% у женщин (р = 0,07). У мужчин с легкой ЖДА (гемоглобин менее 130 г/л), риск переломов был повышен в 2 раза по сравнению с пациентами с нормальным уровнем гемоглобина [13].
Медь
Медь, как и железо, участвует в модификации определенных лизиновых остатков коллагена и эластина, что имеет важное значение для формирования коллагеновых и эластиновых фибрилл. Одним из факторов, способствующих потере костной массы, являются субклинические дефициты цинка и меди, возникающие вследствие уменьшенного потребления или нарушений всасывания этих микроэлементов в организме. Цинк и медь — принципиально важные кофакторы ферментов, участвующих в синтезе различных молекулярных компонентов матрикса костной ткани. В частности, медь, являясь кофактором фермента лизилоксидазы (ген LOX), имеет важное значение для формирования внутри- и межмолекулярных поперечных связей в коллагене [14].
Недостаток меди у человека и у животных связан с нарушениями роста, остеогенеза и хрупкостью костей, что во многом обусловлено недостаточным количеством этих поперечных сшивок [15]. В эксперименте дефицит меди приводил к нарушению структуры коллагена и снижению таких механических свойств кости, как устойчивость к скручиванию и угловой деформации (р < 0,05) [16, 17]. Дефицит меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии костей, легких и сердечно-сосудистой системы [18]. Совместный прием препаратов меди/цинка с препаратами кальция может способствовать значительному снижению всасывания цинка и меди вследствие фармакокинетического антагонизма [19].
Марганец
Марганец — эссенциальный микроэлемент и кофактор более 200 белков, участвующих в столь разнообразных процессах, как кроветворение, иммунитет, энергетический метаболизм и метаболизм соединительной ткани. К клиническим симптомам марганцевого дефицита у беременных относятся дерматиты, инсулинорезистентность, жировой гепатоз, остеопения; последствия дефицита марганца для плода включают нарушения образования хрящевой ткани, аномалии развития скелета. Исследования влияния марганца на развитие и структуру соединительной ткани проводятся с первой половины XX века [20].
В эксперименте эффекты долгосрочного дефицита марганца и меди в диете включают снижение минерализации в сочетании с увеличением резорбции кости [21]. Этот эффект осуществляется за счет падения активности Mn-зависимых ферментов, принимающих участие в синтезе глюкозаминогликанов и других углеводных компонентов протеогликанов. К этим ферментам относятся галактозилксилозил-глюкуронозилтрансферазы (в биосинтезе таких гликозаминогликанов соединительной ткани, как хондроитинсульфат, дерматансульфат, гепарансульфат и гепарин), бета-галактозилтрансферазы (участвуют в биохимических модификациях и присоединении глюкозаминогликанов) и N-ацетилгалактозаминил-трансферазы (необходимы для синтеза глюкозаминогликана хондроитинсульфата) [22].
Хронический сочетанный дефицит марганца и меди приводит к снижению активности строящих кость остеобластов, увеличению резорбции костного матрикса и, следовательно, снижению плотности и массы костей. Недостаточность потребления меди и марганца приводит к значительному снижению содержания кальция в костях (180 мг/г, дефицит Mn/Cu и 272 мг/г, контроль). Рентгенограммы плечевых костей указали на присутствие многочисленных очагов повреждения кости как при сочетанном дефиците Mn/Cu, так и при глубоком дефиците марганца [21].
В эксперименте диетарный дефицит марганца в течение 25 дней приводил к снижению содержания марганца в кости до 2% от контрольной группы. При этом 88% животных проявляли выраженные признаки остеопороза, причем значительно снижалось поглощение сульфата для синтеза уроновых гликозаминогликанов соединительной ткани вследствие снижения активности ряда марганец-зависимых гликозилтрансфераз. Восстановление марганца в диете приводило к быстрому возрастанию его содержания в кости и восстановлению нормальной структуры кости [21].
Кремний
Кремний имеет важное значение для формирования скелета и соединительной ткани, т. к. необходим для синтеза сиалопротеинов кости. Диетическое потребление кремния ассоциировано с МПК [23]. Наблюдения за Фремингемовской когортой (n = 2847, 30–87 лет) показало, что более высокое диетарное потребление кремния соответствовало более высокой МПК у мужчин и женщин до 50 лет [24].
Стронций
Стронций близок по химическим свойствам к кальцию и включается в состав гидроксиапатита, способствуя существенному увеличению минеральной плотности костной ткани. Препараты на основе солей стронция снижают риск переломов позвоночника на 41% [25], а риск непозвонковых переломов — на 15% [26].
Бор и костная ткань
Ультрамикроэлемент бор играет важную роль в метаболизме костной ткани. Ежедневное потребление бора в разных странах колеблется от 0,3 мг/сут до 41 мг/сут [27]; источником бора является диета, обогащенная фруктами, овощами, орехами и бобовыми.
Обнаружена жизненная необходимость микродоз бора на примере влияния на обмен кальция, фосфора и особенно магния. Бор взаимодействует с гидроксильными группами многих органических соединений, включая сахара, полисахариды, аденозин-5-фосфат, пиридоксин, образуя биологически активные соединения. Бор регулирует активность паратгормона. В организме человека около 20 мг бора. Максимально концентрируется в костях > зубной эмали > почках = легких = лимфатических узлах > печени > мышцах = семенниках > мозге [28].
С фармакологической точки зрения препараты бора характеризуются гиполипидемическим, противовоспалительным, антионкологическим эффектами. Дефицит бора стимулирует развитие таких состояний, как анемия, остео-, ревматоидный артрит, когнитивная дисфункция, остеопороз, мочекаменная болезнь и нарушение обмена половых гормонов.
Результаты экспериментальных и клинических исследований, проводимых с начала 1960-х гг., показали, что препараты бора являются безопасным и эффективным средством для лечения некоторых форм артрита. Дальнейшие исследования подтвердили важность обеспеченности бором для поддержания структуры кости. Так, костная ткань пациентов с более высоким потреблением бора характеризовалась более высокой механической прочностью. В тех географических регионах, где потребление бора составляет менее 1 мг/сут, заболеваемость артритом колеблется от 20% до 70%, в то время как в регионах с потреблением 3–10 мг/сут — не более 10%. Эксперименты с моделями артрита показали эффективность перорального или внутрибрюшинного введения препаратов бора [29].
О молекулярно-физиологических механизмах воздействия бора
Бор влияет на активность ряда ферментных каскадов, включая метаболизм стероидных гормонов и гомеостаз кальция, магния и витамина D, также способствуя снижению воспаления, улучшению профиля липидов плазмы и функционирования нейронов [30] (дефицит бора снижает электрическую активность мозга, результаты тестов на двигательную ловкость, внимание и кратковременную память [31]). Бораты могут образовывать сложные эфиры с гидроксильными группами различных соединений, что может являться одним из возможных механизмов осуществления их биологической активности [32]. Повышенное содержание бора в пище повышает экспрессию борат-транспортера (NaBCl) в тощей кишке и понижает — в ткани почек [33].
Хотя детали молекулярных механизмов воздействия бора на физиологические процессы остаются неизвестными, бор оказывает существенное воздействие на процессы роста клеток костной ткани и хряща. Так, бор повышает одонтогенную и остеогенную дифференцировку клеток ростка стволовых клеток зубов. Прием пентабората натрия оказывал дозозависимый эффект на активность щелочной фосфатазы и экспрессию генов, связанных с одонтогенезом [34]. Поэтому дефицит бора во время беременности, наряду с дефицитами кальция и других микронутриентов, также будет способствовать нарушениям развития зубов и у беременной, и у ребенка.
Бор дозозависимо влияет на процессы дифференцировки стромальных клеток костного мозга. Концентрации бора в 1, 10 и 100 нг/мл повышали, а уровни более 1000 нг/мл ингибировали дифференцировку клеток (р < 0,05). При повышении уровня бора в 10–100 раз в питательной среде культуры клеток костного мозга также повышались уровни белков остеогенеза — остеокальцина, коллагена I, белков морфогенеза костей 4, 6 и 7 (р < 0,05) [35], а также остеопонтина, сиалопротеина кости (ген BSP), белка Runx2 и другие [36].
Последствия дефицита бора
Экспериментальное исследование эффектов дефицита бора показало, что даже при достаточном содержании кальция в пище, дефицит бора приводил к снижению прочности кости. И наоборот, добавление бора в пищу способствовало повышению прочности костной ткани [37].
Экспериментальная оценка последствий низкого (40 мкг/кг) или достаточного (2 мг/кг) содержания бора в диете в течение 6 недель показала, что дефицит бора снижает фертильность за счет уменьшения числа сайтов, приводящих к успешной имплантации эмбриона, замедления роста бластоцисты и увеличения числа тяжелых пороков развития [38].
Дефицит бора в эксперименте приводит к сокращению популяции остеобластов, тормозя формирование пародонта [39]. При приеме бор-дефицитной диеты, гистоморфометрические исследования указали на снижение относительного трабекулярного объема кости на 36% к концу 1-й недели и на 63% через 14 дней эксперимента. К концу 2-й недели эксперимента общая поверхность остеобластов снизилась на 87%, что указывает на заметное сокращение остеогенеза на фоне дефицита бора [40] (рис. 1).
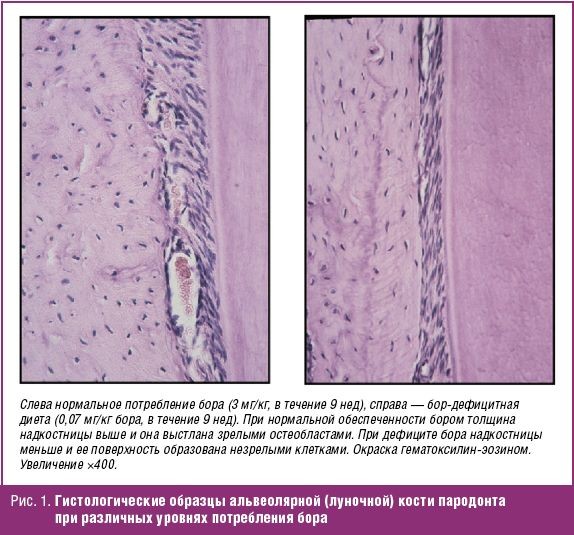
Биохимические и физиологические последствия дефицита бора и компенсации дефицита были изучены в группе здоровых добровольцев (12 женщин в постменопаузе). Участницы сначала принимали бор 0,25 мг/сут/2000 ккал в течение 119 дней, а затем в 3 мг/сут в течение 48 дней. Добавки бора сокращали потери кальция и магния с мочой и повышали уровни 17-бета-эстрадиола в сыворотке [41].
Экспериментальные и клинические исследования эффектов компенсации дефицита бора
При приеме бораты и борная кислота легко и полностью всасываются и быстро распределяются по жидкостям тела посредством пассивной диффузии. Соотношение содержания бора кровь/мягкая ткань составляет 1,0, кровь/кость — 4,0. Период полувыведения боратов составляет приблизительно 21 ч при перорально или внутривенном введении [32].
В эксперименте дополнение бора к пищевым добавкам кальция и витамина D способствовало нормализации массы тела, увеличению уровней эстрадиола в плазме крови и повышению прочности ткани бедренной кости [42]. Добавление бора в дозах 4, 10, 30, 50 мг/сут/кг массы тела к обычной диете кроликов (люцерна) дозозависимо увеличивало содержание кальция, магния и фосфора в костях и повышало механическую прочность берцовой кости [43].
Добавление к питьевой воде кальция (210 мг/сут), фторида (0,7 мг/сут) и боратов (1,2 мг/сут) в течение 8 недель приводит к значительному положительному воздействию на механические свойства кости [44]. Добавки бора в пищу (50 мг/кг в виде тетрабората натрия) улучшали параметры состояния позвоночной и бедренной костной массы на фоне регулярной нагрузки на беговой дорожке. При приеме тетрабората натрия длина и вес, содержание минералов и плотность, трабекулярный и губчатый объемы бедренных и позвоночных костей были значительно выше (р < 0,005) [45].
Дотации бора в эксперименте (борная кислота, 5 мг/кг, в течение 5 нед) усиливают позитивные эффекты эстрогенов на костную ткань у крыс с удаленными яичниками при подкожном введении эстрогенов (30 мкг/кг/сут). Дотации бора способствовали увеличению содержания Ca, P, Mg в кости, повышению трабекулярного объема и плотности кости [46, 47].
Добавление 50 мг/кг бора в пищу для кур приводило к значительному увеличению прочности берцовой и бедренной кости на сдвиг [48], улучшало овогенез [49]. Совместное введение бора и витамина D в эмбрионы кур на фоне дефицита витамина D (0,5 мг бора, 0,3 мкг витамина D, 8 сут эмбриогенеза) улучшало выводимость эмбрионов из яиц, минеральное содержание и плотность кости, активизировало зону роста эпифизарной пластины, обеспечивая тем самым более быстрое формирование кости [50].
Препараты бора могут оказывать противовоспалительное действие. В частности, фруктоборат кальция значительно снижает сывороточные уровни С-реактивного белка, тем самым контролируя воспаление, приводящее к потере минеральной плотности костной ткани [51].
Экскреция бора с мочой в группе здоровых добровольцев (n = 18) составила 0,4–3,5 мг/сут. Прием препаратов бора в дозе 10 мг/сут в течение 4 недель приводил к 84-процентному увеличению уровней бора в моче. В результате приема добавок бора концентрация эстрадиола в плазме достоверно увеличилась от 52 ± 21 пмоль/л до 74 ± 22 пмоль/л (р < 0,004) [52].
Витамины группы В
Витамины В6 (пиридоксин), В9 (фолаты) и В12 (цианокобаламин) способствуют нормализации фолатного метаболизма и снижению уровней гомоцистеина плазмы крови. Более высокие уровни гомоцистеина ассоциированы с повышенными хрупкостью костей и частотой переломов, в т. ч. переломов бедра у пожилых [53]. Наблюдения за группой 702 пожилых участников (65–94 лет) в течение 4 лет показали, что более низкие уровни гомоцистеина на фоне дефицита фолатов являются фактором риска остеопороза [54]. Наблюдения за пожилыми участниками Фремингемовской когорты (n = 1002) подтверждают взаимосвязь между дефицитом фолатов и остеопорозом [55]. Риск остеопороза также повышается на фоне дефицита витамина В12 [56]. В Роттердамском исследовании более 5000 человек, которые наблюдались в течение 7 лет, снижение риска переломов была связано с более высоким потреблением пиридоксина [57].
Фолат- и витамин-В12-зависимая пернициозная анемия также является значимым фактором риска развития остеопороза. Наблюдения 131 пациента с анемией в течение 10 показали, что у пациентов с пернициозной анемией риск переломов проксимального отдела бедренной кости был повышен в 1,9 раза, переломов позвоночника — в 1,8 раза, а также переломов дистального отдела предплечья — в 3 раза по сравнению с популяционным контролем [58].
Витамин С
Эпидемиологические исследования показали, что более низкое потребление витамина С связано с более быстрыми темпами потери костной массы, а более высокое потребление витамина С — с меньшим количеством переломов [59]. Высокое потребление витамина С в пожилом возрасте (более 300 мг/сут) было ассоциировано со значительно меньшей потерей костной массы по сравнению с более низким потреблением витамина [60, 61]. Наблюдения, проводимые в течение 15 лет за участниками Фремингемовской когорты, показали, что более высокое потребление витамина С в составе витаминно-минеральных комплексов проводило к достоверному снижению частоты переломов бедра (р < 0,04) и непозвоночных переломов (р < 0,05) [62]. Употребление витаминов С и Е в составе витаминно-минеральных комплексов достоверно снижало резорбцию кости в соответствии с уровнями С-терминального телопептида, известного биомаркера костного обмена [63].
Витамин К
Витамин К (менахинон, филлохинон) необходим для карбоксилирования многих белков и, в частности, остеокальцина — основного структурного белка кости. Дефицит витамина приводит к снижению карбоксилирования остеокальцина и, следовательно, нарушает структуру костной ткани [64]. В рандомизированном исследовании женщины получали 200 мкг/сут филлохинона (витамин K1), витамина D и кальция, что приводило к более выраженному повышению МПК по сравнению только с приемом кальция и витамина D [65]. Метаанализ 7 проведенных в Японии исследований показал, что прием менахинона (витамин К2) снижает риск переломов позвонков на 60% (ОШ 0,40, 95% ДИ 0,25–0,65), риск переломов бедра — на 67% (ОШ 0,23, 95% ДИ 0,12–0,47) и риск непозвонковых переломов — на 71% (ОШ 0,19, 95% ДИ 0,11–0,35) [66].
Каротиноиды
Каротиноды α-, β-, γ-каротин и β-криптоксантин могут трансформироваться в витамин А, известный фактор роста тканей; каротиноиды ликопин, лютеин, зеаксантин являются антиоксидантами, но в ретинол (витамин А) не трансформируются. По сравнению с женщинами с нормальной МПК, более низкие концентрации ликопина и криптоксантина были установлены в сыворотке женщин с остеопорозом [67]. В исследовании «Инициатива по охране здоровья женщин» более высокие уровни β-каротина были ассоциированы с более высокой МПК [68]. Более высокое потребление каротинов и ликопина снижает частоту переломов на 46% у женщин и на 34% у мужчин при наблюдениях в течение 15 лет в рамках исследования Фремингемской когорты [62].
Флавоноиды
Флавоноид кверцетин является сильным антиоксидантом и тормозит дифференциацию и активность остеокластов [69] — клеток, осуществляющих резорбцию кости [70, 71]. Исследование когорты близнецов показало, что более высокое потребление кверцетина связано с более высокой МПК позвоночника. Более высокое потребление антоцианина также было положительно ассоциировано с повышением МПК позвоночника, костей таза и бедра [72].
Омега-3 жирные кислоты
Хроническое воспаление нарушает физиологическое протекание процесса ремоделирования кости. В крупномасштабных клинических исследованиях было показано, что более высокие уровни С-реактивного белка, известного маркера воспаления, связаны со сниженной минеральной плотностью костной ткани. Факторы, способствующие снижению уровней С-реактивного белка (т. е. снижающие системное воспаление), также улучшают баланс между резорбцией и формированием кости [51]. Омега-3 полиненасыщенные жирные кислоты (ПНЖК), участвуя в каскаде арахидоновой кислоты и снижая уровни провоспалительных простагландинов, способствуют снижению уровней провоспалительных цитокинов, стимулирующих активацию остеокластов и резорбцию кости [73].
Более высокое диетарное потребление омега-3 ПНЖК соответствует повышению МПК бедра [74] и поясничного отдела позвоночника [75]. Положительная ассоциация была найдена между диетарным потреблением омега-3 ПНЖК и МПК в исследовании группы 78 здоровых добровольцев 16–22 лет [76]. В то же время более высокое соотношение омега-6 к омега-3 при потреблении омега-ПНЖК с пищей стимулирует воспаление и соответствует снижению МПК [77, 78].
Заключение
Возможности полного восполнения дефицитов микроэлементов, необходимых для функционирования костной ткани, существенно расширяются при использовании специальных микронутриентных препаратов. Например, непереносимость лактозы у индивидуального пациента может способствовать возникновению дефицита кальция вследствие ограничений на прием молочных продуктов, так что для этого пациента становится необходимым прием специальных препаратов кальция. В настоящей работе показано, что поддержанию здоровья костной системы способствуют такие микроэлементы, как магний, железо, медь, марганец, кремний, стронций, бор, и ряд других микронутриентов: витамины В6, В9 (фолаты), В12, С, К, каротиноиды, флавоноиды, омега-3 ПНЖК (рис. 2). Магний, марганец, медь, цинк и бор принято называть остеотропными минералами. Они способствуют синтезу коллагена и эластина (рис. 2). Известно, что костный матрикс на 90% состоит из коллагена [79]. Коллаген, в свою очередь, входит не только в состав костной ткани, но и в состав всех соединительных тканей, включая суставные связки и кожный покров.
Следует отметить, что для нутриентной коррекции метаболизма костной ткани используют различные поколения препаратов (табл.). К первому поколению принято относить препараты солей кальция, а также их комбинации: глюконат кальция, карбонат кальция, цитрат кальция, лактоглюконат кальция и т. д.; ко второму — комбинации препаратов кальция и витамина D
Литература
- Zofkova I., Nemcikova P., Matucha P. Trace elements and bone health // Clin Chem Lab Med. 2013; 51 (8): 1555–61 doi.
- Zittermann A., Schleithoff S. S., Koerfer R. Vitamin D and vascular calcification // Curr Opin Lipidol. 2007; 18 (1): 41–46.
- Schaafsma A., de Vries P. J, Saris W. H. Delay of natural bone loss by higher intakes of specific minerals and vitamins // Crit Rev Food Sci Nutr. 2001; 41 (4): 225–249.
- Lakhkar N. J., Lee I. H., Kim H. W., Salih V., Wall I. B., Knowles J. C. Bone formation controlled by biologically relevant inorganic ions: role and controlled delivery from phosphate-based glasses // Adv Drug Deliv Rev. 2013; 65 (4): 405–420 doi.
- De Francisco A. L., Rodriguez M. Magnesium — its role in CKD // Nefrologia. 2013; 33 (3): 389–99 doi.
- Торшин И. Ю., Громова О. А. Молекулярные механизмы дефицита магния в недифференцированной дисплазии соединительной ткани // Росс. мед. журнал. 2008, № 2, с. 62–67.
- Swaminathan R. Nutritional factors in osteoporosis // Int J Clin Pract. 1999; 53 (7): 540.
- Parlier R., Hioco D., Leblanc R. Metabolism of magnesium and its relation to that of calcium. I. Apropos of a study of magnesium balance in the normal man, in osteopathies and nephropathies // Rev Fr Endocrinol Clin. 1963; 4: 93–135.
- Ryder K. M., Shorr R. I., Bush A. J., Kritchevsky S. B., Harris T., Stone K., Cauley J., Tylavsky F. A. Magnesium intake from food and supplements is associated with bone mineral density in healthy older white subjects // J Am Geriatr Soc. 2005; 53: 1875–1880.
- Jones G., Riley M. D., Dwyer T. Maternal diet during pregnancy is associated with bone mineral density in children: a longitudinal study // Eur J Clin Nutr. 2000; 54 (10): 749–756.
- Smoliar V. I. Effect of iron-deficient diets on the formation of bone tissue // Vopr Pitan. 1984; 5: 55–59.
- Diaz-Castro J., Lopez-Frias M. R., Campos M. S., Lopez-Frias M., Alferez M. J., Nestares T., Ojeda M. L., Lopez-Aliaga I. Severe nutritional iron-deficiency anaemia has a negative effect on some bone turnover biomarkers in rats // Eur J Nutr. 2012; 51 (2): 241–247.
- Jorgensen L., Skjelbakken T., Lochen M. L., Ahmed L., Bjornerem A., Joakimsen R., Jacobsen B. K. Anemia and the risk of non-vertebral fractures: the Tromso Study // Osteoporos Int. 2010; 21 (10): 1761–1768 doi.
- Kaitila I. I., Peltonen L., Kuivaniemi H., Palotie A., Elo J., Kivirikko K. I. A skeletal and connective tissue disorder associated with lysyl oxidase deficiency and abnormal copper metabolism // Prog Clin Biol Res. 1982; 104: 307–315.
- Smoliar V. I., Biniashevskii E. V. Effect of copper deficiency on growth and bone tissue formation // Vopr Pitan. 1988; (6): 28–32.
- Jonas J., Burns J., Abel E. W., Cresswell M. J., Strain J. J., Paterson C. R. Impaired mechanical strength of bone in experimental copper deficiency // Ann Nutr Metab. 1993; 37 (5): 245–252.
- Opsahl W., Zeronian H., Ellison M., Lewis D., Rucker R. B., Riggins R. S. Role of copper in collagen cross-linking and its influence on selected mechanical properties of chick bone and tendon // J Nutr. 1982; 112 (4): 708–716.
- O’Dell B. L. Roles for iron and copper in connective tissue biosynthesis // Philos Trans R Soc Lond B Biol Sci. 1981; 294 (1071): 91–104.
- Lowe N. M., Lowe N. M., Fraser W. D., Jackson M. J. Is there a potential therapeutic value of copper and zinc for osteoporosis? // Proc Nutr Soc. 2002; 61 (2): 181–185.
- Gallup W. D., Norris L. C. The essentialness of manganese for the normal development of bone // Science. 1938; 87 (2245): 18–19.
- Strause L. G., Hegenauer J., Saltman P., Cone R., Resnick D. Effects of long-term dietary manganese and copper deficiency on rat skeleton // J Nutr. 1986; 116 (1): 135–141.
- Керимкулова Н. В., Торшин И. Ю., Громова О. А., Cеров В. Н., Никифорова Н. В. Систематический анализ молекулярно-физиологических эффектов синергидного воздействия железа, марганца и меди на соединительную ткань // Гинекология. 2012. № 6. С. 51–60.
- Jugdaohsingh R. Silicon and bone health // J Nutr Health Aging. 2007; 11: 99–110.
- Jugdaohsingh R., Tucker K. L., Qiao N., Cupples L. A., Kiel D. P., Powell J. J. Dietary silicon intake is positively associated with bone mineral density in men and premenopausal women of the Framingham Offspring cohort // J Bone Miner Res. 2004; 19: 297–307.
- Meunier P. J., Roux C., Seeman E. et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis // N Engl J Med. 2004; 350: 459– 468.
- Reginster J. Y., Felsenberg D., Boonen S. et al. Effects of long-term strontium ranelate treatment on the risk of nonvertebral and vertebral fractures in postmenopausal osteoporosis: results of a five-year, randomized, placebo-controlled trial // Arthritis Rheum. 2008; 58: 1687–1695.
- Naghii M. R., Samman S. The role of boron in nutrition and metabolism // Prog Food Nutr Sci. 1993; 17 (4): 331–349.
- Ребров В. Г., Громова О. А. Витамины, макро- и микроэлементы. М.: Геотармед, 2008, 958 с.
- Newnham R. E. Essentiality of boron for healthy bones and joints // Environ Health Perspect. 1994; 102 Suppl: 83–85.
- Devirian T. A., Volpe S. L. The physiological effects of dietary boron // Crit Rev Food Sci Nutr. 2003; 43 (2): 219–231.
- Penland J. G. The importance of boron nutrition for brain and psychological function // Biol Trace Elem Res. 1998; 66 (1–3): 299–317.
- Murray F. J. A comparative review of the pharmacokinetics of boric acid in rodents and humans // Biol Trace Elem Res. 1998; 66 (1–3): 331–341.
- Liao S. F., Monegue J. S., Lindemann M. D., Cromwell G. L., Matthews J. C. Dietary supplementation of boron differentially alters expression of borate transporter (NaBCl) mRNA by jejunum and kidney of growing pigs // Biol Trace Elem Res. 2011; 143 (2): 901–912.
- Tasli P. N., Dogan A., Demirci S., Sahin F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro // Biol Trace Elem Res. 2013; 153 (1–3): 419–27 doi.
- Ying X., Cheng S., Wang W., Lin Z., Chen Q., Zhang W., Kou D., Shen Y., Cheng X., Rompis F. A., Peng L., Zhu Lu C. Effect of boron on osteogenic differentiation of human bone marrow stromal cells // Biol Trace Elem Res. 2011; 144 (1–3): 306–15 doi.
- Hakki S. S., Bozkurt B. S., Hakki E. E. Boron regulates mineralized tissue-associated proteins in osteoblasts (MC3 T3-E1) // J Trace Elem Med Biol. 2010; 24 (4): 243–250 doi.
- Naghii M. R., Torkaman G., Mofid M. Effects of boron and calcium supplementation on mechanical properties of bone in rats // Biofactors. 2006; 28 (3–4): 195–201.
- Lanoue L., Taubeneck M. W., Muniz J., Hanna L. A., Strong P. L., Murray F. J., Nielsen F. H., Hunt C. D., Keen C. L. Assessing the effects of low boron diets on embryonic and fetal development in rodents using in vitro and in vivo model systems // Biol Trace Elem Res. 1998; 66 (1–3): 271–298.
- Gorustovich A. A., Steimetz T., Nielsen F. H., Guglielmotti M. B. A histomorphometric study of alveolar bone modelling and remodelling in mice fed a boron-deficient diet // Arch Oral Biol. 2008; 53 (7): 677–682 doi.
- Gorustovich A. A., Steimetz T., Nielsen F. H., Guglielmotti M. B. Histomorphometric study of alveolar bone healing in rats fed a boron-deficient diet // Anat Rec (Hoboken). 2008; 291 (4): 441–447 doi.
- Nielsen F. H. Biochemical and physiologic consequences of boron deprivation in humans // Environ Health Perspect. 1994; 102 Suppl: 59–63.
- Naghii M. R., Ebrahimpour Y., Darvishi P., Ghanizadeh G., Mofid. M, Torkaman G., Asgari A. R., Hedayati M. Effect of consumption of fatty acids, calcium, vitamin D and boron with regular physical activity on bone mechanical properties and corresponding metabolic hormones in rats // Indian J Exp Biol. 2012; 50 (3): 223–231.
- Hakki S. S., Dundar N., Kayis S. A., Hakki E. E., Hamurcu M., Kerimoglu U., Baspinar N., Basoglu A., Nielsen F. H. Boron enhances strength and alters mineral composition of bone in rabbits fed a high energy diet // J Trace Elem Med Biol. 2013; 27 (2): 148–53 doi.
- Ghanizadeh G., Babaei M., Naghii M. R., Mofid M., Torkaman G., Hedayati M. The effect of supplementation of calcium, vitamin D, boron, and increased fluoride intake on bone mechanical properties and metabolic hormones in rat // Toxicol Ind Health. 2014; 30 (3): 211–217 doi.
- Rico H., Crespo E., Hernandez E. R., Seco C., Crespo R. Influence of boron supplementation on vertebral and femoral bone mass in rats on strenuous treadmill exercise. A morphometric, densitometric, and histomorphometric study // J Clin Densitom. 2002; 5 (2): 187–192.
- Sheng M. H., Taper L. J., Veit H., Qian H., Ritchey S. J., Lau K. H. Dietary boron supplementation enhanced the action of estrogen, but not that of parathyroid hormone, to improve trabecular bone quality in ovariectomized rats // Biol Trace Elem Res. 2001; 82 (1–3): 109–123.
- Sheng M. H., Taper L. J., Veit H., Thomas E. A., Ritchey S. J., Lau K. H. Dietary boron supplementation enhances the effects of estrogen on bone mineral balance in ovariectomized rats // Biol Trace Elem Res. 2001; 81 (1): 29–45.
- Wilson J. H., Ruszler P. L. Effects of boron on growing pullets // Biol Trace Elem Res. 1997; 56 (3): 287–294.
- Qin X., Klandorf H. Effect of dietary boron supplementation on egg production, shell quality, and calcium metabolism in aged broiler breeder hens // Poult Sci. 1991; 70 (10): 2131–2138.
- King N., Odom T. W., Sampson H. W., Yersin A. G. The effect of in ovo boron supplementation on bone mineralization of the vitamin D-deficient chicken embryo // Biol Trace Elem Res. 1991; 31 (3): 223–233.
- Scorei I. D., Scorei R. I. Calcium fructoborate helps control inflammation associated with diminished bone health // Biol Trace Elem Res. 2013; 155 (3): 315–21 doi.
- Naghii M. R., Samman S. The effect of boron supplementation on its urinary excretion and selected cardiovascular risk factors in healthy male subjects // Biol Trace Elem Res. 1997; 56 (3): 273–286.
- Gjesdal C. G., Vollset S. E., Ueland P. M., Refsum H., Drevon C. A., Gjessing H. K., Tell G. S. Plasma total homocysteine level and bone mineral density: the Hordaland Homocysteine Study // Arch Intern Med. 2006; 166: 88–94.
- Ravaglia G., Forti P., Maioli F., Servadei L., Martelli M., Brunetti N., Bastagli L., Cucinotta D., Mariani E. Folate, but not homocysteine, predicts the risk of fracture in elderly persons // J Gerontol A Biol Sci Med Sci. 2005; 60: 1458–1462.
- McLean R. R., Jacques P. F., Selhub J., Fredman L., Tucker K. L., Samelson E. J., Kiel D. P., Cupples L. A., Hannan M. T. Plasma B vitamins, homocysteine, and their relation with bone loss and hip fracture in elderly men and women // J Clin Endocrinol Metab. 2008; 93: 2206–2212.
- Tucker K. L., Hannan M. T., Qiao N., Jacques P. F., Selhub J., Cupples L. A., Kiel D. P. Low plasma vitamin B12 is associated with lower BMD: the Framingham Osteoporosis Study // J Bone Miner Res. 2005; 20: 152–158.
- Baines M. Kredan M. B., Davison A., Higgins G., West C., Fraser W. D., Ranganath L. R. The association between cysteine, bone turnover, and low bone mass // Calcif Tissue Int. 2007; 81: 450–454.
- Goerss J. B., Kim C. H., Atkinson E. J., Eastell R., O’Fallon W. M., Melton L. J. 3 rd. Risk of fractures in patients with pernicious anemia // J Bone Miner Res. 1992; 7 (5): 573–579.
- New S. A., Bolton-Smith C., Grubb D. A., Reid D. M. Nutritional influences on bone mineral density: a cross-sectional study in premenopausal women // Am J Clin Nutr. 1997; 65: 1831–1839.
- Tucker K. L., Chen H., Hannan M. T., Cupples L. A., Wilson P. W., Felson D., Kiel D. P. Bone mineral density and dietary patterns in older adults: the Framingham Osteoporosis Study // Am J Clin Nutr. 2002; 76: 245–252.
- Sahni S., Hannan M. T., Gagnon D., Blumberg J., Cupples L. A., Kiel D. P., Tucker K. L. High vitamin C intake is associated with lower 4-year bone loss in elderly men // J Nutr. 2008; 138: 1931–1938.
- Sahni S., Hannan M. T., Blumberg J., Cupples L. A., Kiel D. P., Tucker K. L. Protective effect of total carotenoid and lycopene intake on the risk of hip fracture: a 17-year follow-up from the Framingham Osteoporosis Study // J Bone Miner Res. 2009; 24: 1086–1094.
- Pasco J. A., Henry M. J., Wilkinson L. K., Nicholson G. C., Schneider H. G., Kotowicz M. A. Antioxidant vitamin supplements and markers of bone turnover in a community sample of nonsmoking women // J Womens Health (Larchmt). 2006); 15: 295–300.
- Binkley N., Harke J., Krueger D., Engelke J., Vallarta-Ast N., Gemar D., Checovich M., Chappell R., Suttie J. Vitamin K treatment reduces undercarboxylated osteocalcin but does not alter bone turnover, density, or geometry in healthy postmenopausal North American women // J Bone Miner Res. 2009; 24: 983–991.
- Bolton-Smith C., McMurdo M. E., Paterson C. R., Mole P. A., Harvey J. M., Fenton S. T., Prynne C. J., Mishra G. D., Shearer M. J. Two- year randomized controlled trial of vitamin K1 (phylloquinone) and vitamin D3 plus calcium on the bone health of older women // J Bone Miner Res. 2007; 22: 509–519.
- Cockayne S., Adamson J., Lanham-New S., Shearer M. J., Gilbody S., Torgerson D. J. Vitamin K and the prevention of fractures: systematic review and meta-analysis of randomized controlled trials // Arch Intern Med. 2006; 166: 1256–1261.
- Yang Z., Zhang Z., Penniston K. L., Binkley N., Tanumihardjo S. A. Serum carotenoid concentrations in postmenopausal women from the United States with and without osteoporosis // Int J Vitam Nutr Res. 2008; 78: 105–111.
- Wolf R. L., Cauley J. A., Pettinger M. et al. Lack of a relation between vitamin and mineral antioxidants and bone mineral density: results from the Women’s Health Initiative // Am J Clin Nutr. 2005; 82: 581–588.
- Woo J. T., Nakagawa H., Notoya M., Yonezawa T., Udagawa N., Lee I. S., Ohnishi M., Hagiwara H., Nagai K. Quercetin suppresses bone resorption by inhibiting the differentiation and activation of osteoclasts // Biol Pharm Bull. 2004; 27: 504–509.
- Boots A. W., Haenen G. R., Bast A. Health effects of quercetin: from antioxidant to nutraceutical // Eur J Pharmacol. 2008; 585: 325–337.
- Wattel A., Kamel S., Prouillet C., Petit J. P., Lorget F., Offord E., Brazier M. Flavonoid quercetin decreases osteoclastic differentiation induced by RANKL via a mechanism involving NF kappa B and AP-1 // J Cell Biochem. 2004; 92: 285–295.
- Hardcastle A. C., Aucott L., Reid D. M., Macdonald H. M. Associations between dietary flavonoid intakes and bone health in a Scottish population // J Bone Miner Res. 2011; 26: 941–947.
- Miggiano G. A., Gagliardi L. Diet, nutrition and bone health // Clin Ter. 2005; 156 (1–2): 47–56.
- Salari P., Rezaie A., Larijani B., Abdollahi M. A systematic review of the impact of n-3 fatty acids in bone health and osteoporosis // Med Sci Monit. 2008; 14: 37–44.
- Jarvinen R., Tuppurainen M., Erkkila A. T., Penttinen P., Karkkainen M., Salovaara K., Jurvelin J. S., Kroger H. Associations of dietary polyunsaturated fatty acids with bone mineral density in elderly women // Eur J Clin Nutr. 2012; 66: 496–503.
- Hogstrom M., Nordstrom P., Nordstrom A. n-3 Fatty acids are positively associated with peak bone mineral density and bone accrual in healthy men: the NO2 Study // Am J Clin Nutr. 2007; 85: 803–807.
- Eriksson S., Mellstrom D., Strandvik B. (2009) Fatty acid pattern in serum is associated with bone mineralisation in healthy 8-year- old children. Br J Nutr 102: 407–412
- Weiss L. A, Barrett-Connor E., von Muhlen D. (2005) Ratio of n-6 to n-3 fatty acids and bone mineral density in older adults: the Rancho Bernardo Study. Am J Clin Nutr 81: 934–938.
- Дыдыкина И. С., Дыдыкина П. С., Алексеева О. Г. Вклад микроэлементов (меди, марганца, цинка, бора) в здоровье кости: вопросы профилактики и лечения остеопении и остеопороза // Эффективная фармакотерапия. 38/2013.
О. А. Громова*, 1, доктор медицинских наук, профессор
И. Ю. Торшин*, кандидат физико-математических наук
О. А. Лиманова**, кандидат медицинских наук
* РСЦ Международного института микроэлементов ЮНЕСКО, Москва
** ГБОУ ВПО ИвГМА МЗ РФ, Иваново
1 Контактная информация: unesco.gromova@gmail.com
Купить номер с этой статьей в pdf