Актуальность проблемы бесплодного брака не вызывает сомнения. По данным ВОЗ, частота бесплодных браков колеблется в широких пределах и не имеет тенденции к снижению. При этом в настоящее время растет число проводимых программ вспомогательных репродуктивных технологий (ВРТ). Эффективность проводимого лечения методами ВРТ растет из года в год. По данным Российской ассоциации репродукции человека среднестатистические значения частоты наступления беременности в расчете на перенос в программе экстракорпорального оплодотворения (ЭКО) — 38% за 2007 год, но все-таки остается значительно высок процент неудачных программ ВРТ. Одной из причин неудач имплантации эмбрионов в программах ВРТ является патология эндометрия, в том числе и хронический эндометрит (ХЭ) [1]. По некоторым данным у женщин с бесплодием ХЭ встречается в 12–68% случаев, достигая своего максимума при наличии трубно-перитонеального фактора бесплодия [2]. Также по данным ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова» МЗ РФ, у женщин с ХЭ почти в 50% случаев диагностируют бесплодие (преимущественно вторичное), у 37% в анамнезе имеются неудачные попытки ЭКО и переноса эмбриона (ПЭ) (в среднем 3,3 ± 0,4 попытки на пациентку). Длительная и часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в тканевой структуре, препятствуя нормальной имплантации и плацентации и формируя патологический ответ на беременность, а также вызывая нарушение пролиферации и нормальной циклической трансформации эндометрия [3]. ХЭ существенно снижает результативность программ ВРТ, уменьшая частоту имплантации [4].
Изучены основные характеристики и методы диагностики ХЭ, но не учитывается тот факт, что золотой стандарт диагностики ХЭ, а именно гистероскопия с раздельным диагностическим выскабливанием полости матки, является фактором риска и приводит к невынашиванию беременности. Таким образом, является актуальным разработка альтернативных методов диагностики с учетом прогноза развития ХЭ. Кроме того, предложены различные схемы лечения ХЭ, но данные разноречивы, также нет четких данных о подготовке пациенток, планирующих программы ВРТ. Разработка схем прегравидарной подготовки данной группы пациенток крайне необходима для повышения результативности программ ЭКО.
Материалы и методы
Нами было обследовано 139 пациенток, имеющих в анамнезе неудачу имплантации эмбрионов в программе ЭКО.
У всех пациенток данной группы собраны анамнестические данные, проведено обследование, включающее: оценку микробного пейзажа влагалища и цервикального канала путем микроскопии мазка, исследование методом полимеразной цепной реакции (ПЦР) на наличие в цервикальном канале Chlamydia trachomatis, Ureaplasma urealyticum, Ureaplasma parvum, Mycoplasma genitalium, Cytomegalovirus, Herpes Simplex Virus 1-го и 2-го типов, исследование качества эндометрия и содержимого полости матки, которое проводилось путем гистероскопии, пайпель-биопсии эндометрия с последующим гистологическим, иммуногистохимическим, бактериологическим исследованием соскоба эндометрия. Гистероскопия проводилась по стандартной методике с использованием гистероскопа фирмы Storz на 5–10 день менструального цикла. Эндоскопическими критериями постановки диагноза «хронический эндометрит» явились локальная или диффузная гиперемия поверхности эндометрия, на фоне которой определялись центрально расположенные белесоватые очаги, отечность эндометрия. Гистероскопия проводилась с последующим раздельным диагностическим выскабливанием полости матки и цервикального канала. Пайпель-биопсия эндометрия как метод оценки качества проведенной терапии ХЭ проводилась на 5–10 день менструального цикла. Для введения пайпеля в полость матки не нужно расширять цервикальный канал, процедура атравматична, безболезненна и осуществляется в амбулаторных условиях. Таким образом, аспирационная пайпель-биопсия эндометрия имеет ряд преимуществ перед диагностическим выскабливанием полости матки. Содержимое полости матки, полученное двумя вышеперечисленными способами, отправлялось на гистологическое исследование, проводимое после соответствующей обработки и заливки в парафин срезов, окрашенных гематоксилином и эозином и по Ван-Гизону. В зависимости от особенностей общей и тканевой реактивности, продолжительности заболевания, наличия обострений и степени их выраженности, морфологическими критериями постановки диагноза «хронический эндометрит» явились [10]:
- воспалительные инфильтраты, состоящие преимущественно из лимфоцитов, нейтрофильных лейкоцитов, расположенных чаще вокруг желез и кровеносных сосудов, реже диффузно;
- наличие плазматических клеток;
- альтерация стромы эндометрия.
Также проводилось иммуногистохимическое исследование ткани эндометрия с использованием моноклональных антител (Novocastra, UK; DAKO, Дания; Epitomics, США) к рецепторам эстрогена и прогестерона. Системы детекции LSAB2 (DAKO, Дания), KP-500 (Diagnostics BioSystems, США). Использованы следующие количественные критерии (степень): отсутствие позитивно меченых клеток — 0, до 20% — 1, до 40% — 2, до 60% — 3, до 80% — 4, до 100% — 5. Дополнительно по степени интенсивности окрашивания: слабая, умеренная, высокая интенсивность.
Всем пациенткам группы исследования было проведено ультразвуковое исследование (УЗИ) с определением кровотока в сосудах эндометрия (аппарат Voluson 730 Expert, в режиме 3D, оценивались индексы резистентности (ИР) базальных, спиральных, аркуатных и маточных артерий).
На основании результатов проведенного гистологического исследования содержимого полости матки выделена основная группа из 72 пациенток (группа Iа) с установленным диагнозом ХЭ, определена его этиология и состояние рецепторного статуса эндометрия. 67 пациенток, имеющих в анамнезе неудачу имплантации эмбрионов в программе ЭКО, не страдающих хроническим эндометритом, составили группу контроля (группа Iб).
Разработан алгоритм обследования, лечения и прегравидарной подготовки пациенток, имеющих в анамнезе неудачу имплантации эмбрионов в программе ЭКО на фоне ХЭ. При этом 41 пациентке, составившей основную группу (IIa), проведено этиотропное лечение (если таковое было необходимо) с последующей контрольной гистероскопией либо пайпель-биопсией эндометрия и комплекс прегравидарной подготовки перед вступлением в очередной протокол ЭКО.
Группу контроля составила 31 пациентка (IIб), также имеющая в анамнезе одну и более неудачных попыток ЭКО на фоне ХЭ, отказавшаяся от лечения либо прошедшая стандартный курс противовоспалительной терапии
Результаты и их обсуждение
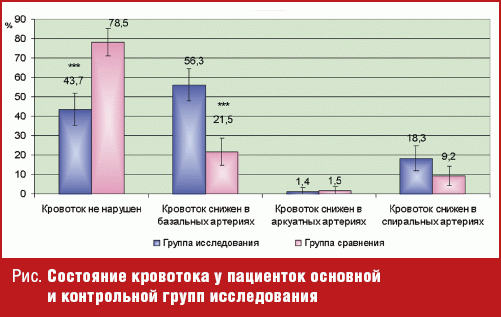
После проведения гистероскопии с последующим гистологическим исследованием содержимого полости матки, как «золотого» стандарта диагностики ХЭ, была определена его частота, которая составила 51,8% пациенток, имеющих в анамнезе неудачу имплантации эмбрионов в программе ЭКО. Также были проанализированы факторы бесплодия у пациенток группы исследования, ведущим в данной группе явился трубно-перитонеальный фактор, который составил 81,3%. В группе пациенток, имеющих в анамнезе неудачу имплантации эмбрионов в программе ЭКО, диагностическая чувствительность пайпель-биопсии с последующим гистологическим исследованием для диагностики ХЭ составляет 98,6%, а специфичность 97,0%. Таким образом, пайпель-биопсия с последующим гистологическим исследованием, имея высокую чувствительность и специфичность, может быть использована для диагностики ХЭ. У всех пациенток было проведено УЗИ с определением кровотока в сосудах эндометрия в предполагаемое окно имплантации (5–6 сутки после овуляции). У 78,5 ± 5,0% пациенток, не страдающих ХЭ, кровоток не был нарушен, тогда как на фоне ХЭ кровоток страдал в 43,7 ± 5,8% (p < 0,001). Причем в данной группе пациенток превалировало снижение кровотока в базальных артериях в 56,3 ± 5,8%, в контрольной группе в 21,5 ± 5,0% (p < 0,001) (рис.).
При проведении сравнительной оценки микробного пейзажа полости матки в основной группе исследования хламидийная контаминация полости матки определилась в 8,3 ± 3,3%, тогда как ни у одной пациентки группы контроля хламидии в полости матки не были выявлены, что также явилось статистически значимым (p < 0,01). При бактериологическом исследовании содержимого полости матки бактериальная контаминация у пациенток, страдающих ХЭ, составила 48,6 ± 5,9%, у пациенток без ХЭ — 16,4 ± 4,5% (p < 0,001). Причем у пациенток основной группы преобладала контаминация энтерококком (30,2%), тогда как у пациенток, не страдающих ХЭ, с равной частотой определялись Enterococcus faecalis и Staphylococcus epidermidis в 26,7% случаев. Статистически значимых различий между интенсивностью распределения прогестероновых (PR) и эстрогеновых (ER) рецепторов в строме и железах у пациенток основной и контрольной групп исследования не было найдено. Но при использовании корреляционного метода исследования с применением коэффициента Спирмена была выявлена прямая средневыраженная корреляционная связь между сохранным кровотоком в сосудах эндометрия и интенсивностью распределения ER в железах и строме эндометрия, а также интенсивностью распределения PR в строме (+0,421, +0,475 и +0,514 соответственно). При снижении кровотока в базальных сосудах эндометрия была выявлена обратная корреляционная связь средней силы с интенсивностью распределения ER и PR в строме эндометрия (-0,421 и -0,475 соответственно), а также слабая корреляционная связь с интенсивностью распределения ER в железах эндометрия -0,296.
На основании суммированных литературных данных о схемах антибактериальной терапии пациенток, страдающих ХЭ [5], применения инфузионной терапии [6], физиотерапии [7], озонотерапии [8], иглорефлексотерапии [9] у данной категории пациенток, а также результатов проведенного исследования, а именно влияние ряда анамнестических данных, состояния микробного пейзажа полости матки, рецептивности и васкуляризации эндометрия по данным УЗИ на развитие ХЭ, разработана программа прегравидарной подготовки пациенток, имеющих в анамнезе неудачу имплантации эмбрионов в программе ЭКО.
Выбор метода гормональной терапии
- Пациенткам, имеющим нормальную толщину эндометрия (более 8 мм) после овуляции и нормальный кровоток в сосудах эндометрия ИР в базальных артериях не более 0,48, в спиральных артериях 0,38, ИР в аркуатных артериях 0,64, ИР в маточной артерии 0,8) при проведении допплерометрии на 20–22 день менструального цикла, в качестве прегравидарной подготовки назначался дидрогестерон внутрь 10 мг 2 раза в сутки с 16-го по 25-й день менструального цикла).
- У пациенток со сниженной толщиной эндометрия (менее 6–8 мм) после овуляции препаратами выбора явились Фемостон 2/10 с 1 дня менструального цикла в течение 28 дней по 1 таблетке 1 раз в сутки с добавлением дидрогестерона внутрь 10 мг 1 раз в сутки с 16-го по 25-й день менструального цикла либо фазовая гормонотерапия препаратами: эстрадиол внутрь 2 мг 1 раз в сутки с 1-го по 15-й день менструального цикла и дидрогестерон внутрь 10 мг 2 раза в сутки с 16-го по 25-й день менструального цикла.
- Пациенткам, имеющим сочетание снижения толщины эндометрия со снижением кровотока в сосудах эндометрия на фоне заместительной гормональной терапии, назначался курс иглорефлексотерапии, с подбором точек акупунктуры, направленных на улучшение кровотока в матке, а также комплекс метаболической терапии.
- Пациенткам группы сравнения на этапе прегравидарной подготовки назначались оральные контрацептивы внутрь по 1 таблетке 1 раз в день с 1-го дня менструального цикла в течение 21-го дня.
Метаболическая терапия при ХЭ направлена на усиление тканевого обмена, активацию энергетических процессов в клетках, устранение последствий гипоксии ткани, в том числе перевод с анаэробного гликолиза на аэробный [2].
В качестве метаболической терапии применялась внутривенная инфузия аскорбиновой кислоты 5% — 5,0 мл с Рибоксином 2% — 10,0 мл на глюкозе 5% — 200 м в течение 10 дней. Депротеинизированный гемодериват крови телят (Актовегин) 5,0 мл (200 мг) внутривенно капельно на 200 мл физиологического раствора через день 5 процедур. Затем в качестве второго этапа назначался Актовегин в таблетках (200 мг) 3 раза в сутки в протоколе ЭКО до получения результата. Наш опыт показал, что применение препарата Актовегин у пациенток, страдающих ХЭ, за счет метаболического действия, а именно увеличения транспорта и утилизации глюкозы и кислорода клетками тканей, позволяет повысить результативность программ ЭКО.
Все пациентки, имеющие несостоявшуюся беременность в программе ЭКО и ПЭ на фоне ХЭ, были разделены на две группы. IIa — основная группа, состоящая из 41 пациентки, страдающей ХЭ, которым была проведена предложенная программа прегравидарной подготовки перед проведением повторной попытки ЭКО и ПЭ; IIб — группа контроля, в которую вошла 31 пациентка, также имеющая в анамнезе одну и более неудачных попыток ЭКО и ПЭ на фоне хронического эндометрита и отказавшаяся от проведения предложенной терапии либо прошедшая ее выборочно. Эффективность повторной попытки ЭКО и ПЭ оценивалась после обнаружения плодного яйца в полости матки и соcтавила в IIа группе 92,7 ± 5,6%, тогда как в группе IIб — 26,7 ± 6,1%, что явилось статистически значимым (p < 0,001). Проведенный комплекс прегравидарной подготовки влиял на результативность повторной попытки ЭКО и ПЭ в 46,61% (а < 0,01): с применением комплексной метаболической терапии в 8,56% (а < 0,01).
Выводы
- Частота ХЭ при несостоявшейся беременности в программе ЭКО и ПЭ составляет 51,8%, из них 81,3% — пациентки с трубно-перитонеальным фактором бесплодия.
- Чувствительность и специфичность анамнестических факторов риска в сочетании с ультразвуковыми методами диагностики и пайпель-биопсией полости матки как методов верификации ХЭ сопоставимы с данными гистероскопического исследования с раздельным диагностическим выскабливанием и последующим гистологическим исследованием содержимого полости матки.
- Микробный пейзаж полости матки у пациенток, имеющих в анамнезе несостоявшуюся беременность в программе ЭКО и ПЭ на фоне ХЭ, преимущественно представлен ассоциациями условно-патогенных микроорганизмов и вирусов. При этом бактериальная обсемененность в группе пациенток, имеющих в анамнезе неудачу имплантации в программе ЭКО, и в группе сравнения составляет соответственно 5,6% и 1,5% в цервикальном канале (р = 0,091), тогда как в полости матки 48,6% и 16,4% (p < 0,001).
- Предложенный алгоритм врачебных действий в зависимости от микробного пейзажа полости матки, состояния рецепторного аппарата, толщины эндометрия и состояния кровотока в сосудах эндометрия у пациенток, имеющих в анамнезе неудачу имплантации в программе ЭКО на фоне ХЭ, позволяет повысить эффективность последующих программ ВРТ.
Литература
- Никитин А. И. Факторы неудач в программах вспомогательной репродукции // Проблемы репродукции. 1995. № 2. С. 36–43.
- Шуршалина А. В. Хронический эндометрит у женщин с патологией репродуктивной функции: автореф. дисс. … д-ра мед. наук: 14.00.01. М., 2007. 280 с.
- Бесплодный брак. Современные подходы к диагностике и лечению / Под ред. В. И. Кулакова. М.: ГЭОТАР-Мед. 2006. 616 с. ISBN: 5–9704–0268–0.
- Серебренникова К. Г., Лапшихин А. А., Кузнецова Е. П. и др. Хронический эндометрит. Особенности подготовки к программам ВРТ // Репродуктивные технологии сегодня и завтра. Материалы XXI международной конференции Российской ассоциации репродукции человека. СПб, 2011. С. 65–67.
- Сидельникова В. М. Подготовка и ведение беременности у женщин с привычным невынашиванием: методические пособия и клинические протоколы. М.: МЕДпресс-информ. 2011. 224 с. ISBN 978–5-98322–729–3.
- Чандра Д. Р. Использование озонотерапии в комплексном консервативном и эндохирургическом лечении бесплодия трубно-перитонеального генеза: дисс. … канд. мед. наук: 14.00.01. Иваново. 2005. 117 с.
- Силантьева Е. С. Физические методы структурно-функционального ремоделирования эндометрия у женщин с нарушением репродуктивной функции: автореф. дис. … д-ра мед. наук: 14.00.01, 14.00.51. М., 2007. 48 с.
- Сидеропулос Н. Х. Структурно-функциональные особенности эндометрия у женщин с хроническими воспалительными заболеваниями гениталий: автореф. дис. … канд. мед. наук: 14.00.01. М., 2008. 20 с.
- Овчинникова В. В. Оптимизация прегравидарной подготовки женщин с невынашиванием беременности на фоне хронического эндометрита: дисс. … канд. мед. наук: 14.00.01. М., 2006. 130 с.
- Cravello L. et al. Identification and treatment of endometritis // Contracept Fertil Sex. 1997, Jul-Aug; 25 (7–8). P. 585–586.
Е. Б. Рудакова*, доктор медицинских наук, профессор
О. А. Лобода**, ***
*ГУЗ Московский областной перинатальный центр, Балашиха
**ГБОУ ВПО ОмГМА,
***Центр репродуктивной медицины, Омск
Контактная информация об авторах для переписки: ks.loboda@mail.ru
Купить номер с этой статьей в pdf