Первичный склерозирующий холангит (ПСХ) — это хроническое прогрессирующее холестатическое заболевание печени неясной этиологии, характеризующееся негнойным деструктивным воспалением, облитерирующим склерозом и сегментарной дилятацией внутри- и внепеченочных желчных протоков, приводящее к развитию вторичного билиарного цирроза, портальной гипертензии и печеночной недостаточности [1]. Распространенность ПСХ в разных странах отличается. Так, в Северной Европе она составляет 10 на 100 тысяч населения, а в Азии ПСХ встречается в 10–100 раз реже. Болезнь развивается чаще у мужчин (женщины болеют в 1,5–2 раза реже) [2]. Чаще всего заболевание начинается в возрасте 30–40 лет, хотя известны случаи развития ПСХ в детском и пожилом возрасте [3].
В патогенезе ПСХ важная роль принадлежит нарушению иммунной толерантности. Доказательством этого являются обнаружение широкого спектра аутоантител в сыворотке крови таких больных: обнаружены антитела к ДНК, к гладкой мускулатуре, к билиарному эпителию, к тиреопероксидазе, антимитохондриальные антитела и некоторые другие (описано более 25 видов аутоантител у больных ПСХ), а также частое сочетание ПСХ с другими аутоиммунными заболеваниями, которые могут быть рассмотрены как системные проявления ПСХ [4]. Хронические воспалительные заболевания кишечника обнаруживают у 80–90% больных ПСХ, чаще это язвенный колит, реже встречается болезнь Крона с поражением толстой кишки [2, 3]. Реже ПСХ сочетается с аутоиммунным гепатитом, аутоиммунным тиреоидитом, сахарным диабетом 1-го типа, псориазом (до 10% случаев). Описаны отдельные наблюдения развития ревматоидного артрита, системной склеродермии, системной красной волчанки, склерита, увеита у больных ПСХ [5]. Частое сочетание ПСХ и воспалительных заболеваний кишечника легло в основу предположения о триггерной роли бактериальных антигенов в возникновении ПСХ, однако доказать это не удалось [2]. У родственников больных ПСХ в 11,5 раз повышен риск развития ПСХ, в 3 раза — язвенного колита и в 1,4 раза — болезни Крона [6]. Было сделано предположение о ключевой роли некоторых генов в развитии ПСХ. Были проведены исследования генов HLA-A, HLA-B, HLA-DR, MST1R, NOD2, ATG16L1, однако какого-либо одного гена, специфичного для ПСХ, не было найдено [2].
ПСХ можно заподозрить при наличии у больного синдрома холестаза, не объяснимого другими причинами. Чаще всего больных беспокоит выраженный кожный зуд, желтуха, лихорадка (чаще субфебрильная, при присоединении бактериального холангита — фебрильная), боли в правом подреберье, тошнота, общая слабость, быстрая утомляемость. Нередко (примерно у трети больных) жалобы отсутствуют, и холестаз выявляется случайно при лабораторном исследовании по другому поводу [3]. При лабораторном исследовании выявляют повышение активности гамма-глутамилтранспептидазы и щелочной фосфатазы, гипербилирубинемию (при развитии бактериального холангита уровень билирубина может резко возрастать), гиперлипидемию, повышение скорости оседания эритроцитов, иногда эозинофилию [7]. Диагноз подтверждают при магнитно-резонансной холангиографии или эндоскопической ретроградной холангиопанкреатографии («золотой стандарт»). При этих исследованиях выявляются участки сужения желчных протоков с неравномерными контурами, чередующиеся с нормальными или расширенными участками; мелкие внутрипеченочные протоки видны не все или не видны совсем (симптом «обгорелого дерева») [2]. При биопсии печени можно выявить особую форму ПСХ — мелкопротоковую (поражаются только мелкие внутрипеченочные протоки), а также иногда удается получить участки пораженных крупных протоков [3]. Морфологически ПСХ характеризуется негнойным деструктивным холангитом с облитерацией просветов желчных протоков и склерозом их стенок, выраженным перидуктальным фиброзом (феномен «луковичной шелухи»). Чаще всего (в 75% случаев) поражаются и крупные, и мелкие протоки, хотя встречаются случаи поражения только крупных или только мелких желчных протоков [2].
Препаратом выбора при консервативном лечении ПСХ является урсодезоксихолевая кислота в дозе 20–30 мг/кг/сут (Урсофальк, Урсосан, Урдокса). Урсодезоксихолевая кислота обладает гепатопротективным действием — она образует нетоксичные мицеллы с токсичными желчными кислотами (хенозедоксихолевой, литохолевой), а также включается в состав мембран гепатоцитов и холангиоцитов, увеличивая их стабильность. Это уменьшает степень повреждения клеток печени токсичными желчными кислотами. Урсодезоксихолевая кислота обладает свойствами иммуномодулятора, угнетая экспрессию HLA-антигенов на мембранах гепатоцитов и холангиоцитов. Кроме того, препарат уменьшает литогенность желчи за счет уменьшения абсорбции холестерина в кишечнике, а также стимулирует холерез, что увеличивает выведение желчных кислот через кишечник [2, 3]. При неэффективности монотерапии урсодезоксихолевой кислотой к терапии добавляют фибраты, которые способствуют уменьшению холестаза [2].
Получены данные о том, что лактулоза (Дюфалак, Нормазе) в дозе 15–45 мл/сут обладает гепатопротективным действием, которое может реализовываться посредством нескольких механизмов: 1) ингибирование продукции аммиака и других ксенобиотиков; 2) утилизация образовавшегося аммиака; 3) нарушение всасывания и быстрое выведение аммиака с калом [7, 8]. Уменьшение образования аммиака в кишечнике под действием лактулозы связано с уменьшением количества кишечной микрофлоры, продуцирующей уреазу. Утилизация аммиака происходит при помощи бактерий, использующих азотсодержащие соединения в качестве субстрата для синтеза собственных белков; лактулоза способствует увеличению количества этих микроорганизмов в кишечнике. Кроме того, лактулоза способна связывать молекулы аммиака и увеличивать скорость транзита содержимого по кишечнику, что способствует быстрому выведению аммиака из организма. Лактулоза обладает свойствами пребиотика: под ее воздействием в кишечнике увеличивается количество бифидобактерий и уменьшается количество патогенных бактерий, что предотвращает избыточный бактериальный рост и снижает риск проникновения антигенов патогенных бактерий из кишечника в кровь [14]. Недавно в России было проведено исследование, согласно результатам которого при лечении больных с холестазом урсодезоксихолевой кислотой в комбинации с лактулозой (Урсолив) наблюдается большее уменьшение выраженности холестаза, чем при лечении только урсодезоксихолевой кислотой [9].
Таким образом, совместное применение урсодезоксихолевой кислоты и лактулозы приводит к синергизму гепатопротективного эффекта обоих веществ.
При сочетании ПСХ с аутоиммунным гепатитом к лечению добавляют глюкокортикостероиды и/или иммуносупрессанты в дозах, стандартных для лечения аутоиммунного гепатита [9]. С целью устранения зуда в качестве препарата первой линии применяют Холестирамин (4 г/сут), однако не все пациенты хорошо его переносят: наиболее частыми причинами отказа от препарата являются его вкус, вздутие живота, запоры или диарея. При непереносимости Холестирамина применяют Рифампицин (300 мг/сут), Сертралин (75–100 мг/сут), Налтрексон (50 мг/сут). При выраженном зуде может потребоваться альбуминовый диализ или плазмаферез. Нестерпимый зуд, не купирующийся консервативными методами, может являться самостоятельным показанием к трансплантации печени. Длительный холестаз является фактором риска развития остеопороза, поэтому таким пациентам в схему лечения необходимо включать кальций (1500 мг/сут) и витамин D (1000 МЕ/сут). Витамин K назначается при наличии геморрагического синдрома, особенно перед инвазивными диагностическими процедурами [3, 10].
К хирургическим методам лечения ПСХ относятся установка стентов, резекция пораженных участков желчных протоков, трансплантация печени. Стентирование, баллонная дилятация и резекция пораженных участков протоков лишь временно уменьшают выраженность холестаза, не останавливая прогрессирование ПСХ. Наиболее эффективным хирургическим методом лечения ПСХ является трансплантация печени, которая улучшает выживаемость больных. Однако у 15–20% больных развивается рецидив ПСХ в трансплантате, что ухудшает прогноз таких пациентов [2, 3, 10].
При естественном течении ПСХ часто развивается холангиокарцинома (до 40% больных), повышен риск развития рака поджелудочной железы и колоректального рака, поэтому необходимы как можно более ранние диагностика и лечение этого заболевания [11, 12].
Цель исследования. Изучение распространенности и спектра внепеченочных проявлений первичного склерозирующего холангита.
Материалы и методы. Объектом исследования были 23 больных первичным склерозирующим холангитом, наблюдавшихся в Клинике нефрологии, внутренних и профессиональных заболеваний им. Е. М. Тареева Первого МГМУ им. И. М. Сеченова в период с 1984 по 2010 гг. В группе было 12 мужчин и 11 женщин, средний возраст данной группы составил 36,4 ± 13,7 года, средний возраст начала заболевания 30,6 ± 15 лет, средняя продолжительность заболевания 5,8 ± 5,2 года.
Материалами исследования служили данные из архивных записей в историях болезни и амбулаторных картах. Критерием включения в исследование являлся подтвержденный диагноз ПСХ (морфологически, посредством магнитно-резонансной холангиографии или ретроградной эндоскопической холангиопанкреатографии). Критерием исключения являлось наличие у больного сочетания ПСХ и аутоиммунного гепатита, так как аутоиммунный гепатит также характеризуется широким спектром системных проявлений. Изучалось наличие следующих системных проявлений ПСХ: хронические воспалительные заболевания кишечника (язвенный колит и болезнь Крона), поражение глаз (склерит, кератит), аутоиммунный тиреоидит, синдром Шегрена, геморрагический васкулит.
Результаты и обсуждение. У 16 больных (69,6%) были выявлены внепеченочные проявления ПСХ. Из данных, представленных в табл. 1, видно, что в обследованной группе были выявлены хронические воспалительные заболевания кишечника (язвенный колит и болезнь Крона), синдром Шегрена, геморрагический васкулит, поражение глаз (склерит, кератит), поражение щитовидной железы (аутоиммунный тиреоидит).
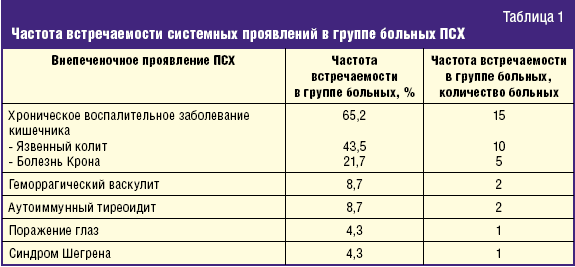
У пациентов с сочетанием ПСХ и болезни Крона (5 больных) в 1 случае была поражена только толстая кишка; в 2 случаях — и тонкая, и толстая кишка; в 2 случаях — только тонкая кишка. Отсутствие поражения толстой кишки у двух больных с болезнью Крона при ПСХ указывает на необходимость длительного динамического наблюдения за этими пациентами, так как в дальнейшем у них возможно присоединение поражения толстой кишки.
У 4 больных (17,4%) отмечено сочетание нескольких системных проявлений ПСХ. У 3 больных выявлено два внепеченочных проявления ПСХ (2 случая — язвенный колит в сочетании с аутоиммунным тиреоидитом, 1 случай — язвенный колит в сочетании с геморрагическим васкулитом). У 1 пациента выявлено три внепеченочных проявления ПСХ — язвенный колит в сочетании с геморрагическим васкулитом и поражением глаз (склерит, кератит).
В связи с повышенным риском развития онкологических заболеваний у больных ПСХ мы изучили распространенность злокачественных заболеваний в изучаемой группе больных. Онкологические заболевания были выявлены у 3 больных (13%): 1 случай (пациент с ПСХ в сочетании с болезнью Крона) — лимфома с поражением тонкой кишки, выявлена одновременно с подтверждением диагноза ПСХ; 1 случай (больная с ПСХ без системных проявлений) — лимфома с поражением печени, лимфатических узлов ворот печени, забрюшинных лимфатических узлов, выявлена одновременно с подтверждением диагноза ПСХ; 1 случай (пациентка с ПСХ в сочетании с язвенным колитом) — аденокарцинома толстой кишки, выявлена через 13 лет после подтверждения диагноза ПСХ. В связи с частым развитием злокачественных опухолей у больных ПСХ необходима постоянная онкологическая настороженность врачей, работающих с этой категорией больных.
Также мы проанализировали распространенность системных проявлений ПСХ в зависимости от пола больных и возраста первых проявлений ПСХ (табл. 2 и 3).
Как видно из табл. 2, хронические воспалительные заболевания кишечника, поражение глаз и синдром Шегрена встречались чаще у мужчин, а поражение щитовидной железы было зарегистрировано только у женщин. Возможно, меньшая подверженность женщин хроническим воспалительным заболеваниям кишечника связана с большей концентрацией эстрогенов в их крови, чем у мужчин. В эксперименте на мышах (Harnish D. C. et al., 2004) был доказан положительный эффект эстрогенов при лечении хронических воспалительных заболеваний кишечника, однако необходимо дальнейшее исследование этого вопроса [13]. Более частое развитие аутоиммунного тиреоидита у женщин, наиболее вероятно, связано с более низким содержанием тестостерона в их крови, чем у мужчин. В исследовании, проведенном на мышах, Ansar A. S. et al. (1986) доказали положительный эффект тестостерона при лечении аутоиммунного тиреоидита [14].
С целью изучения связи частоты обнаружения системных проявлений ПСХ и возраста начала заболевания мы разделили больных ПСХ на две подгруппы — тех, у кого заболевание началось в детском возрасте (6 человек, возраст начала заболевания от 10 до 17 лет), и тех, у кого первые проявления ПСХ возникли во взрослом состоянии (17 человек, возраст начала заболевания от 20 до 66 лет) (табл. 3).
Из табл. 3 следует, что в группе больных, у которых ПСХ начался в детском возрасте, внепеченочные проявления регистрировались чаще, чем в группе пациентов, заболевших во взрослом состоянии. Причина такого различия распространенности системных проявлений ПСХ в различных возрастных группах в настоящее время неясна, необходимы дальнейшие исследования этого вопроса, в том числе обследование больших групп больных ПСХ.
Выводы
- ПСХ часто сопровождается внепеченочными проявлениями, наиболее распространенные из которых — хронические воспалительные заболевания кишечника.
- У одного больного может встречаться сочетание нескольких системных проявлений ПСХ.
- Поражение кишечника при ПСХ чаще развивается у мужчин, поражение щитовидной железы — у женщин.
- ПСХ, развившийся в детском возрасте, сопровождается системными проявлениями чаще, чем ПСХ, начавшийся у взрослых.
Литература
- Лазебник Л. Б., Рыбак В. С., Ильченко Л. Ю. Первичный склерозирующий холангит // Consilium Medicum. 2003; 6: 28–30.
- Авдеев В. Г. Первичный склерозирующий холангит // Гепатологический форум. 2009; 1: 24–32.
- Karlsen T. H., Schrumpf E., Boberg K. M. Update on primary sclerosing cholangitis // Digestive and Liver Disease. 2010; 42: 390–400.
- Hov J. R., Boberg K. M., Karlsen T. H. Autoantibodies in primary sclerosing cholangitis //World J. Gastroenterol. 2008; 14 (24): 3781–3791.
- Saarinen S., Olerup O., Broome U. Increased frequency of autoimmune diseases in patients with primary sclerosing cholangitis // Am. J. Gastroenterol. 2000; 95: 3195–3199.
- Bergquist A., Montgomery S. M., Bahmanyar S. et al. Increased risk of primary sclerosing cholangitis and ulcerative colitis in first-degree relatives of patients with primary sclerosing cholangitis // Clin. Gastroenterol. Hepatol. 2008; 6 (8): 939–943.
- VanBerge-Henegouwen G. P., Portincasa P., van Erpecum K. J. Effect of lactulose and fiber-rich diets on bile in relation to gallstone diosease: an update // Scand. J. Gastroenterol. Suppl. 1997; 222: 68–71.
- Григорьев П. Я., Яковенко Э. П. Лактулоза в терапии заболеваний органов пищеварения // Российский гастроэнтерологический журнал. 2000; № 2: 71–78.
- Кучмин А. Н., Резван В. В., Евсюков К. Б. и соавт. Исследование клинической эффективности совместного применения урсодезоксихолевой кислоты и лактулозы у больных с гепато-билиарной патологией // Русский медицинский журнал. 2011; Том 19, № 12: 742–747.
- Авдеев В. Г., Бурневич Э. З., Северов М. В. Первичный склерозирующий холангит. В кн.: Практическая гепатология. Под ред. Мухина Н. А. М.: Проект «Мы». 2004. 111–115.
- Duclos-Vallee J. C., Sebagh M. Recurrence of autoimmune disease, primary sclerosing cholangitis, primary biliary cirrhosis, and autoimmune hepatitis after liver transplantation // Liver Transpl. 2009; 15 (Suppl. 2): S25-S34.
- Мухин Н. А., Абдурахманов Д. Т., Лопаткина Т. Н. и соавт. Первичный склерозирующий холангит у молодой женщины // Клиническая гепатология. 2006; 3: 34–39.
- Harnish D. C., Albert L. M., Leathurby Y. et al. Beneficial effects of estrogen treatment in the HLA-B27 transgenic rat model of inflammatory bowel disease // Am. J. Physiol. Gastrointest. Liver Physiol. 2004; 286 (1): G118–125.
- Ansar Ahmed S., Young P. R., Penhale W. J. Beneficial effect of testosterone in the treatment of chronic autoimmune thyroiditis in rats // J. Immunol. 1986; 136 (1): 143–147.
Е. А. Александрова*
Э. З. Бурневич*, кандидат медицинских наук, доцент
Е. А. Арион**
* ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития РФ,
**Клиника нефрологии, внутренних и профессиональных болезней им. Е. М. Тареева, Москва
Контактная информация об авторах для переписки: katja52@yandex.ru
Купить номер с этой статьей в pdf