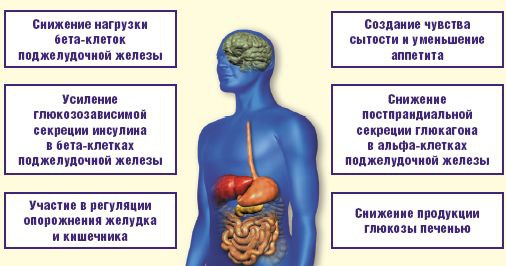
Современная эпидемиологическая ситуация в России характеризуется, с одной стороны, значительным ростом заболеваемости сахарным диабетом 2-го типа (СД), а с другой стороны, недостаточной эффективностью существующих методов терапии. Нередко пациенты с СД имеют одно или несколько сопутствующих заболеваний со стороны сердечно-сосудистой, дыхательной, пищеварительной и мочеполовой систем, что отражается в трудностях и ограничении выбора оптимальной сахароснижающей терапии. В подобной клинической ситуации наиболее естественным и эффективным методом сахароснижающей терапии служит назначение инсулина. Одним из составляющих факторов инсулинотерапии является назначение его высоких доз, что нередко приводит к риску развития гипогликемии, кроме того, возможна прибавка веса. Гипогликемия может представлять наибольший барьер для оптимального гликемического контроля, особенно у лиц старшей возрастной группы, которые в меньшей степени способны реагировать на гипогликемические эпизоды. В этой ситуации все актуальнее становятся разработка и внедрение новых препаратов для лечения СД [1]. Ввиду необходимости в качественном контроле над уровнем гликемии без увеличения массы тела, риска развития гипогликемии и негативного влияния на другие органы и системы организма, множество научных исследований было направлено на поиск нового механизма регуляции гомеостаза глюкозы, которым стали инкретины — гормоны желудочно-кишечного тракта [2]. Их представителями являются глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид-1 (ГПП-1) [3]. Детальное изучение инкретинов показало их непосредственное влияние не только на синтез инсулина поджелудочной железой, но и на ткани печени, желудка, головного мозга, сердечной мышцы [4, 5]. Эффекты инкретинов наглядно представлены на рис. 1.
Инкретины являются основными интестинальными гормонами, которые секретируются в ответ на прием пищи и стимулируют глюкозозависимую секрецию инсулина. Действие инкретинов составляет около 60% от инсулинового ответа
в постпрандиальном состоянии. У больных СД уровень инкретинов снижен [7], при этом инфузия инкретинов данной категории пациентов восстанавливает у них инсулиновый ответ, что приводит к нормализации гликемии и доказывает роль инкретинов в углеводном обмене [8]. Однако инкретины, синтезируемые в кишечнике в ответ на прием пищи, быстро и активно инактивируются ферментом дипептидилпептидазой-4 (ДПП-4). Образованные неактивные метаболиты инкретинов существуют в организме всего около двух минут [9]. В этой связи было выдвинуто предположение, что ингибирование ДПП-4 может увеличить концентрацию эндогенных инкретинов за счет предотвращения их инактивации, а следовательно, усилит нарушенный при СД инкретиновый ответ и улучшит состояние метаболического контроля в результате коррекции многочисленных дефектов [10]. Первые данные, доказывающие данную гипотезу, появились еще в 2000 году [11, 12]. Таким образом, у больных СД действие инкретинов можно восстановить путем введения высокоселективных ингибиторов ДПП-4, наиболее изученным среди которых являются вилдаглиптин (Галвус), ситаглиптин и саксаглиптин. Сравнение основных представителей ингибиторов ДПП-4 дано в табл. 1.
Механизм действия ингибиторов ДПП-4 максимально приближен к естественным процессам, происходящим в здоровом человеческом организме. Под их действием происходит уменьшение частоты защитных перекусов, которые пациенты употребляют во избежание гипогликемий, уменьшение всасывания жира из кишечника, повышение расхода энергии, а также повышение окисления липидов во время приема пищи [13]. Кроме того, при СД в результате повышенного апоптоза бета-клетки теряют свою массу, что выражается в значительных нарушениях их функций, основной из которых является синтез инсулина. Физиологичное действие данной группы препаратов поддерживает жизнеспособность бета-клеток поджелудочной железы, увеличивает их массу на 75% и на 65% уменьшает апоптоз [14]. Наиболее других ингибиторов ДПП-4 изучен вилдаглиптин [15]. В зарубежной и отечественной литературе имеются многочисленные работы, посвященные эффективности и безопасности вилдаглиптина и его комбинации с метформином (Галвус Мет) у пациентов с избыточным весом [16], пожилого возраста [17], а также у больных кардиоваскулярной патологией [18]. Сердечно-сосудистые эффекты вилдаглиптина сводятся к уменьшению ремоделирования миокарда, улучшению функции эндотелия, снижению атерогенных фракций липопротеидов, снижению артериального давления (АД), уменьшению симптомов недостаточности кровообращения, защите миокарда от ишемии, а также к функциональному восстановлению миокарда после ишемии и увеличению числа рецепторов к инсулину в кардиомиоцитах [19]. Кардиометаболизм ингибиторов ДПП-4 представлен в табл. 2.
Доказательная база кардиальных эффектов вилдаглиптина складывается из исследования Nathewani (2006), в котором автор показал снижение систолического АД (САД) на 4,1 мм рт. ст. и диастолического АД (ДАД) — на 2,7 мм рт. ст. под влиянием вилдаглиптина [20]; исследования Bosi (2007) со снижением у 536 пациентов САД на 8,3 мм рт. ст., а ДАД — на 4,5 мм рт. ст. [21]; исследования Matikainen (2006) со снижением уровня триглицеридов [22]; работы Kothny (2008), демонстрирующей снижение общей частоты сердечно-сосудистых явлений по сравнению с плацебо и группой сравнения на 1,15% и 1,29% соответственно [23].
Кроме того, не следует забывать, что более 80% пациентов старшей возрастной группы, госпитализированных в многопрофильные стационары, одновременно сочетают в себе более трех заболеваний, а в единичных случаях на долю одного больного приходится до 8–10 болезней, каждое из которых, посредством своих осложнений, может доставить пациенту с СД массу неприятностей (рис. 2).
| |
| Рис. 2. Органные поражения у коморбидных больных СД |
В условиях коморбидности весьма распространена полипрагмазия, а комбинировать лекарственные препараты приходится намного чаще. Вилдаглиптин не взаимодействует с основными препаратами, применяемыми в кардиологической практике, среди которых ингибиторы ангиотензинпревращающего фермента (АПФ), сердечные гликозиды, статины, непрямые антикоагулянты, бета-адреноблокаторы, антагонисты кальция, антиагреганты и сартаны. За все время существования вилдаглиптина клинически значимых случаев взаимодействия его с указанными препаратами отмечено не было [24, 25].
Таким образом, терапия вилдаглиптином должна быть назначена пациентам, не достигшим гликемического контроля на монотерапии инсулином или метформином; с непереносимостью и противопоказаниями к назначению бигуанидов; с рецидивирующими гипогликемиями и ожирением; а также с коморбидной сосудистой патологией и низким комплаенсом.
С целью определения эффективности и безопасности вилдаглиптина в лечении коморбидных больных СД, авторами было проведено клиническое когортное исследование в амбулаторных условиях. В работу были включены 30 пациентов с СД, получавших инсулинотерапию в средней дозе 35,65 ± 10,6 ЕД в сутки. Диагноз СД, его тип и степень тяжести устанавливали в соответствии с рекомендациями Всемирной Организации Здравоохранения (1999). В исследование включали коморбидных пациентов с индексом массы тела (ИМТ) от 25 до 45 кг/м2, абдоминальным ожирением (превышение коэффициента ожирения, соответствующего 0,85 у женщин и 1,0 у мужчин) и концентрацией гликированного гемоглобина от 7% до 9%.
В исследование не вошли больные СД 1-го типа, пациенты с повышенной чувствительностью к компонентам вилдаглиптина, пациенты со злокачественными новообразованиями, а также больные тяжелой хронической почечной и печеночной недостаточностью.
У всех пациентов исходно и через 12 недель терапии вилдаглиптином проводили общеклинический осмотр, антропометрическое обследование (рост, вес, окружность талии (ОТ), ИМТ, коэффициент ожирения (КО)). КО как отношение ОТ к окружности бедер (ОБ). ИМТ рассчитывали по формуле Кетле. Всем больным был выполнен биохимический анализ крови (общий холестерин (ОХС), липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), триглицериды (ТГ), аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ), креатинин), а также была определена концентрация гликированного гемоглобина (НbА
После предварительного обследования пациентам в дополнение к плановой инсулинотерапии назначали вилдаглиптин в дозе 50 мг 2 раза в сутки. Терапию, назначенную по поводу сопутствующей патологии, в ходе исследования не изменяли.
У всех пациентов имело место ожирение разной степени выраженности. Средняя масса тела составляла 85,74 ± 14,6 кг, ИМТ 32,11 ± 3,64 кг/м2 и КО 1,0 ± 0,08. Соотношение мужчин и женщин в группе составило 7 и 23, а их средний возраст 63,37 ± 7,0 лет и 66,24 ± 5,1 года соответственно. В структуре сопутствующей патологии обследуемых пациентов преобладала артериальная гипертензия (87%), ишемическая болезнь сердца (64%), ХПН (13%), хроническая обструктивная болезнь легких (12%), желчно-каменная болезнь (10%) и язвенная болезнь желудка и 12-перстной кишки (9%) (рис. 3).
| |
|
Реклама |
| |
| Рис. 4. Динамика массы тела и окружности талии на фоне терапии вилдаглиптином |
На фоне терапии вилдаглиптином авторы наблюдали снижение уровня постпрандиальной глюкозы на 15,8% (с 10,08 ± 1,83 ммоль/л до 8,49 ± 1,25 ммоль/л) (р < 0,05) и уровня глюкозы натощак — на 20,1% (с 7,21 ± 1,31 ммоль/л до 5,76 ± 1,53 ммоль/л) (р < 0,05). Доза вводимого инсулина снизилась с 33,8 ± 8,15 ЕД/сутки до 26,4 ± 5,69 ЕД/сутки. Важным преимуществом терапии являлось то, что достижение целевых значений гликемии не сопровождалось увеличением массы тела. Через 12 недель на фоне применения вилдаглиптина масса тела снизилась на 6,2% (с 85,7 ± 14,6 кг до 80,4 ± 11,8 кг) (p < 0,05). Окружность талии уменьшилась на 5,3% (со 109,2 ± 11,2 см до 103,4 ± 12,3 см) (p < 0,05) (рис. 4).
Кроме того, после 12-недельного лечения вилдаглиптином авторы отметили у исследуемых пациентов снижение уровня ОХС на 11,4% (с 6,07 ± 1,71 ммоль/л до 5,38 ± 1,48 ммоль/л) (p < 0,05), ЛПНП на 11,8% (с 3,56 ± 0,88 ммоль/л до 3,14 ± 0,84 ммоль/л) (p < 0,05), ТГ на 20,6% (с 2,14 ± 0,52 ммоль/л до 1,7 ± 0,42 ммоль/л) (p < 0,05).
| |
| Рис. 5. Динамика концентрации гликированного гемоглобина на фоне вилдаглиптина |
На момент включения в программу исследования пациентов их уровень НbА1с в среднем составлял 7,92 ± 0,57%. При этом 63% больных имели HbA1c от 7% до 8%, а 33% пациентов — от 8% до 9%. В целом добавление вилдаглиптина к инсулину в течение 12 недель привело к снижению уровня HbA1c на 1,8% в сравнении с исходными значениями (с 7,92 ± 0,55% до 7,78 ± 0,56%) (p < 0,05) (рис. 5).
В ходе исследования у всех пациентов претерпели изменения цифры АД. Так, по данным СМАД было зарегистрировано снижение показателей САД и ДАД в дневные часы: САД на 3,8% (с 142,0 ± 9,3 мм рт. ст. до 136,6 ± 5,3 мм рт. ст.) (p < 0,05) и ДАД на 6,1% (с 87,6 ± 5,5 мм рт. ст. до 82,3 ± 5,3 мм рт. ст.) (p < 0,05). В ночные часы САД снизилось на 6,9% (со 129,5 ± 7,3 мм рт. ст. до 120,5 ± 3,21 мм рт. ст.) (p < 0,001), а ДАД — на 7,4% (с 78,1 ± 3,5 мм рт. ст. до 72,3 ± 5,5 мм рт. ст.) (p < 0,01). На фоне лечения вилдаглиптином существенных изменений функционального состояния эндотелия отмечено не было (p > 0,01).
Применение вилдаглиптина не влияло на общее количество зарегистрированных нарушений ритма сердца. В целом у исследуемых пациентов в течение двенадцати недель терапии вилдаглиптином по данным биохимических показателей и клинической картины эпизодов гипогликемии не наблюдалось, лишь у одного из тридцати пациентов (3%) по истечении семи недель терапии был зафиксирован эпизод гипогликемии до 2,8 ммоль/л. Кроме того, у одного пациента (3%) был трехдневный эпизод диареи с последующей нормализацией стула, без отмены препарата.
Результаты данного исследования не противоречат материалам, полученным Fonseca (2006), который в группе, состоявшей из 256 больных с неудовлетворительными показателями углеводного обмена (исходно уровень гликированного гемоглобина составлял 8,4%), в течение 24 недель изучал эффективность добавления вилдаглиптина (50 мг в сутки) к инсулину (средняя суточная доза составляла 82 ЕД). Важно отметить, что на протяжении периода исследования режим инсулинотерапии у пациентов не менялся. К концу наблюдения значения уровня гликированного гемоглобина в основной группе снизились на 0,5%, а в группе контроля (инсулин в сочетании с плацебо) — всего на 0,2%. При этом у больных в возрасте старше 65 лет комбинация инсулина с вилдаглиптином способствовала уменьшению уровня гликированного гемоглобина на 0,7%, в то время как в контрольной группе статистически значимой разницы по возрасту отмечено не было.
Таким образом, в проведенном авторами исследовании вилдаглиптин показал высокую эффективность в компенсации углеводного и липидного обмена, а также хороший профиль безопасности. Прием препарата приводил к снижению массы тела, не повышая сердечно-сосудистый риск и не изменяя биохимические параметры. На основании выполненной работы можно заключить, что внедрение в широкую клиническую практику новой группы пероральных сахароснижающих препаратов — ингибиторов ДПП-4 весьма перспективно для лечения коморбидных пожилых больных СД.
Литература
- Дедов И. И., Шестакова М. В. Сахарный диабет в пожилом возрасте: диагностика, клиника, лечение. Практическое руководство для врачей. М., 2011.
- Аметов А. С., Карпова Е. В. Инкретиномиметики — новый этап в лечении сахарного диабета 2-го типа // РМЖ. Эндокринология. 2010, № 23, с. 1410–1415.
- Drucken D. J., Nauck M. A. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes // Lancet. 2006, Vol. 368, p. 1696–1605.
- Романцова Т. И. Ингибитор дипептидилпептидазы — 4-ситаглиптин: новые возможности терапии сахарного диабета 2-го типа // Ожирение и метаболизм. 2006, 4 (9).
- Maegawa H. Sitagliptin added to ongoing treatment with pioglitazone study up-to 52 weeks in Japanese patients with T2 DM // EASD Poster August. 2008.
- Fonseca V., Dejager S., Albrecht S. Vildagliptin as add-on to insulin in patients with type 2 diabetes (T2 DM) // Diabetes. 2006; 55 (suppl. 1): A111.
- Toft-Nielsen M. B. Determinants of the impaired secretion of glucagon-like peptide-1 in type 2 diabetic patients // J Clin Endocrinol Metab. 2001, 86: 3717–3723.
- Vilsboll T. Defective amplification of the late phase insulin response to glucose by GIP in obese Type II diabetic patients // Diabetologia. 2002, 45: 1111–1119.
- Knop F. K. Resolution of type 2 diabetes following gastric bypass surgery: involvement of gut-derived glucagon and glucagonotropic signalling? // Diabetologia. 2009, 52: 2270–2276.
- Kieffer T. J. Degradation of glucose-dependent insulinotropic polypeptide and truncated glucagon-like peptide 1 in vitro and in vivo by dipeptidyl peptidase IV // Endocrinology. 1995, 136: 3585–3596.
- Deacon C. F. Both subcutaneously and intravenously administered glucagon-like peptide 1 are rapidly degraded from the NH2-terminus in type II diabetic patients and in healthy subjects // Diabetes. 1995, 44: 1126–1131.
- Rothenberg P. Treatment with a DPP-IV inhibitor, NVP-DPP728, increases prandial intact GLP-1 levels and reduces glucose exposure in humans // Diabetes. 2000; 49 (suppl. 1): A39.
- Rosenstock J. Comparison of vildagliptin and rosiglitazone monotherapy in patients with type 2 diabetes: double-blind, randomized trial // Diabetes Care. 2007, 30 (2): 217–223.
- Matikainen N. Vildagliptin therapy reduces postprandial intestinal triglyceride-rich lipoprotein particles in patients with type 2 diabetes // Diabetologia. 2006, 49: 2049–2057.
- Duttaroy A. The DPP-4 inhibitor vildagliptin increases pancreatic beta-cell neogenesis and decreases apoptosis // Poster № 572 presented at ADA, 2005.
- Bosi E. Effects of vildagliptin on glucose control over 24 weeks in patients with type 2 diabetes inadequately controlled with metformin // Diabetes Care. 2007, 30: 890–895.
- Boschmann M. Dipeptidyl-peptidase-IV inhibition augments postprandial lipid mobilization and oxidation in type 2 diabetic patients // J Clin Endocrinol Metab.2009, 94: 846–852.
- Nikolaidis L., Mankad S., Sokos G. Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after successful reperfusion // Circulartion. 2004, 109: 962–965.
- Ban K. Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor–dependent and independent pathways // Circulation. 2008, 117: 2340–2350.
- Nathewani A. Reduction in blood pressure in patients treated with vildagliptin as monotherapy or in combination with metformin for type 2 diabetes // ADA. 2006, p. 474.
- Diess D., Bosi E. Improved glycemic control in poorly controlled patients with type 1 diabetes using real-time continuous glucose monitoring // Diabetes Care. 2006, 29: 2730–2732.
- Matikainen N. Vildagliptin therapy reduces postprandial intestinal triglyceride-rich lipoprotein particles in patients with type 2 diabetes // Diabetologia. 2006, 49 (9): 2049–2057.
- Ligueros-Saylan M., Schweizer A., Dickinson S., Kothny W. Vildagliptin therapy is not associated with an increased risk of pancreatitis // EASD. 2009, Poster presentation.
- He Y-L. Effect of the novel oral dipeptidyl peptidase IV inhibitor vildagliptin on the pharmacokinetics and pharmacodynamics of warfarin in healthy subjects // Curr Med Res Opin. 2007, 23: 1131–1138.
- Ayalasomayajula S. P., Dole K. Evaluation of the potential for steady-state pharmacokinetic interaction between vildagliptin and simvastatin in healthy subjects // Curr Med Res Opin. 2007, 23 (12): 2913–2920.
А. Л. Верткин, доктор медицинских наук, профессор
А. Ю. Магомедова
А. С. Скотников, кандидат медицинских наук
МГМСУ, Москва
Контактная информация об авторах для переписки: skotnikov.as@mail.ru
Купить номер с этой статьей в pdf