В последние годы отмечена тенденция к росту числа детей, у которых острые респираторные заболевания сопровождаются бронхообструктивным синдромом, каждый третий ребенок на первом году жизни переносит острый бронхиолит или обструктивный бронхит на фоне ОРВИ [1]. В англоязычной литературе это состояние определяется у детей младше шестилетнего возраста как «virus-induced wheezing» — вирус-индуцированная одышка или «wheezing-associated respiratory infection» — одышка, ассоциированная с респираторной инфекцией [2]. Основными возбудителями вирус-индуцированной одышки в настоящее время являются респираторно-синцитиальный вирус — RSV, аденовирус — AdV, риновирус — HRV, метапневмовирус — HMPV, коронавирусы — HCoV-NL63, HCoV-229E, HCoV-OC43, бокавирус — HBoV (табл. 1).
В ряде популяционных исследований установлено, что у 30% детей первый эпизод обструкции нижних дыхательных путей регистрируется в течение первого года жизни и раннем возрасте [9–11]. Рецидивирование бронхообструктивного синдрома у детей, перенесших острый бронхиолит на первом году жизни, в 34–40% случаев сопровождается формированием гиперреактивности трахеобронхиального дерева, с последующим развитием бронхиальной астмы в дошкольном и школьном возрасте у 23–39% детей [12]. Как правило, не у всех этих детей удается установить семейную предрасположенность к атопии, однако у них может определяться высокий уровень общего IgE в сыворотке крови, а также вирус-специфических IgE [13, 14].
В России, согласно данным эпидемиологических исследований, бронхиальной астмой страдают около 7 млн человек (5% взрослых и 10% детей) [15]. Несмотря на значительные успехи в диагностике и лечении бронхиальной астмы, сохраняется тенденция к увеличению заболеваемости и ее более тяжелому течению. Вирусная инфекция нижних дыхательных путей является одним из факторов, предрасполагающих к развитию бронхиальной астмы, наряду с генетической предрасположенностью, курением матери во время беременности, сенсибилизацией аллергенами в раннем детском возрасте, атопическим дерматитом [16]. Известно, что дебют бронхиальной астмы у большинства больных относится к раннему детскому возрасту, начальные проявления заболевания, как правило, носят характер бронхообструктивного синдрома, сопровождающего респираторные вирусные инфекции [17, 18]. Окончательная диагностика бронхиальной астмы в этом возрастном периоде представляет известные трудности в связи с тем, что начало заболевания характеризуется вирус-индуцированной одышкой, а проведение традиционных методов функционального исследования органов дыхания для выявления бронхиальной обструкции ограничено малым возрастом пациентов [19]. Вместе с тем рецидивирующие пневмотропные инфекции в детском возрасте могут служить фактором риска развития хронической обструктивной болезни легких, которая остается одной из важнейших причин заболеваемости и смертности в мире и выявляется у 10% взрослого населения [20, 21].
Респираторные вирусы повреждают мерцательный эпителий слизистой оболочки дыхательного тракта, увеличивают ее проницаемость для аллергенов, триггеров и чувствительность ирритантных рецепторов подслизистого слоя бронхов, тем самым они влияют на формирование гиперреактивности трахеобронхиального дерева, являющейся ведущим компонентом патогенеза бронхиальной астмы и хронической обструктивной болезни легких [22].
Прямое и опосредованное влияние пневмотропных вирусов на подавление функции гамма-интерферона (IFN) и интерлейкина (IL) 12 определяет девиацию иммунного ответа в пользу Th2-профиля цитокинов (IL-4, IL-5, IL-9, IL-10, IL-13) с последующим образованием вирус-специфических IgE, играющих важную роль в развитии вирус-индуцированной одышки и гиперреактивности бронхов [23]. Особое внимание в последние годы уделяется длительной персистенции респираторных вирусов в эпителии нижних дыхательных путей, за счет инициации транскрипции ядерных факторов NF-κB и JNK/AP1 с образованием IL-1, IL-6, IL-8, IL-11, фактора некроза опухоли — TNF-альфа, гранулоцитарно-макрофагального колониестимулирующего фактора — GM-CSF, молекул межклеточной адгезии — ICAM-1, регулятора активации нормальной Т-клеточной экспрессии и секреции — RANTES, которые влияют на хемотаксис моноцитов, макрофагов, нейтрофилов, эозинофилов, а также базофилов и тучных клеток, секретирующих в больших количествах гистамин и липидные медиаторы (простагландины, лейкотриены, фактор активации тромбоцитов), что определяет отек подслизистого слоя, гиперсекрецию вязкой слизи, спазм и сокращение гладкой мускулатуры бронхов, гиперплазию и гипертрофию гладкомышечных волокон, нарушение баланса протеазы/антипротеазы, активацию нейтрофильных эластаз, катепсина G, матриксных металлопротеиназ (MMP-8, MMP-9, MMP-12), ростовых факторов (TGF-бета, VEGF, FGF-2, CTGF) с последующей структурной перестройкой тканей и утолщением стенки бронхов и бронхиол, формированием гиперреактивности и ремоделированием трахеобронхиального дерева [24, 25].
По данным наших исследований, в анамнезе жизни 24,7% детей раннего возраста, поступивших с вирус-индуцированной одышкой, перенесли острый бронхиолит на первом году жизни. Отягощенная наследственность по бронхиальной астме у родственников первого порядка была установлена у 19% детей, атопический дерматит в анамнезе — у 39,1% детей.
Рецидивирующий характер течения острого обструктивного бронхита (три и более эпизода бронхиальной обструкции в год на фоне ОРВИ) зарегистрирован у 40,7% детей, при этом концентрация общего IgE в сыворотке крови была достоверно выше — 89,1 ± 9,12 МЕ/мл, по сравнению с впервые выявленным эпизодом бронхиальной обструкции — 29,2 ± 3,06 МЕ/мл (р = 0,0000). Установлена прямая корреляционная связь между перенесенным острым бронхиолитом на первом году жизни и концентрацией общего IgE (r = 0,521, p = 0,0000), а также рецидивированием бронхообструктивного синдрома (r = 0,507, p = 0,0000).
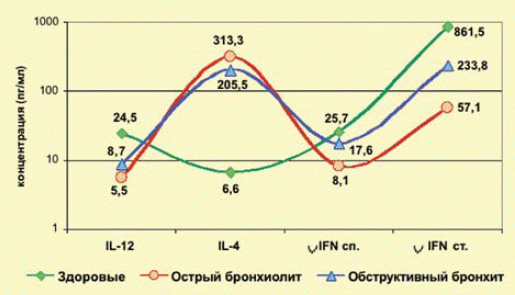
Анализ уровня IL-12, IL-4, спонтанного и стимулированного гамма-IFN) показал девиацию иммунного ответа в пользу Th2-профиля цитокинов, на фоне вирус-индуцированной одышки у детей раннего возраста, при этом острый бронхиолит сопровождается более глубоким дисбалансом цитокинового профиля, что подтверждает соотношение IL-4/гамма-IFNст. = 5,49, по сравнению с IL-4/гамма-IFNст. = 0,88 при обструктивном бронхите у детей старше года (рис. 1).
Было установлено, что для рецидивирующего течения вирус-индуцированной одышки характерно выраженное угнетение синтеза Th1-профиля цитокинов, это отражает соотношение IL-4/гамма-IFNст. = 2,46 и IL-4/IL-12 = 77,1, против IL-4/гамма-IFNст. = 1,38 и IL-4/IL-12 = 21,1 при впервые возникшем эпизоде бронхиальной обструкции.
Таким образом, принимая во внимание высокую частоту вирус-индуцированной одышки у детей раннего возраста, особенности влияния респираторных вирусов на иммунную систему с девиацией иммунного ответа в пользу Th2 субпопуляции лимфоцитов, тенденцию к хронизации воспалительного процесса, с последующим формированием гиперреактивности и ремоделирования трахеобронхиального дерева, целесообразно рассмотреть вопрос о включении в традиционные схемы лечения вирус-индуцированной одышки индукторов интерферона.
Противовирусное действие альфа/бета-IFN и гамма-IFN обусловлено подавлением трансляции и транскрипции вирусного генома благодаря активации альфа/бета- и гамма-интерферонового сигнального пути, NK-клеток и CD8 лимфоцитов, повышению экспрессии MHC I и II класса, образованию противовирусных протеинов олигоаденилатсинтетазы, dsRNA-зависимой протеинкиназы и Мх-протеина. Более того, биологические эффекты гамма-IFN связаны с регуляцией взаимодействия между клетками иммунной системы, в том числе обеспечением баланса Th1 и Th2 субпопуляциями лимфоцитов, посредством активации гамма-интерферонового сигнального пути, функциональной активности антигенпрезентующих клеток и увеличения выработки ими IL-12 и IL-18, непосредственно направляющего дифференцировку Th0-лимфоцитов в Th1 [26].
Индукторы интерферона являются веществами природного и/или синтетического происхождения, вызывают в организме образование эндогенных альфа/бета- и гамма-IFN, что является более физиологичным сбалансированным процессом, чем постоянное введение больших доз рекомбинантных IFN (табл. 2). В отличие от рекомбинантных интерферонов они не приводят к образованию антител к интерферону, не угнетают синтез аутологичных интерферонов, слабоаллергенны, а главное, вызывают пролонгированную продукцию эндогенного интерферона в физиологических дозах, достаточных для достижения терапевтического эффекта [27]. Однократное введение индукторов IFN обеспечивает относительно длительную циркуляцию эндогенного IFN на терапевтическом уровне, тогда как для достижения подобных концентраций при применении рекомбинантных IFN требуется многократное введение значительных доз [28].
Циклоферон и Амиксин — низкомолекулярные индукторы в большей степени альфа/бета-IFN, чем гамма-IFN. Ограничение применения данных препаратов в терапии вирус-индуцированной одышки у детей раннего возраста связано с тем, что Циклоферон противопоказан детям младше 4 лет, Амиксин — детям младше 7 лет.
Неовир — иммуностимулирующий препарат, который вызывает образование в организме «позднего» альфа/бета-IFN, достигающего максимальной концентрации через 16–20 часов, после внутримышечного введения. Неовир не применяется у детей.
Кагоцел вызывает образование в организме «позднего» альфа/бета-IFN, достигающего максимальной концентрации через 48 часов, препарат накапливается в основном в печени, в меньшей степени — в легких, тимусе, селезенке, почках, лимфатических узлах, при однократном применении препарата альфа/бета-IFN циркулирует в организме пациента на терапевтическом уровне в течение одной недели. Препарат противопоказан детям младше 6 лет.
Ридостин — высокомолекулярный индуктор IFN природного происхождения, относящийся к классу малотоксичных соединений. Введение Ридостина стимулирует продукцию «раннего» IFN, что наиболее важно в формировании адекватного ответа на вирусную инфекцию, максимальная концентрация которого в сыворотке крови и в тканях респираторного тракта и селезенки определяется через 6–8 часов после парентерального введения [29]. Преимущество над другими индукторами интерферона заключается в коротком курсе, состоящем из двух внутримышечных инъекций через 48 часов в дозе 8 мг/сутки.
Особенностью биологического действия ридостина является его способность усиливать синтез не только альфа/бета-IFN, но и в большей степени гамма-IFN, что определяет не только противовирусный, но и иммунокорригирующий эффект препарата, тогда как другие индукторы интерферона в терапевтических дозах индуцируют преимущественно образование альфа/бета-IFN, не обладающего иммуномодулирующей активностью.
По данным нашего исследования, включение в терапию бронхообструктивных состояний у детей раннего возраста индуктора интерферона Ридостина позволило уменьшить продолжительность интоксикационного и бронхообструктивного синдромов, что обусловлено ранней коррекцией иммунного ответа.
В контрольной группе, получающей стандартную терапию вирус-индуцированной одышки, концентрация общего IgE достоверно превышала допустимые показатели и имела тенденцию к нарастанию в динамике, напротив, в исследуемой группе уровень общего IgE снизился в 3 раза, составив у детей первого полугодия 14,8 ± 3,27 МЕ/мл, второго полугодия — 8,6 ± 1,82 МЕ/мл, 1–3 года — 21,3 ± 3,84 МЕ/мл (р = 0,0000, р = 0,0006 и р = 0,0000 соответственно).
Показатели цитокинового профиля, на 5 сутки после терапии Ридостином, характеризовались достоверным нарастанием уровня IL-12, спонтанного и стимулированного гамма-IFN и снижением синтеза IL-4 (рис. 2).
| |
|
Реклама |
Таким образом, иммунокоррекция бронхообструктивных состояний индуктором IFN Ридостином позволяет сбалансировать взаимоотношения между основными факторами противовирусной защиты, а значит, предотвратить формирование гиперреактивности трахеобронхиального дерева, что обуславливает целесообразность включения препарата в алгоритм терапии вирус-индуцированной одышки (табл. 3).
Литература
- Wu P. et al. Evidence of a causal role of winter virus infection during infancy in early childhood asthma // Am. J. Respir. Crit. Care Med. 2008; 173: 1123–1129.
- Oh J. Respiratory viral infections and early asthma in childhood // Allergology International. 2006; 55: 369–372.
- Rakes G. P. et al. Rhinovirus and respiratory syncytial virus in wheezing children requiring emergency care. IgE and eosinophil analyses // Am. J. Respir. Crit. Care Med., 1999; 159 (3): 785–790.
- Heymann P. W. et al. Viral infections in relation to age, atopy, and season of admission among children hospitalized for wheezing // J. Allergy Clin. Immunol. 2004; 114 (2): 239–247.
- Jartti T. et al. Respiratory picornaviruses and respiratory syncytial virus as causative agents of acute expiratory wheezing in children // Emerg. Infect. Dis. 2004; 10 (6): 1095–1101.
- Kesebir D. et al. Human bocavirus infection in young children in the United States: molecular epidemiological profile and clinical characteristics of a newly emerging respiratory virus // J. Infect. Dis. 2006; 194 (9): 1276–1282.
- Miller E. K. et al. Rhinovirus-associated hospitalizations in young children // J. Infect. Dis. 2007; 195: 773–281.
- Calvo C. et al. Role of rhinovirus in hospitalized infants with respiratory tract infections in Spain // Pediatr. Infect. Dis. J. 2007; 26 (10): 904–908.
- Hyvarinen M. K. et al. Lung function and bronchial hyper-responsiveness 11 years after hospitalization for bronchiolitis // Acta Pediatrica. 2007; 96: 1464–1469.
- Taussig L. M. et al. Tucson children’s respiratory study: 1980 to present // J. Allergy Clin. Immunol. 2003; 111: 661–675.
- Sigurs N. et al. Asthma and allergy patterns over 18 years after severe RSV bronchiolitis in the first year of life // Thorax. 2010; 65: 1045–1052.
- Sigurs N. et al. Severe respiratory syncytial virus bronchiolitis in infancy and asthma and allergy at age 13 // Am. J. Respir. Crit. Care Med. 2005; 171: 137–141.
- Kimpen J. Viral Infections and Childhood Asthma // Am. J. Respir. Crit. Care Med. 2000; 162: 108–112.
- Dakhama A. et al. The role of virus-specific immunoglobulin E in airway hyperresponsiveness // Am. J. Respir. Crit. Care Med. 2004; 170: 952–959.
- Чучалин А. Г. и др. Роль респираторных инфекций в обострениях бронхиальной астмы // Пульмонология. 2007. № 5. С. 14–18.
- Arruda L. K. et al. Risk factors for asthma and atopy // Curr. Opin. Allergy Clin. Immunol. 2005; 5: 153–159.
- Saga R. et al. Relationship between bronchial hyperresponsiveness and development of asthma in wheezy infants // Chest. 2001; 119: 685–690.
- Чуптхаева Г. Э., Чучалин А. Г. Респираторные инфекции и бронхиальная астма // Пульмонология. 2008; 5: 75–79.
- Сюракшина М. В. и др. Функциональные характеристики легких при бронхиальной астме у детей первых лет жизни // Российский вестник перинатологии и педиатрии. 2008; 4: 28–34.
- Rabe K. F. et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary // Am. J. Respir. Crit. Care Med. 2007; 176: 532–555.
- Респираторная медицина (руководство). Под ред. А. Г. Чучалина. М.: ГЭОТАР-Медиа, 2007. Т. 1. 800 с.
- Piippo-Savolainen E. Wheezy babies — wheezy adults? Review on long-term outcome until adulthood after early childhood wheezing // Acta Paediatrica. 2008; 97: 5–11.
- Martin J. G. et al. Immuno reponses to viral infections: relevance for asthma // Pediatric. Respir. Rev. 2006; 1: 125–127.
- Hashimoto S. et al. Viral Infection in Asthma // Allergology International. 2008; 57: 21–31.
- Holgate S. T. The airway epithelium is central to the pathogenesis of asthma // Allergology International. 2008; 57: 1–10.
- Goodbourn S. et al. Interferons: cell signalling, immune modulation, antiviral response and virus countermeasures // J. of General Virol. 2000; 81: 2341–2364.
- Аллергология и иммунология: национальное руководство. Под ред. Р. М. Хаитова, Н. И. Ильиной. М.: ГЭОТАР-Медиа, 2009. 656 с.
- Романцов М. Г. Респираторные заболевания у детей. Этиопатогенез, клиника, фармакотерапия. М.: Изд. Дом «Русский врач», 2003. 136 с.
- Ершов Ф. И. Новое поколение препаратов для профилактики вирусных инфекций // Журнал микробиологии, эпидемиологии и иммунобиологии. 2007; 4: 100–103.
М. В. Старикович*, кандидат медицинских наук
Л. А. Безрукова**, кандидат медицинских наук
*ОмГМА, **МУЗ ГДКБ № 3, Омск
Контактная информация об авторах для переписки: byb0407@mail.ru
Купить номер с этой статьей в pdf