В 2006 г. состоялся очередной Римский консенсус III, посвященный функциональным желудочно-кишечным расстройствам. В ходе многочисленных международных эпидемиологических исследований было установлено, что распространенность синдрома раздраженного кишечника (СРК) в индустриально развитых странах достигает 20% среди лиц трудоспособного возраста. Подтверждено положение, что чаще от данного синдрома страдают женщины. В развитии СРК подчеркнута роль генетической предрасположенности, психосоциальных факторов, нарушений моторно-эвакуаторной функции, снижения порога висцеральной чувствительности. Впервые указано, что у 1/3 больных развитие СРК связано с перенесенной кишечной инфекцией. В этой группе больных отмечается воспаление слизистой оболочки толстой кишки, повышение содержания провоспалительных цитокинов и избыточный бактериальный рост в тонкой кишке. У части больных СРК при назначении
Диагностические критерии СРК, включая «тревожные симптомы», оставлены без изменений, но длительность клинических проявлений сокращена с 12 до 6 мес. Продолжительность клинических симптомов заболевания должна быть не менее 6 мес до момента обращения к врачу, а регулярность — чаще 3 дней в месяц в течение последних 3 мес [11].
В основу классификации СРК положены изменения частоты и консистенции стула, определяемые согласно Бристольской шкале.
Различают четыре варианта СРК.
- СРК с запором — твердый либо шероховатый стул ≥ 25% и расслабленный (кашицеобразный) или водянистый стул ≤ 25% из числа опорожнений кишечника.
- СРК с диареей — кашицеобразный или водянистый стул ≥ 25% и твердый или шероховатый стул ≤ 25% из числа опорожнений кишечника.
- СРК смешанный — твердый или шероховатый стул ≥ 25% и кашицеобразный или водянистый стул ≥ 25% из числа опорожнений кишечника.
- Неклассифицированный СРК — недостаточная выраженность отклонений консистенции стула для смешанного варианта.
В целом предлагается различать следующие функциональные нарушения кишечника:
- СРК;
- функциональный метеоризм;
- функциональный запор;
- функциональная диарея;
- неклассифицированные функциональные нарушения кишки;
- функциональный абдоминальный болевой синдром.
Этиология, патофизиология и классификация
Наиболее распространены функциональные запоры. Критериями функционального запора являются не менее двух из следующих характеристик стула: а) менее трех дефекаций в неделю, б) затруднения дефекации, и/или в) плотный или фрагментированный стул, и/или г) ощущение неполного опорожнения или закупорки прямой кишки, и/или д) необходимость в принудительном опорожнении прямой кишки [13].
Механизм функционального запора связан с нарушением моторной функции кишечника. По существу он является вариантом СРК, отличаясь лишь отсутствием болей в животе. Эта особенность объясняется сохранением порога чувствительности кишечника. Причины нарушения моторики кишечника сходны с таковыми при СРК [11].
Часто приходится иметь дело с молодыми людьми, преимущественно девушками, у которых моторно-эвакуаторная функция кишечника нарушается настолько, что позывы к дефекации и самостоятельный стул отсутствуют. Заболеванию предшествуют искусственное голодание или слабительные и очистительные клизмы, предпринимаемые с целью похудения или поддержания веса тела на желаемом уровне, а также психоэмоциональные факторы [1].
Запором принято считать опорожнение кишечника реже 3 раз в неделю. Объективным критерием запора считается уменьшение веса стула до 35 г/сут и ниже. Клиническую картину могут дополнять затрудненная дефекация, чувство неполного опорожнения кишечника и дискомфорт в животе [7].
В зависимости от причин развития различают первичные и вторичные запоры. Первичные запоры являются следствием аномалий, пороков развития толстой кишки и начинаются в детстве. Вторичные запоры развиваются в результате болезней кишечника и других внутренних органов, а также вследствие применения некоторых лекарств.
В патогенезе запора играют роль алиментарный, механический и дискинетический механизмы.
Алиментарный запор развивается вследствие сухоядения и гипогидратации кишечного содержимого. Механический запор является следствием сужения кишки. Гипо- и дискинетический запор развивается в результате нарушения регуляции моторики кишечника и возникает у лиц с неврозами, психическими заболеваниями и при СРК. Запорами страдают большинство больных с депрессией, шизофренией и нервной анорексией [1].
Диагноз, дифференциальный диагноз
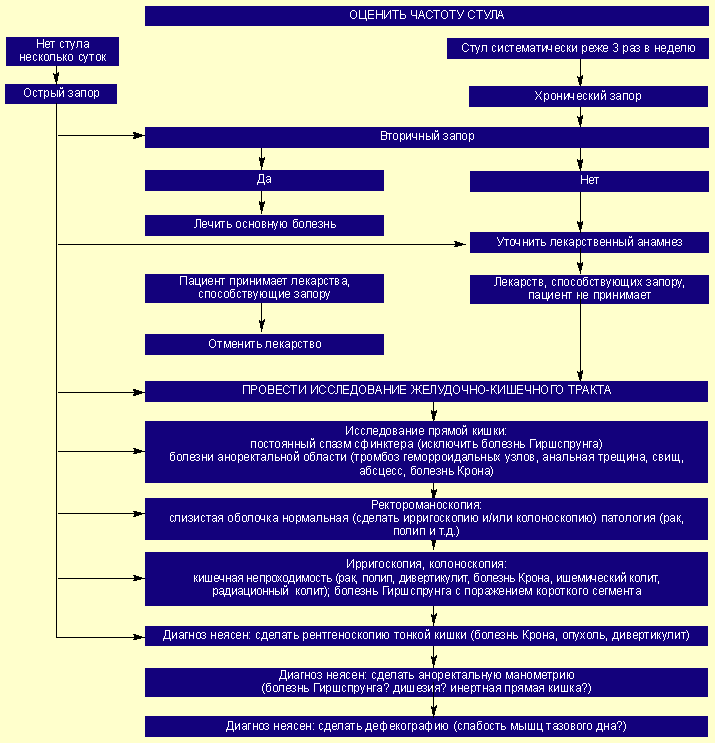
Последовательность диагностического процесса при запоре показана на схеме (рис.). Прежде всего необходимо уточнить, является запор внезапным (острым) или хроническим. Далее надо выяснить, не страдает ли пациент заболеванием, с которым может быть связан запор, и не принимает ли он лекарств, которые могут вызывать задержку стула. Если причину запора не удалось выяснить, то надо установить заболевание кишечника, являющееся его причиной. В противном случае речь идет об идиопатическом запоре или инертной толстой кишке. Для детального определения степени нарушения моторной функции исследуют время толстокишечного транзита и, если есть такая возможность, применяют сфинктероманометрию. Время транзита по кишечнику определяют с помощью различных маркеров. Эти тесты имеют диагностическое значение не только для объективизации запора, но и для строгого отбора больных для хирургического лечения запора.
Нарушения нервномышечной координации акта дефекации, возникающие в результате нарушения выхода кала, выявляют с помощью анальной манометрии. Манометрия позволяет также диагностировать болезнь Гиршспрунга. Применение дефекографии аноректальной области дает возможность исследовать функцию мышц тазового дна. Для этого прямая кишка заполняется густой бариевой взвесью. По данным серийных рентгенограмм, выполненных во время опорожнения прямой кишки, устанавливают возможную связь запора с аномалиями мышечного аппарата, обеспечивающего дефекацию [8, 9].
Длительный бесконтрольный прием слабительных средств приводит к довольно быстрому привыканию. Поэтому больные вынуждены постепенно увеличивать дозу, доводя ее нередко до сверхвысокой. Большие дозы препаратов антрагликозидового ряда способны вызывать поражения печени и почек, нервных сплетений в стенке толстой кишки. В результате моторика ее еще более нарушается. Развиваются инертная толстая кишка и меланоз: слизистая оболочка ее приобретает темный цвет за счет отложения в стенке пигмента [1, 6, 10].
Лечение
В основу программы лечения больных функциональными запорами должно быть положено обогащение рациона стимуляторами моторики по возможности пищевого происхождения. К ним относятся пищевые волокна. Количество их в пищевом рационе многих людей значительно снижено, так как в погоне за вкусовыми качествами балластные вещества удаляют из продуктов в процессе технологической обработки. Употребление такой рафинированной пищи играет ключевую роль в формировании запоров у большинства людей с функциональными запорами. У пожилых людей имеют значение также отсутствие зубов и плохое состояние зубных протезов, что заставляет их употреблять пищу, не содержащую волокон.
Для профилактики и лечения запоров широко используют пшеничные отруби. Содержащиеся в них пищевые волокна впитывают в себя воду и, поскольку они не подвергаются ферментативному перевариванию в тонкой кишке, увеличивают объем кала, делают его менее твердым.
Отруби следует залить кипятком и, спустя 30–60 мин, добавлять в суп, компот или кефир. Количество отрубей подбирают индивидуально, в зависимости от степени нарушения функции кишечника. Поэтому суточная доза может варьировать от 1–2 до 6–8 столовых ложек.
Наряду с отрубями применяют смеси, содержащие пищевые волокна хлебных злаков. К ним относится, например, мукофальк.
Мукофальк — препарат, содержащий семена подорожника. Благодаря высокой гидрофильности мукофальк увеличивает объем кишечного содержимого, улучшает моторно-эвакуаторную функцию кишечника и устраняет запор. Препарат применяют на ночь в количестве 1–2 пакетиков, предварительно заварив их горячей водой.
Хороший эффект оказывают также слабительные средства, вызывающие увеличение объема каловых масс. К ним относится форлакс, который содержит невсасывающийся макроголь (полиэтиленгликоль) [5].
Форлакс применяют на ночь по 10–20 г (1–2 пакетика), предварительно растворив в воде.
Объем каловых масс увеличивают также морская капуста, агар-агар, метилцеллюлоза, псиллиум (фиберлак), поликарбофил кальция, льняное семя.
Объемные агенты приемлемы для долгосрочного использования. Они действуют медленно, мягко и безопасны для систематической поддержки нормального стула. Вызывая раздражение механорецепторов за счет увеличения объема каловых масс, они стимулируют моторно-эвакуаторную функцию толстой кишки. Принимать эти пищевые добавки лучше всего утром и на ночь с достаточным количеством жидкости, добавляя 2–3 стакана в день жидкости дополнительно.
Пищевые волокна имеют первостепенное значение в поддержании на физиологическом уровне симбионтной микрофлоры кишечника, в профилактике и лечении дисбиоза кишечника. Одним из важных свойств симбионтной микрофлоры является регуляция моторики кишечника путем образования летучих жирных кислот, изменения рН и других механизмов, многие из которых являются предметом исследования. Поэтому дисбактериоз может быть причиной нарушения моторики кишечника [1].
Одним из направлений профилактики и лечения функциональных запоров является включение в рацион представителей нормальной микрофлоры кишечника. Первыми бактериями, использовавшимися в качестве пробиотика, были лактобациллы. Позднее стали применять бифидобактерии, в частности B. bifidum, B. infantis, B. longum и B. animalis. Другой способ поддержания нормального состава микробиоты заключается в обеспечении ее веществами, способствующими размножению. К ним относятся не перевариваемые олиго- и дисахариды (фруктоолигосахариды, галактоолигосахариды, инулин, лактулоза и др.) [3].
Лактулоза является синтетическим дисахаридом, состоящим из галактозы и фруктозы. В кишечнике человека отсутствует дисахаридаза, способная расщеплять лактулозу. Поэтому она не всасывается в тонкой кишке и поступает в ободочную кишку, где ассимилируется микрофлорой. Образующиеся в процессе микробного метаболизма короткоцепочечные карбоновые кислоты алифатического ряда способствуют стимуляции моторики кишечника.
Таким образом, лактулоза способствует росту нормальной микрофлоры кишечника и относится к разряду пребиотиков.
Лактулоза является также слабительным средством. Эффект ее основан на повышении осмотического давления в кишечнике и снижении внутрикишечной рН, что способствует задержке жидкости, разжижению химуса, увеличению его объема и активизации перистальтики.
Метаболическая цепь превращения лактулозы с образованием избыточного количества короткоцепочечных жирных кислот послужила основой для применения ее в терапии печеночной энцефалопатии, запоров и дисбактериоза кишечника.
Послабляющее действие лактулозы наступает обычно через 6–8 ч. В отличие от большинства слабительных лактулоза не оказывает раздражающего влияния на слизистую оболочку толстой кишки и не вызывает привыкания, в связи с чем может применяться длительное время.
Лактулозу назначают на ночь. Дозу подбирают индивидуально в пределах 15–30 г (1–2 десертные ложки) [1].
Одним из важных компонентов комплексной программы терапии и профилактики функциональных запоров является использование пробиотических продуктов, содержащих определенные виды лакто-или бифидобактерий. Контролируемые клинические исследования показали эффективность пробиотических кисломолочных продуктов «Активиа», содержащих штамм B. animalis DN-173010 (коммерческое название Actiregularis) [4]. Их включение в рацион питания пациентов с функциональными запорами обеспечивает нормализацию времени кишечного транзита и купирование запоров.
Механизм действия пробиотического продукта «Активиа» связан с ростом облигатной микрофлоры кишечника (прежде всего бифидо- и лактобактерий, подавляющих рост условно-патогенной микрофлоры) нормализацией метаболической активности микробиоты (повышению абсолютного суммарного содержания короткоцепочечных жирных кислот, в частности абсолютной концентрации пропионовой кислоты, участвующей в нормализации моторной функции толстой кишки) [2].
Фармакологическая стратегия терапии функциональных запоров в настоящее время направлена на регуляцию нейротрансмиттеров, обеспечивающих функциональную деятельность кишечника. Именно на такой подход к лечению рассчитано применение антагонистов рецепторов серотонина-4. Рецепторы 5-гидрокситриптамина-4 (5-HT4) находятся в энтериновой сенсорной системе [12]. Серотонин (5-гидрокситриптамин) продуцируют клетки гастроинтестинальной эндокринной системы. Он стимулирует перистальтику, связываясь с рецепторами серотонина-3 и серотонина-4, расположенными в энтериновой системе. Агонисты этих рецепторов замедляют транзит по толстой кишке, снижают гастроцекальный рефлекс и уменьшают чувствительность рецепторов кишки к растяжению [9].
Агонист рецепторов 5-HT4 тегасерод у здоровых добровольцев в дозе 6 мг 2 раза в день вызывал ускорение эвакуации из желудка и транзита по тонкой и в меньшей степени по толстой кишке [12]. C. M. Prather и соавторы исследовали двойным слепым методом воздействия тегасерода на пропульсивную функцию желудка, тонкой и толстой кишки у 24 больных СРК с преобладанием запоров. Тегасерод назначали по 2 мг 2 раза в сутки. Пропульсивную функцию оценивали с помощью сцинтиграфического метода в течение 1 нед до лечения и после 1 нед лечения. Авторы установили, что тегасерод не влияет на моторику желудка, увеличивает скорость транзита по тонкой кишке на 70,4±1,3% и недостоверно ускоряет транзит по толстой кишке [12].
По данным трех больших рандомизированных двойных слепых исследований с использованием плацебо, применение тегасерода в дозе 6 мг 2 раза в сутки у больных СРК с запорами оказывало желаемый эффект в течение 3 мес. У больных прекращались боли и запоры. Препарат оказывал более выраженный эффект у женщин. Побочные эффекты тегасерода ограничивались умеренной диареей, появившейся у 10% пациентов.
Таким образом, антагонист серотониновых рецепторов 5-НТ4 тегасерод находит все более широкое применение в лечении функциональных запоров. Препарат назначают по 4–6 мг в день в течение 2–4 нед и более.
Заключение
- Систематическое длительное применение слабительных средств недопустимо. Для успешного лечения запоров необходимо установить нозологическую форму болезни, явившуюся причиной нарушения стула, и выработать программу лечения, в которой слабительные средства должны играть лишь третьестепенную роль (после этиотропной и патогенетической терапии).
- Для профилактики и лечения функциональных запоров следует рекомендовать употреблять пищу, богатую пищевыми волокнами, продукты пре- и пробиотического ряда и регуляторы моторики желудочно-кишечного тракта.
Литература
- Парфенов А. И. Энтерология. М.: Триада-Х. 2002. С. 84–95.
- Сильвестрова С. Ю., Парфенов А. И., Ручкина И. Н. Влияние «Активия» творожной на состояние микрофлоры толстой кишки больных с синдромом раздраженного кишечника с запорами. Сборник тезисов V съезда научного общества гастроэнтерологов России, XXXII сессия Центрального научно-исследовательского института гастроэнтерологии. М., 2005. С. 490–491.
- Antoine J. M. et al. Effect of a specific probiotic (Bifidobacterium sp. DN-173 010) on gut transit time in elderly. 2000. The Faseb Journal, vol 14, number 4: 160.11.
- Bouvier M. et al. Effects of consumption of a milk fermented by the probiotic Bifidobacterium animalis DN-173 010 on colonic transit time in healthy humans. Bioscience and Microflora, 2001. vol 20 (2): 43–48, 2001.
- Camileri M., Bueno L. de Ponti F. et al. Pharmacological and pharmacokinetic aspects of functional gastrointestinal disorders. Gastroenterology. 2006; 130(5); 1421–34.
- Degen L., Matzinger D., Merz M. et al. Tegaserod, a 5-HT4 receptor partial agonist, accelerates gastric emptying and gastrointestinal transit in healthy male subjects. Aliment Pharmacol Ther 2001; 15: 1745–1751.
- Drossman D. A. The Functional Gastrointestinal Disorders and the Rome III Process. Gastroenterology 2006; 130: 5: 1377–1390.
- Glatzle R. G., Sternini C., Robin C. et al. Expression of 5-HT3 receptors in the rat gastrointestinal tract. Gastroenterology 2002; 123: 217–226.
- Jin J. G., Foxx-Orenstein A. E., Grider J. R. Propulsion in guinea pig colon induced by 5-hydroxytryptamine (HT) via 5-HT4 and 5-HT3 receptors. J Pharmacol Exp Ther 1999; 288: 93–97.
- Kozlowski C. M., Green A., Grundy D., Boissonade F. M., Bountra C. The 5-HT(3) receptor antagonist alosetron inhibits the colorectal distention induced depressor response and spinal c-fos expression in the anaesthetized rat. Gut 2000; 46: 474–480.
- Longstreth G. F., Thompson W.G., Chey W.D. et al.Functional Bowel Disorders. Gastroenterology. 2006; 130(5); 1480–91
- Prather C. M., Camilleri M., Zinsmeister A. R. et al. Tegaserod Accelerates Orocecal Transit in Patients With Constipation-Predominant Irritable Bowel Syndrome. Gastroenterol. 2000; 118: 463–468.
- Thompson W. G. The road to Rome Gastroenterology. 2006; 130(5); 1466–79.
А. И. Парфенов, доктор медицинских наук, профессор
И. Н. Ручкина, доктор медицинских наук
С. Ю. Сильвестрова, кандидат медицинских наук
ЦНИИ гастроэнтерологии, Москва
Приложения
-
- Тактика лечения и профилактики функциональных запоров в свете Римского консенсуса III - Рисунок.
Алгоритм диагностики при запоре