В России и других странах Европы болезни сердечно-сосудистой системы занимают первое место среди причин заболеваемости и смертности населения. Так, в 2002 г. распространенность заболеваний сердечно-сосудистой системы составила свыше 15,6 тыс. случаев на 100 тыс. населения России. По данным аутопсий умерших в стационарах трех мегаполисов России, в течение последних лет на долю болезней системы кровообращения у взрослых приходится более половины из всех первоначальных причин летального исхода (рис. 1).
В группе острых ишемических болезней сердца (ИБС) наиболее распространенной причиной смерти является «неуточненная» ИБС, включая некоторую долю случаев острого, повторного и рецидивирующего инфаркта миокарда (ИМ), и такие заболевания, как нестабильная стенокардия, коронарный тромбоз, не приводящий к ИМ, а также другие острые и подострые формы ИБС. Таким образом, летальность при обострении ИБС можно с наибольшей степенью достоверности определить только в группе ИМ; так, например, в 2004 г. в России она составила 19,5%.
Дифференцирование острых форм ИБС на догоспитальном этапе, а нередко и в течение первых суток госпитализации, сопряжено со значительными трудностями. По статистике при некоторых формах ИБС — острой коронарной недостаточности или хронической аневризме сердца — неверным является каждый пятый или шестой диагноз (табл. 1).
Однако в клинике неотложной кардиологии уход от диагностики конкретной формы обострения ИБС представляется не только допустимым, но и общепринятым, обеспечивающим «преемственность» лечения на этапе догоспитальной помощи и в стационаре [32]. Согласно международному консенсусу, групповое понятие «острый коронарный синдром» (ОКС) отражает патогенетическую общность любой из форм обострения ИБС и объединяет любые клинические признаки, позволяющие заподозрить ИМ или нестабильную стенокардию. В случае ОКС с подъемом сегмента ST больному необходимо провести системный тромболизис или чрескожную ангиопластику коронарных артерий. При ОКС без подъема сегмента ST тромболитическая терапия не показана. И в том и в другом случае морфологическим субстратом ОКС является осложненная атеросклеротическая бляшка с развитием пристеночного либо окклюзирующего тромба в пораженной коронарной артерии. Одно из тяжелых и потенциально летальных осложнений ОКС — желудочно-кишечное кровотечение из «стрессовых» острых повреждений гастродуоденальной слизистой.
Термин «стрессовые острые повреждения гастродуоденальной слизистой» (ОПГС) также является собирательным и обозначает эрозивно-язвенное поражение слизистой оболочки желудка и/или двенадцатиперстной кишки, развившееся у критически больного человека. Патогенез ОПГС универсален и практически не зависит от особенностей основного заболевания. Установлено, что ОПГС развивается в результате пептического (кислотного) повреждения слизистой оболочки на фоне глубокой ишемии с угнетением всех механизмов гастропротекции: секреции бикарбоната, муцина, пролиферации эпителия [1, 2, 3, 4]. У части больных, особенно длительно иммобилизированных, развитие ОПГС могут провоцировать и другие факторы агрессии, такие, как дуоденогастральный желчный рефлюкс и гастропарез [1, 5]. У больных, перенесших оперативное вмешательство, в развитии ОПГС также нельзя исключить влияние гипопротеинемии, анемии, резорбции эндотоксинов, а также последствий анестезии. Тем не менее многие исследователи настаивают на том, что ОПГС следует рассматривать как острое, ассоциированное с гиперацидностью повреждение гастродуоденальной слизистой, при котором первичным этиологическим фактором является не хеликобактерный гастрит, как при пептической язве, не длительный прием нестероидных противовоспалительных препаратов (НПВП), как при НПВП-гастропатии, а тяжелое заболевание [6]. Тяжелое заболевание приводит к гипотонии, ишемии гастродуоденальной слизистой, которая, в свою очередь, вызывает обратную диффузию Н+, ацидоз, истощение буферных систем, гибель клеток эпителия, приводящие к повреждению целостности слизистой оболочки.
Как правило, ОПГС располагаются на малой кривизне, в дне и в антральном отделе желудка. Характер повреждений варьирует от поверхностных эрозий до глубоких язв слизистой оболочки желудка и двенадцатиперстной кишки, часто — множественных и занимающих значительную поверхность слизистой оболочки. В частности, у больных ИМ наиболее часто встречаются острые эрозии и язвы, располагающиеся на малой кривизне или в дне желудка (табл. 2).
Желудочно-кишечное кровотечение (ЖКК) при ОГПС носит характер паренхиматозного, часто развивается на 2–5-е сутки после госпитализации больного в отделение интенсивной терапии и начинается бессимптомно [4, 5, 22].
ОПГС необходимо предполагать у любого больного с гипотонией, дыхательной недостаточностью и нарушением перфузии внутренних органов. Установлено, что у пациентов с гипотонией, сепсисом, ожогами, черепно-мозговой травмой и людей, перенесших обширное хирургическое вмешательство, ОПГС развиваются в 40–100% случаев [3, 7]. Однако риски, связанные с ОПГС, обусловлены не собственно частотой этого поражения, а возможностью развития у находящихся в критическом состоянии больных массивного ЖКК. Летальность при ЖКК у критически больных достигает, по разным данным, 50–80% [7, 9, 10, 23]. В то же время определить, насколько распространены ОПГС среди пациентов, находящихся в критическом состоянии, практически невозможно, поскольку для этого требуется проведение эндоскопии всем пациентам отделений реанимации. В известной степени реальную частоту гастродуоденальных поражений при острых формах ИБС отражают результаты отечественного клинико-морфологического исследования, в ходе которого ОПГС были выявлены у 10% умерших от ИМ. Среди больных с ОПГС кровотечение развилось у каждого пятого больного с острым ИМ и каждого второго — с повторным ИМ и сахарным диабетом [8]. В целом же, по данным литературы, частота ЖКК у критически больных варьирует в больших пределах 1–14%. В отделениях общей и хирургической реанимации, в том числе у больных после ангиопластики, частота развития клинически значимых ЖКК не превышает 1–5% и на протяжении последних 30 лет неуклонно снижается [1, 7, 11, 12]. У больных старшего возраста, а также у пациентов нехирургического профиля с более длительным стажем болезни ЖКК развивается чаще — не менее чем в 8% случаев, а кровь в содержимом желудка находят более чем у 25% больных [11, 13, 16]. Таким образом, все, что касается частоты развития ОПГС, риска возникновения и особенностей ЖКК у больных с ИБС, гипотонией, инсультом, сепсисом, полиорганной недостаточностью, требует отдельного исследования [15, 17, 18, 24].
Впрочем, большинство исследователей согласны с тем, что на самом деле ЖКК у критически больных развиваются гораздо чаще, чем выявляются. Однако, поскольку в большинстве случаев они протекают субклинически и не приводят к существенным гемодинамическим нарушениям, ЖКК не являются актуальной клинической проблемой [1, 10]. В этой связи значительная часть исследователей считают, что не стоит преувеличивать клиническое значение ОПГС [1, 10, 23]. С этим не согласны С. В. Колобова и соавторы (2002), по данным которых у больных с ИМ состоявшееся ЖКК в 30% случаев приводит к острой постгеморрагической анемии [8]. При этом известно, что анемия у больных ИМ в 1,5 раза повышает риск госпитальной смерти и в 4 раза — риск массивного ЖКК [13]. В свою очередь, при ЖКК в 2 раза возрастает риск летального исхода (RR-1-4), а сроки лечения в отделении интенсивной терапии удлиняются в среднем на 4–8 дней [9, 19]. Не связанными между собой факторами наиболее высокого риска развития ЖКК у критически больных — вне зависимости от основного заболевания — являются дыхательная недостаточность, коагулопатия, искусственная вентиляция легких более 48 ч [6, 22, 41, 44].
Вероятно, у пациентов с ОКС факторами риска возникновения ЖКК необходимо считать и такие обычные для нашей практики параметры коморбидности, как постинфарктный кардиосклероз, сахарный диабет и плохо контролируемая артериальная гипертензия. Так, при ретроспективном изучении результатов аутопсий 3008 пациентов, умерших от ИМ, было установлено, что ОПГС с ЖКК чаще развивается у пожилых больных с повторным ИМ и артериальной гипертензией [8, 48].
Согласно данным нашего собственного клинико-морфологического анализа летальных исходов, имевших место в нехирургических отделениях крупной больницы скорой медицинской помощи, острый повторный и рецидивирующий инфаркт стал причиной 2/3 летальных исходов от ИМ. При этом установлено, что острые язвы или эрозии желудка и двенадцати- перстной кишки у больных с ИМ и сахарным диабетом развиваются более чем в 45% случаев, а ЖКК — у 15–20% больных.
Отдельного рассмотрения требуют риск неблагоприятного исхода и особенности течения ЖКК у больных с ОКС, на амбулаторном этапе длительно получавших ацетилсалициловую кислоту (АСК) или другие тромболитики [14]. Согласно последним исследованиям, длительный прием низких (до 100 мг в день) доз АСК в 2–3 раза повышает риск развития ЖКК. Установлено, что даже доза, равная 10 мг АСК в день, при длительном назначении способна привести к изъязвлению слизистой оболочки желудка [30]. Как утверждает B. Cryer (2002), вероятно нет такой дозы аспирина, которая бы обладала антитромботическим эффектом и не была гастротоксичной [25]. Таким образом, уменьшение резистентности гастродуоденальной слизистой на фоне терапии АСК потенциально угрожает любому пациенту с ИБС, однако наиболее высок риск развития ЖКК у больных, имеющих установленные в ходе получившего широкую известность исследования ARAMIS (J. T. Fries, 1997) факторы риска возникновения НПВП-гастропатии: язвенная болезнь в анамнезе; возраст старше 65 лет; сопутствующий прием кортикостероидов.
Если говорить о суммарной вероятности развития осложненного ОПГС у больных, поступающих в стационары СМП, ЖКК из острых эрозий или язв гастродуоденальной слизистой выявляется чуть ли не у каждого пятого из пациентов с повторным инфарктом и сахарным диабетом.
При ОКС риск кровотечения существенно увеличивается у пожилых женщин и в тех случаях, когда больной уже перенес ЖКК, а также имеет сердечную недостаточность, анемию или уремию [7, 20, 26, 29, 35, 36]. Риск ЖКК также возрастает, если пациент получает АСК и варфарин [33]. Таким образом, у некоторых пациентов с ОКС суммарный риск развития ЖКК оказывается настолько высоким, что врачу приходится «выбирать между ‘‘интересами сердца’’ и безопасностью» [25]. Действительно, и в случае ОКС с подъемом сегмента ST, когда больному необходимо провести системный тромболизис, и при ОКС без подъема сегмента ST, когда целесообразно начать гепаринотерапию, — выполнение существующих клинических рекомендаций, еще более увеличивает вероятность ЖКК. Очевидно, что на догоспитальном этапе необходимо выбирать безопасность [32]. Однако подобная альтернатива возникает только в том случае, если пациент не получает лечения, уменьшающего кислотность желудочного сока. Установлено, что эффективная антисекреторная терапия, позволяющая повысить рН содержимого желудка до 5,0–7,0 в период активного влияния факторов риска снижает вероятность ЖКК у критически больных как минимум на 50% [7].
Установлено, что адекватная антисекреторная терапия у критически больных позволяет решить как минимум три задачи: прекратить активное кровотечение; предотвратить рецидив кровотечения; предотвратить ЖКК в принципе [6].
Способность антисекреторной терапии — влиять на объем активного кровотечения и предотвращать его рецидивы — основана на возможности добиться устойчивого сдвига рН содержимого желудка в щелочную сторону, что блокирует лизис свежих тромбов и таким образом обеспечивает полноценный сосудисто-тромбоцитарный гемостаз. Еще один фактор представляется особенно важным для пациентов с ОКС, страдающих от нарастающего снижения сократительной способности миокарда, гипотонии и длительной ишемии гастродуоденальной слизистой – это прекращение, при условии раннего назначения антисекреторной терапии, прогредиентной пептической агрессии на слизистую желудка и двенадцатиперстной кишки.
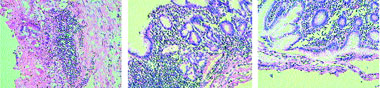
Доказательства необходимости как можно более раннего назначения адекватной антисекреторной терапии были получены в ходе уже упомянутого, уникального клинико-морфологического исследования, проведенного С. В. Колобовым и соавторами (2002). При иммуноморфологическом исследовании авторы обнаружили, что у пациентов с ИМ имеют место тяжелые нарушения микроциркуляции и угнетение пролиферации эпителия слизистой оболочки желудка и двенадцатиперстной кишки [8, 48]. При этом продукция соляной кислоты нисколько не уменьшается и приводит к стабильному уменьшению рН содержимого желудка в остром периоде ИМ. Внутривенное капельное введение 40 мг омепразола уже в течение первых суток приводит к значительному повышению пролиферативной активности эпителиоцитов и активной репаративной регенерации слизистой оболочки, темпы которой практически не зависят от тяжести текущего ИМ (рис. 2).
Рисунок 2. Морфологическое исследование биоптатов слизистой желудка у больной с ИМ на фоне лечения омепразолом: |
Теоретически нейтрализации содержимого желудка можно добиться введением любых антацидов или антисекреторных препаратов: гидроокисей магния и алюминия, сукральфата, антагонистов Н2-рецепторов к гистамину, ингибиторов протонной помпы (ИПП) [2, 6, 41, 43, 49]. Во многих публикациях приводятся данные о высокой эффективности внутривенного введения 80 мг в сутки фамотидина при лечении и профилактике ЖКК у критически больных [18, 40]. Однако по результатам новейших доказательных исследований, оптимальными благодаря антисекреторной активности, быстроте развития эффекта, отсутствию толерантности, безопасности и простоте применения у больных с ЖКК были признаны ИПП [3, 19, 22, 38, 39, 41]. ИПП также более эффективны, чем антагонисты Н
В то же время необходимость широкого профилактического назначения антисекреторных препаратов тяжелобольным пациентам нередко оспаривается на том основании, что потенциально летальные кровотечения развиваются не более чем у 5–8% больных, а ощелачивание желудка у всех пациентов, во-первых, стимулирует рост грамотрицательной флоры в желудочно-кишечном тракте и приводит к увеличению частоты нозокомиальной пневмонии, во-вторых, создает существенную экономическую нагрузку. В связи с этим некоторые авторы предлагают априори назначать стандартную антисекреторнную терапию только больным, находящимся на искусственном дыхании и имеющим коагулопатию [7, 23, 44]. Однако новейшие исследования показали, что увеличение риска нозокомиальной пневмонии на фоне антисекреторной терапии происходит именно у больных, находящихся на аппаратном дыхании, в то же время у пациентов нехирургического профиля этот риск не выше, чем для стационаров в целом и не может служить аргументом для отказа от широкой фармакологической профилактики ЖКК с летальностью, превышающей 50% [5].
Интересно проследить взаимосвязь ОПГС и Helicobacter pylori (Н. pylori). По данным литературы, инфицированность критически больных Н. pylori в странах Европы превышает средние показатели для соответствующего возраста и составляет 38–67% — вне зависимости от возрастной группы, основного заболевания, тяжести болезни и «набора» факторов риска ЖКК [4, 45, 46]. В исследовании M. S. Robertson, J. F. Cade, R. L. Clancy уровень антител у критически больных коррелировал исключительно с длительностью пребывания в отделении интенсивной терапии, однако авторы не считают, что больным без ЖКК целесообразно проводить эрадикационное лечение в условиях реанимации, как этого требуют стандарты лечения больных, перенесших ЖКК другой этиологии [45, 47].
Таким образом, сегодня в России в условиях, когда не удовлетворяются потребности населения в кардиохирургической помощи, не говоря уже об известных социально-демографических и медицинских особенностях контингента больных с острыми формами ИБС, а также высокой распространенности НПВП-гастропатии, важность проблемы острых эрозивно-язвенных поражений и ЖКК у больных с ОКС уже не требует доказательств. Другое дело, что организационному решению этой проблемы препятствует отсутствие достоверных данных о реальной распространенности ОПГС у больных с заболеваниями сердца и сосудов. Кроме того, на сегодняшний день в нашей стране не разработана методика выявления и формирования групп риска по развитию ЖКК среди пациентов с ИБС, ведь у больных с ОКС без витальных показаний невозможно выполнить эндоскопическое исследование в связи с риском для жизни больного [53]. Создание условий и протокола назначения антисекреторной терапии на фоне ОКС в настоящее время не требует приложения больших дополнительных сил и средств, поскольку огромная доказательная база по применению ИПП является общедоступной и препараты этого ряда давно вошли в практику здравоохранения. Вопрос заключается только в том, чтобы эти препараты были доступны организациям, работающим в сфере первичной медицинской помощи и больницам СМП.
Сложнее обстоит дело с организацией первичной профилактики ОПГС, которая должна быть «встроена» в систему фармакотерапии больных с ИБС. Как показывает опыт систем первичной медицинской помощи в странах Европы и США, этот процесс сопряжен с большими трудностями субъективного порядка. По некоторым данным, врачи общей практики, хирурги и анестезиологи только в общих чертах представляют себе проблему ОПГС и в 50% случаев не владеют современными рекомендациями по проведению антисекреторной терапии [49]. У больных с ОКС, особенно у пожилых пациентов, риск ЖКК врачи часто переоценивают, в связи с чем отказываются от проведения тромболизиса и гепаринотерапии, даже если противопоказания носят относительный характер [50, 52]. Около 10% больным после ИМ не назначают АСК, мотивируя это наличием таких относительных противопоказаний, как перенесенное во время ИМ ЖКК или пептическая язва в анамнезе. Однако среди не получавших АСК больных смертность в течение 1 года после ИМ была в 2 раза больше, чем в группе получавших АСК [51]. Одно время казалось, что проблема предотвращения ЖКК у больных, которым необходима терапия антиагрегантами, решена благодаря появлению клопидогреля, эффективность которого в отношении профилактики коронарного тромбоза оказалась сравнима с длительной терапией АСК. Рекомендации по назначению 75 мг в сутки клопидогреля тем пациентам, кто не может принимать низкие дозы АСК, были включены в национальные стандарты США. Эти рекомендации и сегодня все еще действуют, несмотря на то что в новейшем исследовании F. K. Chan и соавторов (2005) было показано, что при высоком риске ЖКК длительная терапия низкими дозами АСК+ 20 мг эзомепразола в сутки значимо реже сопровождается кровотечением, чем длительная терапия клопидогрелем [25, 31].
Литература
- Yang Y. X., Levis J. D. Prevention and treatment of stress ulcers in critically ill patients. Semin Gastrointest Dis. 2003; 14(1): 11-19.
- Spirt M. J. Stress-related mucosal disease: risk factors and prophylactic therapy. Clin Ther. 2004; 26(2): 197-213.
- Raynard B., Nitenberg G. Is prevention of upper digestive system hemorrhage in intensive care necessary? Schweiz Med Wochenschr. 1999; 30; 129(43): 1605-1612.
- Loginov A. S., Zvenigorodskaia L. A., Potapova V. B. et al. The characteristics of peptic ulcer in subjects with concomitant ischemic heart disease. Ter. Arh. 1998. 70 (2): 9-13.
- Гельфанд Б. В., Гурьянов В. А., Мартынов А. Н. и др. Профилактика стресс-повреждений желудочно-кишечного тракта у больных в критических состояниях//Consilium Medicum, 2005. Т. 7. № 6. С. 464.
- Peterson W. L. The role of acid in upper gastrointestinal haemorrhage due to ulcer and stress-related mucosal damage. Aliment Pharmacol Ther. 1995; 1: 43-46.
- Лапина Т. Л. Фармакотерапия эрозивно-язвенных поражений желудка и двенадцатиперстной кишки. БОП. РМЖ. БОП. 2003. Т. 5. № 2.
- Колобов С. В., Зайратьянц О. В., Попутчикова Е. А. Морфологические особенности острых эрозий и язв желудка у больных инфарктом миокарда при лечении препаратом "Лосек"// Морфологические ведомости. 2002. № 3-4. С. 800-882.
- Cook D. J., Griffin L. E., Walter S. D. et al. The attributable mortality and length of intensive care unit stay of clinically important gastrointestinal bleeding in critically ill patients. Crit Care. 2001; 5(6): 368-375.
- Pimentel M., Roberts D. E., Bernstain C. N. et al. Clinically significant gastrointestinal bleeding in critically ill patients in an era of prophylaxis. Am J Gastroenterol. 2000; 95(10): 2801-2806.
- Zanini R., Romano M., Buffoli F. Coronary disease: early intervention saves lives. Treatment of acute myocardial infarction in Mantova: results of thirty months of work after the implementation of a province network G Ital Nefrol. 2005; 22: 31: 75-83.
- Abbas A. E., Brodie B., Dixon S. et al. Incidence and prognostic impact of gastrointestinal bleeding after percutaneous coronary intervention for acute myocardial infarction. Am J Cardiol. 2005; 15: 96(2): 173-176.
- Dauerman H. L., Lessard D., Yargebski J. et al. Am J Cardiol. 2005. 96 (10): 1379-1383.
- Braunwald E., Antman E. M., Beasley J. W. et al. ACC/AHA guideline update for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction - 2002: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients with Unstable Angina). Circulation 2002; 06: 1893-1900.
- Bardes C. L., Charlson M. E. Gastrointestinal Bleeding in Critically Ill Patients. The New England J of Medicine. 2003; 331(1): 51-53.
- Martin L. F. Stress ulcers are common after aortic surgery: endoscopic evaluation of prophylactic therapy. Am Surg 1994; 60: 169-174.
- Martin L. F., Booth F. V. M., Reines H. D. et al. Stress ulcers and organ failure in intubated patients in surgical intensive care units. Ann. Surg. 1992; 215: 332-337.
- Geus W. P., Lamers C. B. Intravenous gastric acid inhibition for stress ulcers and bleeding peptic ulcers. Ned Tijdschr Geneeskd. 1999; 143 (50): 2514-2518.
- Stollman N., Metz D. C. Pathophysiology and prophylaxis of stress ulcer in intensive care unit patients .J Crit Care. 2005; 20(1): 35-45.
- Bar-Dayan Y., Levy Y., Amital H., Shoenfeld Y. Aspirin for prevention of myocardial infarction. A double-edged sword. Ann Med Interne (Paris). 1997; 148(6): 430-433.
- Peterson W. L. Prevention of upper gastrointestinal bleeding. N Engl J Med. 1994; 330: 428-429.
- Robert G. M. Contemporary strategies for the prevention of stress-related mucosal bleeding American Journal of Health-System Pharmacy. 2004; 62 (10); 2: 11-17.
- Cook D. J., Fuller H. D., Guyatt G. H. et al. Risk Factors for Gastrointestinal Bleeding in Critically Ill Patients. The New England J of Medicine. 1994; 330(6): 377-381.
- Davenport R. J., Dennis M. S., Warlow C. P. Gastrointestinal Hemorrhage After Acute Stroke Stroke. 1996; 27: 421-424.
- Cryer B. Reducing the Risks of Gastrointestinal Bleeding with Antiplatelet Therapies Circulation. 2002; 106: 1893.
- Derry S., Loke Y. K. Risk of gastrointestinal haemorrhage with long term use of aspirin: meta-analysis. BMJ. 2000; 321: 1183-1187.
- Peters R. J. G., Mehta S. R., Fox K. A. A. et al. Effects of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndromes: observations from the Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) study. Circulation. 2003; 108: 1682-1687.
- Cryer B., Feldman M. Effects of very low doses of daily, long-term aspirin therapy on gastric, duodenal and rectal prostaglandin levels and on mucosal injury in healthy humans. Gastroenterology. 1999; 117: 17-25.
- Laine L. Approaches to nonsteroidal anti-inflammatory drug use in the high-risk patient. Gastroenterology 2001; 120: 594-606.
- Lai K. C., Lam S. K., Chu K. M. et al. Lansoprazole for the prevention of recurrences of ulcer complications from long-term low-dose aspirin use. N Engl. J. Med. 2002; 346: 2033-2038.
- Chan F. K. L., Ching J. Y. L., Hung L. C. T. et al. Clopidogrel versus aspirin and esomeprazole to prevent recurrent ulcer bleeding. N. Engl. J. Med. 2005; 352: 238-244.
- Schiff J. H., Arntz H. R., Bottiger B. W. Acute coronary syndrome in the prehospital phase// Anaesthesist. 2005; 54(10): 957-974.
- Herlitz J., Holm J., Peterson M. et al. Effect of fixed low-dose warfarin added to aspirin in the long term after acute myocardial infarction; the LoWASA Study. Eur Heart J. 2004; 25(3): 232-239.
- Buresly K., Eisenberg M. J., Zhang X. et al. Bleeding complications associated with combinations of aspirin, thienopyridine derivatives, and warfarin in elderly patients following acute myocardial infarction. Arch Intern Med. 2004; 165(7): 784-789.
- Malik S., Vaccarino V. Outcomes of thrombolytic therapy for acute myocardial infarction in women. Prog Cardiovasc Dis. 2004; 47(1): 58-71.
- Kuo P. I., Severino R., Pashkov F. J. Mortality rates and hemorrhagic complications in asian-pacific islanders during treatment of acute myocardial infarction. Am J Cardiol. 2004; 94(5): 644-646, A9.
- Devlin J. W., Welage L. S., Olsen K. M. Proton Pump Inhibitor Formulary Considerations in the Acutely Ill Part 1: Pharmacology, Pharmacodynamics, and Available Formulations. The Annals of Pharmacotherapy. 2005; 39 (10): 1667-1677.
- Barkun A., Bardou M., Marshall J. K. Consensus recommendations for managing patients with nonvariceal upper gastrointestinal bleeding. Ann Intern Med. 2003; 139(10): 843-857.
- Денисов И. Н., Топчий Н. В., Латышев О. А. и др. Эффективность Омитокса при стрессовых язвах. РМЖ. БОП . 2003. Т. 5. № 2.
- Мамедова Л. Д., Лоранская И. Д., Басхаева Р. Г., Ракитская Л. Г. Медикаментозная коррекция острых желудочно-кишечных кровотечений язвенной этиологии//РМЖ, БОП. 2004. Т. 6 . № 2.
- Steinberg K. P. Stress-related mucosal disease in the critically ill patient: risk factors and strategies to prevent stress-related bleeding in the intensive care unit. Crit Care Med. 2002. 30(6): 362-364.
- Laterre P. F., Horsmans Y. Intravenous omeprazole in critically ill patients: a randomized, crossover study comparing 40 with 80 mg plus 8 mg/hour on intragastric pH. Crit Care Med. 2001; 29(10): 1931-1935.
- Phillips J. O., Metzler M. H., Palmieri M. T. et al. A prospective study of simplified omeprazole suspension for the prophylaxis of stress-related mucosal damage. Crit Care Med. 1996; 24(11): 1793-1800.
- Kantorova I., Svoboda P., Scheer P. et al. Stress ulcer prophylaxis in critically ill patients: a randomized controlled trial. Hepatogastroenterology. 2004; 51(57): 757-761.
- Robertson M. S., Сade J. F., Clancy R. L. Helicobacter pylori infection in intensive care: increased prevalence and a new nosocomial infection. Crit Care Med. 1999; 27(7): 1276-1280.
- Van der Voort P. H., van der Hulst R. W., Zandstra D. F. et al. Suppression of Helicobacter pylori infection during intensive care stay: related to stress ulcer bleeding incidence? J Crit Care. 2001; 16(4): 182-187.
- Halm U., Halm F., Thein D. et al. Helicobacter pylori infection: a risk factor for upper gastrointestinal bleeding after cardiac surgery? Crit Care Med. 2000; 28(1): 110-113.
- Колобов С. В., Лоранская И. Д., Зайратьянц О. В. и др. Эрозивно-язвенные поражения желудка и двенадцатиперстной кишки при остром инфаркте миокарда. Экспериментальная и клиническая гастроэнтерология. 2003. № 1. С. 95-97.
- Lam N. P., Le P. D., Grawford S. Y., Patel S. National survey of stress ulcer prophylaxis. Crit Care Med. 1999; 27(1): 98-103.
- Coursol C. J., Sanzari S. E. Impact of Stress Ulcer Prophylaxis Algorithm Study. The Annals of Pharmacotherapy. 2005; 39(5): 810-816.
- Frilling B., Schiele R., Gitt A. K. et al. Too little aspirin for secondary prevention after acute myocardial infarction in patients at high risk for cardiovascular events: Results from the MITRA study (Maximal Individual Therapy in Acute Myocardial Infarction Study Group). Am Heart J. 2004; 148(2): 306-311.
- Alexander K. P., Roe M. T., Chen A. Y. et al. Revolution in Cardiovascular Care for Elderly Patients With Non-ST-Segment Elevation Acute Coronary Syndromes (CRUSADE Initiative) J. Am. Coll. Cardiol. 2005; 46: 1479-1487.
- Cappell M. S., Iacovone F. M. Jr. Safety and efficacy of esophagogastroduodenoscopy after myocardial infarction. Am J Med. 1999; 106(1): 29-35.
О. В. Зайратьянц, доктор медицинских наук, профессор
Е. И. Вовк, кандидат медицинских наук, доцент
МГМСУ, ННПОСМП, Москва
Приложения
-
- Поражения желудка и двенадцатиперстной кишки у больных с острым коронарным синдромом - Рисунок 1.
Доля болезней системы кровообращения среди основных причин смерти в крупных мегаполисах России (по данным аутопсий в 1999–2004 гг.)
-
- Поражения желудка и двенадцатиперстной кишки у больных с острым коронарным синдромом - Таблица 1
Частота расхождений диагнозов у взрослых при ИБС в 1999–2004 гг.
Диагноз Частота случаев, % 1999 г. 2000 г. 2001 г. 2002 г. 2003 г. 2004 г. ИБС (все нозологии) 11 11 12 13 12 12,9 Острая коронарная недостаточность 22 23 21 23 18 15,1 Инфаркт миокарда (все формы) 17 16 12 16 15 12,2 Острый инфаркт миокарда 15 11 11 17 15 12,8 Повторный инфаркт миокарда 12 10 9 14 15 10,6 Постинфарктный кардиосклероз 12 12 10 16 15 14,7 Хроническая аневризма сердца 22 27 18 19 17 21,7
-
- Поражения желудка и двенадцатиперстной кишки у больных с острым коронарным синдромом - Таблица 2
Локализация и характер повреждений слизистой оболочки желудка и двенадцатиперстной кишки у больных с инфарктом миокарда (С. В. Колобов, О. В. Зайратьянц, Е. А. Попутчикова, 2003)
Локализация повреждения Характер повреждения слизистой оболочки (n = 152) Острые эрозии Острые язвы Эрозивно-геморра- гический гастрит Петехии, геморрагии Малая кривизна 31 19 4 8 Дно желудка 22 12 1 7 Антрум 16 2 6 6 Привратник 2 0 0 4 Двенадцатиперстная кишка 3 3 0 6 Всего 74 36 11 31