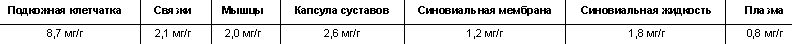Ревматические заболевания являются одной из основных причин временной нетрудоспособности, инвалидизации и снижения качества жизни пациентов, особенно среди лиц среднего и пожилого возраста, что обусловливает важную социально-экономическую значимость данной патологии и необходимость проведения дальнейшего изучения и совершенствования методов диагностики и лечения этой нозологии.
Основными клиническими проявлениями, характерными для этой группы заболеваний, являются боль и воспаление. По данным Harris, почти у 90% больных с различным типом хронической боли оказывается снижена трудоспособность, а у 2/3 — активность в повседневной жизни. Это, в свою очередь, приводит к развитию депрессивных или тревожных состояний более чем у половины пациентов, а выраженность этих проявлений у таких больных в 2 раза выше, чем в популяции [1].
Наиболее широко применяющаяся в ревматологии группа лекарственных средств представлена нестероидными противовоспалительными препаратами (НПВП). Они различаются по степени выраженности противовоспалительного, анальгетического и антипиретического эффектов, а также в плане индивидуальной чувствительности и переносимости, что необходимо учитывать при подборе терапии для каждого конкретного больного. Основной механизм действия НПВП связан с подавлением циклооксигеназы (ЦОГ) — фермента, участвующего в выработке простагландинов — медиаторов боли и воспаления.
Одним из хорошо известных и часто использующихся НПВП является ибупрофен. Препарат был создан в 1962 г. и зарекомендовал себя как средство, обладающее хорошей эффективностью и переносимостью, что было подтверждено в ряде клинических исследований [2]. Согласно данным, полученным профессором Autret-Leca (Франция), в плане переносимости ибупрофен представляет собой один из лучших препаратов среди НПВП. Ибупрофен может применяться как у взрослых пациентов, так и у детей. В отличие от аспирина ибупрофен не вызывает развития синдрома Рея. Кроме того, препарат, в отличие от парацетамола, не образует токсических метаболитов, а его токсичность при случайной или преднамеренной передозировке ниже, что обусловливает более широкий терапевтический диапазон применения ибупрофена.
В настоящее время накоплено достаточное количество данных, свидетельствующих о том, что основные терапевтические эффекты НПВП (анальгезия, противовоспалительное и жаропонижающее действия) являются результатом ингибирования так называемой индуцированной изоформы ЦОГ (ЦОГ-2), которая в норме отсутствует и вырабатывает простагландины при активизации медиаторами воспаления. В то же время развитие побочных реакций связано с ингибированием изоформы ЦОГ-1, в физиологических условиях вырабатывающей простагландины с защитной функцией и оказывающей цитопротекторное действие на слизистую желудка, предотвращающей агрегацию тромбоцитов при ее высвобождении клетками эндотелия и участвующей в нормальном функционировании почек. Таким образом, применение классических НПВП, подавляющих выработку как провоспалительных, так и физиологических простагландинов, сопряжено с повышенным риском возникновения «НПВП-гастропатий», развития и нарастания артериальной гипертензии и возникновения целого ряда других неблагоприятных реакций. В связи с этим при необходимости использования НПВП широко применяют локальную терапию, которая способствует созданию максимума концентрации анальгетического и противовоспалительного средства в месте поражения и при этом не оказывает столь выраженного отрицательного воздействия на организм, как при системном применении НПВП. Помимо этого, использование локальной терапии способствует уменьшению дозы перорально и парентерально применяемых НПВП.
Существуют определенные требования для локально применяемых средств [3]. Препарат должен быть эффективным, не должен вызывать местных токсических и аллергических реакций; концентрация препарата в крови не должна достигать уровня, приводящего к развитию нежелательных явлений, но при этом необходимо, чтобы создавались высокие концентрации средства в тканях-мишенях.
В плане доказательности эффекта НПВП при локальном их применении представляет интерес анализ результатов контролируемых исследований, посвященных терапии острой и хронической боли, проведенный R. A. Moore и соавторами [4]. В отношении острой боли было проанализировано 37 плацебо-контролируемых исследований с включением 3556 больных и 24 активно контролируемых (4171 пациент); при хронической боли соответственно 13 (1161 пациент) и 12 (1272 больных). Результаты этих исследований свидетельствуют о том, что в плане купирования боли локальное применение НПВП статистически более эффективно, чем использование плацебо-средств. Предпочтение авторы отдают кетопрофену, ибупрофену и пироксикаму.
Для локальной терапии ибупрофен используется с 1980-х гг.: как с целью анальгезии при спортивных травмах, так и для купирования воспаления. Используя 10% крем ибупрофена у 40 больных с различными формами посттравматического поражения, G. Baracchi и соавторы [5] через 14 дней получили достоверные показатели различий по выраженности боли, отечности суставов и функциональной активности в сравнении с плацебо. Эффективность препарата, по мнению врачей, была очень высокой и высокой у 17 больных, прошедших курс лечения ибупрофеном, и лишь у 3 — в группе плацебо. Малая эффективность либо полное отсутствие положительного воздействия отмечались в 3 случаях у пациентов основной группы и в 17 — в группе плацебо.
Терапевтическая оценка крема была дана и другими исследователями, использовавшими его при лечении болевого синдрома, возникшего в результате острого растяжения связок голеностопного сустава у 51 пациента. В группу плацебо входили 49 больных. Пациенты включались в исследование не позднее чем через сутки после травмы. Различия в плане купирования боли были достоверны в первые двое суток терапии, а к 14-му дню показатели нивелировались [6].
Быстрое купирование боли и восстановление функции суставов после 7-дневного использования крема, содержащего ибупрофен, при лечении тендинитов отметил и R. L. Dreiser [7].
Отечественные ревматологи использовали отечественный 5% крем ибупрофена у взрослых пациентов с ревматоидным артритом (РА) и остеоартрозом и у детей с ювенильным хроническим артритом (ЮХА) [3]. Улучшение констатировали у 75,6% пациентов с РА и у 90% — с остеоартрозом по оценке самих больных, у 80,9% и 87,2% больных соответственно по оценке врача. У 1/3 пациентов с остеоартрозом и у 1/4 больных с РА удалось уменьшить суточную дозу НПВП на 30–50%.
У больных ЮХА к концу курса лечения достоверно уменьшились такие показатели локального воспаления, как боль в покое и при пальпации, а также припухлость. Таким образом, авторы приходят к выводу, что используемый крем эффективен при лечении суставного синдрома у пациентов с ревматическими заболеваниями. Препарат хорошо переносится и у ряда больных может служить альтернативой системному применению НПВП.
О хорошем эффекте и переносимости 5% крема ибупрофена свидетельствуют данные M. Guillaume, который лечил больных с остеоартрозом мелких суставов кистей [8]. При оценке в конце лечения (14-й день) интенсивности боли в покое, движении, при давлении, а также функции суставов результаты были достоверно лучше, чем в группе плацебо. Кроме того, в период лечения у больных улучшился сон.
Позднее были созданы более удобные формы ибупрофена для локальной терапии — гели, которые быстро всасываются, не оставляют следов на одежде, а по эффективности не уступают своим предшественникам.
Всем этим требованиям отвечает нурофен-гель, содержащий в качестве активного вещества ибупрофен 5% (производитель — Бутс Хелскэр Интернешнл). Исследование M. Dominkus и соавторов [9] продемонстрировало, что после локального применения 5% ибупрофен-геля концентрация препарата в фасциях, мышцах и подкожножировой клетчатке была значительно выше, чем в плазме крови (р < 0,05), что подтверждает низкий риск развития системных побочных реакций при использовании этого геля. Терапевтический уровень концентрации препарата в месте назначения сохраняется в течение 15 ч после топического применения лекарственного средства, чем и определяется длительный эффект геля. По данным Peters, при перкутанном способе применения концентрация ибупрофена в мышцах и фасциях в 500 раз выше, чем в плазме, и составляет только 5% от таковой при пероральном приеме [10]. Кроме того, при локальном применении ибупрофена период полувыведения составляет 8–12 ч (при пероральном приеме — 2 ч).
Аналогичные данные получил P. W. Billigmann [11], который определял концентрацию препарата в различных тканях после 3-дневной аппликации 6 г ибупрофен-микрогеля (доза эквивалентна 300 мг ибупрофена) 3 раза в сутки или 8 г микрогеля (доза эквивалентна 400 мг ибупрофена) 3 раза в сутки (табл.).
Эффективность 5% ибупрофен-геля оценивалась в ходе плацебо-контролируемого исследования у пациентов с заболеваниями мягких тканей [12]. Больные получали активный гель (1-я группа) или плацебо-гель (2-я группа) в течение 7 дней. Степень выраженности боли и изменения физической активности определяли по визуальной аналоговой шкале.
К 7-му дню терапии выявили статистически значимое (р < 0,001) превосходство терапевтического действия ибупрофен-геля по сравнению с плацебо-контролем. При оценке боли в 1-й группе у 75% пациентов было констатировано клинически значимое уменьшение боли, в то время как во 2-й группе этот показатель составил лишь 39%. Клинически значимое улучшение физической активности отметили 79% пациентов в 1-й группе и 44% пациентов — во 2-й.
В ходе другого двойного, слепого плацебо-контролируемого исследования проводилась сравнительная оценка эффективности локального применения 5% ибупрофен-геля и перорально используемого ибупрофена (1200 мг/сут) у пациентов с патологией околосуставных мягких тканей [13]. Пациенты 1-й группы получали активный гель и плацебо-таблетки (50 чел.), во 2-й группе — активные таблетки и плацебо-гель (50 чел.). Терапия проводилась не менее 7 дней. По результатам исследования в обеих группах была выявлена аналогичная эффективность проводимой терапии по таким показателям, как время, необходимое для достижения полного клинического улучшения (р = 0,59), а также для ликвидации отдельных симптомов, а именно боли в покое, при движении и припухлости в пораженных суставах.
Высокая эффективность и хорошая переносимость 5% ибупрофен-геля была продемонстрирована при остеоартрозе, РА, ЮХА [8, 14], различных поражениях сухожильно-мышечного аппарата как травматического, так и воспалительного характера [15].
При назначении препарата следует объяснить пациентам, что для достижения эффекта необходимо 3–4-кратное нанесение геля в оптимальной дозировке с учетом площади пораженного сустава (на мелкие — 1–2-сантиметровые полоски, на крупные — 5–10-сантиметровые) и состояния кожного покрова. Не следует наносить гель на открытые раны или слизистые оболочки.
Таким образом, нурофен-гель является эффективным средством для локальной терапии больных с повреждением мягких тканей, хорошо переносится и может быть рекомендован для использования в практике ревматолога, травматолога и терапевта.
Литература
- Лесновская Е. Е., Коноплева Е. Ф. Финалгон в борьбе с болью//Русский медицинский журнал. 2001. Т. 9. № 7–8. С. 277–278.
- Геппе Н. А. К 40-летию создания ибупрофена. Первая международная конференция по применению ибупрофена в педиатрии//Русский медицинский журнал. 2002. Т. 10. № 18.
- Насонова В. А., Муравьев Ю. В., Кузьмина Н. Н. Является ли локальная терапия суставного синдрома препаратом «Долгит» при ревматических заболеваниях альтернативой системному назначению нестероидных противовоспалительных препаратов//Терапевтический архив. 1998. № 11. C. 64–66.
- Moore R. A., Tramer M. R., Carroll D. et al. Quantitive systematic review of topically applied non-steroidal anti-inflammatory drugs//Br. Med. J. 1998; 316: 333–338.
- Baracchi G., Messina Denaro S., Piscini S. Study of the topical application of isobutylphenyl-propionic acid (Ibuprofen) in traumatic inflammation. Double-blind comparison with a placebo//Gaz Med It. 1982; 141: 691–694.
- Campbell J., Dunn T. Evaluation of topical ibuprofen cream in the treatment of acute ankle sprains//J. Accident and Emergency Medicine. 1994; 11: 178–182.
- Dreiser R. L. Clinical study of the efficacy and tolerance of percutaneous ibuprofen in the treatment of tendonitis//J. Intern. Med. 1988; 119: 70–73.
- Guillaume M. Clinical study on efficacy and tolerance of percutaneous ibuprofen in the symptomic treatment of arthrosis of small joints//Le Journal International de Medicine. 1989; 1–4.
- Dominkus M., Nicolakis M., Kotz R. et al. Comparison of tissue and plasma levels of ibuprofen after oral and topical administration //Arzneimittelforschung. 1996; 46(12): 1138–1143.
- Peters H., Chlud K., Berner G. et al. Zur perkutanen kinetic von ibuprofen//Aktuelle Rheumatologie.1987; 12: 208–211.
- Billigman P. W. Treatment of ankle-joint sprains with ibuprofen microgel. Rapidly effective percutaneous therapy without systemic stress//Therapiewoche. 1996; 21: 1187–1192.
- Machen J., Whitefield M. Efficacy of a proprietary ibuprofen gel in soft tissue injuries: a randomised, double-blind placebo-controlled study//Int. J. Clin. Pract. 2002; 56(2): 102–106.
- Whitefield M., O, Kane C. J., Anderson S. Comparative efficacy of a proprietary topical ibuprofen gel and oral ibuprofen in acute soft tissue injuries: a randomised, double-blind study//J. Clin. Pharm. Ther. 2002; 27(6): 409–417.
- Schimek J., Hilken K., Vogtle-Junkert U. Percutaneous medication used on its own in rheumatological therapy: an alternative to oral treatment?//Therapiewoche. 1991; 41: 1170–1176.
- Castiaux J. P. Openstudy of the tolerance if ibuprofen 5% gel in the treatment of mild lesions of the musculoskeletal and connective tissues in 30 pstients //Study Report. 192; 533.
Р. М. Балабанова, доктор медицинских наук, профессор
Т. П. Гришаева, кандидат медицинских наук
Институт ревматологии, Москва
Приложения
-
- Опыт применения нурофен-геля в клинической практике - Таблица
Концентрация ибупрофена в человеческом организме после 3-дневной аппликации