С чем связана малая эффективность лечения СД 2-го типа?
Каков алгоритм достижения компенсации при СД 2-го типа?
Cахарный диабет (СД) 2-го типа — одно из самых распространенных в развитых странах заболеваний. Число больных СД 2-го типа в 2000 году составило около 147 млн человек, а к 2010 году предположительно возрастет до 215 млн. На основании эпидемиологических исследований, проводимых в мире, можно утверждать, что представленные цифры, касающиеся распространенности СД 2-го типа, занижены: минимум треть больных СД не подозревают о наличии у них заболевания и не получают адекватной терапии. Диагноз данному контингенту больных в лучшем случае ставят чисто случайно, а в худшем — лишь при развитии той или иной макроваскулярной катастрофы, которая у многих больных заканчивается фатально. Этот факт представляет собой серьезную медико-социальную проблему и требует обязательного проведения скрининга населения в целях выявления нарушений углеводного обмена, особенно в группе риска (артериальная гипертензия, избыточная масса тела, высокий индекс отношения окружности талии к бедрам). Однако даже при диагностированном заболевании риск инвалидизации и преждевременной смерти, к сожалению, остается высоким. Данное обстоятельство связано с высокой распространенностью декомпенсации углеводного обмена среди больных СД 2-го типа. Около 75% больных сахарным диабетом 2-го типа хронически пребывают в состоянии декомпенсации, что ускоряет темпы развития, а также прогрессирования макро- и микрососудистых осложнений, приводящих к снижению качества жизни, преждевременной инвалидизации и смерти пациентов.
Анализ причин подобного явления показал, что при подборе терапии далеко не всегда учитываются все известные звенья патогенеза СД 2-го типа. В связи с этим подавляющее большинство пациентов получают лишь монотерапию тем или другим пероральным сахароснижающим препаратом (ПССП), производными сульфонилмочевины (ПСМ). Кроме того, довольно часто отсутствие строгого контроля и самоконтроля за состоянием углеводного обмена в сочетании с повышенным порогом чувства жажды в пожилом возрасте позволяет длительное время поддерживать иллюзию относительного благополучия, что препятствует принятию решительных мер, направленных на оптимизацию лечения. С другой стороны, даже при регулярном контроле гликемии пациенты, а нередко и врачи игнорируют обнаруженные неудовлетворительные показатели состояния углеводного обмена и изменяют тактику лечения лишь в тех случаях, когда гликемия превышает рекомендуемые значения на 50% и более. Наконец, при отсутствии эффекта от проводимой терапии, несмотря на использование максимальных суточных доз ПССП, инсулинотерапия либо не назначается вовсе, либо проводится значительно позже, чем это реально необходимо. Вместо того чтобы добавить к проводимой терапии инсулин, врачи пытаются достичь компенсации состояния углеводного обмена путем дальнейшего (безрезультатного) увеличения суточной дозы ПССП либо комбинирования двух различных ПСМ.
В патогенезе атеросклероза при сахарном диабете 2-го типа важную роль играют общеизвестные факторы риска, такие, как артериальная гипертензия, дислипидемия, центральное ожирение, инсулинорезистентность, гиперинсулинемия, нарушение фибринолиза, курение и гипергликемия. Многоцентровые исследования доказали прямую корреляцию между декомпенсацией СД, то есть гипергликемией, и прогрессированием атеросклероза. Следовательно, нормализация углеводного обмена является важным звеном борьбы с макроваскулярными осложнениями.
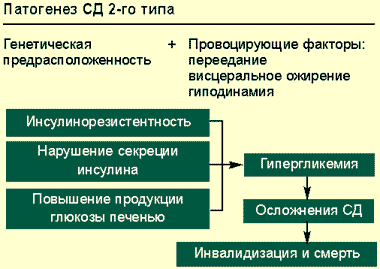
Сахарный диабет 2-го типа — гетерогенное заболевание, в связи с чем достижение компенсации углеводного обмена возможно лишь при максимально рациональном воздействии на все известные звенья его патогенеза.
В настоящее время при терапии больных СД 2-го типа используют диету, физические нагрузки, назначают производные сульфонилмочевины, постпрандиальные регуляторы глюкозы, метформин, тиазолидиндионы, ингибиторы α-глюкозидаз и инсулинотерапию.
Субкалорийная диета и физические нагрузки — залог успешной терапии сахарного диабета вообще и СД 2-го типа в частности. Однако подавляющему большинству пациентов для достижения компенсации заболевания требуется назначение ПССП, а при их неэффективности — инсулинотерапии. Минимальным набором сахароснижающих средств, достаточным для воздействия на все известные звенья патогенеза СД 2-го типа, являются ПСМ, бигуаниды и/или инсулин (при неэффективности последних).
Производные сульфонилмочевины
ПСМ связываются со специфическими белками на плазматической мембране β-клеток, что приводит к быстрому закрытию АТФ-К+-каналов, пассивному выходу ионов калия из β-клеток, деполяризации мембраны, открытию потенциалзависимых Са2+-каналов и значительному увеличению кальциевого тока внутрь β-клетки. Быстрое увеличение цитозольной концентрации Са2+ активирует Са2+-зависимые эффекторные системы, контролирующие внутриклеточную транслокацию секреторных гранул, дегрануляцию инсулина и его экзоцитоз.
Вопрос о наличии у ПСМ экстрапанкреатических эффектов остается открытым. В настоящее время большинство исследователей все же склонны связывать сахароснижающий эффект ПСМ преимущественно со стимуляцией секреции эндогенного инсулина.
Независимо от того, обладают ПСМ экстрапанкреатическим действием или нет, они, без сомнения, стимулируют эндогенную секрецию инсулина и уже таким образом снижают гипергликемию, которая сама по себе вследствие глюкозотоксичности углубляет имеющиеся нарушения секреции инсулина.
В настоящее время при лечении СД 2-го типа в основном используются ПСМ II генерации. Особенности химической структуры препаратов II генерации обусловливают их большее сродство с рецептором сульфонилмочевины на мембране β-клеток. В связи с этим они оказывают более выраженный сахароснижающий эффект и употребляются в значительно меньших дозах.
ПСМ были и на протяжении почти 40 лет остаются самой распространенной лекарственной формой при терапии СД 2-го типа. Несмотря на гиперинсулинемию (ГИ), являющуюся результатом инсулинорезистентности (ИР), у больных СД 2-го типа всегда наблюдается более или менее выраженный дефицит (относительный) инсулина, а также нарушение его секреции. В связи с этим положительный эффект применения ПСМ обусловлен их способностью стимулировать секрецию собственного эндогенного инсулина и тем самым нивелировать его дефицит.
Среди препаратов ПСМ II генерации в настоящее время широко используются глибенкламид, глипизид, гликлазид, гликвидон и глимепирид. По сравнению с ПСМ I генерации аффинность к рецепторам β-клеток у них на 2-5 порядков выше, что означает возможность достижения терапевтического эффекта при назначении минимальных доз, возникновение побочных реакций на фоне которых практически исключено.
ПСМ II генерации обладают различной способностью стимулировать секрецию инсулина, что следует обязательно учитывать в каждом конкретном случае при назначении препарата. Очевидно, что в зависимости от длительности заболевания и соответственно глубины нарушения функций β-клеток предпочтение следует отдавать тем препаратам, которые стимулируют β-клетки в большей степени (традиционный глибенкламид, глипизид). И наоборот, в дебюте заболевания начинать терапию следует с препаратов, в меньшей степени стимулирующих секрецию инсулина и соответственно обладающих минимальным риском развития гипогликемических состояний. Это связано с тем, что в начале заболевания секреция инсулина нарушена в наименьшей степени, а рецепторы β-клеток лучше отвечают на стимуляцию, что повышает риск гипогликемий. Целесообразно отдавать предпочтение таким препаратам, как глимепирид, микронизированный глибенкламид, гликлазид, ГИТС форма глипизида.
Выше было указано, что механизм действия всех ПСМ идентичен, а вызываемый ими секреторный ответ различен. Все перечисленные ПСМ связываются с белковой субстанцией в составе АТФ-зависимых К-каналов на поверхности β-клеток с молекулярной массой 140 кД. Исключение в настоящее время составляет лишь глимепирид, ассоциирующийся с субстанцией, молекулярная масса которой 65 кД (этим, вероятно, и объясняются особенности механизма его действия).
Глибенкламид (манинил 5, манинил 3,5, манинил 1,75) обладает максимальным сродством с АТФ-зависимыми К-каналами β-клеток и поэтому оказывает самый мощный сахароснижающий эффект, нередко являющийся причиной гипогликемии (обычно в случае нарушения режима питания или при физических нагрузках). Сахароснижающий эффект при приеме традиционного глибенкламида 5 наступает относительно поздно, возможно, вследствие медленной абсорбции препарата и низкой биодоступности (24-69%). В течение последних 10 лет с успехом применяются так называемые микронизированные формы глибенкламида, характеризующиеся значительно большей биодоступностью, отличающейся от обычного глибенкламида фармакокинетикой и фармакодинамикой, большей эффективностью при употреблении в меньшей разовой и суточной дозе. Микронизированная форма глибенкламида обеспечивает полное высвобождение действующего вещества в течение 5 мин после растворения и быстрое всасывание. Максимальная концентрация микронизированного глибенкламда обеспечивается через 1,7 ч (1,75 мг) и 2,5 ч (3,5 мг). Риск гипогликемических эпизодов в периоды между приемами пищи снижается.
Глипизид (глибенез, глибенез ретард, минидиаб) — препарат, прекрасно зарекомендовавший себя в терапии больных СД 2-го типа как в начале заболевания, так и при длительном его течении благодаря активному действию в сочетании с низким риском развития гипогликемии. Последнее крайне важное обстоятельство связано с тем, что в процессе метаболизма глипизида образуются четыре неактивных метаболита, не обладающие гипогликемическим эффектом и быстро выводящиеся из организма. Абсолютная биодоступность глипизида составляет 100% на 2-3-й час после приема.
В настоящее время глипизид представлен двумя основными формами — традиционной (глибенез, минидиаб), хорошо известной, и новой ГИТС (гастроинтестинальной терапевтической системы) (глибенез ретард), обеспечивающей медленное высвобождение препарата в течение суток. Отличие его от традиционной формы глипизида заключается в наличии осмотически активного ядра препарата, который окружен полупроницаемой для воды мембраной. Мембрана, окружающая таблетку, проницаема для воды, но не для препарата или осмотического акцептора. Вода из кишечного тракта поступает в таблетку, увеличивая давление в осмотическом слое, которое «выдавливает» активную часть препарата из центральной зоны. Это обеспечивает возможность выхода препарата через мельчайшие отверстия в наружной мембране таблетки. Поступление препарата из таблетки в ЖКТ осуществляется постоянно и постепенно. При приеме однократной суточной дозы пролонгированного глипизида эффективная концентрация в плазме поддерживается в течение 24 ч, что позволяет сократить количество суточных приемов препарата до одного раза в сутки. ГИТС высокоэффективна в плане сахароснижающего действия и безопасна в отношении гипогликемических реакций. Это особенно ценно, когда речь идет о пациентах старше 65 лет, риск развития гипогликемий у которых, как правило, выше при физических нагрузках и пропуске приема пищи.
Глимепирид является ПСМ, кардинально отличающимся от остальных известных сегодня. Отличие обусловлено тем, что глимепирид связывается с белком с молекулярной массой 65 Kda на рецепторе АТФ-зависимых К-каналов β-клеток по сравнению со всеми остальными ПСМ, которые ассоциируют с протоном 140 Kda. Этим качеством глимепирида и объясняются отличительные свойства данного препарата. Сахароснижающая активность глимепирида сравнима с таковой у глибенкламида, но в отличие от последнего глимепирид быстрее и эффективнее вызывает высвобождение инсулина при нормальной и повышенной концентрации глюкозы в крови. Данный феномен можно объяснить их различным воздействием на АТФ-зависимые К+- каналы, играющие ключевую роль в механизме секреции инсулина. Ввиду того что глимепирид ассоциируется с белком с более низкой молекулярной массой, он связывается с рецептором в 2,5-3 раза быстрее и распадается в 8-9 раз быстрее, чем глибенкламид. Подобная особенность ассоциации и диссоциации глимепирида с рецептором ПСМ объясняет быстрое начало действия препарата и низкий риск развития гипогликемий не только на фоне физической нагрузки, но и при пропуске приема пищи.
Гликлазид (диабетон, диабетон МВ, глидиаб, реклид) — препарат сульфонилмочевины, обладающий мягким сахароснижающим эффектом, в связи с чем он безопасен для применения на начальных стадиях заболевания, а также у лиц пожилого возраста. Недавно выпущена новая форма гликлазида — диабетон МВ (модифицированного высвобождения). Гранулы, содержащие активное вещество гликлазида, находятся в гидрофильном матриксе, который обеспечивает его модифицированное высвобождение в течение всех суток при однократном приеме.
Независимо от особенностей фармакокинетики и фармакодинамики ПСМ все препараты данной группы стимулируют секрецию инсулина в ответ на прием пищи. Следовательно, их максимальный терапевтический эффект проявляется в виде снижения постпрандиальной гипергликемии. Иными словами, они уменьшают относительный дефицит инсулина, то есть воздействуют на важное, но единственное звено патогенеза СД 2-го типа. На повышенную продукцию глюкозы печенью (ППГ) и на инсулинорезистентность ПСМ клинически значимого терапевтического эффекта не оказывают, с чем и связана необходимость комбинации их с бигуанидами.
Бигуаниды. Единственным производным гуанидина, который применяется в настоящее время для лечения СД 2-го типа, является метформин. От применения фенформина и буформина в 80-е годы полностью отказались по причине развития спонтанного лактацидоза.
Механизм сахароснижающего действия метформина связан прежде всего с подавлением глюконеогенеза в печени, а следовательно, со снижением ППГ печенью и инсулинорезистентности. Применение метформина способствует значительному снижению гликемии натощак в связи с повышением под его воздействием чувствительности печеночных клеток к инсулину, угнетением в печени процессов глюконеогенеза и гликогенолиза, а также увеличением синтеза гликогена. В результате проведенных исследований доказано, что метформин уменьшает продукцию глюкозы печенью (ПГП) в среднем на 30%, что приводит к снижению уровня глюкозы крови натощак. Так, при уменьшении ПГП на 17,6% показатели гликемии натощак снижаются примерно на 40%. Основным механизмом, за счет которого происходит снижение ПГП, является подавление печеночного глюконеогенеза. Метформин снижает продукцию глюкозы из аланина, пирувата, лактата, глютамина и глицерола. Это происходит, прежде всего, вследствие торможения поступления перечисленных субстратов глюконеогенеза в гепатоциты и ингибирования его ключевых ферментов — пируваткарбоксилазы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы.
Поскольку метформин выводится из организма через почки, то любая степень нарушения их функций при приеме метформина увеличивает риск развития лактацидоза. Следовательно, повышение концентрации креатинина в крови свыше 1,5 мг/дл служит противопоказанием для применения метформина. Кроме нарушения азотвыделительной функции почек, противопоказанием к назначению метформина служит гипоксия (застойная сердечная недостаточность и тяжелые хронические обструктивные заболевания легких). Эти состояния по причине имеющейся стойкой гипоксии предрасполагают к развитию ацидоза, в том числе лактацидоза, даже на фоне нормальных цифр сывороточного креатинина. Метформин может сочетаться с любым из сахароснижающих препаратов, в том числе с инсулином.
Назначать метформин целесообразно перед сном, начиная с 500 мг. В случае недостаточного снижения гликемии натощак следует постепенно увеличивать дозу препарата до 850-1000 мг. При отсутствии желаемого эффекта или при наличии у больного противопоказаний к применению метформина рассматривается вопрос о назначении перед сном (в 22 часа) пролонгированного (ПИ) инсулина в дозе 0,1-0,2 ед/кг.
У больных с преобладающей инсулинорезистентностью и ожирением метформин рассматривается как препарат первого выбора и для нормализации гликемии в дневное время. Помимо перечисленных выше эффектов, метформин задерживает интестинальную абсорбцию глюкозы. При использовании терапевтических доз метформина скорее имеет место именно задержка всасывания углеводов, так как общий объем введенной меченой глюкозы при этом не уменьшается. Безусловно, данный эффект метформина играет важную роль в достижении компенсации углеводного обмена, позволяя «сглаживать» пики постпрандиальной гипергликемии. Исследования показали, что метформин значительно повышает утилизацию глюкозы в кишечнике, усиливая анаэробный гликолиз, как в состоянии насыщения, так и натощак. Скорее всего, это обусловлено повышением утилизации глюкозы в кишечнике, которая превышает активность данного процесса в мышцах в состоянии покоя. Наибольшую активность метформин проявляет в слизистой оболочке тонкой кишки. Таким образом, действие метформина в кишечнике способствует предотвращению постпрандиального подъема гликемии. Клинические наблюдения показывают, что на фоне терапии метформином сахар крови после приема пищи снижается в среднем на 20-45%.
Обычно дневная доза метформина составляет 500-1700 мг, а суточная — до 3000 мг. Максимальное насыщение препаратом обычно достигается при дозе, равной 3 г. В связи с этим назначение более высоких доз считается нецелесообразным, так как это не способствует дальнейшему усилению антигипергликемического эффекта. Невозможность достичь желаемого уровня гликемии через два часа после приема пищи на фоне лечения метформином свидетельствует о значительном нарушении секреции инсулина β-клетками, его относительном дефиците и необходимости добавления ПСМ в целях стимуляции эндогенной секреции гормона.
В последнее время появился комбинированный препарат глибомет, содержащий метформин (400 мг) и глибенкламид (2,5 мг). Это средство одновременно стимулирует секрецию инсулина, подавляет продукцию глюкозы печенью и снижает инсулинорезистентность.
На начальных этапах заболевания при выборе типа ПСМ предпочтение следует отдавать тем препаратам, с которыми связан наименьший риск развития гипогликемических состояний (глимепириду, пролонгированному глипизиду, микронизированным формам глибенкламида, гликлазиду, гликвидону). При отсутствии компенсации углеводного обмена через 2 ч после еды необходимо назначить максимальную суточную дозу получаемого ПСМ, а при сохранении гипергликемии — заменить его глимепиридом, глипизидом или глибенкламидом, обладающими наибольшим аффинитетом к рецепторам АТФ-зависимых калиевых каналов β-клеток.
При сохранении гипергликемии в дневное время после указанных действий перед завтраком назначается пролонгированный (ПИ) или комбинированный (КИ) инсулин в дозе 0,1 ед/кг с постепенным увеличением последней до достижения желаемых значений гликемии. При отсутствии явных признаков дефицита инсулина (прогрессирующее снижение массы тела, снижение базального и стимулированного С-пептида, кетоацидоз) целесообразно назначать комбинированную терапию ПСМ и инсулином, преимущества которой очевидны. Так, ПСМ обеспечивают секрецию эндогенного инсулина непосредственно в воротную вену, синтез гликогена и снижение глюконеогенеза в печени, а также уменьшение постпрандиальной гипергликемии. ПИ (или КИ), введенный перед завтраком и действующий в дневные часы, уменьшает относительный дефицит и обеспечивает необходимый базальный уровень гормона, что проявляется нормализацией гликемии в периоды между приемами пищи. Назначение ПИ (или КИ) перед сном подавляет ночную продукцию глюкозы и СЖК печенью и нормализует гликемию натощак. Суточная потребность в экзогенном инсулине при комбинированной терапии (инсулин + СМ/метформин) снижается на 25-50% по сравнению с моноинсулинотерапией.
При наличии объективных признаков дефицита инсулина или абсолютных показаний к его назначению к ПИ добавляется инсулин короткого действия перед основными приемами пищи, а все ПССП отменяют.