Что такое стопа Шарко?
В чем трудность диагностики диабетической остеоартропатии?
Диабетическая остеоартропатия (ОАП, стопа Шарко, сустав Шарко) — редкое, но крайне тяжелое осложнение сахарного диабета, при неадекватном лечении приводящее к необратимой инвалидизации. Это осложнение можно назвать одной из самых загадочных форм синдрома диабетической стопы, так как предсказать развитие ОАП и выделить группы риска среди пациентов с сахарным диабетом крайне трудно. С этим осложнением диабета встречаются врачи разных специальностей — хирурги, эндокринологи, ортопеды, но далеко не всегда оно вовремя распознается.
Современное определение диабетической остеоартропатии — «деструкция кости и сустава неинфекционного характера, вызванная диабетической нейропатией» [1].
Деструктивная остеоартропатия была описана в ХIХ веке французским неврологом Шарко [2], но не при сахарном диабете (в доинсулиновую эру поздние осложнения диабета практически не встречались), а при сифилитическом поражении проводящих путей спинного мозга (tаbеs dоrsаlis). Впоследствии было установлено, что подобные изменения суставов стоп также встречаются при различных заболеваниях, приводящих к нарушению иннервации нижних конечностей (сирингомиелии, диабетической полинейропатии и др.). В настоящее время наиболее частой формой остеоартропатии является диабетическая.
Распространенность данного осложнения среди больных сахарным диабетом составляет менее 1% [3], хотя в литературе встречаются данные о поражении костной ткани стоп у 0,1-55% больных [4]. Такая противоречивость сведений, очевидно, связана с различиями в методике обследования и разными критериями диагностики остеоартропатии.
Локализация поражений
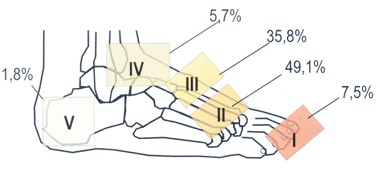
В подавляющем большинстве случаев ОАП поражает кости и суставы стоп. В 1991 году была предложена классификация ОАП [3] в зависимости от локализации процесса (рис. 1). У 20-25% пациентов ОАП поражает обе стопы, но обычно не одновременно. Встречаются случаи ОАП с поражением других суставов: коленного и даже локтевого.
Рисунок 1. |
Этиология, патогенез и естественное течение ОАП
Остеоартропатия — это по сути поражение костной ткани в отличие от типичных форм остеопороза, имеющих исключительно локальный характер. Причиной такого поражения кости является нарушение иннервации нижних конечностей вследствие диабетической нейропатии.
Длительное время развитие ОАП рассматривалось в основном с позиций нейротравматической и нейроваскулярной [5]. Согласно первой, моторная и сенсорная (посредством утраты проприоцептивных рефлексов) формы нейропатии приводят к нарушениям биомеханики стопы. Результатом этого является аномальная нагрузка на отдельные суставы стопы при ходьбе, приводящая через некоторое время к их деструкции. Альтернативная теория основана на обнаружении при ОАП признаков артериовенозного шунтирования крови через сосудистое русло костной ткани, в связи с чем было сделано заключение о ведущей роли аномального усиления кровотока в костной ткани в развитии локальной остеопении [6]. В 1989 году ученые выдвинули предположение о том, что в развитии ОАП определенную роль играют как рецидивирующая травма стоп, так и усиление кровотока в костной ткани. Таким образом оба этих патологических процесса нашли отражение в «синтетической» теории [7].
Известно, что ОАП не развивается у пациентов с нарушениями кровоснабжения нижних конечностей. Это объясняется тем, что при ишемической и нейроишемической формах синдрома диабетической стопы невозможно аномальное усиление кровотока в костной ткани.
Несмотря на то что факт развития ОАП лишь при тяжелой диабетической нейропатии хорошо известен, предсказать развитие ОАП практически невозможно, так как это осложнение возникает далеко не у всех больных даже с выраженной нейропатией. В связи с этим было высказано предположение, что ОАП вызывает не любая форма, а лишь определенные «подвиды» нейропатии. В 1992 году британские исследователи выдвинули гипотезу (впоследствии подтвержденную в ряде работ), что к ОАП приводит особая форма диабетической нейропатии с преимущественным поражением миелиновых нервных волокон и относительной сохранностью безмиелиновых, что вызывает нарушение тонуса микрососудов, которое влечет за собой усиление кровотока в костной ткани [8].
Эти патологические процессы служат предпосылкой, своего рода фоном для манифестации ОАП — остеопороза дистальных отделов нижних конечностей, снижающего устойчивость кости к повреждающим воздействиям. В этой ситуации провоцирующий фактор (минимальная травма при ходьбе или хирургическое вмешательство на стопе) приводит к повреждению кости или усилению в ней кровотока, активации остеокластов и «запускает» бурный и безостановочный процесс остеолиза, в отсутствие лечения приводящий к разрушению скелета стопы.
После манифестации ОАП процесс проходит четыре стадии [4].
Рисунок 2. |
Первая (острая) стадия характеризуется отеком стопы, умеренной гиперемией и местной гипертермией (рис. 2). Боли и лихорадка нехарактерны. Рентгенография может не выявлять деструктивных изменений (на этой стадии они представлены лишь микропереломами); обнаруживается остеопороз костей стоп.
Рисунок 3. |
Вторая (подострая): фрагментация костей и начало деформации стопы. В типичных случаях происходит уплощение свода стопы на пораженной стороне (рис. 3). Отек и воспалительные явления в этой стадии уменьшаются. Рентгенологически определяются фрагментации костных структур.
Рисунок 4. |
Рисунок 5а. |
Третья (хроническая): выраженная деформация стопы, наличие спонтанных переломов и вывихов. Вид деформации зависит от локализации поражения. В типичных случаях нагрузки на стопу при ходьбе приводят к деформации по типу «пресс-папье» или «стопы-качалки» (рис. 4). Это сопровождается вальгусной деформацией внутреннего края стопы в области предплюсны, клювовидной деформацией пальцев. Рентгенологически — фрагментация костей, выраженная деформация скелета, периостальное и параоссальное обызвествление (рис. 6). Функция скелета стопы полностью нарушается, в тяжелых случаях стопу можно образно сравнить с «мешком с костями».
Рисунок 5б. |
Четвертая (стадия осложнений): перегрузка отдельных участков деформированной стопы приводит к образованию язвенных дефектов (рис. 5); при их инфицировании возможно развитие флегмоны стопы, остеомиелита, гангрены.
Диагностика
Из-за сложности лечения ОАП, а также в связи с тем, что в популяции это состояние встречается достаточно редко, пациентов с подозрением на ОАП для диагностики и лечения следует направлять в специализированные отделения (центры) «Диабетическая стопа».
Рисунок 6. |
ОАП диагностируется на основании клинической картины, анамнеза (небольшая травма, хирургическое вмешательство) и рентгенологических признаков, соответствующих той или иной стадии. Очень часто из-за недостаточной информированности врачей общей практики об ОАП это осложнение ошибочно диагностируется как лимфостаз, тромбофлебит, флегмона стопы и др.
Наиболее затруднен дифференциальный диагноз в острой стадии, когда несвоевременное начало адекватного лечения приводит к необратимой инвалидизации.
Рисунок 7. |
Дифференциальная диагностика ОАП в острой фазе включает два основных вопроса:
- Являются ли воспалительные изменения следствием поражения костных структур или их следует рассматривать как проявление другого заболевания (флегмоны стопы, острого тромбофлебита, подагрического артрита, ревматических поражений суставов и др.)?
- При наличии рентгенографических признаков деструкции кости имеет она неинфекционную (ОАП) или инфекционную (остеомиелит) природу?
Для решения первого вопроса необходимы данные рентгенографии стоп (хотя в острой фазе могут присутствовать лишь неспецифические изменения в виде остеопороза). Магнитно-резонансная томография и сцинтиграфия скелета стопы выявляют микропереломы, воспалительные изменения, усиление кровотока в пораженных костях.
Возможна оценка биохимических маркеров распада костной ткани (гидроксипролина, дезоксипиридинолина, фрагментов коллагена и др.). С аналогичной целью могут использоваться и маркеры перестройки костной ткани, отражающие активность остеобластов (то есть остеосинтеза), — костный изофермент щелочной фосфатазы и др. Но уровень этих веществ во многом зависит от активности процессов распада костной ткани в скелете в целом.
Очевидно, что изменения, характерные для других заболеваний: признаки острого тромбофлебита при УЗДГ венозной системы, типичная клиника подагрического артрита (с болевым синдромом и лихорадкой, соответствующей рентгенологической и биохимической картиной) и прочие — делают диагноз ОАП менее вероятным.
Для остальных случаев наиболее приемлемым на сегодняшний день алгоритмом диагностики ОАП в острой фазе можно считать следующий [9]:
Клинические данные — подозрение на ОАПРентгенография стопы при отрицательных результатахСцинтиграфия с 99mTc подтверждение диагнозаМРТ и/или повторная рентгенография («прицельная», с исследованием конкретной «зоны интереса»)
При возникновении у больного сахарным диабетом одностороннего отека стопы (особенно при неповрежденной коже) следует обязательно исключить возможность ОАП. При подозрении на ОАП и при повышенном риске ее развития (длительное течение сахарного диабета, выраженная диабетическая нейропатия) целесообразнее назначить лечение сразу, чем через несколько месяцев наблюдать необратимую деформацию стопы.
Второй вопрос чаще возникает при наличии трофической язвы стопы или в послеоперационном периоде после ампутации в пределах стопы или другого оперативного вмешательства. Это связано с тем, что остеомиелит при синдроме диабетической стопы чаще всего вторичный, являющийся осложнением трофической язвы или раневого процесса. В решении этого вопроса помогают данные анализа крови: нейтрофильный лейкоцитоз характерен (хотя и необязателен) для остеомиелита, но не для ОАП. Об остеомиелите свидетельствуют также некоторые рентгенологические признаки (реакция надкостницы), а также наличие свища, зондирование костных структур в дне раны. Эффективный, но малодоступный метод исследования — сцинтиграфия скелета с введением лейкоцитов с радиоактивной меткой. «Золотым стандартом» в определении природы деструкции костной ткани является биопсия кости.
Лечение ОАП
В острой фазе цель лечения — остановка процессов остеолиза, предотвращение патологических переломов или их консолидация.
Наиболее частая ошибка — назначение вазоактивных препаратов. Эти средства показаны далеко не при всех формах синдрома диабетической стопы (только при ишемической и нейроишемической), а при ОАП способны усилить и без того избыточный кровоток в костной ткани.
Основой лечения ОАП в острой стадии является полная разгрузка конечности до исчезновения признаков воспаления (отека, локальной гипертермии). Адекватная разгрузка обеспечивает консолидацию костных отломков и более важна, чем медикаментозное лечение [3]. Если разгрузка не проводится, наиболее вероятны смещение костных отломков и развитие прогрессирующей деформации стопы, представленной на рис. 2-5. В первые дни и недели заболевания показан строгий постельный режим. В дальнейшем возможна ходьба, но только в специально изготовленном ортезе, переносящем значительную часть нагрузки со стопы на голень. Временная разгрузка в период изготовления ортеза может выполняться с помощью тутора, который отличается от ортеза стандартной формой (продается в готовом виде) и менее плотной фиксацией конечности.
После разрешения отека (обычно через 4 месяца) от ношения ортеза постепенно отказываются, а пациенту разрешают ходить в индивидуально изготовленной ортопедической обуви (рис. 7).
Стандартным методом разгрузки конечности при ОАП в большинстве зарубежных стран, особенно англоязычных (США, Великобритания, Австралия и др.), является применение фиксирующих повязок из полимерных материалов, по свойствам аналогичных гипсу (Тоtаl Соntасt Саst). Но даже при наличии высококвалифицированного персонала, проводящего эту процедуру, метод чреват развитием повреждений кожи (пролежней) под иммобилизирующей повязкой в 10% случаев.
В острой фазе ОАП применяются лекарственные препараты, влияющие на метаболизм костной ткани.
Тормозят процесс резорбции костной ткани бифосфонаты и кальцитонин.
Отечественный бифосфонат первого поколения ксидифон (этидронат) отличается доступной ценой. Назначается по 15-25 мл готового раствора натощак прерывистыми курсами (например, первые 10 дней каждого месяца), так как постоянный его прием создает риск остеомаляции. Современные бифосфонаты — фосамакс (алендронат) и другие — применяются в постоянном режиме и более эффективны. Доза фосамакса — 10,0 мг (одна таблетка) натощак ежедневно. Имеются сообщения о внутривенном применении бифосфонатов [бонефос (клодронат)] при ОАП.
Кальцитонин (миакальцик) применяется подкожно или внутримышечно по 100 МЕ один раз в день (обычно 1-2 недели), далее — в виде назального аэрозоля по 200 МЕ ежедневно.
Образование костной ткани стимулируют активные метаболиты витамина Д
Альфа Д3-Тева применяется по 0,5-1 мкг/сут (2-4 капсулы) после еды. Альфа Д3-Тева способствует улучшению абсорбции кальция в кишечнике и активации процессов костного ремоделирования, обладает способностью подавлять повышенный уровень паратиреоидного гормона, усиливать нервно-мышечную проводимость, уменьшая проявления миопатии. Длительная терапия Альфа Д3-Тева способствует уменьшению болевого синдрома, повышению мышечной силы, координации движений, снижению риска падений и переломов костей. Частота побочных реакций на фоне длительной терапии Альфа Д3-Тева остается низкой.
Анаболические стероиды (ретаболил, неробол) назначают в виде инъекций один раз в неделю в течение 3-4 недель.
Препараты кальция самостоятельного действия на метаболизм костной ткани не оказывают, поскольку включение кальция в состав костной ткани регулируется соответствующими гормонами. Эти препараты применяются как вспомогательные для обеспечения достаточного потребления кальция при лечении патологии костной ткани (которое должно составлять с учетом всех пищевых продуктов 1000-1500 мг/сут). Наибольшей биодоступностью обладают лактат и карбонат кальция. Они входят в состав препаратов кальций-Сандоз форте, витрум-кальциум и кальций-Д3-Никомед, которые можно назначать по одной таблетке в день (около 500 мг элементарного кальция). Последний из названных препаратов содержит также витамин Д
Кальцитонин и бифосфонаты способны вызывать гипокальциемию, витамин Д3 и препараты кальция — повышать уровень кальция в крови. Поэтому необходимо определение уровня ионизированного кальция до начала лечения и ежемесячно на его фоне (в современных лабораториях этот показатель определяется в капиллярной крови). Обычно применяется комбинация какого-либо из ингибиторов резорбции, витамина Д3 и препаратов кальция. В зависимости от уровня ионизированного кальция дозы тех или иных препаратов увеличиваются или уменьшаются. Продолжительность лечения составляет 4-6 месяцев.
Вспомогательные средства (НПВС, эластичное бинтование конечности, иногда диуретики) применяются в целях устранения отека.
Рентгенотерапия пораженных суставов позволяет достаточно быстро купировать воспалительные явления. Однако, по данным ряда плацебо-контролируемых исследований, факт улучшения прогноза течения ОАП после рентгеновского облучения не подтвердился. Поэтому рентгенотерапию следует применять только в сочетании с адекватной разгрузкой конечности.
Оптимальным результатом лечения, начатого в острой фазе, является предотвращение переломов или консолидация отломков. О результатах лечения позволяют судить изменения клинической картины и контрольная рентгенография через 4-6 месяцев от манифестации заболевания.
После стихания воспалительных явлений сохраняется повышенный риск ОАП (в этой же или других зонах). Помимо общих профилактических мер (см. ниже) целесообразно носить ортопедическую обувь, уменьшающую нагрузку на суставы стопы (в первую очередь, предплюсны) при ходьбе.
В том случае, если процесс находится на второй или третьей стадии, основной целью лечения становится предотвращение осложнений ОАП. При наличии деформаций стопы необходима сложная ортопедическая обувь с внутренним рельефом, повторяющим аномальную форму стопы. Ригидная подошва с так называемым перекатом — приподнятой передней частью — препятствует дальнейшему смещению костных отломков при ходьбе. Постоянное ношение качественной ортопедической обуви предотвращает развитие трофических язв в местах повышенного давления. Попытки ортопедической коррекции деформаций при ОАП (супинаторы и т. п.) бесперспективны и чреваты быстрым развитием язв.
Методы хирургического восстановления скелета стопы при ОАП
Предложен ряд методов оперативного вмешательства, направленных на коррекцию деформации стопы при ОАП (артродез, резекция костных структур, создающих повышенное давление на подошвенную поверхность и приводящих к образованию незаживающей язвы), но в России опыт их применения невелик. Несомненным условием использования этих методов является полное стихание воспалительного процесса и остеолиза (так как в противном случае оперативное вмешательство может способствовать появлению новых очагов деструкции). Вероятно, лечение препаратами, укрепляющими костную ткань, создает более благоприятные условия для проведения операции. Однако вопрос о показаниях к хирургическому лечению и его безопасности при ОАП по-прежнему остается спорным. Чаще всего показанием к такому лечению служит тяжелая деформация стопы, делающая невозможным изготовление адекватной ортопедической обуви. В любом случае после оперативного вмешательства необходимо обеспечить полную 3-месячную разгрузку пораженной конечности (постельный режим, далее — Total Contact Cast или его аналог) [3].
Профилактика ОАП
Вопрос о методах профилактики в группах риска окончательно не решен. Своевременное выявление остеопении в дистальных отделах конечностей позволило бы восстанавливать костную плотность с помощью соответствующих препаратов. Однако остеопороз скелета стоп при рентгенографии у больных диабетом встречается в десятки раз чаще, чем ОАП, в связи с чем группа пациентов, имеющих показания для профилактического лечения, становится неоправданно большой. Кроме того, недостаточно разработаны методы количественной оценки костной плотности (денситометрии) скелета стоп, без которых невозможно составить представление об изменениях плотности костной ткани на фоне лечения, а также выбрать наиболее эффективные препараты и т. п.
Следовательно, основой профилактики ОАП остается адекватное лечение сахарного диабета, подобранное с учетом современных рекомендаций: обучение больных методам самоконтроля, поддержание гликемии на уровне, близком к «недиабетическому», и своевременное назначение инсулина при СД 2-го типа.
Литература
- International Working Group on the Diabetic Foot. International Consensus on the Diabetic Foot., 1999.
- Charcot J. M. Sur quelques arthropathies qui paraissent dependre d'une lesion du cerveau ou de la moelle epiniere // Archives Phisiologie Normale et Patologie. 1868. V. 1. P. 161-178.
- Frykberg R., Mendeszoon E. Management of the diabetic Charcot foot Diabetes // Metabolism research and reviews. 2000. V. 16 (Suppl. 1). P. S59-S65.
- Дедов И. И., Анциферов М. Б., Галстян Г. Р., Токмакова А. Ю. Синдром диабетической стопы. М.: Федеральный диабетологический центр МЗ РФ, 1998.
- Bradshaw T. W. Aetiopathogenesis of the Charcot, vol. foot: an overview//Practical Diabetes International. January-February 1998. V. 15. № 1. P. 22-24.
- Boulton A. J. M., Scarpello J. H. B., Ward J. D. Venous oxygenation in the diabetic neuropathic foot: evidence of arterial venous shunting? // Diabetologia. 1982. V. 22. P. 6-8.
- Bаnks A. M., МсGlаmry R. A. Neuroarthropathy (Charcot joints) in diabetes mellitus // Journal of American Podiatry Medical Association. 1989. V. 79. P. 110.
- Stevens M., Edmonds M., Foster A., Watkins P. Selective neuropathy and preserved vascular responses in the diabetic Charcot foot // Diabetologia. 1992. V. 35. P. 148-154.
- Petrova N., Foster A., Bates M. et al. Can Charcot osteoarthropathy be prevented? // Materials of the annual meeting of the EASD Diabetic Foot Study Group (7-9 Sept. 2001). P. A25.
Ключевые моменты диагностики и лечения ОАП
- Нарушения магистрального кровотока в нижних конечностях и диабетическая остеоартропатия - взаимоисключающие заболевания
- Во всех случаях одностороннего отека стопы у больного сахарным диабетом следует исключать ОАП
- Лишь своевременное и "агрессивное" лечение позволяет остановить процесс разрушения скелета стопы
- Основой лечения ОАП является полная разгрузка конечности
- Нередкая ошибка - ампутация стопы, пораженной остеоартропатией, принятой за гнойно-деструктивный процесс
- Применение вазоактивных препаратов ухудшает прогноз при ОАП
- Для пациентов с диабетической остеоартропатией ношение индивидуально изготовленной ортопедической обуви обязательно