Каковы основные причины соматотропной недостаточности у взрослых?
Каковы ее клинические проявления?
Какие методы лабораторно подтверждают диагноз?
Как известно, гормон роста (ГР) был последним из классических гормонов, который начали применять с целью заместительной гормональной терапии у взрослых. У детей история медикаментозной коррекции низкорослости насчитывает около тридцати лет, ко взрослым же лечение с использованием биосинтетических препаратов ГР впервые было применено около десяти лет назад. В течение многих лет с целью терапии использовался ГР, получаемый из гипофизарных экстрактов, однако в 1985 году, когда были описаны четыре случая болезни Крейтцфельдта — Якоба у реципиентов гипофизарного ГР, использование последнего было запрещено. Это послужило отправной точкой для начала работ по производству биосинтетического ГР [2].
Использование ГР у детей и произошедший параллельно научный прорыв в отношении диагностирования дефицита гормона роста у взрослых привели к появлению в клинической эндокринологии новой нозологии и, соответственно, новых методов обследования и лечения. Ни один конгресс или симпозиум, проходящий в настоящее время, не обходится без докладов, посвященных проблемам диагностики дефицита ГР (ДГР) у взрослых, выявлению нарушений, сопровождающих заболевание, и принципам подбора терапии.
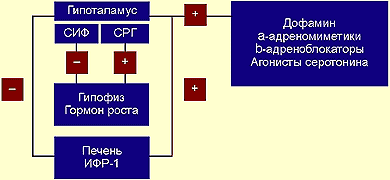
Для того чтобы создать более точное представление о спектре нарушений, развивающихся на фоне соматотропной недостаточности, необходимо кратко напомнить о структуре ГР, механизмах его секреции и влиянии на органы и системы. ГР, синтезируемый соматотрофами передней доли гипофиза, относится к особому семейству пептидных гормонов, в состав которого кроме ГР входят пролактин (ПРЛ) и плацентарный соматомаммотропин человека (СМЧ). Секреция ГР находится под контролем двух гипоталамических гормонов: соматостатина или соматотропин-ингибирующего фактора (СИФ), который оказывает блокирующее действие на синтез и секрецию соматотрофами ГР. Соматотропин — рилизинг гормон (СРГ) — оказывает стимулирующее действие на соматотрофы, что проявляется увеличением продукции ГР.
Как многие гормоны, ГР синтезируется в определенном импульсном режиме, пики секреции приходятся на 22.00 и 4.00 часа.
Несмотря на существование специфических рецепторов ГР, его действие осуществляется посредством специфических факторов, аналогичных по своей структуре инсулину: инсулиноподобного ростового фактора I (ИФР-I) и инсулиноподобного ростового фактора II (ИФР-II). ИФР-I, действуя через собственные рецепторы, оказывает ростовые эффекты преимущественно в постэмбриональном онтогенезе организма. Действие ИФР-II проявляется преимущественно в процессе эмбриогенеза.
Многочисленные исследования, результаты которых публикуются в современных медицинских изданиях, красноречиво свидетельствуют о наличии серьезных нарушений в соматическом и психологическом статусе пациентов с декомпенсированной недостаточностью гормона роста. Эти нарушения характеризуются изменением соотношения жировая/мышечная ткань в сторону снижения удельного веса последней, увеличения удельного веса жировой ткани и сопровождаются висцеральным отложением последней. При проведении денситометрии обнаруживается снижение плотности костной ткани (МПК). Scacchi at al отметили обратно пропорциональную зависимость между индексом массы тела (ИМТ) и периодом полужизни ГР, а также амплитудой секреции ГР. Процент содержания жировой ткани находился в обратной зависимости от интегрального показателя концентрации ГР, определяемого в течение 24 часов.
Со стороны метаболических нарушений необходимо выделить снижение толерантности к углеводам при проведении инсулинтолерантного теста, увеличение продукции инсулина, проинсулина, повышение содержания триглицеридов плазмы крови, липопротеидов низкой и очень низкой плотности [3].
Не до конца изучено влияние недостаточности ГР на увеличение риска развития сердечно-сосудистых заболеваний, однако при ретроспективном исследовании 333 пациентов с гипопитуитаризмом выявлено, что в течение 22 лет случаи кардиоваскулярной смерти встречались в два раза чаще по сравнению с группой контроля. При проведении эхокардиографии исследователи обнаруживали снижение массы левого желудочка, уменьшение толщины перегородки и задней стенки желудочков, а также снижение фракции выброса левого желудочка.
Еще сравнительно недавно проблема дефицита ГР у взрослых не находила отражения в исследованиях эндокринологов, хотя вопросы, связанные с недостаточностью секреторной функции гипофиза, возникали с того времени, когда были впервые описаны пациентки с синдромом Шиена (Шихана). Данная патология обусловлена развитием инфарктов и кровоизлияний в раннем послеродовом периоде и характеризуется развитием пангипопитуитаризма. Долгие годы пациентки получали заместительную гормональную терапию глюкокортикоидами, тиреоидными гормонами, половыми стероидами, однако при этом продолжали предъявлять неспецифические жалобы на повышенную утомляемость, слабость, немотивированное увеличение массы тела. При попытке исследовать уровень гормонов сыворотки крови с целью выяснения степени компенсации имеющихся нарушений патологических отклонений обнаружено не было, а сниженному уровню ГР не придавали значения. В дальнейшем многочисленные клинические и лабораторные исследования продемонстрировали, что снижение секреции ГР в организме взрослого человека приводит к целому ряду нарушений, которые остаются незамеченными и не имеют такой яркой клинической окраски, как, например, гиперсекреция ГР и развивающаяся вследствие этого акромегалия.
Перечислим причины развития соматотропной недостаточности у взрослых
- оперативные вмешательства по поводу аденом гипофиза: пролактином, соматотропином, тиреотропином, кортикотропином, нефункционирующих аденом гипофиза;
- лучевая терапия на область турецкого седла;
- удаление краниофарингиом и эндоселлярных кист;
- травматическое поражение срединных структур головного мозга;
- синдром Шиена.
Количество пациентов, подвергшихся тем или иным вмешательствам на селлярной области, растет год от года, и связано это с повышением разрешающей способности диагностических методов, используемых при обследовании больных, и расширением лечебных возможностей современной медицины. Исходя из этого можно прогнозировать, что количество пациентов, нуждающихся в проведении скринингового обследования ДГР, будет увеличиваться год от года. Современная фармакология, в свою очередь, располагает целым спектром препаратов, призванных компенсировать соматотропную недостаточность; ниже приводится перечень средств, имеющихся на сегодняшний день в отечественной аптечной сети.
- Гентропин — Pharmacia, США.
- Хуматорп — Eli Lilly, США.
- Сайзен — Ares-Serono, Швеция.
- Нордитропин — Novo Nordisk, Дания.
«Золотым стандартом» в диагностике ДГР у взрослых справедливо считается инсулинотолерантный тест. Необходимо оговориться, что его проведение возможно только после компенсации вторичного гипотиреоза и вторичного гипокортицизма, в противном случае результаты теста могут быть недостоверными.
В рамках исследования, проведенного в клинике эндокринологии ММА им. И. М. Сеченова и посвященного изучению целесообразности назначения препарата генноинженерного гормона роста взрослым, была обследована группа больных с подозрением на наличие соматотропной недостаточности.
В группу вошли 15 человек в возрасте от 15 до 45 лет: 12 женщин (80%) и трое мужчин (20%). Девять женщин (60%) были прооперированы по поводу макропролактином гипофиза, трое мужчин (20%) и трое женщин (20%) подверглись оперативному вмешательству по поводу краниофарингиомы гипофиза, у одного мужчины (6,7%) при проведении МРТ выявлена агенезия гипофиза. Среди всех обследованных пациентов задержка роста зафиксирована у троих мужчин (20%) в возрасте 16, 21 и 27 лет, оценка роста у них проводилась с использованием таблицы «Перцентильный график роста для мальчиков». У первого пациента рост был равен 148 см, при оценке перцентильных значений величина стандартного отклонения (SDS) составила –3,5. Рост второго и третьего пациентов был равен 145 и 152 см соответственно, но в связи с невозможностью оценить величину SDS исходя из паспортного возраста последняя была рассчитана исходя из костного. В первом случае паспортный возраст ровнялся 13-14 годам и SDS –2, во втором случае костный возраст соответствовал 16 годам и SDS –3. Структура эндокринных заболеваний, выявленных у пациентов с подозрением на соматотропную недостаточность, отражена в табл. 2.
Регуляция секреции гормона роста |
Перед проведением провокационных тестов, направленных на диагностику соматотропной недостаточности, всем пациентам был проведен комплекс лабораторно-диагностических мероприятий для уточнения соматического и гормонального статуса пациентов.
Большинство пациентов получали заместительную гормональную терапию по поводу вторичного гипотиреоза, вторичной надпочечниковой недостаточности, несахарного диабета; у всех было проведено скрининговое исследование концентрации свободного Т4, пролактина, ЛГ, ФСГ, эстрадиола с целью коррекции доз получаемых препаратов.
Исследование соматического статуса предусматривало определение следующих показателей: расчет индекса массы тела (ИМТ), вычисление отношения объем талии/объем бедер (ОТ/ОБ), определение уровня глюкозы, холестерина, триглицеридов, ЛПНП, ЛНВП, АЛТ, АСТ. Проводилось ЭКГ и измерение артериального давления с целью исключения патологии со стороны сердечно-сосудистой системы.
Для оценки качества жизни пациентов с рассматриваемой патологией использовался опросник, разработанный специально для пациентов с дефицитом ГР — QoL-AGHDA (Quality of Life — Assessment of Growth Hormone — Deficiency in Adults) и содержащий 25 вопросов, на которые необходимо было ответить «да» или «нет». Каждый положительный ответ оценивался в один балл; чем больше оказывалась полученная в результате сумма, тем ниже показатель качества жизни.
В ходе обследования были получены следующие результаты.
Нормальные показатели ИМТ (18<ИМТ<25) были выявлены у семи пациентов (46,6%), избыток массы тела (25<ИМТ<30) — у троих (20%), ожирение (ИМТ>30) диагностировано у четырех человек (26,7%). У одного пациента наряду с задержкой роста был выявлен дефицит массы тела, ИМТ составил 15,9 (6,7%). У одной пациентки (6,7%) обнаружен сахарный диабет II типа. Признаки висцерального ожирения выявлены у четырех пациенток (26,7%).
При обследовании у шести пациенток обнаружено повышение гликемии натощак, которое составило 7,025 ± 0,12 ммоль/л; показатели гликемии у 11 пациентов были в пределах нормы и варьировали от 3,6 до 5,5 ммоль/л. Для исключения возможных нарушений углеводного обмена: тощаковой гипергликемии, нарушения толерантности к углеводам, сахарного диабета, гиперинсулинемии всем пациентам был проведен оральный глюкозотолерантный тест с 75 г глюкозы. При определении гликемии через 2 часа после приема 75 г глюкозы последняя составила 6,6 ± 0,14 ммоль/л. Сахарный диабет был выявлен у одной пациентки (гликемия 11,9 ммоль/л), еще у двоих пациентов определено нарушение толерантности к углеводам (гликемия 8,3 и 9,0 ммоль/л). При исследовании уровня С-пептида сыворотки крови были получены следующие результаты: базальная гиперинсулинемия (>2,5 нг/мл) обнаружена у пяти пациентов (3,33%) и составила 3,89 ± 0,1 нг/мл. Более чем двукратное увеличение концентрации С-пептида через 120 минут после стимуляции отмечено у девяти пациентов (60%) и составило 10,5 ± 0,4 нг/мл. При оценке липидного обмена гиперхолестеринемия выявлена у десяти пациентов (66,6%), гипертриглицеридемия обнаружена у семи пациентов (46,6%).
Всем пациентам был проведен инсулинотолерантный тест с целью подтверждения дефицита гормона роста. В условиях стационара пациентам внутривенно вводился инсулин короткого действия: Humulin R или Actrapid HM, из расчета 0,1 ЕД/кг [1]. Исходно через каждые 15 минут в дальнейшем пациентам проводилось определение гликемии в капиллярной крови и забор крови для последующего выявления уровня гормона роста в сыворотке крови.
В ответ на инсулин-индуцированную гипогликемию у 12 обследованных (80%) концентрация ГР не превысила 5 нг/мл, а составила в среднем 0,76 ± 0,013 нг/мл. У троих на фоне гипогликемии было зарегистрировано повышение уровня ГР до 30,78 ± 0,45 нг/мл.
По результатам проведенного теста девяти пациентам была назначена терапия генотропином (Pharmacia&Upjohn). Двое пациентов с задержкой роста получают препарат в настоящее время, у семи человек завершился шестимесячный курс терапии. При расчете дозы препарата использовались рекомендации Janssen и соавт., дозировка генотропина определялась из расчета 0,018 МЕ/кг для шести пациентов, а для трех пациентов с задержкой роста доза была вычислена из расчета 0,1 МЕ/кг [2].
Спустя 6 месяцев после начала терапии все пациенты прошли повторное обследование. Сколько-нибудь значимых изменений ИМТ отмечено не было, показатель ОТ/ОБ снизился у пяти человек, у двоих он остался на прежнем уровне. У троих пациентов выявлено некоторое снижение концентрации холестерина, составившее 8,4, 9,7 и 26,6% от первоначального уровня. У троих пациентов не определено каких-либо изменений, у одного пациента выявлено повышение концентрации холестерина на 17% от исходного. По показателям содержания триглицеридов выявлены следующие данные: у четверых пациентов снижение ТГ составило 56,4, 47,2, 3,7 и 6,3% от исходного. В одном случае динамики отмечено не было, а у двоих человек зафиксировано повышение концентрации ТГ, составившее 68 и 92% от исходного уровня. Снижение уровня ТГ и холестерина на фоне терапии генотропином подтверждается данными зарубежных исследователей, демонстрирующих нормализацию показателей липидного обмена на фоне заместительной терапии.
Перед началом терапии средний показатель качества жизни составил 12,5 балла, а на последней неделе терапии он снизился до 8,9 балла (необходимо отметить, что, по данным Holmes и соавт., у здоровых пациентов, обследованных в Швеции, он составляет 3,7).
Пациент с задержкой роста за 6 месяцев лечения вырос на 5 см, и его рост на момент окончания терапии составил 157 см.
Среди зафиксированных пациентами побочных эффектов чаще всего встречались: отеки, артралгии и миалгии, которые развивались на 3-6-й неделе терапии; о них сообщили четверо пациентов. Аналогичные данные демонстрируют и зарубежные исследователи, проводившие наблюдения за более многочисленными группами пациентов, получавших ГР.
По результатам проведенного исследования можно сделать следующие выводы.
- При обследовании группы пациентов, оперированных по поводу объемных образований селлярной области, в 80% случаев было подтверждено наличие соматотропной недостаточности.
- При оценке ИМТ и ОТ/ОБ ожирение зафиксировано у 33,4% обследованных, избыток массы тела — у 25%. Признаки висцерального ожирения выявлены у четырех пациентов (33,4%).
- У больных с дефицитом ГР нарушения углеводного обмена: сахарный диабет, тощаковая гипергликемия, нарушение толерантности к углеводам выявлены в 74,9% случаев. Базальная гиперинсулинемия выявлена у 41,6% обследованных, более чем двукратное повышение концентрации С-пептида регистрировалось в 75% случаев.
- Гиперхолестеринемия обнаружена у большинства обследованных (83,3%), гипертриглицеридемия выявлена в 58,3% случаев. Через 6 месяцев терапии генотропином снижение уровня холестерина от исходного обнаружено у 42,8%. У 51,4% пациентов зарегистрировано снижение содержания триглицеридов.
- При оценке показателей качества жизни было достоверно выявлено улучшение его; средний балл до начала терапии составлял 12,5, на фоне лечения он снизился до 8,9 балла.
Литература
1. Алгоритмы диагностики и лечения болезней эндокринной системы/ Под ред. И. И. Дедова, 1997.
2. Дедов И. И., Тюльпаков А. Н., Петеркова В. А. Соматотропная недостаточность, 1998.
3. Monson J. P. Growth Hormone Therapy. Oxf, 1999. Р. 93-103.