Увеличение числа больных с местнораспространенным первичным раком мочевого пузыря и с рецидивами заболевания, направляемых в последнее время на облучение, вновь заставляет обратить пристальное внимание на совершенствование клинико-методической базы лучевой терапии как одного из широкодоступных и экономически обоснованных способов противоопухолевого лечения.
В течение последних десятилетий сформировалось принципиально новое научное направление, связанное с реализацией автоматизированной дистанционной и внутриполостной гамма-терапии, завершившееся созданием соответствующих аппаратурных комплексов для ее проведения — «Рокус-АМ», «Рокус-Аспект» и «Агат-ВУ», АГАМ.
Ранее, в рамках клинического использования автоматизированной дистанционной и внутриполостной гамма-терапии, были всесторонне изучены и обобщены перспективные возможности метода в лечении наиболее распространенных онкогинекологических заболеваний — рака шейки и тела матки, рака яичников [3, 4].
При этом наиболее значимыми среди этих методов являются:
— формирование суммарных изодозных распределений принципиально любой геометрической формы и протяженности, что позволяет облучать местнораспространенные опухоли с различными анатомо-топографическими параметрами первичного очага;
— обеспечение эффективной защиты органов высокого радиационного риска за счет ограничений поглощенных доз в заданных направлениях.
Реализация данных условий облучения позволяет снизить уровни поглощенных доз в конкретных анатомических областях на 20-30% по сравнению с дозами от статической дистанционной гамма-терапии противолежащими пучками излучения. Автоматизированная лучевая терапия в рамках различных терапевтических программ была проведена 41 больному раком мочевого пузыря (9 больных — с рецидивами заболевания) на аппарате «Рокус» с системой «Аспект».
Индивидуальному планированию дистанционной гамма-терапии предшествовало комплексное исследование больных, включавшее современные методы визуализации первичного очага и зон регионального метастазирования.
По данным комплексного диагностического исследования осуществляли построение эскизов поперечных сечений тела больных на трех уровнях (по центру мочевого пузыря, на уровне верхнего и нижнего сегмента) с учетом тугого наполнения органа и в условиях эвакуации мочи.
Индивидуальное планирование осуществляли по центральному уровню — сечению, где располагался центр опухоли. Оценку распределения энергии ионизирующего излучения в облучаемом объеме проводили как на уровне анатомического среза планирования, так и в сечениях выше и ниже оптимизированного дозного распределения.
Анализ многоплоскостных дозных распределений был проведен нами для различных вариантов статического многопольного и подвижного облучения, а также радиобиологических программ, включавших расщепленные курсы — 13 больных (31,7%) — и режим мультифракционного подведения разовой очаговой дозы (РОД) 2-2,6 Гр — 26 больных (63,4%). Остальные (4,9%) получали фармакологическое лечение. В виду высокой токсичности примененных препаратов, приведшей к развитию цистита, адъювантная лучевая терапия была ограничена рамками симптоматического воздействия с суммарными очаговыми дозами (СОД) менее 40 Гр.
Статическая многопольная автоматизированная дистанционная лучевая терапия была включена в программы лечения 13 больных в основном с тотальным поражением органа и распространением процесса на паравезикальную и тазовую клетчатку.
Учитывая значительное распространение опухоли, умеренно выраженные общие симптомы (слабость, вторичная анемия, дизурические явления средней и сильной степени, гематурия), использовалось сочетание двух или четырех противолежащих пучков с неравномерным временным воздействием (учитывая эксцентричное положение органа) и решетчатые диафрагмы (С-2).
Лучевая терапия злокачественных опухолей мочевого пузыря занимает одно из ведущих мест среди всех видов специального лечения при раке данной локализации. Однако для ее эффективной реализации необходимо подведение к облучаемому объему достаточно высоких доз излучения, что, несомненно, приводит и к большой лучевой нагрузке на окружающие здоровые ткани. В то же время попытки снижения дозы облучения на эти области, как правило, приводит и к недостаточному облучению самой «мишени», что, как известно, почти всегда является причиной возникновения впоследствии рецидива заболевания |
Вместе с тем возможность уточнения локализации и протяженности опухоли на основе УЗИ, цистоскопии, компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) и других дополняющих методов исследования позволила нам сформулировать условия предпочтительного формирования терапевтического изодозного распределения по факту подведения РОД и СОД.
Рассматривая статические варианты облучения, как наиболее распространенные в клинической практике дистанционной лучевой терапии, целесообразно сформулировать условия рационального их использования в лечении местнораспространенного рака мочевого пузыря с позиции оценки характеристик распределения энергии ионизирующего излучения на протяжении всего органа.
Как было сказано выше, облучение двумя противолежащими пучками в сочетании с последующим переходом на ту же методику в условиях формирующих устройств (решетчатые диафрагмы С-2) можно считать приемлемым лишь для достижения кратковременного симптоматического эффекта при опухолях с массивным внеорганным распространением до СОД, не превышающих 40 Гр. В отдельных случаях, учитывая эксцентричное положение органа, нами использовались неравномерные временные соотношения: кратно увеличению времени облучения по кратчайшим направлениям.
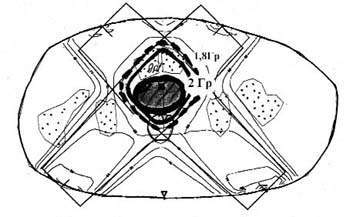
В рамках воздействия на опухоли, ограниченные стенкой мочевого пузыря, применялись четыре пучка, расположенные под углом друг к другу. При этом индивидуализация подбора ширины и углов терапевтического пучка гарантирует корректное совмещение изодозного контура с органом-мишенью, что иллюстрирует эскиз поперечного сечения с дозным распределением, выполненный по результатам КТ на уровне центра опухоли — среднего сегмента мочевого пузыря. Как видно, на этом уровне терапевтический изодозный контур распространяется на предпузырную и ретровезикальную клетчатку.
Дозное распределение на уровне дна мочевого пузыря при этом не претерпевает изменений ни по форме, ни по площади. Однако следует иметь в виду возможность вовлечения в терапевтический изодозный контур определенного объема тонкой кишки (особенно при сопутствующих колитах с нарушением моторики), что может быть подтверждено данными КТ. В данном случае эти физиологические особенности могут быть причиной раннего развития лучевых реакций при нетрадиционных режимах облучения или поздних — при радикальных программах облучения.
Рисунок 1. Суммарное дозное распределение на уровне нижнего сегмента мочевого пузыря и простаты: статическое облучение, 4 поля 8x8 см, РИК 75 см, РОД 2 Гр при воспроизведении параметров облучения по центральной плоскости терапевтического пучка |
Рассматривая дозное распределение на уровне нижнего сегмента мочевого пузыря в проекции лонных костей (рис. 1), воспроизведенное по физико-техническим параметрам основного сечения, на котором осуществляли дозиметрическое планирование, мы констатировали, что изменения формы и размеров изодозного максимума не происходит, несмотря на различия в объеме костной ткани, окружающей опухолевый очаг. Однако при этом в зону, соответствующую значениям РОД и СОД, могут быть вовлечены расположенные ретровезикально нормальные органы — предстательная железа у мужчин, шейка матки у женщин и прямая кишка, что должно быть учтено при выборе радиобиологического режима облучения и результирующих СОД.
Необходимо подчеркнуть, что увеличение площади опухолевого очага, охватываемого терапевтическим изодозным контуром, требует увеличения ширины терапевтического пучка. Это, в свою очередь, влечет за собой возрастание площади и объема нормальных тканей, вовлекаемых в терапевтический изодозный контур.
Рисунок 2. Суммарное дозное распределение на уровне центра опухоли мочевого пузыря: статическое облучение, 4 поля 8x8 см, РИК 75 см, РОД 2 Гр при удвоении времени облучения по кратчайшим направлениям |
При автоматизированной гамма-терапии с компьютерным управлением процессом облучения возможности традиционного статического лучевого воздействия могут быть расширены за счет гибкого моделирования временных параметров (рис. 2), размеров терапевтических пучков, сочетания статических и подвижных вариантов облучения (рис. 3).
Анализ суммарных дозных распределений во всем объеме обеспечивает подведение необходимых поглощенных доз с учетом индивидуальных характеристик опухолевого очага, гарантируя при этом максимальный лечебный эффект и минимизируя частоту осложнений.
Широкие возможности формирования лечебных дозных распределений при подвижных вариантах облучения также позволяют индивидуализировать клинические показания к их использованию при раке мочевого пузыря.
Рисунок 3. Суммарное дозное распределение при сочетанном использовании статического многопольного и ротационного облучения с углом качания 240 Реклама |
Так, применение равномерного подвижного абдоминального облучения с углом вращения 2400 наиболее эффективно при облучении опухолей, локализованных на одной из стенок мочевого пузыря. При этом суммарное дозное распределение по центру мочевого пузыря имеет округлую форму и заключает весь объем органа, визуализированного в условиях наполнения. Вместе с тем при подвижных вариантах облучения влияние внешнего контура и костных структур оказывает определенное воздействие на форму и размеры терапевтического изодозного контура. Так, на уровне дна мочевого пузыря контур со значением РОД 2 Гр имеет меньшую площадь и бобовидную форму, проецируясь преимущественно на переднюю стенку мочевого пузыря. Эти же изменения контура оказываются характерными и для дозного распределения, воспроизведенного по параметрам планирования на уровне шейки мочевого пузыря.
Увеличение площади, охватываемой терапевтическим изодозным контуром при сохранении описанных выше изменений формы, достигается увеличением ширины терапевтического пучка. Поэтому, как показывает наш опыт, частота рецидивов рака мочевого пузыря после подвижного облучения в данном режиме может быть объяснена недостаточным лучевым воздействием на опухоли с преимущественной локализацией по задней стенке или с тотальным поражением органа и распространением на паравезикальную клетчатку.
Следовательно, клинические показания к режиму подвижного облучения с углом вращения 2400 целесообразно ограничить локализованными опухолями с вовлечением избирательно передней или задней стенки мочевого пузыря. При этом для последнего варианта расположения опухоли предпочтителен режим задней ротации с углом вращения 240o.
Рисунок 4. Суммарное дозное распределение на уровне нижнего сегмента мочевого пузыря и простаты: равномерная ротация 3600, поле 8x8 см, РИО 75 см |
Анализируя многоплоскостные суммарные дозные распределения при одном из вариантов подвижного облучения с углом вращения 360o, мы пришли к заключению, что эта методика может быть эффективно использована в рамках пред- или послеоперационного воздействия при операции типа трансуретральной резекции (ТУР), так как позволяет формировать локальное дозное распределение в форме окружности по эскизу планирования со значительным градиентом дозы в направлении окружающих органов и тканей. При этом в проекции дна мочевого пузыря изодозный контур принимает форму вытянутого в переднезаднем направлении овала, вовлекая в терапевтический изодозный контур ретровезикальные ткани.
Изодозный контур на эскизе поперечного сечения, выполненного на уровне шейки мочевого пузыря, также сохраняет форму овала, захватывая ткани под лонным сочленением (рис. 4).
Таким образом, формирование достаточного локализованного дозного распределения при варианте подвижного облучения с углом вращения 360о позволяет рекомендовать для него нетрадиционные режимы среднего и укрупненного фракционирования, для этапов комбинированного и (или) симптоматического (гемостатического) лечения больных раком мочевого пузыря.
Автоматизированная гамма-терапия с компьютерным управлением процесса облучения дает широкие возможности формирования лечебных доз распределений при подвижных вариантах облучения, а также позволяет индивидуализировать процесс облучения |
Особое место в лечении больных раком мочевого пузыря занимает метод внутриполостной лучевой терапии в условиях высоких мощностей дозы. Сложность широкого клинического внедрения этого метода заключена в низком уровне комплектования универсальных гамма-терапевтических аппаратов «Агат-ВУ» и АГАМ соответствующими эндостатическими устройствами.
Располагая большим клиническим опытом высокомощностной автоматизированной гамма-терапии, мы использовали разработанные ранее варианты многопозиционного перемещения одноканальных эндостатов с различной длиной дуги при опухолях мочевого пузыря с локализацией в области шейки и нижнего сегмента [3, 4]. При этом локализацию первичной опухоли и ее протяженность уточняли по данным цистоскопии, УЗИ, КТ или МРТ. Введение эндостатов в мочевой пузырь проводили под премедикацией, а их пространственное расположение контролировали под ЭОП и документировали на полиграммах. В этом случае объемные суммарные дозные распределения, нормированные к вершинам изогнутого эндостата, имели форму эллипса при шестипозиционном перемещении эндостата под 60о и уплощенного в задней части эллипса для тех случаев, когда ротация эндостата в направлении задней стенки мочевого пузыря была невозможна из-за уменьшения его объема или выраженной болезненности в процессе ротации эндостата.
Внутриполостную гамма-терапию в условиях этого методического приема мы считаем возможной в пред/послеоперационном периоде при опухолях, локализованных преимущественно по передней стенке. В этом случае мы применяли РОД = 5 Гр до СОД — 20-25 Гр.
Литература
1. Костромина К. Н., Титова В. А., Демидова Л. Д. Достижения и направления развития лучевой терапии гинекологического рака: Доклад IV сессии общего собрания РАМН. Москва, 1995.
2. Павлов А. С., Костромина К. Н., Фадеева М. А., Стиоп Л. Д., Мардашева Л. В. Оптимальное планирование в автоматизированном лучевом лечении больных злокачественными опухолями //Мед. Физика. 1995. № 2. С.71.
3. Титова В. А. Автоматизированная лучевая терапия в комплексном лечении больных раком эндометрия с факторами неблагоприятного прогноза. Дис. ... д. н. 1998. С. 450.
4. Титова В. А., Горбунова В. В., Клеппер Л. Я., Скрыпкин Ю. Л., Короткова С. В. Индивидуальное планирование автоматизированной лучевой терапии рака матки и яичников с учетом реальных объемов тканей //Мед. Физика. 1997. Новые технологии в радиационной онкологии. Обнинск. 1997. С. 31-32.
Обратите внимание!
- Автоматизированная лучевая терапия местнораспространенного рака мочевого пузыря позволяет с высокой степенью точности воспроизводить индивидуальные программы облучения в соответствии с особенностями топографической анатомии опухолевого очага
- Сочетание в едином курсе многопараметровых программ статической и подвижной гамма-терапии существенно расширяет терапевтические возможности метода у больных местнораспространенным раком мочевого пузыря
- Применение определенных методических приемов позволяет реализовать высокомощнную внутриполостную гамма-терапию в рамках комбинированного и самостоятельного лечения больных местнораспространенным раком мочевого пузыря
- Внутриполостная гамма-терапия может быть использована и в качестве симптоматического гемостатического способа паллиативного воздействия при макрогематурии, не поддающейся фармакологической коррекции