Преимущества мРНК-вакцин против инфекционных заболеваний
Cuiling Zhang, Giulietta Maruggi, Hu Shan, Junwei Li
Перевод из журнала Frontiers in Immunology (оригинал).
Опубликовано 27 марта 2019 г.
Аннотация
На протяжении двух последних десятилетий пристальное внимание привлекают технологии на основе РНК, используемые для создания профилактических и терапевтических вакцин. Доклинические и клинические испытания показали, что мРНК-вакцины обеспечивают безопасный и длительный иммунный ответ как на животных моделях, так и у людей. В данном обзоре мы суммируем текущую информацию о научном прогрессе в области мРНК-вакцин, которые могут быть быстро разработаны и стать мощным оружием против инфекционных заболеваний, а также подчеркиваем, что создание и применение таких вакцин ожидает большое будущее.
Введение
Вакцинация представляет собой наиболее успешный медицинский подход к профилактике и контролю заболеваний. Успешная разработка и применение вакцин уже спасли тысячи жизней и огромное количество денежных средств. В будущем вакцины смогут применяться не только против инфекционных заболеваний, но также и против рака в качестве средств профилактики и лечения, а также для элиминации аллергенов [1-3]. До 1980-х гг. вакцины разрабатывались с целью защиты от микроорганизмов. Опытным путем получали инактивированные вакцины либо методом нагревания, либо химической обработкой, а также получали живые аттенуированные вакцины, главным образом с использованием животных, клеточных линий или неблагоприятных для роста условий. В ходе разработки вакцины механизмы, вовлеченные в процесс иммунизации, оставались неизвестными. Тем не менее, использование живых аттенуированных вакцин или убитых цельноклеточных вакцин имело колоссальный успех для контроля и эрадикации ряда тяжелых инфекционных заболеваний человека, включая натуральную оспу, полиомиелит, корь, паротит, краснуху, а также инфекционных заболеваний животных, таких как классическая чума свиней, чума рогатого скота и инфекционная анемия лошадей. В последнее время благодаря успехам в теории и практике молекулярной биологии были разработаны живые аттенуированные (LAV), субъединичные и пептидные вакцины. Результаты, полученные при вакцинации живыми ослабленными вакцинами, очень сильно расширили наши представления о механизмах, связанных с иммунным ответом, вызванным этими вакцинами. В случае инактивированных вакцин главный вклад в профилактику и контроль инфекционных заболевания, вызванных микроорганизмами, вносят антиген-специфичные антитела. LAV вызывают сильный клеточный иммунный ответ, который имеет решающее значение для эрадикации многих внутриклеточных патогенов. Тем не менее, неудачи, которые иногда случаются при использовании инактивированных вакцин, объясняются мутацией поверхностных антигенов патогена. Дополнительные вопросы о применении LAV включают их способность вызывать заболевание у лиц с ослабленным иммунитетом, а также возможность возврата к вирулентной форме из-за обратной мутации, приобретения компенсаторных мутаций или рекомбинации с циркулирующими передаваемыми штаммами дикого типа [4, 5]. Тем не менее, субъединичные и пептидные вакцины менее эффективны для вызывания устойчивого CD8+ иммунного ответа, который важен в случае внутриклеточных патогенов, включая вирусы и некоторые бактерии [6, 7].
Использование вакцин на основе нуклеиновых кислот с невирусной доставкой против имитаторов инфекций или иммунизация живыми микроорганизмами стимулирует возможности фолликулярного Т-хелпера и иммунный ответ зародышевой B-клетки [8, 9]. Более того, производство вакцины на основе нуклеиновых кислот с невирусной доставкой безопасно и экономно с точки зрения времени, не дает роста высокопатогенных организмов в большом масштабе, а также менее рискованно в смысле загрязнения живыми инфекционными агентами и утечки опасных патогенов. Следует заметить, что наибольшую трудность представляет получение нужного запаса за короткое время [10]. Вакцины на основе нуклеиновых кислот с невирусной доставкой могут удовлетворить потребность в вакцинах против эпидемических заболеваний [10]. Нуклеиновые кислоты с невирусной доставкой подразделяются на ДНК- и РНК- в соответствии со своим типом сахарида, содержащего 5 атомов углерода. ДНК-вакцины и РНК-вакцины действуют по-разному. На этапах между иммунизацией при помощи ДНК-матрицы и экспрессией целевого антигена, ДНК должна преодолеть цитоплазматическую мембрану и оболочку ядра клетки, быть транскрибирована в мРНК и переместиться обратно в цитоплазму для инициации трансляции (Рис. 1). Несмотря на то, что ДНК-вакцины имеют многообещающие свойства и характеризуются доказанными безопасностью, переносимостью и иммуногенностью, по данным ранних клинических испытаний, они имеют неоптимальную специфическую активность [11]. Улучшенные технологии доставки, такие как электропорация, повышали эффективность ДНК-вакцин у человека [12], но не уменьшали возможный риск интеграции чужеродной ДНК в геном хозяина, что может вызвать тяжелые мутации и новые заболевания [13, 14]. После того, как было обнаружено, что депротеинизированная ДНК, in vitro транскрибированная в мРНК, может быть экспрессирована in vivo после прямой инъекции в мышцу мыши, мРНК стала широко изучаться в качестве основы для профилактики и терапии [15-19]. Для сравнения, мРНК-вакцины обладают рядом преимуществ относительно вакцин на основе вирусного вектора и ДНК-вакцин (суммировано в Табл. 1). Использование РНК в качестве терапевтического инструмента не находится в фокусе внимания данной работы и широко представлено в других источниках [2, 19, 20]. В данном обзоре мы представляем мРНК-вакцины как многообещающее средство профилактики и контроля инфекционного заболевания.
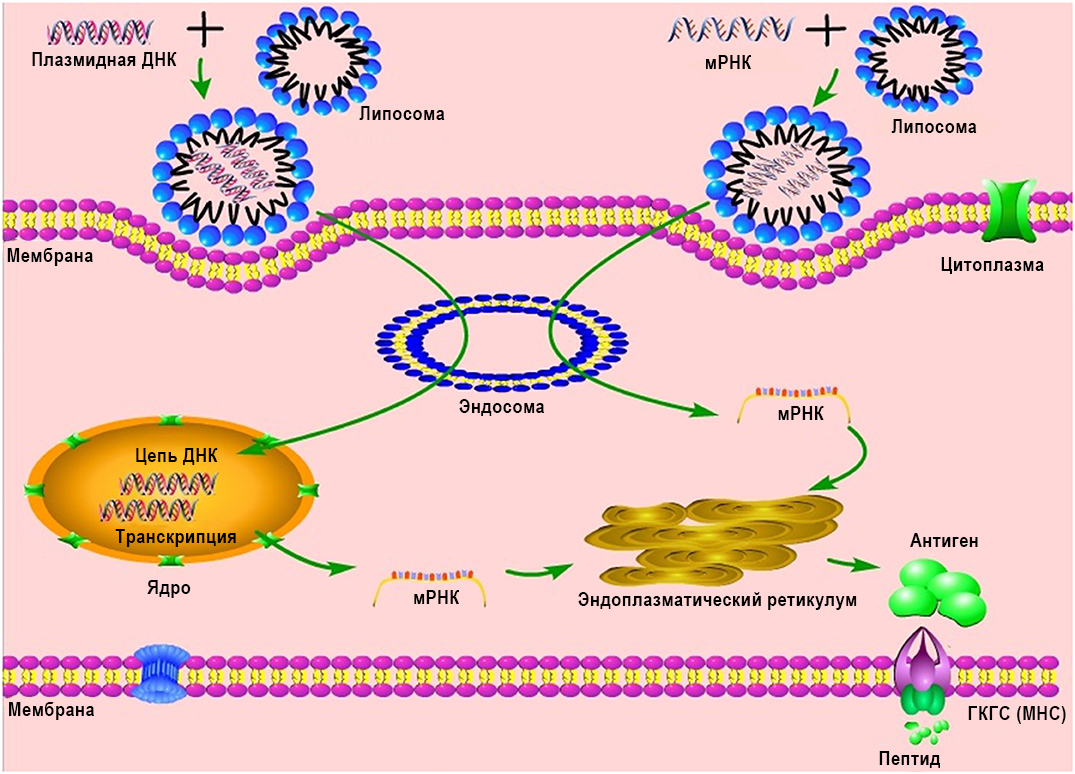
Рисунок 1. Механизмы различных НК-вакцин (в том числе РНК и ДНК). ГКГС - главный комплекс гистосовместимости
Таблица 1. Преимущества и недостатки вирусных вакцин, ДНК- и РНК-вакцин
Концепция и виды мРНК-вакцин
Впервые о том, что мРНК-вакцины эффективны для прямого переноса генов, сообщили Woff и соавт. [15]. В настоящее время разработаны два вида мРНК-вакцин: обычные мРНК-вакцины и самоамплифицирующиеся мРНК-вакцины, полученные из положительной цепи РНК вирусов. Хотя мРНК-вакцины впервые испытывались в начале 1990-х гг., сперва они не применялись широко по причине опасений, связанных с их ненадежной стабильностью, обусловленной повсеместным присутствием рибонуклеаз, а также из-за малых масштабов производства. Ross и соавт. в 1995 г. впервые продемонстрировали, что стабильность мРНК может быть повышена путем оптимизации и подбора состава препарата [25]. С этого момента начался быстрый прогресс в исследованиях мРНК-вакцин, в настоящее мРНК можно производить синтетическим путем посредством внеклеточной реакции ферментативной транскрипции. Реакция транскрипции in vitro включает в качестве основных компонентов линеаризованную плазмидную ДНК, кодирующую мРНК-вакцину, в качестве шаблона, рекомбинантную РНК-полимеразу и нуклеозидтрифосфаты. Кэп-структура ферментативно добавляется к продукту транскрипции в конце реакции, или как синтетический аналог кэпа при одноэтапной процедуре. В завершение получают поли(А)-хвост для образования зрелой мРНК-последовательности.
Обычные мРНК-вакцины включают в самом простом своем варианте открытую рамку считывания для целевого антигена, защищенную по краям нетранскрибируемыми участками (UTRs), а также с концевым поли(А)-хвостом. После трансфекции они управляют транзиторной экспрессией антигена. Дополнительно к обычным вакцинам существует другая основа мРНК-вакцин, базирующаяся на геноме положительной цепи вирусов, обычно альфа-вирусов. Эти мРНК-вакцины основаны на сконструированном вирусном геноме, содержащем гены, кодирующие механизм репликации РНК, тогда как последовательности структурных белков заменены представляющим интерес геном (GoI), полученные в результате геномы называют репликонами. Эти вакцины получили название самоамплифицирующихся мРНК-вакцин, и их саморепликацией можно управлять посредством синтеза РНК-зависимого РНК-полимеразного комплекса, генерирующего множество копий антиген-кодирующей мРНК, и они экспрессируют высокие уровни гетерологичного гена при введении в цитоплазму клетки хозяина, имитируя продукцию антигенов in vivo вирусными патогенами, запуская как гуморальный, так и клеточный иммунный ответ [22-27]. Самоамплифицирующиеся мРНК-вакцины могут быть получены из сконструированных геномов вируса Синдбис, вируса леса Семлики, вируса Кунджин и других [28-30]. Самоамплифицирующиеся мРНК (~9-11 т.п.н.) получают из матричной ДНК при помощи процедур, похожих на описанные ранее для обычных молекул мРНК и РНК, которые можно получать в большом масштабе in vitro. После того, как очищенный РНК-репликон доставлен в клетку хозяина, либо в виде частиц вируса, либо в виде синтетически сконструированной РНК, он широко транслируется и амплифицируется путем кодирования РНК-зависимой РНК-полимеразой. Опубликованные результаты показали, что, по сравнению с быстрой экспрессией обычных мРНК, вакцинация самоамплифицирующимися мРНК-вакцинами дает более высокие уровни экспрессии антигена, хотя и позже по времени, in vivo задержка достигает нескольких дней. Эквивалентная защита достигается, однако, при гораздо меньшей дозе РНК [31]. Из-за нехватки вирусных структурных белков репликон не производит инфекционных частиц вируса. Кроме того, как обычная мРНК, так и самоамплифицирующиеся мРНК, не могут встраиваться в геном хозяина и естественным образом разлагаются в процессе экспрессии антигенов. Эти характеристики показывают, что мРНК-вакцины способны стать намного безопаснее других вакцин, а также являются многообещающей платформой для вакцинации.
Сконструированная мРНК с потенциальной эффективностью
Стабильность и трансляция мРНК имеют решающее значение для создания успешной РНК-вакцины [32, 33]. В процессе трансляции чистота мРНК определяет ее стабильность и выход белка [34]. Загрязнение дцРНК, получающимися из-за побочной полимеразной активности РНК, приводит к ингибированию трансляции и к деградации клеточной мРНК и рибосомной РНК, тем самым снижая экспрессию белка из-за прерывания механизма трансляции. Удаление дцРНК может значительно увеличить трансляцию [35]. Избыток компонентов, а также короткие и двухцепочечные РНК (дцРНК), могут быть удалены очисткой. Изначально для этой цели использовался хлорид лития (LiCl), однако его применение ограничено переходом на промышленное производство мРНК-вакцин, кроме того, он не удаляет дцРНК. Для удаления любых оставшихся продуктов при производстве мРНК в большом масштабе, а также для реализации процессов согласно правилам организации производства и контроля качества лекарственных средств, может быть использована очистка при помощи жидкостной экспресс-хроматографии белков или высокоэффективной жидкостной хроматографии (ВЭЖХ) [35-37]. Некодирующие 5′-фланкирующие и 3′-концевые последовательности открытой рамки считывания имеют определяющее значение для трансляции. 5′-нетранслируемая область, такая как последовательность Козака, или 5′-кэпы необходимы для эффективного продуцирования белка [38-40]. 3′-нетранслируемая область, содержащая оптимальный поли(А)-сигнал, определяла стабильность мРНК и увеличивала трансляцию белка [41-45]. Дополнительно, кодон оптимизации является популярным методом для того, чтобы избежать редких кодонов с низким коэффициентом использования, для увеличения продуцирования белка, содержания мРНК и стабильности [46-49].
мРНК вакцины эффективны при экспрессии антигена, но последовательность и вторичные структуры, образуемые мРНК, распознаются рядом естественных иммунных рецепторов, и это распознавание может подавлять трансляцию белка. Благодаря развитию понимания биологии РНК появилось несколько методов, которые могут использоваться для увеличения эффективности мРНК-вакцин, включая оптимизацию последовательности и применение модифицированных нуклеозидов. Распознавания естественными иммунными сенсорами можно избежать путем введения модифицированных нуклеозидов, таких как псевдоуридин (Ψ), 5-метилцитидин (5 mC), в структуру кэп-1 и оптимизированные кодоны, которые, в свою очередь, улучшают эффективность трансляции [50-55]. В течение транскрипции мРНК in vitro незрелая мРНК может образовываться как примесь, ингибирующая трансляцию путем стимулирования естественной иммунной активации. Очистка при помощи жидкостной экспресс-хроматографии белков и ВЭЖХ разрешает эту проблему [35, 37].
В настоящее время большинство применяемых вакцин, за исключением некоторых вакцин для животных, требуют транспортировки и хранения в условиях непрерывной холодовой цепи, которая легко нарушается, особенно в бедных сельскохозяйственных регионах тропических стран; этим требованиям не отвечают доступные эффективные вакцины для профилактики и контроля инфекционных заболеваний. По этой причине разработка термостойких вакцин представляет большой интерес.
Оптимизация состава синтетических мРНК-вакцин показала, что получить термостабильные вакцины можно. Результаты, представленные Jones, показали, что сублимированная мРНК с трегалозой или депротеинизированная мРНК стабильна по меньшей мере в течение 10 мес. при температуре 4 0С. После трансфицирования эти мРНК экспрессировали высокие уровни белков и обеспечивали высокоэффективный и длительный иммунитет на новорожденных и пожилых животных моделях [56]. Другая лиофилизированная мРНК-вакцина продемонстрировала стабильность при температуре 5-25 0С в течение 36 месяцев и при 40 0С в течение 6 месяцев [57]. Stitz и соавт. показали, что когда протамин-инкапсулированная вакцина от вируса бешенства на основе обычной мРНК была подвергнута колебаниям температуры в интервале от 4 до 56 0С в течение 20 циклов и действию температуры 70 0С, ее иммуногенность и защитное действие не пострадали [58]. Инкапсулирование мРНК в катионную липосому или проникающий пептид (CPP) предохраняло мРНК от разложения рибонуклеазой. Эти интересные применения будут обсуждаться в разделе, посвященном методам доставки.
РНК-вакцины для профилактики инфекционных заболеваний
На протяжении последних двух десятилетий широко исследовались мРНК-вакцины для профилактики инфекционных заболеваний, а также для профилактики и лечения рака. К настоящему моменту достигнуты значительные успехи [19, 20]. Были созданы мРНК-вакцины от рака, предназначенные для экспрессии опухоль-ассоциированных антигенов, которые стимулируют клеточно-опосредованный иммунный ответ с целью уничтожения или подавления раковых клеток [59]. Большинство изученных вакцин от рака являются в большей степени терапевтическими, чем профилактическими, и они рассмотрены в ряде источников [20, 60, 61]. мРНК-вакцины против инфекционных заболеваний могут быть профилактическими и терапевтическими. мРНК-вакцины, экспрессирующие антиген инфекционного патогена, вызывают сильный Т-клеточный и гуморальный иммунный ответ [8, 16, 19]. Как описано выше, процесс производства мРНК-вакцин полностью внеклеточный, простой и быстрый по сравнению с получением целых микробных, живых аттенуированных или субъединичных вакцин. Этот быстрый и простой процесс производства делает мРНК многообещающим биопродуктом, который может удовлетворить потребность в вакцинах против новыхинфекционных заболеваний. Производство РНК в широком масштабе, удовлетворяющим нужды промышленного производства, – это первый шаг к созданию мРНК-вакцин. В настоящее время все компоненты, необходимые для производства мРНК, доступны, и их качество соответствует стандартам GMP; однако некоторые компоненты поставляются в ограниченном количестве. На первом этапе было проведено большое количество исследований по разработке мРНК-вакцин против рака, и они показали осуществимость производства транскрибированной in vitro РНК для клинического применения [60]. Было проведено несколько проектов по мРНК-вакцинам против инфекционных заболеваний, хотя клиническая оценка все еще остается ограниченной. Например, несколько платформ для вакцин на основе РНК были использованы для разработки вакцин против гриппа. Некоторые опубликованные результаты показали, что вакцины против гриппа на основе РНК вызывают широкий защитный иммунный ответ не только против гомологичных, но и против гетеро-субтипических вирусов гриппа [62-66]. мРНК-вакцины против гриппа дают большие надежды, поскольку они сделаны на платформе без использования куриных эмбрионов, и лидируют по производству антигена в клетках млекопитающих. Недавно опубликованные результаты демонстрируют, что потеря центра гликозилирования из-за мутации в гемаггютинине (HA) адаптированной к куриному эмбриону штамму вакцины против H3N2 приводило к слабой нейтрализации циркулирующих варусов H3N2 у вакцинированных людей и хорьков. Напротив, процесс производства мРНК-вакцины осуществляется без использования куриных эмбрионов, и кодируемые мРНК белки имеют нужную структуру и гликозилированы в клетках хозяина после вакцинации, что, таким образом, устраняет риск производства неправильных антигенов [67, 68].
мРНК также используется в ветеринарии для профилактики инфекционных заболеваний у животных. Pulido и соавт. показали, что иммунизация при помощи транскрибированной in vitro мРНК обеспечивала у мышей защиту против энтеровирусного везикулярного стоматита [69]. Saxena и соавт. продемонстрировали, что самоамплифицирующаяся мРНК-вакцина, кодирующая гликопротеин вируса бешенства, вызвала иммунный ответ и обеспечила защиту у мышей, и потенциально может использоваться для профилактики бешенства у собак [70]. Недавно VanBlargan и соавт. разработали инкапсулированную в липидные наночастицы (ЛНЧ) модифицированную мРНК-вакцину, кодирующую гены prM и E вируса Повассан (POWV). Эта мРНК-вакцина вызывала сильный гуморальный иммунный ответ не только против штаммов POWV, но и против эволюционно далекого вируса Лангат [71]. Как описано ранее, модификация нуклеозидов и оптимизация кодонов может помочь избежать распознавания естественными иммунными сенсорами и улучшить эффективность трансляции. В Таблице 2 приведены данные исследований, проведенные на мРНК-вакцинах против инфекционных заболеваний, полученных с использованием модифицированных и не модифицированных нуклеозидов [52, 58, 72-78].
Таблица 2. Нуклеозид-модифицированные или немодифицированные мРНК-вакцины против инфекционных заболеваний.
Кроме использования в качестве вакцины, мРНК может применяться в терапевтических целях. Интересно, что недавняя публикация Pardi и соавт. показала, что применение мРНК, кодирующей легкие и тяжелые цепи нейтрализующего антитела широкого спектра действия против ВИЧ, инкапсулированной в липидные наночастицы (ЛНЧ), защищало гуманизированных мышей от внутривенно введенного ВИЧ [79]. Эти данные предполагают, что использование мРНК с модифицированными нуклеозидами может быть расширено на пассивную иммунотерапию против ВИЧ, цитомегаловируса (ЦМВ), вируса папилломы человека и т. д. Самоамплифицирующиеся мРНК-вакцины способны обеспечивать раннюю экспрессию антигенов и вызывать Т-клеточный иммунный ответ. В таблице 3 мы собрали публикации, посвященные самоамплифицирующимся мРНК-вакцинам против инфекционных заболеваний, доставляемых в виде частиц вирусных репликонов или в виде синтетических мРНК [80, 82-85, 87, 91, 92].
Таблица 3. Самоамплифицирующиеся мРНК-вакцины против инфекционных заболеваний
Путь доставки и состав мРНК-вакцин
Путь введения и рецептура мРНК-вакцин имеют решающее значение для определения кинетики и величины экспрессии антигена, а также силы иммунного ответа. Например, внутривенное введение немодифицированной депротеинизированной мРНК приводило к быстрому ее расщеплению рибонуклеазами и стимулированию естественного иммунного ответа, но эти ограничения могут быть преодолены при помощи подходящих систем доставки и модификации мРНК [93]. мРНК-вакцины применяют системным или локальным методом, основанном на требованиях к локализации экспрессии антигена. Прямая внутримышечная (в/м), внутрикожная (в/к) или подкожная инъекция транскрибированной in vitro мРНК — это основные пути доставки для мРНК-вакцин против инфекционных заболеваний, тогда как внутрибрюшинное (в/б) и внутривенное (в/в) применение используются тогда, когда требуется системная экспрессия нужных антигенов, главным образом при терапевтическом применении. В недавнее время было опубликовано большое количество работ, где показано, что разнообразные антигены могут быть экспрессированы с высокой эффективностью и вызывать сильный гуморальный и клеточный иммунный ответ после вакцинации с использованием мРНК. Например, для исследования влияния пути введения на кинетику экспрессии антигена использовались липидные наночастицы (ЛНЧ), заполненные обычной мРНК с модифицированными нуклеозидами, кодирующей люциферазу светлячка [94]. В/м и в/к введение обеспечивало наилучший уровень и длительность эффекта, продукция белка достигала максимума через 4 часа и поддерживалась локально в течение 8-10 дней посте инъекции, в зависимости от дозы. Как в/м, так и в/к введение макакам-резусам обычной мРНК с модифицированными нуклеозидами, кодирующей грипп H10, инкапсулированной в ЛНЧ, вызывало защитный титр, но этот ответ быстрее достигался при внутрикожном введении, чем при внутримышечном [95].
CV7201 это кандидат в мРНК-вакцины, находящийся в стадии исследований в CureVac AG. в/м и в/к введение CV7201 у мышей и свиней вызывало сильный гуморальный и Т-клеточный иммунный ответ [77]. В фазе I клинических испытаний CV7201 продемонстрирована долгосрочную безопасность и иммуногенность против вируса бешенства при низкой дозе. Относительно безопасности, не наблюдалось никаких отличий между в/м и в/к введением или между использованием шприц-ручки или безыгольной инъекции CV7201. Однако, когда были оценены титры нейтрализующего антитела, индуцированного CV7201, безыгольная инъекция оказалась предпочтительнее использования шприц-ручки [57]. При испытании вакцины против гриппа введение внутрь лимфоузла (в/у) депротеинизированной мРНК вызывало сильный CD4 и CD8 Т-клеточный иммунный ответ у мышей, и повторение в/у инъекции модифицированной мРНК приводило к примированию антиген-специфичных CD4 и CD8 Т-клеток, тогда как подкожное в/к введение не приводило [96]. Сочетание двух и более способов доставки исследовалось и применялось при разработке противораковой мРНК-вакцины. Сочетание в/в и в/к инъекций TriMix-DC-MEL продемонстрировало благоприятный долгосрочный результат у пациентов с широким CD8 и CD4 Т-клеточным иммунным ответом [97]. Дальнейшие исследования показали, что в/у и внутриопухолевое введение TriMix мРНК в дендритные клетки давало лучший терапевтический долгосрочный результат, чем введение в другие места [98, 99]. Однако, в/к введение РНК-активных вакцин показало иммунный ответ, близкий к достигаемому при в/у применении обычных мРНК-вакцин, что является противоречивым результатом [100]. В общей сложности, эти результаты подчеркивают важность пути доставки для эффективности мРНК-вакцин.
Аналогично, Fleeton и соавт. показали, что в/м инъекция транскрибированнной in vitro депротеинизированной самоамплифицируемой мРНК-вакцины на основе генома вируса леса Семлики может вызывать защитный иммунный ответ [62]. Geall и соавт. показали, что в/м введение у мышей и хлопковых хомяков очень низкой дозы самоамплифицирующейся мРНК, кодирующей F-белок респираторно-синцитиального вируса (RSV), инкапсулированной в синтетические ЛНЧ, приводило к очень высоким титрам IgG1 и интерферон (IFN)-продуцирующих CD4 и CD8 Т-клеток [22].
Инструменты для доставки столь же важны для эффективности мРНК-вакцин. В идеале система доставки должна защищать РНК от возможного разложения рибонуклеазой и обеспечивать эффективное поглощение клеткой-мишенью, легкое высвобождение РНК из системы и выход из эндосомы. Преодоление барьера цитоплазматической мембраны и избежание разложения рибонуклеазами – это начальные шаги к эффективной доставке РНК в клетку-мишень. Конечные важные требования к оптимальной системе доставки это отсутствие как токсичности, так и стимуляции иммунитета. На начальных этапах синтезированная in vitro мРНК напрямую вводилась животным с помощью инъекций. Позже подтвердилось, что мРНК-вакцины, помещенные в липосомы, вызывают вирус-специфичный противогриппозный цитотоксический Т-лимфоцитарный (CTL) иммунный ответ у мышей [72]. Несколько методов использовались для увеличения эффективности доставки, и очень большой прогресс был достигнут в области конструирования РНК-вакцин с системой доставки [101-103]. Дополнительно к физическим методам генной пушки и электропорации, мРНК-вакцины доставляли в цитоплазму при помощи катионных липидов и полимеров. Было также показано, что мРНК в виде катионной наноэмульсии тоже вызывает сильный иммунный ответ [8, 23, 85]. Однако, некоторые из этих систем доставки продемонстрировали токсичность in vivo, что ограничивает их применение у людей [104]. Новые платформы для использования в качестве средств транспорта для мРНК-вакцин были разработаны с целью избежать ограничения из-за токсичных агентов химической трансфекции. Большинство этих платформ использовали ЛНЧ на основе катионного липида или липидных полимеров. ЛНЧ облегчают доставку РНК и сильно увеличивают экспрессию антигена. Некоторые группы использовали липиды или полимеры в качестве платформ для доставки мРНК-вакцин против ВИЧ-1 подкожным способом, что эффективно вызывало ВИЧ-специфичный CD4 и CD8 Т-клеточный ответ, или интраназальным способом, что вызывало антиген-специфичный иммунный ответ [73, 105, 106]. мРНК участка гена вируса гриппа HA, инкапсулированная в липид, также была изучена, и было показано, что однократное введение вызывает активацию Т-клеток [107]. Сочетание ЛНЧ-технологии с модификацией нуклеозидов увеличивает эффективность мРНК-вакцин. Модифицированная мРНК вируса гриппа HA из H10N8 и H7N9, помещенная в ЛНЧ, вызывала сильный защитный иммунный ответ у мышей, хорьков и яванских макак [108].
Другая цель, против которой ЛНЧ-доставка мРНК показала очень высокий потенциал, это вирус Зика. Не существует вакцины, способной предотвратить это переносимое комарами заболевание, и недавняя эпидемия вызвала беспокойство во всем мире. Richner и соавт. сообщили, что две вакцины с модифицированной мРНК, кодирующей редактированный prM-E-ген или ген дикого типа, инкапсулированной в ЛНЧ, вызывали высокий порядок титра нейтрализующего антитела [57, 109].
Вакцины на основе модифицированной мРНК, созданные с использованием ЛНЧ, также обеспечивали сильный иммунный ответ и защищали морских свинок от заболевания, вызываемого вирусом Эбола [52]. Внутривенное введение модифицированной мРНК, инкапсулированной в ЛНЧ, продемонстрировала максимальную экспрессию белков через 6 часов после введения [110]. Как в/к, так и в/м введение нерепликационной мРНК, кодирующей вирус гриппа H10, инкапсулированной в ЛНЧ, давало высокие защитные титры, но этот ответ наступал быстрее при в/к введении по сравнению с в/м Введением [95].
ЛНЧ являются популярным средством доставки для вакцин на основе самоамплифицирующейся мРНК. Множество исследований показали, что самоамплифицирующаяся мРНК, инкапсулированная в ЛНЧ, вызывала сильный клеточный и гуморальный иммунный ответ при разных путях введения [19, 107, 111]. Самоамплифицирующиеся мРНК-вакцины с ЛНЧ в составе, кодирующие антигены вируса гриппа, приводили к сильному Т- и В-клеточному иммунному ответу и обеспечивали защиту против заражения гомологичным и гетерогогичным вирусами гриппа [63, 65, 112].
Проникающие пептиды (CPP), вид катионных пептидов, представляют собой многообещающий инструмент для доставки мРНК к внутриклеточным целям. Протамин – это обогащенный аргинином катионный пептид, который может связываться с мРНК и транспортировать ее в цитоплазму. Протамин широко изучался в качестве системы доставки для мРНК-вакцин против рака и вирусов. С применением протамина была создана платформа для самоамплифицирующейся вакцины на основе активированной мРНК, и были продемонстрированы ее возможности против различных инфекционных заболеваний и рака [76, 77, 100]. Недавно Coolen и соавт. сконструировали инновационную платформу для доставки, состоящую из полимолочной кислоты и катионных проникающих пептидов в качестве агента, конденсирующего мРНК. Эти нанокомплексы были поглощены дендритными клетками, и это вызвало сильную экспрессию белков и естественный иммунный ответ [113].
Самоамплифицирующаяся мРНК, кодирующая HA [A/California/ 07/2009(H1N1)], инкапсулированная в наноэмульсию масло-в-воде, стимулировала защиту против гомологичного и гетерологичного вируса гриппа [65]. Использование полиэтиленимина (PEI) в составе с самоамплифицирующейся мРНК, кодирующей H1N1/PR8-HA, приводило к значительно более высокому титру антитела и к более длительной устойчивой экспрессии антигена, чем применение просто самоамплифицирующейся мРНК [31, 114]. Хитозан и PEI использовались для доставки самоамплифицирующейся мРНК и в виде наночастиц [114, 115]. Chahal и соавт. разработали интересную платформу, состоящую из химически модифицированной дендримерной наночастицы, конденсирующей самоамплифицирующуюся мРНК, кодирующую грипп HA. Однократная иммунизация мышей вызывала сильный CD8+ Т-клеточный и гуморальный ответ и защищала мышей против заражения широким спектром летальных патогенов, включая грипп H1N1, Toxoplasma gondii и вирус Эбола [64].
В настоящее время исследуются и другие новые наночастицы, такие как полиплексы, наноплексы, а также доставка с помощью пористых каркасных полимеров [116-122]. Хотя в области разработки средств доставки достигнуты очень большие успехи, возможно, идеальной платформой будет сочетание различных средств доставки мРНК, а также потребуются еще большие усилия в направлении понимания механизма действия.
Механизм иммунного ответа, вызванного мРНК-вакцинами
Механизм иммунного ответа, вызванного мРНК, требует изучения. Процесс распознавания мРНК-вакцины клеточными сенсорами и механизм активации сенсоров все еще остается невыясненным. Внутри клеток обнаружены два типа РНК-сенсоров, эндосомальные толл-подобные рецепторы (TLR) и семейство RIG-I-подобных рецепторов. Первая группа подразделяется на TLR-3, TLR-7, TLR-8 и TLR-9, которые расположены в эндосомальном компартменте специальзированных клеток иммунного надзора, таких как дендритные клетки (ДК), макрофаги и моноциты. TLR-3 распознают дцРНК длиной более 45 пар оснований, а также дцРНК, получающуюся из одноцепочечной РНК (оцРНК), образующей вторичные структуры, или полученную из промежуточных продуктов репликации вируса. TLR-7 и TLR-8 активируются РНК, богатыми полиуридинами, гуанозинами и/или уридинами. TLR-7 могут связывать как дцРНК, так и оцРНК, тогда как TLR-8 распознает только оцРНК [123]. Активация TLR-7 может увеличивать презентацию антигена, способствовать выработке цитокина и стимулировать В-клеточный ответ [124]. Последнее семейство, действуя как паттерн-распознающий рецептор (PRR), включает в себя RIG-I, MDA5 и LGP2 [125]. RIG-I преимущественно распознает оцРНК и дцРНК, несущие 5'-трифосфат, и стимулирует продукцию интерферона [126-130]. Структура "сковорода с ручкой" в участках генома вируса была непосредственно вовлечена в индукцию интерферона через активацию RIG-I [131]. MDA5 представляет собой другой цитозольный РНК-сенсор, который обнаруживает длинную дцРНК, полученную во время репликации РНК-содержащего вируса [132], а также РНК синтетического происхождения, включая сополимер полиинозиновой и полицитидиловой кислот. Распознавание при помощи дцРНК вызывает активацию IRF3 и NF-κB, впоследствии приводящую к увеличению продукции интерферона I типа [127, 133, 134]. Иногда элементы дцРНК, распознанные сенсорами паттерн-распознающего рецептора, могут действовать как адъювант при индукции интерферона [135-137]. мРНК-вакцины могут стимулировать естественный иммунитет через TLR-3, TLR-7, TLR-8, RIG-I b MDA5 [138, 139]. Индукция интерферона, вызванная мРНК-вакцинами через РНК-сенсоры, зависит от качества транскрибированной in vitro мРНК, системы доставки и способа применения. мРНК, воспринимаемая естественной иммунной системой, это обоюдоострое оружие при элиминации поступающих молекул. Природная экзогенная мРНК стимулирует сильную индукцию интерферонов типа I и сильных воспалительных цитокинов, которые вызывают Т- и В-иммунный ответ, но могут отрицательно сказаться на экспрессии антигенов [140-143]. Интересно, что Blanchard и соавт. разработали метод измерения активации паттерн-распознающего рецептора IVT мРНК в клетках и в срезе ткани. В этом подходе использовались методы близкого лигирования (PLA) [144].
В/к вакцинация с использованием технологий вакцин на основе активной РНК, разработанных CureVac AG, вызывала сильный иммунный ответ, который зависел от TLR-7-сигнала. Активация TLR-7 приводит к повышению экспрессии хемокинов, которые в свою очередь привлекают к месту инфицирования естественные иммунные клетки, такие как ДК и макрофаги [100]. В месте инфицирования наблюдалась активация провоспалительных цитокинов, таких как ФНО-α и ИЛ-6, которые, как известно, вносят вклад в привлечение иммунных клеток [145].
С другой стороны, раннее прекращение экспрессии антигена после вакцинации мРНК из-за активации PRR должно быть неблагоприятно.
Соответственно экспрессия антигена, гуморальный и Т-клеточный ответ на вакцинацию мРНК, как при применении обычной, так и самоамплифицирующейся мРНК, были значительно увеличены у мышей IFNAR1/2 −/− [105, 146] или при совместном применении антагониста интерферона [147]. Отрицательное воздействие избыточной активации интерферона может возникать не только из-за предотвращения амплификации РНК (в случае самоамплифицирующихся мРНК-вакцин) и экспрессии, но и от уровня Т-клеток. Поскольку интерферон типа I может определять дифференциацию антиген-примированых CD8+ Т-клеток в цитотоксические эффекторы, они могут также способствовать истощению Т-клеток [140]. Будет ли интерферон типа I подавлять или стимулировать CD8 Т-клеточный ответ на мРНК-вакцины, должно зависеть от времени и интенсивности индуцированного интерферона типа I [140]. Ингибирование Т-клеток превалирует, если включение рецепторов интерферона типа I опережает включение рецепторов Т-клеток.
Модифицированная мРНК с псевдоуридинами и мРНК, очищенная методом ВЭЖХ, могут уменьшить иммунную активацию и увеличить стабильность и экспрессию антигена [35, 148, 149]. Например, в/б инъекция мРНК, содержащей псевдоуридины, вызывала экспрессию антигенов без индукции цитокинов у мышей [150]. Кроме этого, в некоторых публикациях было показано, что чистота и системы доставки влияют на иммунный ответ, вызываемый мРНК [35]. Недавние исследования показали, что модифицированная мРНК, инкапсулированная в ЛНЧ, оказывает эффект адъюванта и вызывает сильный ответ фолликулярных Т-хелперов, а также большое количество зародышевых центров В-клеток с долгоживущими высокоаффинными нейтрализующими антителами [78].
Созревание дендритных клеток оказывает определяющее действие на эффективность вакцин на основе мРНК. В общем случае, TRL-7 экспрессировался у людей в плазмацитоидных дендритных клетках (рДК) и В-клетках, а TLR-8 экспрессировался в обычных дендритных клетках (оДК), моноцитах и макрофагах. оДК составляют основную резидентную популяцию ДК в нормальной дерме человека и характеризуются экспрессией CD1c (также известной как антиген дендритных клеток крови-1 (BDCA-1)), тогда как плазмацитоидные ДК присутствуют в кожном покрове [129, 151, 152]. Расположение TLR-7 и TLR-8 в различных подпопуляциях ДК и расположение ДК в различных органах может прояснить взаимосвязь между иммунной эффективностью и способом применения, а также составом мРНК-вакцин. Замещение модифицированных нуклеотидов в мРНК уменьшало активацию за счет связывания мРНК с PRR и снижало естественный иммунный ответ [153]. мРНК-вакцины не только стимулировали специфический гуморальный иммунный ответ посредством транслированного антигена, но также и антиген-специфический Т-клеточный ответ. Способ применения и состав вакцины определяют пик экспрессии антигена, и это другой путь моделирования иммунного ответа [94, 154, 155]. Liang и соавт. показали, что кинетики клеточной инфильтрации при в/м и в/к введении в NHP очень близки [156]. В/к-группа продемонстрировала более сильный начальный ответ, вероятно, по причине быстрых нацеливания, активации и транспорта к dLN дендритных клеток кожи. Кроме того, на мышах наблюдалось, что только моноциты кожи и ДК продемонстрировали признаки трансляции антигена на 9-й день, что указывает на прологированную доступность антигена после в/к-доставки и подтверждает более длительную экспрессию кодируемого мРНК антигена [94].
Лучшее понимание последовательности событий, приводящих к трансляции мРНК и активации иммунитета может помочь конструировать мРНК-вакцины, обеспечивающие правильный баланс индукции интерферона типа I, положительно влияющий на результат вакцинирования.
Клинические испытания
По сравнению с профилактическим и терапевтическим применением мРНК при раке, клинические испытания мРНК-вакцин против инфекционных заболеваний все еще находятся на раннем этапе. Пилотные клинические испытания с ДК, трансфицированными мРНК, кодирующей различные антигены ВИЧ-1, клеточные молекулы, или антиген pp65 цитомегаловируса человека показали, что мРНК-вакцины безопасны и могут вызывать антиген-специфичный CD4+ и CD8+ Т-клеточный иммунный ответ, однако, уменьшения вирусной нагрузки не наблюдалось [108].
В недавних клинических испытаниях протамин-связанной мРНК-вакцины против вируса бешенства были получены результаты, показавшие, что РНК, связанная в комплекс с протамином, безопасна и хорошо переносится in vivo, но эффективность сильно зависит от дозы и пути применения. Эффективность применения с помощью безыгольного устройства была намного выше, чем при прямой инъекции [57, 161]. Результаты фазы I показали, что ЛНЧ с модифицированной мРНК-вакциной против H10N8 вызывали сильный гуморальный иммунный ответ у добровольцев при легкой или умеренной нежелательной лекарственной реакции [108].
Перспективы вакцин на основе РНК
Множество публикаций показали, что вакцины на основе мРНК представляют собой многообещающую платформу, которая является гибкой, масштабируемой, недорогой и не нуждающейся в холодовой цепи. Что еще более важно, вакцины на основе мРНК могут удовлетворить потребность в эффективных вакцинах против новых инфекционных заболеваний. В рамках множества доклинических и клинических проектов были достигнуты большие успехи в направлении возможного применения мРНК-вакцин, и было сделано предположение, что профилактика и терапия на основе мРНК может применяться и у человека. Несмотря на то, что при медицинском применении величина ответа была меньше, чем предсказывалось по животным моделям, результаты пилотных клинических испытаний показали хорошую переносимость и то, что мРНК-вакцинация может вызывать антиген-специфичный Т- и В-клеточный иммунный ответ [57, 108]. Поэтому мРНК все также подает большие надежды, но для полноценной разработки мРНК-вакцин необходимо дальнейшее изучение механизма действия и возможностей. Для создания применимых мРНК-вакцин и уменьшения дозы необходим поиск новых стратегий. Как сказано выше, молекулярный механизм естественного иммунного ответа, стимулированного мРНК через PAMP-распознавание, остается неясным. Сделаны большие усилия в направлении улучшения стабильности и эффективности мРНК-вакцины доставки in vivo, включая введение 5'- и 3'-конечных нетранслируемых областей и химически модифицированных нуклеозидов [162-164]. Исследование показало, что удаление примесей дцРНК методом ВЭЖХ-очистки транскрибированной in vitro мРНК продляло трансляцию [35]. Исследование продемонстрировало, что модифицированный нуклеозид уменьшает естественный иммунный ответ и увеличивает экспрессию белка. Оптимизация 5'-нетранслируемой области мРНК, вторичные структуры которой могут распознаваться клеточно-специфичными РНК-связывающими белками или молекулами PAMP, может максимизировать трансляционный выход мРНК при терапии или вакцинации [43, 165]. Однако, неправильное введение модифицированных нуклеозидов может оказывать отрицательное влияние на продукты транскрипции и увеличивать затраты.
Основываясь на результатах вышеописанных исследований, могут быть достигнуты лучшее понимание механизма действия мРНК-вакцин, определение и разработка новых систем доставки и улучшение дизайна мРНК-вакцины [166].
мРНК-вакцины имеют огромный потенциал и предполагают преимущества по сравнению с обычными вакцинами. Растущий массив доклинических и клинических результатов показывает, что профилактика и терапия с использованием мРНК может быть полезной для предотвращения инфекционных заболеваний и для лечения опухолей, а также то, что мРНК-вакцины безопасны и переносимы животными и человеком. Кроме того, будущие усовершенствования должны повысить антиген-специфичный иммунный ответ и величину памяти ответа иммунных клеток, включая память В- и Т-клеточных ответов. Хотя технология мРНК-вакцин не очень широко испытывается на людях, в последнее время появились публикации о доклинических и ранних клинических испытаниях, в которых сообщается о перспективных результатах. Это побудило биокомпании заняться коммерческой разработкой мРНК-вакцин [167, 168]. Несколько частных фондов и организаций поддержали исследование и разработку мРНК-вакцин [169, 170]. Несмотря на необходимость дальнейшей оптимизации процесса производства мРНК-вакцин, эти процессы, мы надеемся, будут упрощены с тем, чтобы начать крупномасштабное производство. Применение мРНК-вакцин у человека и животных — всего лишь вопрос времени.
Финансирование
Priority Academic Talent Team Cultivation Program of Shandong Colleges and Universities, Talent Program of Qingdao Agricultural University. The National Thirteen-Five Key research and development program of China (2017YFD0500805).
Кофликт интересов
Giulietta Maruggi - работник GSK, Rockville, MD, США. Остальные авторы заявляют об отсутствии КИ.
Благодарность
Мы приносим свои извинения за то, что не включили все публикации наших коллег.
Литература
1. Lents MP, Barbosa LP, Santana ALA, Pinheiro EEG, Mugabe LC, Biscarde CEA, et al. Immunocastration of goats using anti-gonadotrophin releasing hormone vaccine. Theriogenology. (2018) 114:7–13. doi: 10.1016/j.theriogenology.2018.03.013
2. Cuzick J. Preventive therapy for cancer. Lancet Oncol. (2017) 18:e472–e482. doi: 10.1016/S1470-2045(17)30536-3
3. Scheiblhofer S, Thalhamer J, Weiss R. DNA and mRNA vaccination against allergies. Pediatr Allergy Immunol. (2018) 29:679–88. doi: 10.1111/pai.12964
4. Li B, Fang L, Xu Z, Liu S, Gao J, Jiang Y, et al. Recombination in vaccine and circulating strains of porcine reproductive and respiratory syndrome viruses. Emerg Infect Dis. (2009) 15:2032–5. doi: 10.3201/eid1512.090390
| CrossRef Full Text | Google Scholar5. Zhou B, Meliopoulos VA, Wang W, Lin X, Stucker KM, Halpin RA, et al. Wentworth. reversion of cold-adapted live attenuated influenza vaccine into a pathogenic virus. J Virol. (2016) 90:8454–63. doi: 10.1128/JVI.00163-16
6. Baitsch L, Baumgaertner P, Devevre E, Raghav SK, Legat A, Barba L, et al. Exhaustion of tumor-specific CD8(+) T cells in metastases from melanoma patients. J Clin Invest. (2011) 121:2350–60. doi: 10.1172/JCI46102
7. Li J, Arevalo MT, Chen Y, Chen S, Zeng M. T-cell-mediated cross-strain protective immunity elicited by prime-boost vaccination with a live attenuated influenza vaccine. Int J Infect Dis. (2014) 27:37–43. doi: 10.1016/j.ijid.2014.05.016
8. Pardi N, Parkhouse K, Kirkpatrick E, McMahon M, Zost SJ, Mui BL, et al. Nucleoside-modified mRNA immunization elicits influenza virus hemagglutinin stalk-specific antibodies. Nat Commun. (2018) 9:3361. doi: 10.1038/s41467-018-05482-0
9. Hollister K, Chen Y, Wang S, Wu H, Mondal A, Clegg N, et al. The role of follicular helper T cells and the germinal center in HIV-1 gp120 DNA prime and gp120 protein boost vaccination. Hum Vaccin Immunother. (2014) 10:1985–92. doi: 10.4161/hv.28659
10. Rauch S, Jasny E, Schmidt KE, Petsch B. New vaccine technologies to combat outbreak situations. Front Immunol. (2018) 9:1963. doi: 10.3389/fimmu.2018.01963
11. Kutzler MA, Weiner DB. DNA vaccines: ready for prime time? Nat Rev Genet. (2008) 9:776–88. doi: 10.1038/nrg2432
12. Bagarazzi ML, Yan J, Morrow MP, Shen X, Parker RL, Lee JC, et al. Immunotherapy against HPV16/18 generates potent TH1 and cytotoxic cellular immune responses. Sci Transl Med. (2012) 4:155ra138. doi: 10.1126/scitranslmed.3004414
13. Geall AJ, Mandl CW, Ulmer JB. RNA: the new revolution in nucleic acid vaccines. Semin Immunol. (2013) 25:152–9. doi: 10.1016/j.smim.2013.05.001
14. Faurez F, Dory D, Le Moigne V, Gravier R, Jestin A. Biosafety of DNA vaccines: New generation of DNA vectors and current knowledge on the fate of plasmids after injection. Vaccine. (2010) 28:3888–95. doi: 10.1016/j.vaccine.2010.03.040
15. Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A, et al. Direct gene transfer into mouse muscle in vivo. Science. (1990) 247:1465–8.
| Google Scholar16. Iavarone CT, O'Hagan D, Yu D, Delahaye NF, Ulmer JB. Mechanism of action of mRNA-based vaccines. Expert Rev Vaccines. (2017) 16:871–81. doi: 10.1080/14760584.2017.1355245
17. Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ. Developing mRNA-vaccine technologies. RNA Biol. (2012) 9:1319–30. doi: 10.4161/rna.22269
18. Kallen KJ, Thess A. A development that may evolve into a revolution in medicine: mRNA as the basis for novel, nucleotide-based vaccines and drugs. Ther Adv Vaccines. (2014) 2:10–31. doi: 10.1177/2051013613508729
19. Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines - a new era in vaccinology. Nat Rev Drug Discov. (2018) 17:261–79. doi: 10.1038/nrd.2017.243
20. Fiedler K, Lazzaro S, Lutz J, Rauch S, Heidenreich R. mRNA Cancer Vaccines. Recent Results Cancer Res. (2016) 209:61–85. doi: 10.1007/978-3-319-42934-2_5
22. Geall AJ, Verma A, Otten GR, Shaw CA, Hekele A, Banerjee K, et al. Nonviral delivery of self-amplifying RNA vaccines. Proc Natl Acad Sci USA. (2012) 109:14604–9. doi: 10.1073/pnas.1209367109
23. Brito LA, Chan M, Shaw CA, Hekele A, Carsillo T, Schaefer M, et al. A cationic nanoemulsion for the delivery of next-generation RNA vaccines. Mol Ther. (2014) 22:2118–29. doi: 10.1038/mt.2014.133
24. Deering RP, Kommareddy S, Ulmer JB, Brito LA, Geall AJ. Nucleic acid vaccines: prospects for non-viral delivery of mRNA vaccines. Expert Opin Drug Deliv. (2014) 11:885–99. doi: 10.1517/17425247.2014.901308
25. Tews BA, Meyers G. Self-Replicating RNA. Methods Mol Biol. (2017) 1499:15–35. doi: 10.1007/978-1-4939-6481-9_2
26. Lundstrom K. Replicon RNA viral vectors as vaccines. Vaccines. (2016) 4: pii: E39. doi: 10.3390/vaccines4040039
27. Ljungberg KP. Liljestrom. Self-replicating alphavirus RNA vaccines. Expert Rev Vaccines. (2015) 14:177–94. doi: 10.1586/14760584.2015.965690
28. Anraku I, Harvey TJ, Linedale R, Gardner J, Harrich D, Suhrbier A, et al. Kunjin virus replicon vaccine vectors induce protective CD8+ T-cell immunity. J Virol. (2002) 76:3791–9. doi: 10.1128/JVI.76.8.3791-3799.2002
29. Johanning FW, Conry RM, LoBuglio AF, Wright M, Sumerel LA, Pike MJ, et al. A Sindbis virus mRNA polynucleotide vector achieves prolonged and high level heterologous gene expression in vivo. Nucleic Acids Res. (1995) 23:1495–501.
30. Zhou X, Berglund P, Rhodes G, Parker SE, Jondal M, Liljestrom P. Self-replicating semliki forest virus RNA as recombinant vaccine. Vaccine. (1994) 12:1510–4.
31. Vogel AB, Lambert L, Kinnear E, Busse D, Erbar S, Reuter KC, et al. Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses. Mol Ther. (2018) 26:446–55. doi: 10.1016/j.ymthe.2017.11.017
32. Weissman D. mRNA transcript therapy. Expert Rev Vaccines. (2015) 14:265–81. doi: 10.1586/14760584.2015.973859
33. Sahin U, Kariko K, Tureci O. mRNA-based therapeutics–developing a new class of drugs. Nat Rev Drug Discov. (2014) 13:759–80. doi: 10.1038/nrd4278
34. Probst J, Weide B, Scheel B, Pichler BJ, Hoerr I, Rammensee HG, et al. Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent. Gene Ther. (2007) 14:1175–80. doi: 10.1038/sj.gt.3302964
35. Kariko K, Muramatsu H, Ludwig J, Weissman D. Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. Nucleic Acids Res. (2011) 39:e142. doi: 10.1093/nar/gkr695
37. Weissman D, Pardi N, Muramatsu H, Kariko K. HPLC purification of in vitro transcribed long RNA. Methods Mol Biol. (2013) 969:43–54. doi: 10.1007/978-1-62703-260-5_3
38. Kozak M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Res. (1987) 15:8125–48.
39. Fechter P, Brownlee GG. Recognition of mRNA cap structures by viral and cellular proteins. J Gen Virol. (2005) 86:1239–49. doi: 10.1099/vir.0.80755-0
40. Ramanathan, Robb GB, Chan SH. mRNA capping: biological functions and applications. Nucleic Acids Res. (2016) 44:7511–26. doi: 10.1093/nar/gkw551
41. Lee H, Bingham SE, Webber AN. Function of 3' non-coding sequences and stop codon usage in expression of the chloroplast psaB gene in Chlamydomonas reinhardtii. Plant Mol Biol. (1996) 31:337–54.
42. Gallie DR. The cap and poly(A) tail function synergistically to regulate mRNA translational efficiency. Genes Dev. (1991) 5:2108–16.
43. Holtkamp S, Kreiter S, Selmi A, Simon P, Koslowski M, Huber C, et al. Modification of antigen-encoding RNA increases stability, translational efficacy, and T-cell stimulatory capacity of dendritic cells. Blood. (2006) 108:4009–17. doi: 10.1182/blood-2006-04-015024
44. Zohra FT, Chowdhury EH, Tada S, Hoshiba T, Akaike T. Effective delivery with enhanced translational activity synergistically accelerates mRNA-based transfection. Biochem Biophys Res Commun. (2007) 358:373–8. doi: 10.1016/j.bbrc.2007.04.059
45. Orlandini von Niessen AG, Poleganov MA, Rechner C, Plaschke A, Kranz LM, Fesser S, et al. Improving mRNA-Based therapeutic gene delivery by expression-Augmenting 3' UTRs identified by cellular library screening. Mol Ther. (2018) 18:30595–1. doi: 10.1016/j.ymthe.2018.12.011
46. Puigbo P, Guzman E, Romeu A, Garcia-Vallve S. OPTIMIZER: a web server for optimizing the codon usage of DNA sequences. Nucleic Acids Res. (2007) 35:W126–31. doi: 10.1093/nar/gkm219
PubMed Abstract | CrossRef Full Text |
47. Kudla G, Lipinski L, Caffin F, Helwak A, Zylicz M. High guanine and cytosine content increases mRNA levels in mammalian cells. PLoS Biol. (2006) 4:e180. doi: 10.1371/journal.pbio.0040180
48. Hershberg R, Petrov DA. Selection on codon bias. Annu Rev Genet. (2008) 42:287–99. doi: 10.1146/annurev.genet.42.110807.091442
49. Thess A, Grund S, Mui BL, Hope MJ, Baumhof P, Fotin-Mleczek M, et al. Sequence-engineered mRNA without chemical nucleoside modifications enables an effective protein therapy in large animals. Mol Ther. (2015) 23:1456–64. doi: 10.1038/mt.2015.103
50. Anderson BR, Muramatsu H, Nallagatla SR, Bevilacqua PC, Sansing LH, Weissman D, et al. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. (2010) 38:5884–92. doi: 10.1093/nar/gkq347
51. Andries O, Mc Cafferty S, De Smedt SC, Weiss R, Sanders NN, Kitada T. N(1)-methylpseudouridine-incorporated mRNA outperforms pseudouridine-incorporated mRNA by providing enhanced protein expression and reduced immunogenicity in mammalian cell lines and mice. J Control Release. (2015) 217:337–44. doi: 10.1016/j.jconrel.2015.08.051
52. Meyer M, Huang E, Yuzhakov O, Ramanathan P, Ciaramella G, Bukreyev A. Modified mRNA-based vaccines elicit robust immune responses and protect guinea pigs from ebola virus disease. J Infect Dis. (2018) 217:451–55. doi: 10.1093/infdis/jix592
53. Van Gulck ER, Ponsaerts P, Heyndrickx L, Vereecken K, Moerman F, De Roo A, et al. Efficient stimulation of HIV-1-specific T cells using dendritic cells electroporated with mRNA encoding autologous HIV-1 Gag and Env proteins. Blood. (2006) 107:1818–27. doi: 10.1182/blood-2005-01-0339
54. Pardi N, Weissman D. Nucleoside Modified mRNA Vaccines for Infectious Diseases. Methods Mol Biol. (2017) 1499:109–21. doi: 10.1007/978-1-4939-6481-9_6
55. Pardi N, Muramatsu H, Weissman D, Kariko K. In vitro transcription of long RNA containing modified nucleosides. Methods Mol Biol. (2013) 969:29–42. doi: 10.1007/978-1-62703-260-5_2
56. Jones KL, Drane D, Gowans EJ. Long-term storage of DNA-free RNA for use in vaccine studies. Biotechniques. (2007) 43:675–81. doi: 10.2144/000112593
57. Alberer M, Gnad-Vogt U, Hong HS, Mehr KT, Backert L, Finak G, et al. Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial. Lancet. (2017) 390:1511–20. doi: 10.1016/S0140-6736(17)31665-3
58. Stitz L, Vogel A, Schnee M, Voss D, Rauch S, Mutzke T, et al. A thermostable messenger RNA based vaccine against rabies. PLoS Negl Trop Dis. (2017) 11:e0006108. doi: 10.1371/journal.pntd.0006108
59. Coulie PG, Van den Eynde BJ, van der Bruggen P, Boon T. Tumour antigens recognized by T lymphocytes: at the core of cancer immunotherapy. Nat Rev Cancer. (2014) 14:135–146. doi: 10.1038/nrc3670
60. Grunwitz C, Kranz LM. mRNA cancer vaccines-messages that prevail. Curr Top Microbiol Immunol. (2017) 405:145–64. doi: 10.1007/82_2017_509
61. Zhang R, Billingsley MM, Mitchell MJ. Biomaterials for vaccine-based cancer immunotherapy. J Control Release. (2018) 292:256–76. doi: 10.1016/j.jconrel.2018.10.008
62. Fleeton MN, Chen M, Berglund P, Rhodes G, Parker SE, Murphy M, et al. Self-replicative RNA vaccines elicit protection against influenza A virus, respiratory syncytial virus, and a tickborne encephalitis virus. J Infect Dis. (2001) 183:1395–8. doi: 10.1086/319857
63. Magini D, Giovani C, Mangiavacchi S, Maccari S, Cecchi R, Ulmer JB, et al. Self-Amplifying mRNA vaccines expressing multiple conserved influenza antigens confer protection against homologous and heterosubtypic viral challenge. PLoS ONE. (2016) 11:e0161193. doi: 10.1371/journal.pone.0161193
64. Chahal JS, Khan OF, Cooper CL, McPartlan JS, Tsosie JK, Tilley LD, et al. Dendrimer-RNA nanoparticles generate protective immunity against lethal Ebola, H1N1 influenza, and Toxoplasma gondii challenges with a single dose. Proc Natl Acad Sci USA. (2016) 113:E4133–42. doi: 10.1073/pnas.1600299113
65. Brazzoli M, Magini D, Bonci A, Buccato S, Giovani C, Kratzer R, et al. Induction of broad-based immunity and protective efficacy by self-amplifying mRNA vaccines encoding influenza virus hemagglutinin. J Virol. (2016) 90:332–44. doi: 10.1128/JVI.01786-15
66. Scorza FB, Pardi N. New kids on the block: RNA-based influenza virus vaccines. Vaccines. (2018) 6:pii: E20. doi: 10.3390/vaccines6020020
67. Zost SJ, Parkhouse K, Gumina ME, Kim K, Diaz Perez S, Wilson PC, et al. Contemporary H3N2 influenza viruses have a glycosylation site that alters binding of antibodies elicited by egg-adapted vaccine strains. Proc Natl Acad Sci USA. (2017) 114:12578–83. doi: 10.1073/pnas.1712377114
68. Wu NC, Zost SJ, Thompson AJ, Oyen D, Nycholat CM, McBride R, et al. A structural explanation for the low effectiveness of the seasonal influenza H3N2 vaccine. PLoS Pathog. (2017) 13:e1006682. doi: 10.1371/journal.ppat.1006682
69. Pulido MR, Sobrino F, Borrego B, Saiz M. RNA immunization can protect mice against foot-and-mouth disease virus. Antiviral Res. (2010) 85:556–8. doi: 10.1016/j.antiviral.2009.12.005
70. Saxena S, Sonwane AA, Dahiya SS, Patel CL, Saini M, Rai A, et al. Induction of immune responses and protection in mice against rabies using a self-replicating RNA vaccine encoding rabies virus glycoprotein. Vet Microbiol. (2009) 136:36–44. doi: 10.1016/j.vetmic.2008.10.030
71. VanBlargan LA, Himansu S, Foreman BM, Ebel GD, Pierson TC, Diamond MS. An mRNA Vaccine protects mice against multiple tick-transmitted flavivirus infections. Cell Rep. (2018) 25:3382–3392 e3. doi: 10.1016/j.celrep.2018.11.082
72. Martinon F, Krishnan S, Lenzen G, Magne R, Gomard E, Guillet JG, et al., Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. Eur J Immunol. (1993) 23:1719–22. doi: 10.1002/eji.1830230749
73. Zhao M, Li M, Zhang Z, Gong T, Sun X. Induction of HIV-1 gag specific immune responses by cationic micelles mediated delivery of gag mRNA Drug Deliv. A. (2016) 23:2596–607. doi: 10.3109/10717544.2015.1038856
74. Pardi N, Hogan MJ, Pelc RS, Muramatsu H, Andersen H, DeMaso CR, et al. Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination. Nature. (2017) 543:248–51. doi: 10.1038/nature21428
75. Richner JM, Himansu S, Dowd KA, Butler SL, Salazar V, Fox JM, et al. Diamond. Modified mRNA Vaccines Protect against Zika Virus Infection. Cell. (2017) 168:1114–25 e10. doi: 10.1016/j.cell.2017.02.017
76. Petsch B, Schnee M, Vogel AB, Lange E, Hoffmann B, Voss D, et al. Protective efficacy of in vitro synthesized, specific mRNA vaccines against influenza A virus infection. Nat Biotechnol. (2012) 30:1210–6. doi: 10.1038/nbt.2436
77. Schnee M, Vogel AB, Voss D, Petsch B, Baumhof P, Kramps T, et al. An mRNA vaccine encoding rabies virus glycoprotein induces protection against lethal infection in mice and correlates of protection in adult and newborn pigs. PLoS Negl Trop Dis. (2016) 10:e0004746. doi: 10.1371/journal.pntd.0004746
78. Pardi N, Hogan MJ, Naradikian MS, Parkhouse K, Cain DW, Jones L, et al. Nucleoside-modified mRNA vaccines induce potent T follicular helper and germinal center B cell responses. J Exp Med. (2018). 215:1571–88. doi: 10.1084/jem.20171450
79. Pardi N, Secreto AJ, Shan X, Debonera F, Glover J, Yi Y, et al. Administration of nucleoside-modified mRNA encoding broadly neutralizing antibody protects humanized mice from HIV-1 challenge. Nat Commun. (2017) 8:14630. doi: 10.1038/ncomms14630
80. Khalil SM, Tonkin DR, Mattocks MD, Snead AT, Johnston RE, White LJ. A tetravalent alphavirus-vector based dengue vaccine provides effective immunity in an early life mouse model. Vaccine. (2014) 32:4068–74. doi: 10.1016/j.vaccine.2014.05.053
81. Lundstrom K. In vivo administration of recombinant alphavirus into rodents. Cold Spring Harb Protoc. (2012) 2012:pdb.prot070581. doi: 10.1101/pdb.prot070581
82. Pyankov OV, Bodnev SA, Pyankova OG, Solodkyi VV, Pyankov SA, Setoh YX, et al. A kunjin replicon virus-like particle vaccine provides protection against ebola virus infection in nonhuman primates. J Infect Dis. (2015) 212(Suppl 2):S368–71. doi: 10.1093/infdis/jiv019
83. Oreshkova N, Cornelissen LA, de Haan CA, Moormann RJ, Kortekaas J. Evaluation of nonspreading Rift Valley fever virus as a vaccine vector using influenza virus hemagglutinin as a model antigen. Vaccine. (2014) 32:5323–9. doi: 10.1016/j.vaccine.2014.07.051
84. Van de Wall S, Walczak M, van Rooij N, Hoogeboom BN, Meijerhof T, Nijman HW, et al. Tattoo delivery of a semliki forest virus-based vaccine encoding human papillomavirus E6 and E7. Vaccines. (2015) 3:221–38. doi: 10.3390/vaccines3020221
85. Bogers WM, Oostermeijer H, Mooij P, Koopman G, Verschoor EJ, Davis D, et al. Potent immune responses in rhesus macaques induced by nonviral delivery of a self-amplifying RNA vaccine expressing HIV type 1 envelope with a cationic nanoemulsion. J Infect Dis. (2015) 211:947–55. doi: 10.1093/infdis/jiu522
86. Harvey TJ, Anraku I, Linedale R, Harrich D, Mackenzie J, Suhrbier A, et al. Kunjin virus replicon vectors for human immunodeficiency virus vaccine development. J Virol. (2003) 77:7796–803. doi: 10.1128/JVI.77.14.7796-7803.2003
87. Huang YT, Liao JT, Yen LC, Chang YK, Lin YL, Liao CL. Japanese encephalitis virus replicon-based vaccine expressing enterovirus-71 epitope confers dual protection from lethal challenges. J Biomed Sci. (2015) 22:74. doi: 10.1186/s12929-015-0181-8
88. Hofmann I, Wen Y, Ciferri C, Schulze A, Fuhner V, Leong M, et al. Expression of the human cytomegalovirus pentamer complex for vaccine use in a CHO system. Biotechnol Bioeng. (2015) 112:2505–15. doi: 10.1002/bit.25670
89. Maruggi G, Chiarot E, Giovani C, Buccato S, Bonacci S, Frigimelica E, et al. Immunogenicity and protective efficacy induced by self-amplifying mRNA vaccines encoding bacterial antigens. Vaccin. (2017) 35:361–8. doi: 10.1016/j.vaccine.2016.11.040
90. Moyo N, Vogel AB, Buus S, Erbar S, Wee EG, Sahin U, et al. Efficient induction of T cells against conserved HIV-1 regions by mosaic vaccines delivered as self-amplifying mRNA. Mol Ther Methods Clin Dev. (2019) 12:32–46. doi: 10.1016/j.omtm.2018.10.010
91. Ip PP, Boerma A, Regts J, Meijerhof T, Wilschut J, Nijman HW, et al. Alphavirus-based vaccines encoding nonstructural proteins of hepatitis C virus induce robust and protective T-cell responses. Mol Ther. (2014) 22:881–90. doi: 10.1038/mt.2013.287
92. Aberle JH, Aberle SW, Kofler RM, Mandl CW. Humoral and cellular immune response to RNA immunization with flavivirus replicons derived from tick-borne encephalitis virus. J Virol. (2005) 79:15107–13. doi: 10.1128/JVI.79.24.15107-15113.2005
93. Whitehead KA, Dahlman JE, Langer RS, Anderson DG. Silencing or stimulation? siRNA delivery and the immune system. Annu Rev Chem Biomol Eng. (2011) 2:77–96. doi: 10.1146/annurev-chembioeng-061010-114133
94. Pardi N, Tuyishime S, Muramatsu H, Kariko K, Mui BL, Tam YK, et al. Expression kinetics of nucleoside-modified mRNA delivered in lipid nanoparticles to mice by various routes. J Control Release. (2015) 217:345–51. doi: 10.1016/j.jconrel.2015.08.007
95. Lindgren G, Ols S, Liang F, Thompson EA, Lin A, Hellgren F, et al. Induction of robust b cell responses after influenza mrna vaccination is accompanied by circulating hemagglutinin-specific ICOS+ PD-1+ CXCR3+ T follicular helper cells. Front Immunol. (2017) 8:1539. doi: 10.3389/fimmu.2017.01539
96. Kreiter S, Selmi A, Diken M, Koslowski M, Britten CM, Huber C, et al. Intranodal vaccination with naked antigen-encoding RNA elicits potent prophylactic and therapeutic antitumoral immunity. Cancer Res. (2010) 70:9031–40. doi: 10.1158/0008-5472.CAN-10-0699
97. Van Nuffel AM, Benteyn D, Wilgenhof S, Corthals J, Heirman C, Neyns B, et al. Intravenous and intradermal TriMix-dendritic cell therapy results in a broad T-cell response and durable tumor response in a chemorefractory stage IV-M1c melanoma patient. Cancer Immunol Immunother. (2012) 61:1033–43. doi: 10.1007/s00262-011-1176-2
98. Van Lint S, Goyvaerts C, Maenhout S, Goethals L, Disy A, Benteyn D, et al. Thielemans. Preclinical evaluation of TriMix and antigen mRNA-based antitumor therapy. Cancer Res. (2012) 72:1661–71. doi: 10.1158/0008-5472.CAN-11-2957
99. Van Lint S, Renmans D, Broos K, Goethals L, Maenhout S, Benteyn D, et al. Intratumoral delivery of TriMix mRNA results in T-cell activation by cross-presenting dendritic cells. Cancer Immunol Res. (2016) 4:146–56. doi: 10.1158/2326-6066.CIR-15-0163
100. Kallen KJ, Heidenreich R, Schnee M, Petsch B, Schlake T, Thess A, et al. A novel, disruptive vaccination technology: self-adjuvanted RNActive((R)) vaccines. Hum Vaccin Immunother. (2013) 9:2263–76. doi: 10.4161/hv.25181
101. Kauffman KJ, Webber MJ, Anderson DG. Materials for non-viral intracellular delivery of messenger RNA therapeutics. J Control Release. (2016) 240:227–34. doi: 10.1016/j.jconrel.2015.12.032
102. Guan S, Rosenecker J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Ther. (2017) 24:133–43. doi: 10.1038/gt.2017.5
103. Reichmuth AM, Oberli MA, Jeklenec A, Langer R, Blankschtein D. mRNA vaccine delivery using lipid nanoparticles. Ther Deliv. (2016) 7:319–34. doi: 10.4155/tde-2016-0006
104. Lv H, Zhang S, Wang B, Cui S, Yan J. Toxicity of cationic lipids and cationic polymers in gene delivery. J Control Release. (2006) 114:100–9. doi: 10.1016/j.jconrel.2006.04.014
105. Pollard C, Rejman J, De Haes W, Verrier B, Van Gulck E, Naessens T, et al. Type I IFN counteracts the induction of antigen-specific immune responses by lipid-based delivery of mRNA vaccines. Mol Ther. (2013) 21:251–9. doi: 10.1038/mt.2012.202
106. Li M, Zhao M, Fu Y, Li Y, Gong T, Zhang Z, et al. Enhanced intranasal delivery of mRNA vaccine by overcoming the nasal epithelial barrier via intra- and paracellular pathways. J Control Release. (2016) 228:9–19. doi: 10.1016/j.jconrel.2016.02.043
107. Kranz LM, Diken M, Haas H, Kreiter S, Loquai C, Reuter KC, et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. (2016) 534:396–401. doi: 10.1038/nature18300
108. Bahl K, Senn JJ, Yuzhakov O, Bulychev A, Brito LA, Hassett KJ, et al. Preclinical and Clinical Demonstration of Immunogenicity by mRNA Vaccines against H10N8 and H7N9 Influenza Viruses. Mol Ther. (2017) 25:1316–27. doi: 10.1016/j.ymthe.2017.03.035
109. Scott JM, Lebratti TJ, Richner JM, Jiang X, Fernandez E, Zhao H, et al. Cellular and humoral immunity protect against vaginal zika virus infection in mice. J Virol. (2018) 92:JVI.00038-18. doi: 10.1128/JVI.00038-18
110. Sedic M, Senn JJ, Lynn A, Laska M, Smith M, Platz SJ, et al. Safety evaluation of lipid nanoparticle-formulated modified mRNA in the sprague-dawley rat and cynomolgus monkey. Vet Pathol. (2018) 55:341–354. doi: 10.1177/0300985817738095
111. Oberli MA, Reichmuth AM, Dorkin JR, Mitchell MJ, Fenton OS, Jaklenec A, et al. Lipid Nanoparticle Assisted mRNA Delivery for Potent Cancer Immunotherapy. Nano Lett. (2017) 17:1326–35. doi: 10.1021/acs.nanolett.6b03329
112. Hekele A, Bertholet S, Archer J, Gibson DG, Palladino G, Brito LA, et al. Rapidly produced SAM((R)) vaccine against H7N9 influenza is immunogenic in mice. Emerg Microbes Infect. (2013) 2:e52. doi: 10.1038/emi.2013.54
113. Coolen AL, Lacroix C, Mercier-Gouy P, Delaune E, Monge C, Exposito JY, et al. Poly(lactic acid) nanoparticles and cell-penetrating peptide potentiate mRNA-based vaccine expression in dendritic cells triggering their activation. Biomaterials. (2019) 195:23–37. doi: 10.1016/j.biomaterials.2018.12.019
114. Demoulins T, Milona P, Englezou PC, Ebensen T, Schulze K, Suter R, et al. Polyethylenimine-based polyplex delivery of self-replicating RNA vaccines. Nanomedicine. (2016) 12:711–22. doi: 10.1016/j.nano.2015.11.001
115. McCullough KC, Bassi I, Milona P, Suter R, Thomann-Harwood L, Englezou P, et al. Self-replicating replicon-RNA delivery to dendritic cells by chitosan-nanoparticles for translation In Vitro and In Vivo. Mol Ther Nucleic Acids. (2014) 3:e173. doi: 10.1038/mtna.2014.24
116. Lai WF, Wong WT. Design of polymeric gene carriers for effective intracellular delivery. Trends Biotechnol. (2018) 36:713–28. doi: 10.1016/j.tibtech.2018.02.006
117. Mandal H, Katiyar SS, Swami R, Kushwah V, Katare PB, Kumar Meka A, et al. epsilon-Poly-l-Lysine/plasmid DNA nanoplexes for efficient gene delivery in vivo. Int J Pharm. (2018) 542:142–52. doi: 10.1016/j.ijpharm.2018.03.021
118. Chen R, Zhang H, Yan J, Bryers JD. Scaffold-mediated delivery for non-viral mRNA vaccines. Gene Ther. (2018) 25:556–67. doi: 10.1038/s41434-018-0040-9
119. Fornaguera C, Guerra-Rebollo M, Angel Lazaro M, Castells-Sala C, Meca-Cortes O, Ramos-Perez V, et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Adv Healthc Mater. (2018) 7:e1800335. doi: 10.1002/adhm.201800335
120. Wang Y, Su HH, Yang Y, Hu Y, Zhang L, Blancafort P, et al. Systemic delivery of modified mRNA encoding herpes simplex virus 1 thymidine kinase for targeted cancer gene therapy. Mol Ther. (2013) 21:358–67. doi: 10.1038/mt.2012.250
121. O.Haabeth AW, Blake TR, McKinlay CJ, Waymouth RM, Wender PA, Levy R. mRNA vaccination with charge-altering releasable transporters elicits human T cell responses and cures established tumors in mice. Proc Natl Acad Sci USA. (2018) 115:E9153–61. doi: 10.1073/pnas.1810002115
122. McKinlay CJ, Benner NL, Haabeth OA, Waymouth RM, Wender PA. Enhanced mRNA delivery into lymphocytes enabled by lipid-varied libraries of charge-altering releasable transporters. Proc Natl Acad Sci USA. (2018) 115:E5859–66. doi: 10.1073/pnas.1805358115
123. Ablasser, Poeck H, Anz D, Berger M, Schlee M, Kim S, et al. Selection of molecular structure and delivery of RNA oligonucleotides to activate TLR7 versus TLR8 and to induce high amounts of IL-12p70 in primary human monocytes. J Immunol. (2009) 182:6824–33. doi: 10.4049/jimmunol.0803001
124. Hua Z, Hou B. TLR signaling in B-cell development and activation. Cell Mol Immunol. (2013) 10:103–6. doi: 10.1038/cmi.2012.61
125. Kato H, Oh SW, Fujita T. RIG-I-like receptors and Type I interferonopathies. J Interferon Cytokine Res. (2017) 37:207–13. doi: 10.1089/jir.2016.0095
126. Rehwinkel J, Tan CP, Goubau D, Schulz O, Pichlmair A, Bier K, et al. RIG-I detects viral genomic RNA during negative-strand RNA virus infection. Cell. (2010) 140:397–408. doi: 10.1016/j.cell.2010.01.020
127. Goubau D, Schlee M, Deddouche S, Pruijssers AJ, Zillinger T, Goldeck M, et al. Antiviral immunity via RIG-I-mediated recognition of RNA bearing 5'-diphosphates. Nature. (2014) 514:372–375. doi: 10.1038/nature13590
128. Schlee M. Master sensors of pathogenic RNA - RIG-I like receptors. Immunobiology. (2013) 218:1322–35. doi: 10.1016/j.imbio.2013.06.007
129. Gregorio J, Meller S, Conrad C, Di Nardo A, Homey B, Lauerma A, et al. Plasmacytoid dendritic cells sense skin injury and promote wound healing through type I interferons. J Exp Med. (2010) 207:2921–30. doi: 10.1084/jem.20101102
130. Goubau D, Deddouche S, Reis e Sousa C. Cytosolic sensing of viruses. Immunity. (2013) 38:855–69. doi: 10.1016/j.immuni.2013.05.007
131. Liu G, Park HS, Pyo HM, Liu Q, Zhou Y. Influenza A virus panhandle structure is directly involved in RIG-I activation and interferon induction. J Virol. (2015) 89:6067–79. doi: 10.1128/JVI.00232-15
132. Feng Q, Hato SV, Langereis MA, Zoll J, Virgen-Slane R, Peisley A, et al. MDA5 detects the double-stranded RNA replicative form in picornavirus-infected cells. Cell Rep. (2012) 2:1187–96. doi: 10.1016/j.celrep.2012.10.005
133. Alexopoulou L, Holt AC, Medzhitov R, Flavell RA. Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3. Nature. (2001) 413:732–8. doi: 10.1038/35099560
134. Kawai T, Akira S. Signaling to NF-kappaB by Toll-like receptors. Trends Mol Med. (2007) 13:460–9. doi: 10.1016/j.molmed.2007.09.002
135. Martinez-Gil L, Goff PH, Hai R, Garcia-Sastre A, Shaw ML, Palese P. A Sendai virus-derived RNA agonist of RIG-I as a virus vaccine adjuvant. J Virol. (2013) 87:1290–300. doi: 10.1128/JVI.02338-12
136. Xu J, Mercado-Lopez X, Grier JT, Kim WK, Chun LF, Irvine EB, et al. Identification of a Natural Viral RNA Motif That Optimizes Sensing of Viral RNA by RIG-I. MBio. (2015) 6:e01265–15. doi: 10.1128/mBio.01265-15
137. Caskey M, Lefebvre F, Filali-Mouhim A, Cameron MJ, Goulet JP, Haddad EK, et al. Synthetic double-stranded RNA induces innate immune responses similar to a live viral vaccine in humans. J Exp Med. (2011) 208:2357–66. doi: 10.1084/jem.20111171
138. Kariko K, Ni H, Capodici J, Lamphier M, Weissman D. mRNA is an endogenous ligand for Toll-like receptor 3. J Biol Chem. (2004) 279:12542–50. doi: 10.1074/jbc.M310175200
139. Tatematsu M, Funami K, Seya T, Matsumoto M. Extracellular RNA Sensing by Pattern Recognition Receptors. J Innate Immun. (2018) 10:1–9. doi: 10.1159/000494034
140. De Beuckelaer, Grooten J, De Koker S. Type I interferons modulate CD8(+) T cell immunity to mRNA Vaccines. Trends Mol Med. (2017) 23:216–26. doi: 10.1016/j.molmed.2017.01.006
141. Crouse J, Kalinke U, Oxenius A. Regulation of antiviral T cell responses by type I interferons. Nat Rev Immunol. (2015) 15:231–42. doi: 10.1038/nri3806
142. Ivashkiv LB, Donlin LT. Regulation of type I interferon responses. Nat Rev Immunol. (2014) 14:36–49. doi: 10.1038/nri3581
143. Decker T, Muller M, Stockinger S. The yin and yang of type I interferon activity in bacterial infection. Nat Rev Immunol. (2005) 5:675–87. doi: 10.1038/nri1684
144. Blanchard EL, Loomis KH, Bhosle SM, Vanover D, Baumhof P, Pitard B, et al. Proximity ligation assays for in situ detection of innate immune activation: focus on in vitro-transcribed mRNA. Mol Ther Nucleic Acids. (2018) 14:52–66. doi: 10.1016/j.omtn.2018.11.002
145. Lutz J, Lazzaro S, Habbeddine M, Schmidt KE, Baumhof P, Mui BL, et al. Unmodified mRNA in LNPs constitutes a competitive technology for prophylactic vaccines. NPJ Vaccines. (2017) 2:29. doi: 10.1038/s41541-017-0032-6
146. Pepini T, Pulichino AM, Carsillo T, Carlson AL, Sari-Sarraf F, Ramsauer K, et al. Induction of an IFN-mediated antiviral response by a self-amplifying RNA vaccine: implications for vaccine design. J Immunol. (2017) 198:4012–24. doi: 10.4049/jimmunol.1601877
147. Sheehan KC, Lai KS, Dunn GP, Bruce AT, Diamond MS, Heutel JD, et al. Blocking monoclonal antibodies specific for mouse IFN-alpha/beta receptor subunit 1 (IFNAR-1) from mice immunized by in vivo hydrodynamic transfection. J Interferon Cytokine Res. (2006) 26:804–19. doi: 10.1089/jir.2006.26.804
148. Avci-Adali M, Behring A, Steinle H, Keller T, Krajeweski S, Schlensak C, Wendel HP. In vitro synthesis of modified mRNA for induction of protein expression in human cells. J Vis Exp. (2014):e51943. doi: 10.3791/51943
149. Kariko K, Muramatsu H, Welsh FA, Ludwig J, Kato H, Akira S, et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther. (2008) 16:1833–40. doi: 10.1038/mt.2008.200
150. Kariko K, Muramatsu H, Keller JM, Weissman D. Increased erythropoiesis in mice injected with submicrogram quantities of pseudouridine-containing mRNA encoding erythropoietin. Mol Ther. (2012) 20:948–53. doi: 10.1038/mt.2012.7
151. Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature. (1998) 392:245–52.
152. Zaba LC, Krueger JG, Lowes MA, Resident and “inflammatory” dendritic cells in human skin. J Invest Dermatol. (2009) 129:302–8. doi: 10.1038/jid.2008.225
153. Kormann MS, Hasenpusch G, Aneja MK, Nica G, Flemmer AW, Herber-Jonat S, et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nat Biotechnol. (2011) 29:154–7. doi: 10.1038/nbt.1733
154. Broos K, Van der Jeught K, Puttemans J, Goyvaerts C, Heirman C, Dewitte H, et al. Particle-mediated intravenous delivery of antigen mRNA results in strong antigen-specific t-cell responses despite the induction of type I interferon. Mol Ther Nucleic Acids. (2016) 5:e326. doi: 10.1038/mtna.2016.38
155. Kowalczyk A, Doener F, Zanzinger K, Noth J, Baumhof P, Fotin-Mleczek M, et al. Self-adjuvanted mRNA vaccines induce local innate immune responses that lead to a potent and boostable adaptive immunity. Vaccine. (2016) 34:3882–93. doi: 10.1016/j.vaccine.2016.05.046
156. Liang F, Ploquin A, Hernandez JD, Fausther-Bovendo H, Lindgren G, Stanley D, et al. Dissociation of skeletal muscle for flow cytometric characterization of immune cells in macaques. J Immunol Methods. (2015) 425:69–78. doi: 10.1016/j.jim.2015.06.011
157. Routy JP, Boulassel MR, Yassine-Diab B, Nicolette C, Healey D, Jain R, et al. Immunologic activity and safety of autologous HIV RNA-electroporated dendritic cells in HIV-1 infected patients receiving antiretroviral therapy. Clin Immunol. (2010) 134:140–7. doi: 10.1016/j.clim.2009.09.009
158. Allard SD, De Keersmaecker B, de Goede AL, Verschuren EJ, Koetsveld J, Reedijk ML, et al. A phase I/IIa immunotherapy trial of HIV-1-infected patients with Tat, Rev and Nef expressing dendritic cells followed by treatment interruption. Clin Immunol. (2012) 142:252–68. doi: 10.1016/j.clim.2011.10.010
159. Gandhi RT, Kwon DS, Macklin EA, Shopis JR, McLean AP, McBrine N, et al. Immunization of HIV-1-infected persons with autologous dendritic cells transfected with mrna encoding HIV-1 Gag and Nef: results of a randomized, placebo-controlled clinical trial. J Acquir Immune Defic Syndr. (2016) 71:246–53. doi: 10.1097/QAI.0000000000000852
160. Van Craenenbroeck AH, Smits EL, Anguille S, Van de Velde A, Stein B, Braeckman T, et al. Induction of cytomegalovirus-specific T cell responses in healthy volunteers and allogeneic stem cell recipients using vaccination with messenger RNA-transfected dendritic cells. Transplantation. (2015) 99:120–7. doi: 10.1097/TP.0000000000000272
161. Kubler H, Scheel B, Gnad-Vogt U, Miller K, Schultze-Seemann W, Vom Dorp F, et al. Self-adjuvanted mRNA vaccination in advanced prostate cancer patients: a first-in-man phase I/IIa study. J Immunother Cancer. (2015) 3:26. doi: 10.1186/s40425-015-0068-y
162. Burgess DJ. RNA stability: remember your driver. Nat Rev Genet. (2012) 13:72. doi: 10.1038/nrg3159
163. Lundstrom K. Latest development on RNA-based drugs and vaccines. Future Sci OA. (2018) 4:FSO300. doi: 10.4155/fsoa-2017-0151
164. Kreiter S, Selmi A, Diken M, Sebastian M, Osterloh P, Schild H, et al. Increased antigen presentation efficiency by coupling antigens to MHC class I trafficking signals. J Immunol. (2008) 180:309–18.
165. Trepotec Z, Aneja M, Geiger J, Hasenpusch G, Plank C, Rudolph C. Maximizing the translational yield of mRNA therapeutics by minimizing 5'-UTRs. Tissue Eng Part A. (2018) 25:69–79. doi: 10.1089/ten.TEA.2017.0485
166. Li J, Zeng M, Shan H, Tong C. Microneedle patches as drug and vaccine delivery platform. Curr Med Chem. (2017) 24:2413–22. doi: 10.2174/0929867324666170526124053
167. DeFrancesco L. The ‘anti-hype’ vaccine. Nat Biotechnol. (2017) 35:193–97. doi: 10.1038/nbt.3812
169. Hoerr A. successful founder off the beaten path. Nat Biotechnol. (2017) 35:900–3. doi: 10.1038/nbt.3975
170. Ulmer JB, Geall AJ. Recent innovations in mRNA vaccines. Curr Opin Immunol. (2016) 41:18–22. doi: 10.1016/j.coi.2016.05.008
Купить номер с этой статьей в pdf