Текущая эпидемия в Западной Африке, официально объявленная Всемирной организацией здравоохранения (World Health Organization, WHO) 23.03.2014, этиологически связана с эболавирусом Заир (ZEBOV — Zaire ebolavirus) [1, 2] и имеет целый ряд отличительных характеристик. Во-первых, неожиданной оказалась локализация эпидемии — Западная Африка (рис. 1), в то время как все известные до этого природные очаги возбудителя расположены в Центральной Африке, в пойме р. Конго. Во-вторых, беспрецедентен масштаб эпидемии: уже к лету 2014 г. она приобрела характер региональной. По состоянию на 25.10.2014 Всемирная организация здравоохранения приводит кумулятивные данные о 10 114 заболевших и 4912 умерших (летальность, таким образом, составила 48,6%) в 3 странах, территория которых находится в эпицентре эпидемии (рис. 2): Республике Сьерра-Леоне (1281/3896 ≈ 32,9%), Республике Либерия (2705/4665 ≈ 58,0%), Гвинейской Республике (926/1553 ≈ 59,6%). За этот же период выявлены 28 завозных случаев заболевания с 10 (35,7%) летальными исходами в 5 странах: Нигерии (8/20 = 40,0%), США (1/4 = 25,0%), Сенегале (1/2 = 50,0%), Мали (0/1 = 0,0%), Испании (0/1 = 0,0%). В-третьих, эпидемия в Западной Африке охватила города и крупные населенные пункты, в то время как в Центральной Африке чаще встречались эпидемии в лесных поселениях и деревнях.
Данная работа, выполненная совместной группой российских и гвинейских специалистов, посвящена анализу возможных причин сложившейся эпидемической ситуации.
О работе экспертно-рекогносцировочной группы российских вирусологов в Гвинейской Республике
В августе 2014 г. в Гвинейскую Республику прибыла экспертно-рекогносцировочная группа российских ученых в составе: академик РАН, д.м.н. Малеев Виктор Васильевич (заместитель по научной работе директора ФБУН Центральный НИИ эпидемиологии Роспотребнадзора) и д.б.н. Щелканов Михаил Юрьевич (заведующий лабораторией экологии вирусов ФГБУ НИИ вирусологии им. Д. И. Ивановского Минздрава России) (рис. 3–6).
В задачи группы входили: 1) обеспечение биологической безопасности Посольства Российской Федерации в Гвинейской Республике и Республике Сьерра-Леоне и российских граждан на территории Западной Африки; 2) научно-методическая поддержка местных специалистов; 3) сбор аналитической информации непосредственно в очаге эпидемии; 4) ознакомление с опытом гвинейских коллег по диагностике и лечению лихорадки Эбола; 5) установление контактов с представителями Всемирной организации здравоохранения и других международных организаций, осуществляющих деятельность по предотвращению распространения эпидемии; 6) установление контактов со специалистами Гвинейского Института им. Л. Пастера (г. Киндия); 7) проведение переговоров с Министерством здравоохранения Гвинейской Республики с целью определения масштабов помощи со стороны Российской Федерации, а также получения разрешения на работу российских специализированных противоэпидемических бригад (СПЭБов). Получение приглашения российских СПЭБов имело большую научно-практическую ценность, в первую очередь, для Гвинейской Республики, которая, как и другие страны региона, охваченные эпидемией, остро нуждается в средствах современной молекулярной диагностики, а во-вторых, и для нашей страны, так как отечественные тест-системы имели возможность «пройти обкатку» в условиях реальной эпидемии. К слову сказать, тест-системы российского производства зарекомендовали себя с самой лучшей стороны и строго соответствуют международным требованиям, но анализ их эффективности является предметом другой публикации.
Члены российской экспертно-рекогносцировочной группы проводили активные консультации с гвинейскими коллегами, учитывая их богатый опыт работы в эпицентре эпидемии. Особенно плодотворные научные отношения, естественно, складывались с выпускниками советских ВУЗов, которых в Гвинейской Республике много и которые имеют сегодня большой политический вес. Двое из них — д-р Мамаду Буаро (директор Гвинейского Института им. Л. Пастера) (рис. 5) и д-р Нфали Магассуба (заведующий лабораторией молекулярной диагностики госпиталя «Донка») (рис. 6) — являются соавторами настоящей работы.
Таксономический статус эболавируса Заир
Лихорадка Эбола и ее этиологический агент получили свое название в честь реки Эбола (точнее — таково название верхнего течения реки Монгала, до впадения в нее реки Дуа), в пойме которой был в 1976 г. собран клинический материал, послуживший источником изоляции вируса [3–7].
Здесь же уместно обсудить правильную постановку ударения в термине «лихорадка Эбола», так как часто приходится сталкиваться с англо-американским вариантом «Э'бола» и реже — с французским «Эбола'». При выборе правильного ударения следует принять во внимание, что в среднем течении реки Конго (в том числе — по берегам Эболы) проживает народ бангала, который говорит на языке лингала (языковая семья банту), а в этом языке принято ставить ударение на предпоследний слог. Таким образом, правильно произносить «Эбо'ла».
В настоящее время термин «вирус Эбола» имеет историческое значение, а также используется в качестве допустимого научного сленга. В рамках современной терминологии этот устаревший термин остался в названии рода Ebolavirus, входящий в сем. Filoviridae отряда Mononegavirales (табл. 1) [8, 9]. Видовой состав рода Ebolavirus представлен в табл. 2.
Краткая справка по молекулярной биологии филовирусов
Все филовирусы имеют нитевидные вирионы (Mr = 382 МДа; ρCsCl = 1,32 г/см3; ρKt = 1,14 г/см3; s20,w ≈ 1,40S) (константа седиментации существенно зависит от длины частицы и от наличия топологических узлов), снабженные липидной оболочкой, длиной 600–800 нм и толщиной 50–80 нм. Само название семейства — Filoviridae — происходит от лат. filum (нить), что прекрасно отражает морфологию вириона (рис. 7А). Пик инфекционности приходится на частицы длиной 805 нм (Ebolavirus) и 665 (Marburgvirus). Внутреннюю часть вириона занимает нуклеокапсид, состоящий из вирусной РНК и 4 структурных белков: NP (78–83 кДа; нуклеопротеин), VP30 (29–32 кДа; кофактор вирусной полимеразы), VP35 (31–39 кДа; фосфорилированный белок) и L-белка (252–267 кДа; вирусная РНК-зависимая РНК-полимераза). С липидной оболочкой ассоциированы GP-комплекс (74–75 кДа; поверхностный гликопротеин), VP24 (28–29 кДа) и VP40 (31–35 кДа). GP-комплекс образует внешние «шипы» вириона (см. рис. 7Б) и состоит из двух субъединиц: большой N-концевой GP
Геном филовирусов представлен одноцепочечной РНК негативной полярности длиной порядка 19 тыс. нуклеотидных оснований (18 959 — у ZEBOV) [9, 12, 13]. Структура генома стандартна для отряда Mononegavirales (см. [8]).
Клеточными рецепторами, с которыми связывается вирусный белок GP1, являются специфические лектины — DC-SIGN (dendritic cell-specific ICAM-3-grabbing nonintegrin — неинтегриновые молекулы дендритных клеток, связывающие ICAM-3), L-SIGN (liver/lymph node-specific ICAM-3-grabbing nonintegrin — неинтегриновые молекулы клеток печени/лимфатических узлов, связывающие ICAM-3), hMGL (human macrophage C-type lectin specific to galactose/N-acetylgalactosamine — С-лектин человеческих макрофагов, специфичный к галактозе/N-ацетилгалактозамину), FR-α (human folate receptor type α — человеческий фолатный рецептор α). Эти рецепторы содержатся на поверхности клеток миелоидного ряда (моноцитов/макрофагов, дендритных клеток, гепатоцитов и эндотелиальных клеток), которые и являются основными клетками-мишенями, в цитоплазме которых и происходит репликация вируса [9, 12, 14].
Природная очаговость эболавируса Заир
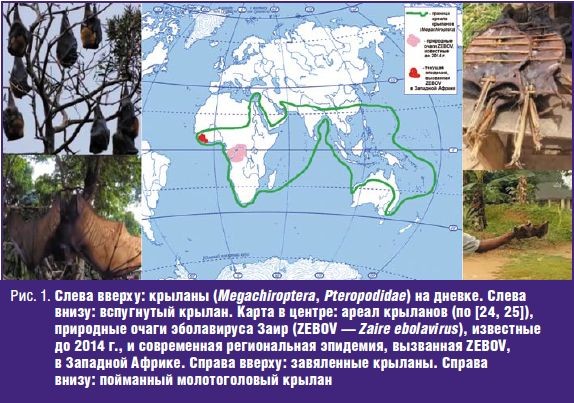
Все известные филовирусы являются природноочаговыми. Что касается ZEBOV, то вплоть до 2014 г. его природные очаги были известны только в Центральной Африке, в бассейне реки Конго (рис. 1, табл. 2).
В период 1978–1991 гг. на базе Гвинейского Института им. Л. Пастера (г. Киндия) (рис. 5) активно работала Российско-Гвинейская вирусологическая и микробиологическая лаборатория [19]. Сотрудниками этой лаборатории была описана эпидемическая вспышка геморрагической лихорадки, вспыхнувшей в марте-августе 1982 г. среди населения районов Вассу и Колахуре в долине реки Коленте (округ Мадина Ула) близ границы Гвинейской Республики и Республики Сьерра-Леоне. По имеющимся оценкам [20], заболеваемость составила 20% от всего местного населения, летальность превысила 30%. Этиологический агент заболевания в то время идентифицировать не удалось, а «…особенности клинического течения болезни в наибольшей степени напоминают описанную симптоматику вирусных геморрагических лихорадок Марбург и Эбола» (цитируется по [20, с. 69]). По-видимому, это было первое указание на существование природных очагов представителей рода Ebolavirus на территории Северо-Гвинейской возвышенности, однако описанные наблюдения не получили в свое время должной оценки.
В 1994 г. в Западной Африке был изолирован эболавирус TAFV (табл. 2), но это нельзя было считать прямым указанием на существование там природных очагов ZEBOV.
В настоящее время известно, что природные очаги ZEBOV располагаются на территории лесистой части Северо-Гвинейской возвышенности, на стыке трех стран, в наибольшей степени вовлеченных в эпидемию лихорадки Эбола: Гвинейской Республики, Республики Сьерра-Леоне и Республики Либерия. Природным резервуаром ZEBOV являются крыланы (Chiroptera, Megachiroptera) — в первую очередь, молотоголовые крыланы (Hypsignathus monstrosus), эполетовый крылан Франке (Epomops franqueti) и ошейниковый крылан (Myonycteris torquata) [21–23]. Крыланы способны переносить инфекцию ZEBOV без клинических проявлений, выделяя вирус с биологическими жидкостями — слюной, мочой, фекалиями, которые могут служить источником заражения других животных (включая человека).
Следует подчеркнуть, что крыланы — это не летучие мыши (Chiroptera, Microchiroptera), а отдельный подотряд рукокрылых (Chiroptera), представленный единственным семейством Pteropodidae
Типы эпидемий лихорадки Эбола
Можно выделить три типа эпидемий/эпидемических вспышек лихорадки Эбола (табл. 3).
Лесной тип эпидемии имеет место в лесных деревнях, и именно этот тип чаще всего встречается в экваториальных и субэкваториальных лесах Центральной Африки. Крыланы, обитающие в верхних ярусах леса, редко становятся добычей охотников. Но от крыланов часто заражаются обезьяны, совершающиеся значительные вертикальные перемещения. Упавшие на землю контаминированные фрукты могут стать причиной заражения животных наземного экологического комплекса — например, копытных. Обезьяны и копытные животные болеют в клинически выраженной форме. Ослабленные животные с пониженной подвижностью становятся добычей охотников, которые заражаются в первую очередь. Если охотники находятся в нескольких днях пути от дома, они могут и не вернуться. Но в большинстве случаев охотники заносят инфекцию в лесные деревни. Последние обычно достаточно изолированы, поэтому эпидемия лихорадки Эбола, неподконтрольная местным знахарям, протекает с высокой летальностью (до 90%).
Деревенский тип эпидемии возникает в тех случаях, когда сельскохозяйственные плантации фруктов подступают вплотную к лесным массивам или даже вклиниваются в них. В этих случаях крыланы предпочитают совершать «набеги» на плантации, где могут, во-первых, контаминировать фрукты, а во-вторых, сами становиться доступным объектом охоты. В результате эпидемические вспышки могут возникать в деревнях, расположенных в окрестностях плантаций.
Городской тип эпидемии — как следует из его названия — возникает в городах и крупных населенных пунктах с высокой плотностью населения. Здесь источником вируса являются больные люди. Возбудитель лихорадки Эбола передается здоровым людям контактным и контактно-бытовым путем через все биологические жидкости: кровь и ее продукты, мочу, кал, рвотные массы, слюну, слезы, пот. Особо следует отметить, что в сперме реконвалесцентов и в тканевых макрофагах выживших реконвалесцентов филовирусы могут находиться до 90 суток после начала заболевания.
Причины беспрецедентных масштабов эпидемии лихорадки Эбола в Западной Африке
Следует выделить фундаментальные причины развития эпидемии Эбола в Западной Африке до беспрецедентных масштабов (ср. данные табл. 2 с современными показателями заболеваемости).
Во-первых, необходимо назвать существование природных очагов ZEBOV на территории лесистой части Северо-Гвинейской возвышенности. Именно этот регион является эпицентром эпидемии; именно оттуда эпидемия начала свое распространение (из провинции Нзерекоре Гвинейской Республики); контакт именно с этим регионом является причиной вовлеченности в эпидемию Гвинейской Республики, Республики Сьерра-Леоне и Республики Либерия.
Во-вторых, до 2014 г. отсутствовала достоверная научная информация о циркуляции ZEBOV в природных очагах Северо-Гвинейской возвышенности. Это имело самые печальные последствия — не удалось вовремя провести дифференциальную диагностику: первый пациент (двухлетний мальчик), положивший начало текущей эпидемии, умер в деревне Мельянду (префектура Гекеду провинции Нзерекоре Гвинейской Республики) еще 06.12.2013 [1]. По-видимому, это была эпидемическая вспышка деревенского типа. С самого начала ошибочно полагали, что это не лихорадка Эбола, а одна из многочисленных инфекций со сходной симптоматикой — например, лихорадки Ласса, Чикунгунья, денге и т. п. Лишь несколько месяцев спустя лабораторные тесты надежно подтвердили, что этиологический агент эпидемии — ZEBOV. Так было упущено время — то самое время, когда эпидемию еще можно было взять под эффективный контроль. В отсутствие соответствующих противоэпидемических мероприятий эпидемия «вышла на оперативный простор», проникнув в крупные населенные пункты и превратившись в эпидемию городского типа (табл. 3).
В связи с «упущенным временем» уместно еще раз вернуться к данным российско-гвинейской вирусологической и микробиологической лаборатории [20], которые мы цитировали выше. Если бы так называемая «перестройка» не порушила научные связи между СССР и Гвинейской Республикой в конце 1980-х гг., то, учитывая развитие молекулярной диагностики за последние четверть века, к 2013 г. мы бы наверняка владели информацией о наличии природных очагов ZEBOV в Западной Африке, и катастрофического сценария развития ситуации можно было бы избежать.
В-третьих, ряд местных обычаев, широко представленных в Западной Африке, существенно способствуют распространению вирусов, передающихся контактным путем (в том числе и ZEBOV): совместное омывание тела умершего всеми родственниками (а труп на пике виремии продолжает выделять вирус со всеми биологическими жидкостями), пышные многолюдные похороны, в процессе которых знавшие покойного люди должны обнять его и даже поцеловать (иначе, согласно поверьям, усопший сам придет попрощаться из горнего мира), одежда покойного донашивается родственниками… Причем, что важно, искоренение указанных традиций встречается резкое противодействие со стороны традиционного западноафриканского общества. Справедливости ради необходимо отметить, что за последние месяцы правительствами стран Западной Африки и международными организациями проделана большая разъяснительная работа по ослаблению влияния традиционных обычаев населения на эпидемический процесс. Сделано много: стало лучше, чем было, но хуже, чем требуется.
В-четвертых, все перечисленные выше причины синергируют с колоссальной бедностью основной части населения Западной Африки и возникающими отсюда социально-экономическими проблемами. Детская смертность в Гвинейской Республике и без ZEBOV достигает уровня 118 на 1000 человек (это один из высочайших показателей в мире). Но самое главное, в регионе отсутствует система здравоохранения (ключевое слово — «система») и санитарно-эпидемиологического надзора (в нашем понимании этих терминов).
В заключение необходимо подчеркнуть, что в Российской Федерации не имеет место ни одна из перечисленных причин. На территории нашей страны отсутствуют (даже теоретически!) условия для формирования природных очагов ZEBOV. Разумеется, сохраняется отличная от нуля вероятность завозных случаев лихорадки Эбола. Однако это будут единичные спорадические случаи, локализованные в самом начале возможного распространения и не имеющие эпидемических последствий. При этом необходимо понимать, что даже самый тщательный досмотр на границе не сводит вероятность завозных случаев к нулю — пограничные досмотры необходимая, но недостаточная мера. Инфицированный человек в инкубационном периоде (2–21 день; чаще 4–7 суток), не имея клинически выраженной симптоматики, преодолевает любой досмотр и заболевает уже на новой территории. Сказанное относится и к другим завозным вирусным инфекциям [26, 27].
Лучшая в мире система обеспечения биологической безопасности государства, доставшаяся в наследство от СССР и не растерянная в «лихие девяностые» благодаря самоотверженному труду армии отечественных специалистов, даже при самом неблагоприятном сценарии развития ситуации является гарантией против развития эпидемии лихорадки Эбола в нашей стране по западноафриканскому сценарию.
Литература
- Baize S., Pannetier D., Oestereich L., Rieger T., Koivogui L., Magassouba N., Soropogui B., Sow M. S., Keita S., De Clerck H., Tiffany A., Dominguez G., Loua M., Traore A., Kolie M., Malano E. R., Heleze E., Bocquin A., Mely S., Raoul H., Caro V., Cadar D., Gabriel M., Pahlmann M., Tappe D., Schmidt-Chanasit J., Impouma B., Diallo A. K., Formenty P., Van Herp M., Gunther S. Emergence of Zaire Ebola virus disease in Guinea // N. Engl. J. Med. 2014. V. 371. № 15. P. 1418–1425.
- Gatherer D. The 2014 Ebola virus disease outbreak in West Africa // J. Gen. Virol. 2014. V. 95. Pt. 8. P. 1619–1624.
- Pattyn S., van der Groen G., Courteille G., Jacob W., Piot P. Isolation of Marburg-like virus from a case of haemorrhagic fever in Zaire // Lancet. 1977. V. 1. P. 573–574.
- Emond R. T., Evans B., Bowen E. T., Lloyd G. A case of Ebola virus infection // Br. Med. J. 1977. V. 2. P. 541–544.
- Ebola haemorrhagic fever in Zaire, 1976. Report of an International Commission // Bulletin of the World Health Organization. 1978. V. 56. № 2. P. 271–293.
- After Marburg, Ebola // Lancet. 1977. № 1. P. 581–582.
- Ebola haemorrhagic fever in Sudan, 1976. Report of a WHO/International study team // Bulletin of the World Health Organization. 1978. V. 56. № 2. P. 247–270.
- Львов Д. К., Щелканов М. Ю. Отряд Mononegavirales / В кн.: Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. Ред. академик РАН Д. К. Львов. М.: МИА, 2013. С. 188–189.
- Львов Д. К., Щелканов М. Ю. Филовирусы (Filoviridae) / В кн.: Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. Ред. академик РАН Д. К. Львов. М.: МИА, 2013. С. 202–205.
- Субботина Е. Л., Качко А. В., Чепурнов А. А. Свойства белков вируса Эбола // Вопросы вирусологии. 2006. Т. 52. № 1. С. 10–16.
- Geisbert T. W., Jahrling P. B. Use of immunoelectron microscopy to show Ebola virus during the 1989 United States epizootic // J. Clin. Pathol. 1990. V. 43. P. 813–816.
- Субботина Е. Л., Чепурнов А. А. Молекулярные механизмы репродукции вируса Эбола // Вопросы вирусологии. 2007. Т. 52. № 1. С. 10–16.
- Борисевич И. В., Маркин В. А., Фирсова И. В., Евсеев А. А., Хамитов Р. А., Максимов В. А. Эпидемиология, профилактика, клиника и лечение геморрагических лихорадок (Марбург, Эбола, Ласса и Боливийской) // Вопросы вирусологии. 2006. Т. 51. № 6. С. 4–10.
- Chan S. Y., Speck R. F., Ma M. C. et al. Distinct mechanisms of entry by envelope glycoproteins of Marburg and Ebola (Zaire) viruses // J. Virol. 2000. V. 74. № 10. P. 4933–4937.
- Negredo A., Palacios G., Vazquez-Moron S., Gonzalez F., Dopazo H., Molero F., Juste J., Quetglas J., Savji N., de la Cruz Martinez M., Herrera J. E., Pizarro M., Hutchison S. K., Echevarria J. E., Lipkin W. I., Tenorio A. Discovery of an ebolavirus-like filovirus in Europe // PLoS Pathog. 2011. V. 7. № 10. P. e1002304.
- WHO. Ebola virus disease. Fact sheet N°103 (updated September 2014) // http://www.who.int/mediacentre/factsheets/fs103/en/.
- Miranda M. E., Miranda N. L. Reston ebolavirus in humans and animals in the Philippines: a review // J. Infect. Dis. 2011. V. 204. Suppl. 3. P. S757–760.
- Pan Y., Zhang W., Cui L., Hua X., Wang M., Zeng Q. Reston virus in domestic pigs in China // Arch Virol. 2014. V. 159. № 5. P. 1129–1132.
- Бутенко А. М. Изучение циркуляции арбовирусов в Гвинейской Республике // Медицинская паразитология и паразитарные болезни. 1996. № 2. С. 40–44.
- Сочинский В. А., Легоньков Ю. А., Конде К., Бутенко А. М., Камара М., Фидаров Ф. М. Клинико-эпидемиологическое изучение острого заболевания, протекающего с геморрагическим синдромом, в округе Мадина Ула области Киндия (1982) / В сб.: Арбовирусы, паразитозы и бактериальные инфекции в Гвинейской Народной Революционной Республике. Конакри, 1983. С. 65–69.
- Leroy E. M., Kumulungui B., Pourrut X., Rouquet P., Hassanin A., Yaba P., Delicat A., Paweska J. T., Gonzalez J. P., Swanepoel R. Fruit bats as reservoirs of Ebola virus // Nature. 2005. V. 438. P. 575–576.
- Pourrut X., Souris M., Towner J. S., Rollin P. E., Nichol S. T., Gonzalez J. P., Leroy E. Large serological survey showing cocirculation of Ebola and Marburg viruses in Gabonese bat populations, and a high seroprevalence of both viruses in Rousettus aegyptiacus // BMC Infectious Diseases. 2009. V. 9. P. e159.
- Pigott D. M., Golding N., Mylne A., Huang Z., Henry A. J., Weiss D. J., Brady O. J., Kraemer M. U., Smith D. L., Moyes C. L., Bhatt S., Gething P. W., Horby P. W., Bogoch I. I., Brownstein J. S., Mekaru S. R., Tatem A. J., Khan K., Hay S. I. Mapping the zoonotic niche of Ebola virus disease in Africa // Elife. 2014. V. 3. P. e04395.
- Наумов Н. П., Карташев Н. Н. Зоология позвоночных. Часть 2. Пресмыкающиеся, птицы, млекопитающие. М.: Высшая школа, 1979. 272 с.
- Eick G. N., Jacobs D. S., Matthee C. A. A nuclear DNA phylogenetic perspective on the evolution of echolocation and historical biogeography of extant bats (chiroptera) // Molecular Biology and Evolution. 2005. V. 22. № 9. P. 1869–1886.
- Ларичев В. Ф., Сайфуллин М. А., Акиншин Ю. А., Хуторецкая Н. В., Бутенко А. М. Завозные случаи арбовирусных инфекций в Российской Федерации // Эпидемиология и инфекционные болезни. 2012. № 1. С. 35–38.
- Ларичев В. Ф., Сайфуллин М. А., Акиншина Ю. А., Хуторецкая Н. В., Бутенко А. М. Случаи завоза арбовирусных инфекций в Россию/В сб.: Новые и возвращающиеся инфекции в системе биобезопасности Российской Федерации. Учебно-методическое пособие. М.: Изд-во Первого МГМУ им. И. М. Сеченова, 2014. С. 72–78.
М. Ю. Щелканов*, 1, доктор биологических наук, профессор
N’F. Magassouba**, Ph. D.
M. Y. Boiro***, Ph. D.
В. В. Малеев, доктор медицинских наук, профессор, академик РАН
* ГБОУ ВПО ТГМУ МЗ РФ, Владивосток
** Госпиталь «Донка», Конакри, Гвинейская Республика
*** Гвинейский институт им. Л. Пастера, Киндия, Гвинейская Республика
**** ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва
1 Контактная информация: adorob@mail.ru.
Купить номер с этой статьей в pdf