Несмотря на успехи, достигнутые в лечении заболеваний сердечно-сосудистой системы (ССЗ), до настоящего времени они остаются основной причиной смерти населения России: по данным Госкомстата, в 2009 году от ССЗ умерло 956 тыс. 273 человека, из них 43,4% — от ишемической болезни сердца [1]. Современная стратегия оказания помощи больным с ишемической болезнью сердца (ИБС) включает модификацию факторов риска, медикаментозную терапию и реваскуляризационные вмешательства, что играет ключевую роль в лечении этих пациентов. Фармакологическое лечение стабильной стенокардии предусматривает, прежде всего, использование препаратов, улучшающих прогноз у больных стенокардией (антитромбоцитарные средства
Миокардиальные цитопротекторы — препараты различных химических классов, действие которых не связано с гемодинамическим эффектом, а опосредуется оптимизацией процессов образования и расхода энергии, коррекцией функции дыхательной цепи, нормализацией баланса между интенсивностью процессов свободно-радикального окисления и антиоксидантной защитой, непосредственным влиянием на кардиомиоциты, что способствует их выживаемости в условиях ишемии, препятствует формированию «метаболического ремоделирования миокарда» (термин предложен М. van Bilsen и соавт. в 2004 году [6] для обозначения патологических изменений, опосредованных избытком активации жирных кислот в кардиомиоците). Единой классификации кардиоцитопротекторов не существует, поэтому с нашей точки зрения привлекает внимание классификация, предложенная Михиным В. П. (2011), построенная на основании локализации фармакологического эффекта препарата [7]:
Классификация кардиоцитопротекторов по локализации фармакологического эффекта:
- Внутримитохондриальные цитопротекторы.
1. 1. Торможение окисления жирных кислот:
— подавление бета-окисления жирных кислот (триметазидин);
— подавление транспорта жирных кислот в митохондрии (мельдоний).
1. 2. Прямая стимуляция окисления глюкозы (сукцинат 2-этил-6-метил-3-оксипиридина).
1. 3. Стимуляция цитохромной цепи (коэнзим Q10). - Транспорт энергетического субстрата в митохондрии (фосфокреатин, глюкозоинсулиновая смесь (малоэффективна), янтарная кислота).
- Стимуляция анаэробного гликолиза (тиатриазолин) — мало разработаны и малоэффективны.
- Антиоксиданты и митохондриальные цитопротекторы, обладающие антиоксидантными свойствами.
В норме между доставкой кислорода к кардиомиоцитам и потребностью в нем имеется четкое соответствие, обеспечивающее нормальный метаболизм и, следовательно, функции клеток сердца. В нормальных условиях основными субстратами для выработки энергии в кардиомиоцитах служат свободные жирные кислоты (СЖК), обеспечивающие от 60% до 80% синтеза аденозинтрифосфата (АТФ), и глюкоза (20–40% синтеза АТФ) [8]. Глюкоза вначале подвергается анаэробному гликолизу с образованием небольшого (около 10%) количества АТФ и пирувата, а затем пируват поступает в митохондрии, где с помощью пируватдегидрогеназного комплекса (ПДК) подвергается окислительному декарбоксилированию с образованием ацетил коэнзима А (ацетил-КоА). Свободные жирные кислоты, поступая в цитоплазму кардиомиоцита, преобразуются в ацилкоэнзим А (ацил-КоА) жирных кислот, который затем подвергается бета-окислению в митохондриях с образованием ацетил-КоА. Образующийся в ходе метаболизма глюкозы и СЖК ацетил-КоА поступает в цикл Кребса, где и синтезируется АТФ [8] (рис. 1, 2).
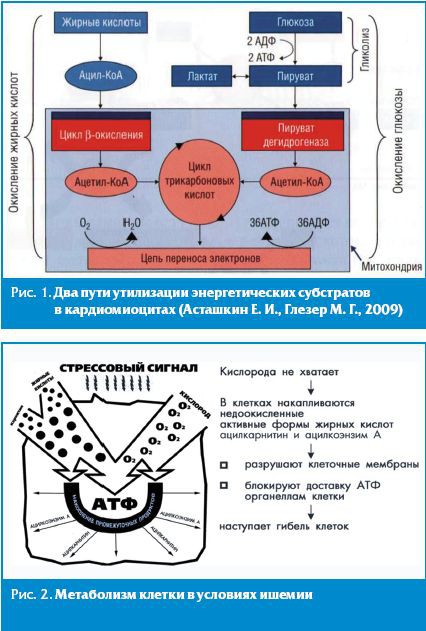
Оптимизация энергетического метаболизма миокарда предоставляет большие возможности в плане защиты сердечной мышцы от ишемических повреждений [9]. Однако при выборе препарата следует учитывать, что окисление глюкозы в метаболической цепи синтеза АТФ требует на одну молекулу АТФ на 35–40% кислорода меньше, чем при окислении жирных кислот (ЖК), при этом экономия кислорода обеспечивается не только за счет особенностей метаболического цикла окисления глюкозы (до 20%), но и за счет отсутствия необходимости поступления жирных кислот в митохондрии (около 15–20%), активный транспорт которых требует АТФ, дефицитного в условиях гипоксии. Установлено, что ишемия миокарда на клеточном уровне характеризуется снижением окисления глюкозы и повышением использования ЖК. Резкий дисбаланс между окислением глюкозы и ЖК в сторону последних, а также повышенная концентрация ЖК в ишемизированной зоне являются основными факторами реперфузионного повреждения и дисфункции миокарда, развития опасных нарушений ритма сердца [10]. Поэтому использование препаратов, разными путями блокирующих бета-окисление ЖК и на альтернативной основе стимулирующих окисление глюкозы, рассматривается как наиболее перспективное направление миокардиальной цитопротекции. Наиболее изученными препаратами, блокирующими окисление ЖК, являются p-FOX-ингибиторы (partial fatty and oxidation inhibitors), к которым относятся используемые в России триметазидин и мельдоний. Каждый из этих препаратов имеет свой механизм блокирования окисления ЖК [11, 12].
Триметазидин тормозит бета-окисление длинноцепочечных и короткоцепочечных жирных кислот в митохондриях, блокируя последнюю реакцию 4-стадийного процесса окисления жирных кислот (3-кетоацил-КоА-тиолазу) [13], что сопровождается относительным возрастанием роли гликолиза в миокарде с соответственным увеличением эффективности процесса энергобразования и одновременным уменьшением образования свободных радикалов на фоне блокады бета-окисления ЖК.
Мельдоний уменьшает интенсивность бета-окисления ЖК посредством предотвращения поступления их в митохондрии: ограничивает транспорт через мембраны митохондрий только длинноцепочечных жирных кислот, в то время как короткоцепочечные могут свободно проникать в митохондрии и окисляться там, при этом не происходит накопления недоокисленных жирных кислот внутри митохондрий, а также нарушения дыхания митохондрий [14]. Вышеописанные положительные эффекты опосредованы тем, что мельдоний, являясь одним из сильнейших обратимых ингибиторов гамма-бутиробетаингидроксилазы, катализирующей конверсию гамма-бутиробетаина в карнитин, тормозит поступление в клетку карнитина, тем самым снижая карнитин-зависимый транспорт ЖК в митохондрии мышечной ткани. Следует отметить, что триметазидин не мешает накоплению активированных ЖК в митохондриях, при этом происходит неизбежное их накопление внутри митохондрий [8], что может служить источником образования токсических пероксидов в результате активации свободно-радикальных процессов при ишемии и реперфузии [15].
Клинические исследования, проведенные до настоящего времени, показали высокую антиангинальную активность каждого из вышеописанных p-FOX-ингибиторов. Триметазидин — первый препарат из группы миокардиальных цитопротекторов, рекомендованный экспертами Европейского общества кардиологов (ЕОК), Американской коллегии кардиологов и Американской ассоциации сердца (АКК/ААС), а также экспертами Всероссийского научного общества кардиологов (ВНОК) в качестве антиангинального средства для лечения больных стабильной стенокардией [2, 16, 17], что явилось отражением клинических исследований, проведенных как за рубежом, так и в нашей стране: TRIMPOL-I, TACT, ТРИУМФ, ПРИМА и др. [18–21]. Согласно российским рекомендациям по диагностике и лечению стабильной стенокардии, триметазидин показан к назначению на любом этапе терапии стабильной ИБС для усиления антиангинальной эффективности гемодинамически активных препаратов (бета-адреноблокаторов, антагонистов кальция или нитратов), а также в качестве альтернативы им при их непереносимости или противопоказаниях к применению [2].
Высокая антиишемическая эффективность мельдония (3-(2,2,2-триметилгидразин) пропионата) продемонстрирована в целом ряде международных исследований последних лет при стенокардии (исследования MILSS, MILSS I, MILSS II) [22–24], инфаркте миокарда, аортокоронарном шунтировании, отмечено положительное действие на толерантность к физической нагрузке, уменьшение клинических проявлений стенокардии, снижение потребления нитратов [25, 26]. Отмечен антиаритмогенный эффект мельдония, уменьшение потребности в ингибиторах ангиотензинпревращающего фермента (ИАПФ) у больных с артериальной гипертензией, в комбинированной терапии как систолической, так и диастолической хронической сердечной недостаточности [27, 28].
Одним из зарегистрированных в России препаратов мельдония является Кардионат. Одним из первых исследований его эффективности стала оценка влияния Кардионата на эффективность антиангинальной терапии и функционального состояния миокарда у больных ИБС в сочетании с артериальной гипертензией (АГ), ассоциированной с сахарным диабетом (СД) 2-го типа, сделанная в работе Кузнецовой А. В. и Теплякова А. Т. (2007) [29]. Добавление Кардионата к стандартной базисной антиангинальной терапии у больных ИБС в сочетании с АГ на фоне СД 2-го типа привело к статистически значимому увеличению переносимости физических нагрузок, достоверному снижению частоты ангинозных приступов и уменьшению потребности в нитроглицерине, отмечено снижение функционального класса стенокардии.
В работе Посненковой О. М. с соавт. (2009) [30] изучено влияние терапии мельдонием на динамику качества жизни у больных острым инфарктом миокарда с подъемом сегмента ST в раннем постинфарктном периоде. Терапия с добавлением Кардионата позволила этим пациентам сохранить близкие к исходному уровень жизненной активности и психоэмоциональное состояние, положительно влияла на физический и психологический компоненты качества жизни у больных, перенесших острый инфаркт миокарда.
Кардионат хорошо зарекомендовал себя в геронтологической практике. Согласно российской статистике, большую часть больных с ИБС составляют пожилые люди, а учитывая возрастные особенности фармакокинетики большинства лекарственных препаратов, в их применении у пожилых возникает довольно много сложностей. В работе Михайлова М. Н. с соавт. (2009) продемонстрирована не только клиническая эффективность, но и хорошая переносимость Кардионата при его использовании в комплексной терапии лиц пожилого и старческого возраста с хроническими формами ИБС. Достоверно сократились число ангинозных приступов в течение суток, их продолжительность, интенсивность, а также потребность в нитроглицерине, что сопровождалось достоверным повышением толерантности к физической нагрузке, улучшением показателей теста с 6-минутной ходьбой. У 56% больных, включенных в исследование, имело место уменьшение степени депрессии интервала ST. Клинический эффект применения препарата проявлялся на 5–7 сутки лечения и достигал максимума к концу 3-й недели [31].
У нас также имеется опыт по использованию Кардионата в клинически сложных ситуациях, а именно у больных с хронической сердечной недостаточностью (ХСН) ишемического генеза в сочетании с метаболическим синдромом (МС). Кардионат назначался в течение 12 недель в суточной дозе 1000 мг в составе базисной терапии (БТ) ХСН, пациентам в возрасте 45–65 лет (основная группа), ХСН II-III функционального класса по классификации Общества специалистов по сердечной недостаточности (ОССН) (2002), перенесшим инфаркт миокарда. Полученные нами результаты продемонстрировали, что препарат Кардионат в составе комбинированной терапии больных с ХСН и МС способствует улучшению структурно-функциональных параметров сердца, уменьшению доли пациентов с концентрическим ремоделированием левого желудочка (ЛЖ) и эксцентрической гипертрофией ЛЖ, более частому выявлению нормальной геометрии ЛЖ (рис. 3, 4). В конце 12-недельной БТ с включением Кардионата отмечен рост количества больных с нормальной геометрией левого желудочка (НГЛЖ). В группе базисной терапии (контрольная группа) количество пациентов с нормальной геометрией ЛЖ увеличилось на 5,6% (p < 0,05). На фоне дополнительного назначения Кардионата произошло уменьшение суммарного количества больных с концентрической гипертрофией ЛЖ (КГЛЖ) с 6,7% до 3,3% и эксцентрической гипертрофией ЛЖ (ЭГЛЖ) с 13,3% до 10%. В группе базисной терапии произошло менее значимое снижение частоты выявления КГЛЖ с 5,8% до 5,0% и ЭГЛЖ с 14,7 до 13,7%. Различия между группами по конечным результатам не достигли критерия достоверности (p < 0,1).
В группе больных, дополнительно принимавших Кардионат, отмечено увеличение доли I стадии диастолической дисфункции (ДД) за счет снижения количества больных со II и III стадиями (рис. 5). Частота выявления ДД II стадии у больных ХСН и МС в основной группе снизилась на 20,1% vs 8,3% в группе контроля (прием препаратов базисной терапии ХСН) (р > 0,05). ДД III стадии, определяемая при первичном обследовании у 3,3% больных основной группы, по окончании 12-недельной терапии не выявлялась. Последняя, как известно, имеет наихудший прогноз и ассоциируется с высоким риском смерти у больных с сердечно-сосудистой патологией [32].
Установлено, что дополнительный к БТ прием Кардионата способствует улучшению нарушенной автономной регуляции сердца за счет снижения гиперсимпатикотонии и уменьшения индекса напряжения регуляторных систем. Анализ результатов проведенной в обеих группах пробы на вегетативную реактивность показал, что исходно у всех больных ХСН и МС преобладал гиперсимпатикотонический тип реакции (70% и 66,7% в основной и контрольной группе соответственно). На втором месте по частоте встречаемости был нормальный тип вегетативной реактивности: 23,3% в 1-й группе и 26,6% во 2-й группе. Асимпатикотоническая вегетативная реактивность была представлена в обеих группах у равного количества больных. Через 12 недель терапии в основной группе нормальная вегетативная реактивность регистрировалась у 36,7% пациентов, гиперсимпатикотоническая — у 53,3% и у 10% — асимпатикотоническая. Таким образом, в 1-й группе доля больных с гиперсимпатикотоническим типом реакции снизилась на 23,9% за счет роста количества пациентов с нормотонией. В группе контроля к концу исследования снижение доли больных с гиперсимпатикотонической вегетативной реактивностью произошло только на 15,0% (р > 0,05).
Применение Кардионата в составе БТ больных с ХСН и МС сопровождается антиангинальным эффектом (достоверным урежением приступов стенокардии (на 31,9% vs 17,4% в контрольной группе) и уменьшением потребности в нитроглицерине — до 2,2 ± 0,8 таблетки в неделю в основной группе vs 3,3 ± 0,7 таблетки в группе контроля; р < 0,05), субъективным и объективным улучшением клинического состояния и качества жизни больных. По нашему мнению, благоприятное действие препарата может быть опосредовано его положительным влиянием на углеводный и липидный обмен (выявлено достоверное повышение содержания холестерина липопротеидов высокой плотности, снижение содержания холестерина липопротеидов низкой плотности и триглицеридов), степень выраженности инсулинорезистентности (оценка проводилась по индексу HOMA–IR — НОmeostasis Мodel Аssessment), что обосновывает патогенетичность и целесообразность использования Кардионата в лечении пациентов с ХСН ишемической этиологии в сочетании с МС [33].
Сукцинат 2-этил-6 метил-3 оксипиридин стимулирует прямое окисление глюкозы по пентозофосфатному шунту, активируя сукцинатдегидроденазный путь окисления, переключая клеточный метаболизм с преимущественного окисления ЖК на окисление глюкозы. При улучшении оксигенации миокарда этилметилгидроксипиридина сукцинат не препятствует окислению ЖК на фоне полного использования в энергетической цепи глюкозы. Это отличает его от триметазидина и мельдония, которые блокируют бета-окисление ЖК как в условиях гипоксии, так и при восстановлении коронарного кровотока. Этилметилгидроксипиридина сукцинат повышает уровень восстановленных нуклеотидов (НАДФН), что усиливает антиоксидантную защиту клетки и способствует сохранению уровня эндогенных антиоксидантов.
Проведенные клинические исследования продемонстрировали эффективность и безопасность применения препарата в комбинированной терапии стабильной стенокардии, приводя к увеличению толерантности к физической нагрузке [34], хронической сердечной недостаточности [35]. Вместе с тем этилметилгидроксипиридина сукцинат обладает выраженной антиоксидантной активностью, что позволяет при его использовании уменьшить клинические проявления оксидативного стресса при неотложной кардиологической патологии [36].
Из нового класса метаболически активных антиангинальных средств, используемых при лечении ИБС, внимания заслуживает никорандил — активатор АТФ-зависимых калиевых каналов. В исследовании IONA (Impact Of Nikorandil in Angina) было продемонстрировано снижение частоты госпитализаций, риска сердечной смерти или нефатального инфаркта миокарда у пациентов со стабильной стенокардией, получавших никорандил дополнительно к обычной терапии [37]. Особенностью его действия является то, что его кардиопротективный эффект проявляется только в случае назначения перед ишемией; прекондиционирование на фоне реперфузии («посткондиционирование») при использовании активаторов АТФ-зависимых калиевых каналов не происходит. Это, разумеется, серьезно ограничивает его клиническое применение.
В заключение хотелось бы отметить еще один важный аспект дополнительных возможностей, ассоциированных с применением МЦ. В свете полученных к настоящему времени данных о положительном их влиянии на функциональное состояние почек, углеводный, липидный обмен, инсулинорезистентность [38–41] представляется весьма актуальным продолжить изучение их влияния не только на патогенетические факторы ишемического процесса, но и на различные органы и системы.
Таким образом, сегодня миокардиальная цитопротекция является новым, получившим доказательную базу направлением в лечении сердечно-сосудистых заболеваний. В связи с малым временем их изучения отсутствует серьезная доказательная база их влияния на выживаемость и смертность у больных с ССЗ. Однако полученные к настоящему времени клинические данные, свидетельствующие о повышении эффективности лечения пациентов с ишемической болезнью сердца, свидетельствуют о перспективности их применения в комбинированной терапии больных с сердечно-сосудистой патологией.
Литература
- Медико-демографические показатели в Российской Федерации в 2009 году. Статистические материалы. М., 2010.
- Диагностика и лечение стабильной стенокардии. Национальные клинические рекомендации. Сборник / Под редакцией Р. Г. Оганова. 3-е издание. М., 2010: 592 с.
- Оганов Р. Г., Лепахин В. К., Фитилев С. Б. и др. Особенности диагностики и терапии стабильной стенокардии в Российской Федерации (международное исследование АТР — Angina Treatment Pattern) // Кардиология. 2003; 5: 9–15.
- Fox K. M., Mulcahy D., Findlay I. et al. On behalf of the TIBET Study Group. The Total Ischaemic Burden European Trial (TIBET). Effects of atenolol, nifedipine SR and their combination on the exercise test and total ischaemic burden in 608 patients with stable angina // Eur Heart J. 1996; 17: 96–103.
- Сыркин А. Л., Добровольский А. В. Антиишемические препараты метаболического действия//Consilium Medicum. 2002; 4 (11): 572–575.
- Van Bilsen M., Smeets P. J., Gilde A. J., van der Vusse G. J. Metabolic remodelling of the failing heart: the cardiac bum-out syndrome? // Cardiovasc. Res. 2004; 61 (2): 218–226.
- Михин В. П. Кардиоцитопротекторы — новое направление клинической кардиологии // Архив внутренней медицины. 2011; 1: 21–28.
- Stanley W. C., Recchia F. A., Lopaschuk G. D. Myocardial substrate metabolism in the normal and failing heart // Physiol Rev. 2005; 85: 1093–1129.
- Шляхто Е. В., Галагудза М. М., Нифонтов Е. М. и др. Метаболизм миокарда при хронической сердечной недостаточности и современные возможности метаболической терапии // Сердечная недостаточность. 2005; 4: 148–156.
- Pillutla P., Hwang Y. C., Augustus A. et al. Perfusion of hearts with triglyceride-rich particles reproduces the metabolic abnormalities in lipotoxic cardiomyopathy // Am J Physiol Endocrinol Metab. 2005; 288: 1229–1235.
- Стаценко М. Е., Туркина С. В., Толстов С. Н. Место p-FOX-ингибиторов свободных жирных кислот в комбинированной терапии сердечно-сосудистых осложнений у больных сахарным диабетом 2 типа // Российский кардиологический журнал. 2011; 2: 102–110.
- Стаценко М. Е., Туркина С. В., Фабрицкая С. В., Полетаева Л. В. Миокардиальная цитопротекция при ишемической болезни сердца: что мы знаем об этом с позиции доказательной медицины? // Вестник Волгоградского государственного медицинского университета. 2011; 2: 9–14.
- Kantor P. F., Lucien A., Kozak R., Lopaschuk G. D. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial longchain 3-ketoacyl coenzyme A thiolase // Circ Res. 2000; 86: 580–588.
- Hanaki Y., Sugiyama S., Ozawa T. Effect of 3-(2,2,2, — trimelhylhydrazinium) propionate, gamma-butyrobetaine hydroxylase inhibitor, on isoproterenol — induced mitochondrial dysfunction//Res. Commun. Chem. Phatol. Pharmacol. 1999; 64: 157–160.
- Калвиньш И. Я. Милдронат и триметазидин: сходство и различие в их действии. Рига: ПАО «Grindex», 2001. 5 с.
- Management of stable angina pectoris: recommendations of the Task force of the European Society of Cardiology // Eur Heart J. 1997; 18: 394–413.
- Gibbons R. J., Chatterjee K., Daley J. et al. ACC/AHA/ACP-ASIM Guidelines for the management of patients with chronic stable angina // J Am Coll Cardiol. 1999; 33: 2092–2197.
- Szwed H., Pachocki R., Domzal-Bochelska M. et al. The antiischemic effects and tolerability of trimetazidine in coronary diabetic patients. A substudy from TRIMPOL-I // Cardiovasc Drug Ther. 1999; 13: 215–220.
- Триметазидин в комбинированной терапии стенокардии напряжения (TACT — Effect of Trimetazidine in patients with stable effort Angina in Combination with existing Therapy) // Сердце. 2002; 1: 204–206.
- Маколкин В. И., Осадчий К. К. Эффективность и переносимость триметазидина при лечении стабильной стенокардии напряжения в течение 8 недель (российское исследование ТРИУМФ) // Кардиология. 2003: 6: 18–22.
- Васюк Ю. А., Шальнова С. А., Куликов К. Г., Школьник Е. Л. Исследование ПРИМА: триметазидин с модифицированным высвобождением действующего вещества в лечении пациентов со стабильной стенокардией, перенесших инфаркт миокарда. Эпидемиологический и клинический этапы // Кардиология. 2008; 12: 10–13.
- Dzerve V., Matisone D., Pozdnyakov Y., Oganov R. Mildronate improves the exercise tolerance in patients with stable angina: results of a long term clinical trial // Sem Cardiovasc Med. 2010; 16 (3): 1–8.
- Дзерве В. Эффективность Милдроната в лечении ишемической болезни сердца: результаты исследования MILSS II // Квітень. 2010, № 7, 236.
- Dzerve Vilnis, MILSS I Study Group. A Dose-Dependent Improvement in Exercise Tolerance in Patients With Stable Angina Treated With Mildronate: A Clinical Trial «MILSS I» Medicina (Kaunas) 2011; 47 (10): 544–551.
- Гордеев И. Г., Лучинкина Е. Е., Хегай С. В. Коррекция дисфункции миокарда у больных стабильной стенокардией, подвергшихся коронарной реваскуляризации, на фоне приема цитопротектора милдроната // Российский кардиологический журнал. 2009; 2 (76): 54–58.
- Карпов Р. С., Кошельская О. А., Врублевский А. В. Клиническая эффективность и безопасность милдроната при лечении хронической сердечной недостаточности у больных ишемической болезнью сердца // Кардиология. 2000; 6: 69–74.
- Хлебодаров Ф. Е., Михин В. П. Роль цитопротекторов в лечении больных артериальной гипертонией на фоне терапии эналаприлом // Российский кардиологический журнал. 2009; 5: 46–50.
- Стаценко М. Е., Туркина С. В., Беленкова С. В. Возможности применения милдроната у больных хронической сердечной недостаточностью с сахарным диабетом 2 типа и автономной кардиальной нейропатией // Российский кардиологический журнал. 2009; 3 (77): 69–75.
- Кузнецова А. В., Тепляков А. Т. Оценка влияния Кардионата на эффективность антиангинальной терапии и функционального состояния миокарда у больных ИБС в сочетании с артериальной гипертензией, ассоциированной с сахарным диабетом 2 типа // Фарматека. 2007; 3: 81–84.
- Посненкова О. М., Киселев А. Р., Шварц В. А. Влияние терапии препаратом Кардионат на качество жизни у больных острым инфарктом миокарда с подъемом сегмента ST в раннем постинфарктном периоде // Consilium medicum. 2010, № 5, с. 94–98.
- Михайлова М. Н., Красильникова И. П., Костромина М. А., Пустозеров В. Г. Опыт применения Кардионата в геронтологической практике // Справочник поликлинического врача. 2009; 9: 20–21.
- Poulsen S. H., Moller J. E., Norager В. Prognostic implications of left ventricular diastolic dysfunction with preserved systolic function following acute myocardial infarction // Cardiology. 2001; 5 (4): 190–197.
- Стаценко М. Е., Евтерева Е. Д., Туркина С. В. с соавт. Возможность применения миокардиального цитопротектора в комбинированной терапии больных с хронической сердечной недостаточностью и метаболическим синдромом // Consiliun Mеdicum. 2010; 12 (10): 76–82.
- Евсевьева М. Е., Никулина Г. П., Ростовцева М. В. Применение метаболических препаратов при основной сердечно-сосудистой патологии у больных различного возраста // Поликлиника. 2008; 4: 72–75.
- Стаценко М. Е., Евтерева Е. Д., Туркина С. В. с соавт. Новые возможности мексикора в лечении хронической сердечной недостаточности у больных с метаболическим синдромом // Российский кардиологический журнал. 2010; 6: 28–33.
- Голиков А. П., Давыдов Д. В., Руднев Б. В. Влияние Мексикора на окислительный стресс при остром инфаркте миокарда // Кардиология. 2005; 7, 21–26.
- Dargie H. Glazgo 2001 IONA — Nikorandil for Stable Angina. Oral presentation, American Heart Association Scentific Session 2001, Anaheim, California // Lancet. 2001, 359 (Issue 9314): 1269–1275.
- Клебанова Е. М., Балаболкин М. И., Креминская В. М. и др. Липидснижающее и антиоксидантное действие мексикора у больных сахарным диабетом // Терапевтический архив. 2006; 8: 67–70.
- Стаценко М. Е., Туркина С. В., Беленкова С. В. и др. Влияние милдроната в составе комбинированной терапии хронической сердечной недостаточности у больных сахарным диабетом 2 типа на углеводный, липидный обмен и показатели оксидативного стресса // Российский кардиологический журнал. 2010; 2 (82): 45–51.
- Fragasso G., Palloshi A., Amarild C. Effect of selective 3-ketoacyl coenzyme A thiolase inhibition on glucose metabolism in cardiac patients // Heart and metabolism. 2006; 30: 21–25.
- Monti L. D., Setola E., Fragasso G. et al. Metabolic and endothelial effects of trimetazidine on forearm skeletal muscle in patients with type 2 diabetes and ischemic cardiomyopathy // Am J Physiol Endocrinol Metab. 2006; 290 (1): 54–59.
1 A, B, C — уровни доказательств.
М. Е. Стаценко, доктор медицинских наук, профессор
С. В. Туркина, кандидат медицинских наук, доцент
Б. А. Лемперт, доктор медицинских наук
Е. Д. Евтерева
ГБОУ ВПО Волгоградский государственный медицинский университет Минздравсоцразвития России, Волгоград
Контактная информация об авторах для переписки: mestatsenko@rambler.ru
Купить номер с этой статьей в pdf